World Journal of Cancer Research
Vol.08 No.01(2018), Article ID:23386,8
pages
10.12677/WJCR.2018.81004
Relationship between Expression of TTF-1, TS and Chemotherapy Effect of Pemetrexed in Advanced Lung Adenocarcinoma
Linjia Zhu, Zongxiao Shangguan, Xiao Ci, Shaofei Yuan*, Renguo Zhao
Department of Respiratory Medicine, The Third Affiliated Hospital, Wenzhou Medical University, Wenzhou Zhejiang
*通讯作者。
Received: Dec. 22nd, 2017; accepted: Jan. 5th, 2018; published: Jan. 12th, 2018

ABSTRACT
Objective: To investigate the relationship between expression of TTF-1, TS and chemotherapy effect of pemetrexed in advanced lung adenocarcinoma. Methods: Eighty patients with advanced lung adenocarcinoma treating by pemetrexed were enrolled in this study and their tumor samples were collected retrospectively for analysis. The expression of TTF-1, TS protein in tumor samples was detected by the immunohistochemical method. The data of therapeutical effect and toxicity were collected and analyzed. Results: The TTF-1 positive staining accounted for 71.25% (57/80). The TS positive staining accounted for 22.50% (18/80). TTF-1 and TS expression in lung cancer tissues had negative correlation (r = −0.356, P = 0.002). The response rate (CR + PR) was 46.25%. The efficiency of patients with over-expression of TTF-1 (64.91%) was significant higher than patients with low-expression of TTF-1 (39.13%) (P < 0.05). The efficiency of patients with over-expression of TS (27.78%) was significant lower than patients with low-expression of TS (51.61%) (P < 0.05). The efficiency, median progress time and 1-survival rate of patients with over-expression TS and low-expression of TTF-1 (28.57%, 3.9 months, 28.6%) were all significant lower than patients with over-expression TTF-1 and low-expression of TS (81.13%, 7.4 months, 69.8%) (P < 0.05). Conclusions: The expression of TTF-1 and TS is associated with chemotherapy effect of pemetrexed in advanced lung adenocarcinoma and can be used to detect the sensitivity.
Keywords:Advanced Lung Adenocarcinoma, Pemetrexed, TTF-1, TS
TTF-1及TS在肺腺癌中的表达及与培美曲塞化疗疗效相关性分析
朱林佳,上官宗校,慈晓,原少斐*,赵仁国
温州医科大学附属第三医院呼吸内科,浙江 温州

收稿日期:2017年12月22日;录用日期:2018年1月5日;发布日期:2018年1月12日

摘 要
目的:探讨晚期肺腺癌中TTF-1和TS的表达与培美曲塞化疗疗效的关系。方法:回顾性分析80例接受培美曲塞化疗的晚期肺腺癌患者的临床病理资料。免疫组织化学法检测肿瘤标本TTF-1和TS蛋白的表达,并对疗效进行分析。结果:TTF-1阳性表达率为71.25% (57/80),TS阳性表达率为22.50% (18/80)。TTF-1和TS在肺癌中的表达呈负相关性(r = −0.356,P = 0.002)。化疗有效率(CR + PR)为46.25%,TTF-1(+)患者有效率(64.91%)显著高于TTF-1(−)患者(39.13%),差异有显著性(P < 0.05)。TS(+)患者有效率(27.78%)显著低于TS(−)患者51.61%,差异有显著性(P < 0.05)。联合检测显示:TTF-1(−)且TS(+)组有效率为28.57%,中位无疾病进展时间为3.9个月,1年生存率为28.6%,TTF-1(+)且TS(−)组有效率为81.13%,中位无疾病进展时间为7.4个月,1年生存率为69.8%,差异均有显著性(P < 0.05)。结论: 联合检测TTF-1和TS的表达可作为培美曲塞化疗方案治疗晚期肺腺癌的疗效预测指标之一。
关键词 :肺腺癌,培美曲塞,甲状腺转录因子-1,胸苷酸合成酶

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肺癌是目前世界范围内发病率和死亡率最高的肿瘤,寻找高效的治疗方法一直是各国研究的重点。肺癌中的非小细胞肺癌近年来随着靶向药物、免疫抑制点阻断药物的开发,疗效和总生存有了长足的进展。然而对于无EGFR、ALK、ROS等相关基因突变或PD-1低表达的晚期非小细胞肺癌,化疗仍是标准的一线治疗,尤其病理类型最高的肺腺癌,培美曲塞为基础的方案是首选化疗方案 [1] 。但是临床上我们发现相同的化疗方案,用在临床分期相同、病理类型相同的肺癌患者身上,常会产生截然不同的效果。提示临床疗效取决于药物与肿瘤组织的相互作用。药物遗传学和药物基因组学的迅速发展已经证明:肿瘤组织的基因表达情况与NSCLC化疗的疗效相关 [2] 。研究证实,肺癌中存在TTF-1基因的扩增及蛋白水平的增高,TTF-1高表达与非小细胞肺癌尤其是腺癌的治疗疗效及预后相关 [3] 。TS是一种叶酸依赖性酶,TS是dTMP从头合成的限速酶,在DNA合成与修复、细胞增殖与分化中起非常重要的作用 [4] 。荟萃分析显示TS低表达的患者可从培美曲塞化疗中明显获益,TS表达水平的增加可能是培美曲塞耐药原因 [5] 。为此,本文回顾性分析80例晚期非小细胞肺癌患者的TTF-1及TS蛋白表达水平,结合培美曲塞联合顺铂化疗方案的疗效分析,初步判断二者与化疗疗效及预后相关性,从而为临床选择此方案时提供药物敏感性生物学指标。
2. 资料与方法
1) 研究对象
收集我院2012年1月~2016年6月共80例晚期肺腺癌患者。年龄33~78岁,中位年龄55岁。其中男性44例,女性36例;临床ⅢB期34例,Ⅳ期46例。病理组织分型按WHO组织学分类(1998)标准,分期按1997年国际抗癌联盟(UICC)制订的标准。所有入组患者均符合以下条件:① 均经病理学证实(手术、支气管镜检,纵隔镜活检,淋巴结切取,CT定位经皮穿刺活检)为晚期非小细胞癌,② 既往未接受过放化疗及无相关驱动基因突变,③ Karnofaky评分 ≥ 70,预计生存期 > 3个月,④ 有客观观察指标可评价疗效,⑤ 血常规、肝肾功、心电图正常,无化疗禁忌症。
2) 化疗方案
培美曲塞500 mg/m2,静脉滴注15 min,dl;顺铂总量75 mg/m2分2~3天静脉滴注。21天为一个周期,至少化疗2个周期。为预防培美曲塞不良反应,使用本品前每天补充叶酸400 ug至少连续5天,前一天补充维生素B12 1000 ug,前一天开始口服地塞米松片4 mg/bid,连续3天。常规给予5HT3受体拮抗剂预防恶心、呕吐。
3) 免疫组化方法
采用免疫组织化学链菌素亲生物素–过氧化物酶法(SP法)染色,SP试剂盒购于北京中山生物技术有限公司,羊抗鼠TTF-1、TS多克隆抗体购于武汉博士德生物工程有限公司。
将待检标本切片后经二甲苯及梯度乙醇脱蜡至水,3% H2O2作用15 min,以阻断内源性过氧化物酶活性;切片置10 m∙mol/L柠檬酸缓冲液中微波加热以修复抗原;冷却后滴加山羊血清封闭液,室温孵育15 min,封闭非特异性抗体。倾去多余血清,加入一抗,4℃过夜。滴加生物素标记羊抗鼠IgG、辣根过氧化物酶–链霉菌卵白素工作液,室温孵育各15 min,DAB显色,苏木素复染,脱水,封片。每种抗体均设阳性和阴性对照,阳性对照为已知表达阳性的组织切片,阴性对照以PBS代替一抗。
4) 结果判断
TTF-1、TS分别以胞核或胞质中出现棕色或棕黄色颗粒为阳性细胞。按半定量积分法判断两者表达 [6] ,根据染色强度及阳性细胞所占比例分别记为0~3分。染色强度:未着色为0分,着色浅为1分,中度着色为2分,着色深为3分。阳性细胞百分率:高倍镜下随机选取10个视野,每个视野计数100个细胞。计算其平均阳性百分率。根据平均阳性细胞百分率分为:阳性细胞数百分率 ≤ 5%为0分,6%~25%为1分,26%~49%为2分,≥50%为3分。两项评分相加,0~1分为(−),2分为(+),3~4分为(++),5~6分为(+++),(+)、(++)、(+++)均表示为阳性。
5) 疗效评价
化疗2周期结束后进行疗效评价,随访时间为1年。按RECIST实体瘤疗效评价标准分为:完全缓解(CR),部分缓解(PR),疾病稳定(SD),疾病进展(PD)。以CR + PR计算客观有效率。并分析患者中位疾病进展时间及1年生存率。
6) 统计学分析
应用SPSS 13.0统计软件包,TTF-1和TS表达与化疗有效率采用χ2检验;二者相关性采用Spearman等级相关性分析,以P < 0.05为有统计学意义。预计生存分析采用Kaplan-Meier曲线法,用Log-rank检验生存率。
3. 结果
1) 免疫组织化学染色结果
80例晚期肺腺癌标本组织中TTF-1阳性表达率为71.25% (57/80),其中男性为70.45%,女性为72.22%;≥55岁为69.77%,<55岁为72.97%;上述均经χ2检验,无统计学意义(P > 0.05);而ⅢB期肺腺癌TTF-1表达率为82.35%,Ⅳ期肺腺癌TTF-1表达率为63.04%,两者差异有统计学意义(P < 0.05)。
TS阳性表达率为22.50% (18/80),其中男性为22.73%,女性为22.22%;≥55岁为23.26%,<55岁为21.62%;上述均经χ2检验,无统计学意义(P > 0.05);而ⅢB期肺腺癌TS表达率为14.71%,Ⅳ期肺腺癌TS表达率为28.26%,两者差异有统计学意义(P < 0.05)。见图1~4和表1。
2) 化疗疗效
本组病例2例CR,35例PR,30例SD,13例PD,总有效率为46.25% (37/80)。其中,TTF-1(+)的患者有效率高(64.91%),TTF-1(−)患者有效率低(39.13%),差异有显著性(P < 0.05)。TS(+)组的有效率为27.78%,低于TS(−)组的51.61%,差异有显著性(P < 0.05)。联合检测显示:TTF-1(+)且TS(−)组有效率为81.13%,TTF-1(−)且TS(+)组有效率为28.57%,两者差异显著(P < 0.05)。见表2,表3。
3) 肺腺癌中TTF-1和TS的相关性
TTF-1和TS共同表达阳性者为4例,共同表达阴性者为9例,TTF-1表达阳性、TS表达阴性者53例,TTF-1表达阴性,TS表达阳性者14例,经Spearman等级相关分析可知两者表达呈负相关性(r = −0.356,P = 0.002)。
4) 生存情况
所有患者均获随访,随访率100%,随访时间1年。TTF-1(−)TS(+)组的中位疾病无进展期为3.9个月,1年生存率为28.6%,TTF-1(+)TS(−)组的中位疾病无进展期为7.4个月,1年生存率为69.8%,差异均有显著性(P < 0.05),见图5,因患者疗效评价进展后的治疗方法各异,我们未对总生存期进行统计。
Table 1. The expression of TTF-1 and TS in the lung tissues of the 80 patients
表1. 80例患者组织中TTF-1与TS的表达情况
Table 2. The relationship between the expression of TTF-1, TS and chemotherapy efficacy
表2. TTF-1与TS的表达与疗效之间的关系
Table 3. The relationship between chemotherapy efficacy and clinical pathology
表3. 化疗疗效与临床病理之间的关系

Figure 1. The high expression of TTF-1 in lung tissue
图1. 肺癌中TTF-1的高表达(SP × 200)

Figure 2. The high expression of TS in lung tissue
图2. 肺癌中TS的高表达(SP × 200)
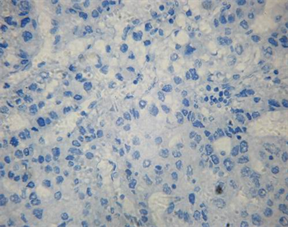
Figure 3. The low expression of TTF-1 in lung tissue
图3. 肺癌中TTF-1的低表达(SP × 200)

Figure 4. The low expression of TS in lung tissue
图4. 肺癌组织中TS的低表达(SP × 200)

Figure 5. The cumulative survival situation of the patients
图5. 患者累计生存情况
4. 讨论
肺癌目前是世界上最常见的恶性肿瘤,在恶性肿瘤相关死亡原因中占第一位。非小细胞肺癌(non-small cell lung cancer, NSCLC)占所有肺癌的80%至85%,其中腺癌约30%~35%。多数NSCLC确诊时已处于晚期,中位生存期为1年左右,5年生存率不足16%,预后极差。即使早期可以手术的患者,仍有多数患者在5年内出现肿瘤复发或转移 [7] 。化疗是晚期NSCLC的主要治疗手段,国内外指南均推荐培美曲塞联合铂类为晚期肺腺癌的一线首选化疗方案。然而令我们困惑的是:即使是相同分期、相同病理类型的病人,采用相同的化疗方案,其疗效与生存期却相差较大,提示每个患者对培美曲塞的敏感性不同。在这种情况下,肺癌的诊断、治疗及预后就不能单纯依靠现行的肺癌组织病理分型和TNM (tumor-node-metastasis)分期。寻找化疗药物疗效预测指标,制定个体化治疗方案,则能极大程度地减少“捆绑和无效化疗”。因此,分子病理学领域也逐渐成为肺癌的研究热点。其中,部分研究致力于分析新的生物因子在致癌过程中的潜在作用。
TTF-1的研究始于通过动物实验发现TTF-1可以调节甲状腺球蛋白基因的特异性表达,为甲状腺球蛋白的特异性转录因子,从而命名为甲状腺转录因子-1。TTF-1也称为NKX同源框-1 (NK2 homeobox 1, NKX2-1),是NKX2转录基因家族的成员之一。TTF-1位于人类染色体14q13.3,由三个外显子和两个内含子组成的单基因编码的含有一个同源结构域的转录因子。TTF-1编码的蛋白含有371个氨基酸,是相对分子量为38 kDa的核蛋白,生理情况分布于甲状腺、呼吸道上皮的II型Clara细胞及部分大脑前腹侧核等,调控甲状腺、肺和中枢神经系统中基因的选择性表达 [8] 。TTF-1是近年来发现的一个新的肿瘤分子标记物,是肺腺癌高敏感性及特异性的分子标记物,目前已证实其在肺癌的诊断和鉴别诊断方面具有非常明显的应用价值 [9] 。
目前关于TTF-1是否影响肺癌的预后的研究已经开展,但是在TTF-1阳性表达与生存的关系存在很大的分歧。Winslow等 [10] 发表的文章显示,低分化的肺癌中TTF-1的表达多为阴性;TTF-1表达与细胞增殖抗原(Ki67)表达呈负性相关,意味着TTF-1表达水平越高,瘤细胞增殖率越低,提示患者的预后越好。TTF-1阳性表达与患者预后较高之间的关系有统计学意义。同时也有学者认为,TTF-1阳性表达是肺癌患者生存期的不良预后因素,如Lee等 [11] 分析118例术后原发性肺腺癌预后,得出TTF-1基因扩增是患者无疾病生存期的独立不良预后因素。我们通过本研究发现,TTF-1阳性组患者中位疾病无进展期为7.4个月,而TTF-1阴性组的中位疾病无进展期为仅为3.9个月,提示TTF-1阳性患者的预后较好。以上研究提示TTF-1与预后之间的结果相对不统一。这可能是与TTF-1在肺癌中的调控机制尚不明确,或可能与在肺癌的不同阶段TTF-1的作用不同相关。迄今为止,少有关于TTF-1和患者对化疗药物之间敏感性相关的研究报道。我们的此项研究通过回顾性分析发现TTF-1阳性患者对培美曲塞联合顺铂的有效率为64.91%,高于TTF-1阴性患者的39.13%。
TS是一种叶酸依赖性酶,由两个相同的亚基构成,是DNA合成的关键酶,也是培美曲塞、5-氟尿嘧啶(5-fluorouracil, 5-FU)为基础化疗的靶向酶。TS是体内调节四种核苷酸数量平衡的关键酶,TS通过甲基化脱氧尿嘧啶核苷酸(deoxyuridinemo nophosphate, dUMP)形成脱氧胸嘧啶核苷酸(deoxythymidine monophosphate, dTMP),dTMP进一步在细胞内代谢为三磷酸胸嘧啶,三磷酸胸嘧啶为DNA合成和修复的基本原料,因此,TS是dTMP从头合成的限速酶,在DNA合成与修复、细胞增殖与分化中起非常重要的作用 [12] 。并且TS是叶酸代谢关键酶,叶酸是核苷酸和DNA合成及甲基化的重要前体物质。低叶酸水平是引起DNA链断裂,导致遗传物质不稳定和癌症风险增加的关键决定因素TS参与DNA复制和修复,是主要的叶酸依赖酶,培美曲塞作为TS的新一代的多靶点抗叶酸制剂,它在体内产生的多聚谷胺酸代谢物来抑制包括TS、二氢叶酸还原酶(dihydrofolate reductase)和甘氨酰胺核苷甲酰转移酶(glycinamide ribonucleotide formyltransferase),而被抑制的这几种酶是参与嘌呤和嘧啶合成的关键酶 [13] 。荟萃分析显 [14] 示TS低表达的患者可从培美曲塞化疗中明显获益,TS表达水平的增加可能是培美曲塞耐药原因。我们本实验也观察到类似情况,通过回顾性分析发现TS阳性组患者对培美曲塞联合顺铂的有效率低于TS阴性组患者(27.78% vs 51.61%)。分析TS与预后关系中,我们发现TS阳性患者进展快,中位无疾病进展时间短,预后差,1年生存率低,与目前一些研究报道相一致。另外本实验的数据显示,晚期肺腺癌组织中TTF-1和TS的表达呈负相关。两者都与患者对化疗疗效及预后相关,联合检测意义更大。
虽然研究的数据表明生物标记物表达水平不同,将直接影响到相关药物的疗效,根据基因表达的效果而选择对应的药物,从而达到更佳的治疗目的,但是,大多数均为回顾性的研究,少数为前瞻性研究。就目前的研究结果并不能作为临床常规诊疗的标准,因此大家更广泛的接受以病理类型、临床分期决定患者的治疗方案。不同的个体对化疗的敏感性存在较大差异,这种差异使得在面对不同的患者而选择不同的方法,个体化的治疗越来越凸显,因此,针对分子标志物表达的不同及耐药的关系而选择个体化治疗,从而避免过度治疗或治疗不够,将仍然是NSCLC研究的重要内容之一。
基金项目
温州市科技计划项目(Y20160245)。
文章引用
朱林佳,上官宗校,慈 晓,原少斐,赵仁国. TTF-1及TS在肺腺癌中的表达及与培美曲塞化疗疗效相关性分析
Relationship between Expression of TTF-1, TS and Chemotherapy Effect of Pemetrexed in Advanced Lung Adenocarcinoma[J]. 世界肿瘤研究, 2018, 08(01): 18-25. http://dx.doi.org/10.12677/WJCR.2018.81004
参考文献 (References)
- 1. Tomasini, P., Barlesi, F., Mascaux, C., et al. (2016) Pemetrexed for Advanced Stage Nonsquamous Non-Small Cell Lung Cancer: Latest Evidence about Its Extended Use and Outcomes. Therapeutic Advances in Medical Oncology, 8, 198-208. https://doi.org/10.1177/1758834016644155
- 2. Liu, D., Wu, J., Shi, G.Y. (2014) Role of XRCC1 and ERCC5 Polymorphisms on Clinical Outcomes in Advanced Non-Small Cell Lung Cancer. Genetics and Molecular Research, 13, 3100-3107. https://doi.org/10.4238/2014.April.17.6
- 3. Yaman, B., Nart, D., Ekren, P.K., et al. (2015) Expression of p63, TTF-1 and Maspin in Non-Small Cell Lung Carcinoma and Their Effect on the Prognosis and Differential Diagnosis. Turkish Journal of Pathology, 31, 163-174. https://doi.org/10.5146/tjpath.2015.01305
- 4. Dong, H., Bao, D., Guo, X., et al. (2015) Effect of Thymidylate Synthase Gene Polymorphism on the Response to Chemotherapy and Clinical Outcome of Non-Small Cell Lung Cancer Patients. Tumor Biology, 36, 7151-7157. https://doi.org/10.1007/s13277-015-3447-6
- 5. Sun, J.M., Ahn, J.S., Jung, S.H., et al. (2015) Pemetrexed Plus Cisplatin versus Gemcitabine Plus Cisplatin According to Thymidylate Synthase Expression in Nonsquamous Non-Small-Cell Lung Cancer: A Bio-marker-Stratified Randomized Phase II Trial. Journal of Clinical Oncology, 33, 2450-2456. https://doi.org/10.1200/JCO.2014.59.9324
- 6. 李燕, 杨明珍. 弥漫大B细胞淋巴瘤免疫组化标记的预后意义及利妥昔单抗对其影响临床研究[J]. 中国实用内科杂志, 2014, 34(2): 187-190.
- 7. Tian, D., Pei, Y., Zheng, Q., et al. (2017) Effect of Vis-ceral Pleural Invasion on the Prognosis of Patients with Lymph Node Negative Non-Small Cell Lung Cancer. Thoracic Cancer, 8, 97-105. https://doi.org/10.1111/1759-7714.12412
- 8. Elsamany, S.A., Al-Fayea, T.M., Alzahrani, A.S., et al. (2015) Thyroid Transcription Factor-1 Expression in Advanced Non-Small Cell Lung Cancer: Impact on Survival Outcome. Asian Pacific Organization for Cancer Prevetion, 16, 2987-2991. https://doi.org/10.7314/APJCP.2015.16.7.2987
- 9. El-Maqsoud, N.M., Tawfiek, E.R., Abdelmeged, A., et al. (2016) The Diagnostic Utility of the Triple Markers Napsin A, TTF-1, and PAX8 in Differentiating between Primary and Metastatic Lung Carcinomas. Tumor Biology, 37, 3123-3134. https://doi.org/10.1007/s13277-015-3964-3
- 10. Winslow, M.M., Dayton, T.L., Verhaak, R.G., et al. (2013) Suppression of Lung Adenocarcinoma Progression by Nkx2-1. Nature, 473, 101-104. https://doi.org/10.1038/nature09881
- 11. Lee, J.S., Kim, H.R., Lee, C.Y., et al. (2013) EGFR and TTF-1 Gene Amplification in Surgically Resected Lung Adenocarcinomas: Clinicopathologic Significance and Effect on Response to EGFR-Tyrosine Kinase Inhibitors in Recurred Cases. Annals of Surgical Oncology, 20, 3015-3022. https://doi.org/10.1245/s10434-013-2937-2
- 12. Liu, Q., Yu, Z., Xiang, Y., Wu, N., et al. (2015) Prognostic and Predictive Significance of Thymidylate Synthase Protein Expression in Non-Small Celllung Cancer: A Systematic Review and Me-ta-Analysis. Cancer Biomarkers, 15, 65-78. https://doi.org/10.3233/CBM-140432
- 13. Yang, M., Fan, W.F., Pu, X.L., et al. (2017) The Role of Thymidylate Synthase in Non-Small Cell Lung Cancer Treated with Pemetrexed Continuation Maintenance Therapy. Journal of Chemotherapy, 29, 106-112. https://doi.org/10.1080/1120009X.2016.1254940
- 14. Giovannetti, E., Zucali, P.A., Rolfo, C., et al. (2016) Prognostic and Predictive Roles of Thymidylate Synthase Expression in Lung Cancer: The Debate Is Still Open. Journal of Clinical Oncology, 34, 511-512. https://doi.org/10.1200/JCO.2015.64.2496
