World Journal of Cancer Research
Vol.
09
No.
03
(
2019
), Article ID:
31433
,
6
pages
10.12677/WJCR.2019.93014
The Current Strategies and Developing Directions of Tumor Immunotherapy
Yuwei Hu1, Yuan Tan1, Yanzhu Yao1, Yuting He1, Yu Xiong1, Qiongwen Liang1, Yingxi Shi1, Huozhen Hu2*
1School of Medicine UESTC, Chengdu Sichuan
2College of Life Science, Sichuan University, Chengdu Sichuan

Received: Jul. 2nd, 2019; accepted: Jul. 19th, 2019; published: Jul. 26th, 2019

ABSTRACT
With the continuous development of oncology, immunology and molecular biology, tumor immunotherapy and transformation research have made great achievements, bringing revolutionary changes to the anti-tumor treatment models. The development potential of immunotherapy is huge, and it will become a key weapon for precision medicine in the future, but it also faces many challenges. This review will discuss the current strategies and development directions of immunotherapy from specific and non-specific tumor adoptive immunotherapy, immunological checkpoint blockade (ICIs) etc.
Keywords:Tumor, Immunotherapy, Adoptive Cellular Immunotherapy, Tumor Vaccine, Immune Checkpoint
肿瘤的免疫治疗现状及发展方向
胡雨薇1,谭源1,姚妍竹1,何雨婷1,熊雨1,梁琼文1,时樱溪1,胡火珍2*
1电子科技大学医学院,四川 成都
2四川大学生命科学学院,四川 成都

收稿日期:2019年7月2日;录用日期:2019年7月19日;发布日期:2019年7月26日

摘 要
随着肿瘤学、免疫学及分子生物学等学科的不断发展,肿瘤免疫治疗及转化研究也取得了巨大的成就,为抗肿瘤治疗模式带来了革命性的改变。免疫治疗发展潜力巨大,今后也将成为精准医疗的关键武器,但目前也面临着诸多挑战。本文将从特异性的及非特异性的肿瘤过继免疫治疗、免疫检验点阻断(ICIs)等几个方面来论述免疫治疗的现状及发展方向。
关键词 :肿瘤,免疫疗法,过继性细胞免疫治疗,肿瘤疫苗,免疫检查点

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
癌症因为其癌细胞异质性、内源性和突变抗药性等原因成为当下医学发展中的难点和重点。传统的治疗方式是:手术、化疗和放疗。
随着肿瘤学、免疫学及分子生物学等学科不断发展和交叉渗透,过继性免疫疗法(ACI, Adoptive Cellular Immunotherapy)应运而生,其能够调动宿主自身免疫系统来控制机体的免疫应答,用于配合常规疗法以减少转移、复发。
 (a)
(a)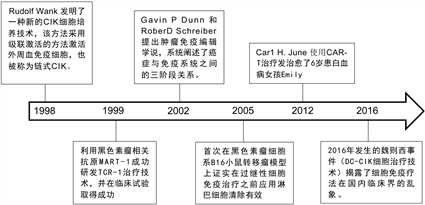 (b)
(b)
Figure 1. (a) Timeline of development of immunotherapy (1893-1991); (b) Timeline of development of immunotherapy (1998-2016) [2]
图1. (a) 免疫治疗的发展时间轴(1893~1991);(b) 免疫治疗的发展时间简轴(1998~2016) [2]
2. 理论基础
正常情况下,免疫系统可以识别并清除肿瘤微环境中的肿瘤细胞,这个过程中有七个环节:1) 肿瘤抗原释放;2) 肿瘤抗原呈递;3) 启动和激活效应性T细胞;4) T细胞向肿瘤组织迁移;5) 肿瘤组织T细胞浸润;6) T细胞识别肿瘤细胞;7) 清除肿瘤细胞 [3]。其中任何一个环节出现问题都会导致免疫系统对肿瘤细胞的有效识别和杀伤效果受到抑制从而产生免疫耐受,甚至促进肿瘤的发生、发展。免疫治疗就是通过解决这些问题恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤的一种治疗方法。
3. 特异性肿瘤过继免疫治疗
3.1. EBV特异性的细胞毒性T淋巴细胞(Cytotoxic T lymphocyte)
Epstein-Barr病毒(EBV)是传染性单核细胞增多症的病原,并与Burkitt淋巴瘤、鼻咽癌等恶性肿瘤有密切关系 [4]。
以治疗鼻咽癌(Nasal Pharyngeal Cancer—NPC)为例,有两个临床试验值得关注。STRAATHOFKC [5] 等对10个晚期NPC病人进行了自体CTL治疗。结果在治疗后的19到27个月,4个治疗后好转的病人仍保持健康。Patrizi a Comolli [6] 等对10例EBV相关的IV期NPC病人进行了自体EBV特异性CTL静脉注射治疗。在6例病人中获得了进展控制,其中2例有效,4例病情稳定。王胜军的定量显示 [3] :在其它条件不变的情况下,加入CTL的间隔为肿瘤细胞增殖1次的时间的42倍时,可取得最好的治疗效果;而增加CTL数量也可以优化治疗效果,但是CTL数量增加到某种程度后,再增加等量的CTL,改善程度将明显下降。
因此,利用该免疫疗法来治疗鼻咽癌病人是效果肯定,且副作用小的方法之一。
3.2. 嵌合抗原受体T细胞(CAR-T)
嵌合抗原受体是一类经人工改造,由胞外抗原结合域、跨膜域和胞内信号转导域组成,集特异性识别靶向肿瘤抗原和激活T细胞两种作用于一身的T细胞受体 [7]。CAR识别肿瘤抗原绕过了抗原呈递阶段,无需MHC限制,同时拥有增加的共刺激信号增强T细胞对肿瘤细胞的杀伤力,此外CAR-T细胞有望在体内循环多年抑制肿瘤复发。
不足之处:1) 跳过免疫检查点的限制很可能对正常细胞造成非期望性损伤,即脱靶效应。2) 在体外进行的细胞转染需要已知目标癌细胞的特异性抗原,而目前很多癌细胞特异性抗原仍未知。3) 细胞整个改造过程基因载体不稳定不特异,可能导致基因突变。4) 体外基因改造会造成细胞凋亡或无法长期表达该基因。5) 大量CAR-T细胞的引入可能产生超量的细胞因子引发细胞因子释放综合征。
3.3. TCR-T细胞治疗技术
T细胞可以通过基因编辑在细胞表面表达识别肿瘤抗原的T细胞受体(TCRs)或嵌合抗原受体(CARs),以此提高免疫细胞的特异性及反应性 [8]。标准的T细胞受体由6个多肽链组成,其中主要的两条肽链a链和β链构成了TCR的结合区域,能够识别胞内加工处理后并经MHC提呈的抗原分子,而由其他肽链所形成的共刺激区域和黏附分子能够将TCR-MHC的结合作用放大并传导给F游信号通路,从而引起T细胞的增殖。其中特异性TCR-T细胞治疗技术主要包括了:
1) NY-ESO-1特异性TCR-T细胞治疗技术;
2) PLAC1介导的特异性TCR-T细胞治疗技术;
3) 个体化新抗原介导的特异性TCR-T细胞治疗技术:新抗原即突变蛋白产生的抗原和脂瘤病毒整合进基因组产生的抗原,属于肿瘤特异性抗原范畴 [9]。自体TILs中存在部分新抗原反应性的T细胞,这类TILs具有抗肿瘤效应,且经过TCR基因修饰的合适的T细胞亚群可避免因扩增培养导致其进入终末分化状态,细胞复制能力消失的问题 [8]。但到目前为止,尚未有针对突变抗原的个体化TCR-T细胞治疗临床应用的报道。
不足之处:1) 已有研究证明并非所有TCR基因治疗靶抗原是安全的,仍需要调整临床的方案以限制T淋巴细胞活化诱导的毒性。2) 中枢耐受和外周耐受机制会大大降低TCR同抗原肽的亲和能力,因此如何设计生产具有强结合能力的TCR成为TCR-T技术的研究焦点。
4. 非特异性肿瘤过继免疫治疗
4.1. CIK细胞治疗癌症
CIK细胞是一种异质细胞,是混合的细胞群体 [10]。
CIK细胞通过5种不同途径作用于肿瘤细胞:1) 引发毒性颗粒依赖性溶细胞作用。2) CIK细胞与T细胞抗原受体结合,合成并释放毒性颗粒,作用于靶细胞。3) CIK细胞自身分泌细胞因子作用于靶细胞或反作用于效应细胞。4) CIK细胞群合成并释放穿孔蛋白,溶解靶细胞。5) CIK细胞激活靶细胞的凋亡基因,使凋亡基因转录并表达。因此,CIK细胞治疗技术有安全性高,特异性明显并且可高效广泛的杀灭肿瘤和病毒的独特优势。
有研究发现将DC细胞和CIK细胞共同培养时,T细胞促使DC进一步成熟后释放大量IL-12、IFN-γ等细胞因子,使CIK细胞对肿瘤细胞的细胞毒活性明显增强,且细胞扩增倍数上升,极大程度的提高了杀伤肿瘤细胞效率,且无明显毒作用,使治疗达到1 + 1 > 2的效果 [11]。
4.2. IL-2与LAK细胞合用
从带瘤宿主中分离具有抗肿瘤反应性的淋巴样细胞时,观察到淋巴细胞在IL-2中培养后导致活化的淋巴样细胞的增殖,后者能溶解自体的同系的或同种的新鲜肿瘤细胞,但不溶解正常新鲜细胞 [12]。LAK细胞不同于经典的溶细胞性T淋巴细胞,杀伤作用不受MHC限制。它的杀伤能力与自然杀伤细胞明显不同。NK细胞对肿瘤细胞的影响很小或无影响。无NK活力的细胞群都能产生良好的LAK活性。
4.3. TILs肿瘤浸润淋巴细胞
肿瘤浸润淋巴细胞即为从肿瘤组织中分离出的浸润淋巴细胞,TIL细胞在体内经肿瘤抗原激活后成为细胞毒T淋巴细胞,对肿瘤细胞具有靶向特异性且能在肿瘤部位聚集,对肿瘤细胞的杀伤活性显著提高。
在基础和临床实验研究中发现对于LAK细胞治疗无效的晚期肿瘤病人,TIL仍有一定治疗效果 [13] :回输病人后TILs可在肿瘤组织聚集且辅以注射IL-2可使TIL聚集量提高5~l0倍 [14]。
5. 免疫检验点阻断(ICIs)
免疫检验点(immune checkpoint)是指保持机体自身免疫耐受,调节免疫应答答复以及产生强度免疫抑制的信号通路 [15]。阻断这些分子的活性可提升T细胞对癌细胞的杀伤能力。目前已鉴定了多种免疫检验点分子,包括细胞毒性T细胞相关抗原4 (CTLA-4)、程序性死亡分子1 (PD-1)、程序性死亡配体l (PD-L1)和 PD-L2等。
PD-1:基因敲除小鼠的试验表明,PD-1是一种免疫抑制分子,局限于外周组织,主要在激活的T细胞、树突细胞和单核细胞等细胞上表达,参与细胞抑制,亦增强Treg细胞的免疫抑制作用。目前,纳武单抗正应用于非小细胞肺癌、晚期黑色素瘤、难治性或复发性弥漫性大B细胞淋巴瘤、复发性或转移性头颈部肿瘤等的临床试验。目前已有多个国家批准该药的使用。
PD-L1和PD-L2:癌细胞的PD-L1通过与免疫细胞表面PD-1结合,启动免疫抑制信号而诱发免疫耐受,一方面促进Tc和TH细胞无能、耗竭、反应迟钝和凋亡,另一方面诱导Treg扩展,从而增强对免疫杀伤和凋亡信号的抵抗,最终达到逃脱机体免疫监控的目的。PD-L1单克隆抗体目前主要集中于I/II期临床试验,有3种PD-L1单克隆抗体BMS-936559、MPDL3280A和MEDl4736尚未被FDA正式批准。其中BMS-936559对黑色素瘤、非小细胞肺癌、肾细胞癌和卵巢癌等均有一定疗效,且临床不良反较少,须进一步全面评估临床效果。
虽然免疫检验点单克隆抗体在癌症治疗上取得了一定突破,但与期望仍有较大距离,也存在很多亟待解决的问题,一方面须提升单一抗体的治疗效果,另一方面应加强联合应用。
6. 免疫疗法组合
在一针对治疗小鼠的横纹肌肉瘤的实验中,除了癌症病毒疗法之外,研究者们还阻断了T细胞表面PD-l的活性,从而解开其对T细胞活性的抑制 [16]。如果病毒的感染能够导致更多T细胞的产生,而PD-1的阻断能起到T细胞杀伤肿瘤的能力。两者的结合能够达到更佳的效果。
7. 肿瘤疫苗
肿瘤疫苗的疗效主要取决于疫苗的免疫原性、肿瘤抗原的表达特异性、机体对肿瘤疫苗的耐受性等。肿瘤疫苗分两类:一类是预防性癌症疫苗目前HPV预防性疫苗主要以组成为晚期蛋白L1病毒样颗粒作为靶抗原诱发机体产生高滴度的血清中和性抗体,并协助T淋巴细胞清除病毒感染 [17]。另一类是治疗性癌症疫苗。治疗性癌症疫苗又分为靶向抗原疫苗、肿瘤肽疫苗和RNA & DNA疫苗 [18] [19]。
靶向抗原疫苗中:1) TAAs (Tumor-associated antigens)肿瘤细胞和正常细胞都可以表达(过表达抗原Her2/neu, surviving, MUC-1、睾丸癌抗原MAGE-3, NY-ESO-1、分化抗原Mart1, PSA, PAP)。而尽管肿瘤相关抗原在正常细胞中也会有一定程度的表达,并具有一定致免疫性,但是免疫自身耐受性是可以避免这种对正常细胞TAAs的特异性免疫反应。2) TSAs (Tumor-specific antigens)。基于新抗原的疫苗策略显示,临床前特异性抗肿瘤免疫在一期的人类临床试验中测试并有稳定有效的效果 [20]。
肿瘤肽疫苗是肿瘤特异性抗原、肿瘤相关抗原、癌基因或抑癌基因突变蛋白多肽组成的疫苗研究人员通过使患者接种肿瘤多肽疫苗,来激发患者自身对肿瘤细胞的特异性免疫应答,以期达到清除肿瘤而不杀伤周围正常细胞的治疗目标。 [21] 多肽疫苗临床治疗一些恶性肿瘤虽已取得一定效果,但仍存在免疫系统中主要组织相容性复合体的限制性、弱的免疫原性、免疫耐受性及免疫应答与临床疗效不尽一致等问题,因此筛选和开发高效的肿瘤治疗性多肽疫苗还需要更深入的研究 [22] [23]。
RNA & DNA疫苗即肿瘤基因疫苗,是通过基因重组技术,将目的基因导入受体细胞所制备的疫苗,(如,黑色素瘤疫苗)也是目前发展最快,倍受人们重视的一个研究方向 [24]。这种疫苗具有可以提高机体抗瘤能力、增强肿瘤细胞的免疫原性、表达产物的直接杀瘤活性的优点。波士顿Dana-Farber癌症研究研制的黑色素瘤疫苗涉及97种抗原,个别疫苗甚至针对20种抗原。来自德国美因茨大学的研究团队,也开发出一种基于RNA 的癌症疫苗。
肿瘤疫苗现在已经成为免疫治疗中热门的领域。不过,还有一些问题需要探讨,比如什么时候应用疫苗,疫苗应针对原发肿瘤还是转移瘤,是否应每几个月就给一次疫苗,疫苗如何及何时与其他疗法联合应用,制作方面及佐剂等。
8. 结语
伴随人们对免疫机制和功能研究的不断深入,各种疾病进程中的免疫机制变化也有了进一步的探索发现。在此基础之上不断开发的肿瘤免疫治疗方案也取得了一定的成果。但是各种方法都还不够完善,还需要大量的临床实验。相信在不久的将来,随着免疫学的发展和人类对于免疫机制的应用技术更加成熟,更多有针对性并且大众化的免疫治疗方案会出现。
文章引用
胡雨薇,谭 源,姚妍竹,何雨婷,熊 雨,梁琼文,时樱溪,胡火珍. 肿瘤的免疫治疗现状及发展方向
The Current Strategies and Developing Directions of Tumor Immunotherapy[J]. 世界肿瘤研究, 2019, 09(03): 98-103. https://doi.org/10.12677/WJCR.2019.93014
参考文献
- 1. 张叔人. 肿瘤免疫治疗进展[M]. 北京: 中国协和医科大学出版社. 2017: 175.
- 2. 上海细胞治疗工程技术中心. 人类癌症与免疫治疗发展史[EB/OL]. https://mp.weixin.qq.com/s?__biz=MzA4MDI2NTMzMA==&mid=2651685914&idx=1&sn =dcd2fa930040d1d113a19c9492b82aac&chksm= 845fcd07b328441154e8fe67d5ff1ded28a6de9912b 85de08bfd224dce103ee0fde0c078420f&mpshare= 1&scene=23&srcid=0502KmyH8J6gSCt1Z8egeInV#rd, 2019-05-10.
- 3. 王胜军. 鼻咽癌的细胞毒性T细胞免疫治疗的定量研究[M]. 博士学位论文, 2019.
- 4. 姜华. EB病毒特异性细胞毒性T淋巴细胞与肿瘤免疫治疗研究进展[J]. 国外医学免疫学分册, 2001, 24(5): 240.
- 5. Straathof, K.C., Bollard, C.M., Popat, U., et al. (2005) Treatment of Nasopharyngeal Carcinoma with Epstein-Barr Virus-Specific T Lymphocytes. Blood, 105, 1898-1904.
https://doi.org/10.1182/blood-2004-07-2975 - 6. Comoli, P., Pedrazzoli, P., Maccario, R., et al. (2005) Cell Therapy of Stage IV Nasopharyngeal Carcinoma with Autologous Epstein-Barr Virus-Targeted Cytotoxic T Lympho-cytes. Journal of Clinical Oncology, 23, 8942-8949.
https://doi.org/10.1200/JCO.2005.02.6195 - 7. 蔡亮, 张凌华, 杨子杰, 裘丽珍. 嵌合抗原受体T细胞(CAR. T)免疫疗法: 绝处逢生的利剑[J]. 自然杂志, 2016, 38(3): 228-231.
- 8. 张兰林, 吴向华. TCR-T细胞免疫疗法在实体肿瘤治疗中的研究进展[J]. 肿瘤, 2018, 38(3): 256-263.
- 9. Morgan, R.A., Dudley, M.E., Wunderlich, J.R., et al. (2006) Cancer Regression in Patients after Transfer of Genetically Engineered Lymphocytes. Science, 314, 126-129.
https://doi.org/10.1126/science.1129003 - 10. 陈怡. 自体免疫免疫细胞治疗技术之CIK细胞治疗癌症[J]. 生物技术世界, 2016(4): 329.
- 11. 王志华. CIK细胞治疗癌症-国际临床试验的现状及展望[J]. 中国肿瘤生物治疗杂志, 2013(2).
- 12. 百度. 肿瘤免疫治疗[EB/OL].
https://baike.baidu.com/item/肿瘤免疫治疗/8945917?fr=Aladdin, 2019-05-06. - 13. 曹雪涛, 叶天垦, 杨嗣坤. IL-2激活的TIL与LAK细胞体内抗肿瘤作用的比较[J]. 中国免疫学杂志, 1990, 21(6): 105-110.
- 14. Horn, S.S. (1991) Common Expression Melanoma Tu-mor-Specific Antigen Recognized by Human Tumor-Infiltrating Lymphocytes: Analysis by Human Lympho-cyte-Antigenrestriction. Immunotherapy, 2, 153-164.
https://doi.org/10.1097/00002371-199106000-00001 - 15. 隋爱霞, 赵静, 郭晓强. 免疫检验点阻断: 癌症免疫治疗的新希望[J]. 科学, 2016, 68(2): 20-23.
- 16. Rosenberg, S.A., 俞慕华. 白细胞介素2免疫治疗癌症的现状与展望[J]. 国际生物制品学杂志, 1989(1): 8-11.
- 17. Kyrgios, M. and Shafi, M.I. (2009) HPV Vaccine. Obstetrics Gynecology and Reproductive Medicine, 19, 26-28.
https://doi.org/10.1016/j.ogrm.2008.09.010 - 18. 小邢爱知识. 深度剖析: 肿瘤疫苗的应用与前景[EB/OL]. http://oncol.dxy.cn/article/104350, 2019-05-10.
- 19. A+医学. 免疫与健康/肿瘤疫苗[EB/OL]. http://www.a-hospital.com/w/%E5%85%8D%E7%96%AB%E4%B8%8E%E5%81%A5%E5%BA%B7/%E8%82%BF%E7%98%A4%E7%96%AB%E8%8B%97, 2019-05-07.
- 20. Mogul, A., Terme, M. and Tanchot, C. (2019) Thera-peutic Cancer Vaccine and Combinations with Antiangiogenic Therapies and Immune Checkpoint Blockade. Frontiers in Immunology, 10, Article 467.
- 21. 万岩岩. 肿瘤多肽疫苗研究进展[J]. 动物医学进展, 2015, 36(2): 101-105.
- 22. Patrick, A.O., Hu, Z.T., Keskinen, D.B., et al. (2017) An Immunogenic Personal Neoantigen Vaccine for Patients with Melanoma. Nature, 547, 217-221.
- 23. 吴亚洪, 高艳锋, 祁元明. 肿瘤抗原细胞毒性T淋巴细胞表位鉴定和多肽疫苗的研究进展[J]. 郑州大学报医学版, 2011, 45(5): 657-660.
- 24. Shahin, U., Derhovanessian, E., Miller, M., et al. (2017) Personalized RNA Mechanome Vaccines Mobilize Poly-Specific Therapeutic Immunity against Cancer. Nature, 547, 222-226.
NOTES
*通讯作者。