Advances in Microbiology
Vol.
07
No.
04
(
2018
), Article ID:
27673
,
9
pages
10.12677/AMB.2018.74019
Research Progress of Xanthomonadin Chemical Structure, Biological Function and Biosynthesis Mechanism in Phytopathogen Xanthomonas
Xueqiang Cao1,2,3, Yawen He1,2,3
1School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Shanghai
2State Key Laboratory of Microbial Metabolism, Shanghai Jiao Tong University, Shanghai
3Joint International Research Laboratory of Metabolic & Development Science, Shanghai Jiao Tong University, Shanghai

Received: Nov. 2nd, 2018; accepted: Nov. 15th, 2018; published: Nov. 22nd, 2018

ABSTRACT
Xanthomonadins are yellow, membrane-bound, brominated, aryl-polyene pigments produced by Xanthomonas bacteria. Xanthomonadins from different Xanthomonas spp. differ in bromination and methylation patterns and the polyene chain length. Xanthomonadin have become useful chemotaxonomic and diagnostic markers for Xanthomonas. Moreover, xanthomonadins play an important role in maintaining the ecological fitness of Xanthomonas species by protecting bacterial cells against photooxidative and peroxidative stress. A pig cluster has been isolated to be responsible for xanthomonadin biosynthesis. Function analysis of the pig cluster showed xanthomonadins are biosynthesized via an unusual type II polyketide synthase pathway, which utilize 3-hydroxybenzoic acid as precursor. This review discusses the chemical structure, biological function and biosynthesis mechanism of xanthomonadin.
Keywords:Xanthomonas, Xanthomonadin, Aryl-Polyene, Biosynthesis Pathway
植物病原黄单胞菌菌黄素化学结构、生物学功能和生物合成机制研究进展
曹雪强1,2,3,何亚文1,2,3
1上海交通大学生命科学技术学院,上海
2上海交通大学微生物代谢国家重点实验室,上海
3上海交通大学教育部代谢与发育科学国际合作联合实验室,上海

收稿日期:2018年11月2日;录用日期:2018年11月15日;发布日期:2018年11月22日

摘 要
菌黄素是由植物病原黄单胞菌产生的一类附膜溴化芳香基多烯类黄色素,在溴取代、芳香环甲基化及多烯链链长方面存在结构多样性。菌黄素不仅作为黄单胞菌属的分类和诊断标记,还能保护细菌抵抗光氧化伤害,促进细菌在寄主植物表层的附生,在黄单胞菌致病性和环境适应性方面发挥重要作用。黄单胞菌基因组上一段pig基因簇负责菌黄素的生物合成,该基因簇介导了以3-羟基苯甲酸为前体物新型的II型聚酮合酶生物合成途径。本文将系统综述菌黄素结构、生物学功能和生物合成机制的研究进展。
关键词 :黄单胞菌,菌黄素,芳香基多烯链,生物合成途径

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
微生物世界丰富多彩,微生物能产生多种色素化合物。常见的微生物色素包括类胡萝卜素、黑色素、灵菌红素、核黄素、绿脓菌素等 [1] 。微生物色素具有重要的生物学功能,如抗氧化活性、抑菌活性、作为酶的辅因子等。除此以外,微生物色素还可以用作食品、化妆品以及药物的添加剂和生物指示剂,具有广泛的应用价值 [2] 。
黄单胞菌(Xanthomonas)是一类革兰氏阴性植物病原细菌,能侵染400多种植物,包括很多重要的食品及经济作物如水稻、甘蓝、大豆、木薯、柑橘、香蕉等 [3] 。其中,侵染十字花科植物造成黑腐病的野油菜黄单胞菌(Xanthomonas campestris pv. campestris, 简称Xcc)和侵染水稻的水稻白叶枯病菌(X. oryzae pv. oryzae,简称Xoo)是两种典型的模式植物病原细菌。黄单胞菌能产生胞外酶、胞外多糖、脂多糖、III型分泌效应因子及黄色素等多种致病因子辅助其侵染植物 [4] 。黄单胞菌产生的黄色素学名为菌黄素(xanthomonadin),附着在细菌细胞外膜,导致菌落呈现亮黄色。菌黄素的研究最早可以追溯到20世纪60年代,1964年Starr等 [5] 首先报道了菌黄素可以作为黄单胞菌属细菌的分类标记;1976年Andrews等 [6] 首次鉴定了菌黄素的化学结构。1990年至今,通过多个实验室的协作研究,菌黄素的生物学功能和生物合成机制基本得以阐明。本文将系统综述菌黄素结构、生物学功能和生物合成机制等方面的研究进展。
2. 菌黄素是一类磷脂类结构的溴化芳香基多烯类色素
早期Stephens和Starr [7] 认为黄单胞菌产生的黄色素属于类胡萝卜素,随后Andrewes等 [8] 的研究结果否定了这一观点,认为该黄色素属于新型黄色色素,并命名为即菌黄素(xanthomonadin)。1973年,Andrewes等 [8] 提取和纯化了核桃黑斑病菌X. juglandis XJ103的菌黄素,发现该菌能产生两种色素复合物(I和II),每个色素的分子量在2200左右。作者用强碱氢氧化钾处理色素复合物得到四种单一的化合物:1a,1b和2a,2b。利用质谱、红外光谱、化学反应等方法推测以上四种化合物分别是含1或2个溴修饰的芳香基辛烯甲酯。1976年,该实验室采用X-射线晶体衍射方法鉴定了XJ103中菌黄素异丁醇酯衍生物的结构,即二溴–芳基辛烯酸异丁醇酯,即xanthomonadin I (见图1) [6] 。随后Starr等人采用同样的方法对17株黄单胞菌的菌黄素进行了分析,发现菌黄素通常以混合物形式存在,不同菌黄素在溴取代、芳香环上的甲基化和多烯链长方面具有结构多样性。
1985年,Aririatu和Kester [9] 采用改良的方法提取了X. juglandis (campestris) ATCC 11329分离株的菌黄素,得到两种磷脂类化合物,结构分析推测第一种为溴化芳香基多烯酸与甘油磷酰山梨醇酯化形成的特殊磷脂,第二种为两个溴化芳香基多烯酸分子与甘油磷酸酯化形成的磷脂。Dianese等 [10] 研究发现菌黄素存在于细菌外膜。近期,Moser等 [11] 在研究Xcc磷脂的过程发现菌黄素能与磷脂同时被提取。据此,我们推测菌黄素可能是一类磷脂类结构的溴化芳香基多烯类色素 [12] 。菌黄素准确的化学结构还有待进一步研究,目前主要有两方面的挑战需要克服:一是高效的提取、分离和纯化方法;二是提取后的菌黄素不稳定性。

Figure 1. Structure of isobutyl ester of xanthomonadin, xanthomonadin I [6] . Xanthomonadins differ in bromination and methylation patterns and the polyene chain length
图1. 菌黄素异丁醇酯的结构 [6] 。菌黄素在溴化、甲基取代、多烯链长方面具有结构多样性
3. 菌黄素的生物学功能
3.1. 菌黄素保护细菌抵抗光氧化损伤
环境因素能影响黄单胞菌的生存活力,比如光照。光照可激发光敏感剂产生活性氧或自由基,对细菌造成损伤。在多种黄单胞菌中的研究发现菌黄素能有效的保护细菌抵抗光氧化损伤,而这一功能主要依赖于菌黄素多烯链结构。Jenkins等 [13] 利用化学诱变剂甲磺酸酯(EMS)对野生型X. juglandis进行处理,获得不产菌黄素的突变株,通过比较突变株与野生株在光敏感剂甲苯胺蓝的存在下经可见光照射后菌株存活状况发现,经过2小时的照射,突变体的活菌数量比野生型降低了大概100倍。Rajagopal等 [14] 测试了水稻白叶枯菌(Xoo)对可见光的敏感性,发现白色突变株相比于野生型对光损伤的敏感性增加了10~100倍。邹华松等 [15] 研究了水稻条纹病菌(X. oryzae pv. oryzicola)菌黄素对菌体的保护作用,发现经紫外光照射后菌黄素缺失突变株的活菌数显著低于野生型。Poplawsky等 [16] 发现野油菜黄单胞菌(Xcc)菌黄素缺失突变体B24-C4经波长635 nm的可见光照射60分钟,其生存活力比野生型降低1000倍。Wang等 [17] 在黄单胞菌科产酶溶杆菌中分离鉴定一种菌黄素类似物,该菌黄素类似物能显著增加细菌对紫外光和可见光的抵抗性。
3.2. 菌黄素可抵抗寄主植物产生的过氧化因子
植物受到病原菌侵染后产生多种免疫反应,比如活性氧。He等 [18] 测定了野生型Xcc和菌黄素缺失突变体对H2O2的抗性,结果显示缺失了菌黄素的突变体对H2O2的抗性降低了50%~75%。Wang等 [17] 发现溶酶杆菌产生的菌黄素类似物也能影响细菌对H2O2的抗性。
3.3. 菌黄素参与黄单胞菌在寄主植物上的致病性
黄单胞菌侵染寄主植物的关键是在寄主表层定殖、繁殖,细菌数量达到一定水平开始侵染。菌黄素在黄单胞菌附生过程中起到重要作用。Poplawsky等 [16] 研究发现Xcc菌黄素缺失突变株在强可见光照射下,在寄主表层生存的能力大幅度降低。Xcc侵染植物的试验表明,菌黄素缺失突变体通过伤口侵染不会影响细菌致病性;而通过自然接种侵染,菌黄素缺失突变株的致病性显著下降。Goel等 [19] 从Xoo突变体库中筛选到一株既不能合成菌黄素而且致病性降低的菌株BXO65,表明菌黄素可能与致病性相关。He等 [18] 的研究也显示Xcc菌黄素缺失突变株对甘蓝的系统侵染能力显著降低(P < 0.05)。
综上所述,菌黄素能保护黄单胞菌抵抗来自外界环境或寄主植物体内的过氧化因子,从而协助细菌在寄主植物表层或维管组织中生存,进而参与细菌的致病性。由于菌黄素附于细菌外膜上,Rajagopal等 [14] 推测菌黄素通过保护脂质过氧化机制抵抗氧化损伤。除此以外,菌黄素具有开发为天然抗氧化剂的潜力,从而替代食品、化妆品中人工合成的抗氧化剂。
4. 菌黄素的生物合成机制
4.1. 菌黄素依赖特殊的II型聚酮合酶途径进行合成
类似于大部分微生物次级代谢产物,菌黄素的生物合成相关基因也是成簇的分布于基因组上。1993年Poplawsky等 [20] 首次利用基因组文库回补实验在Xcc “B-24”分离株中发现一段25.4-Kbp的序列能回补18株菌黄素缺失突变体,随后该实验室从这一序列中鉴定了pigABCDEFG基因簇(约18.6-Kbp)参与菌黄素的生物合成 [21] 。2002年,Goel等 [22] 利用Xcc的pig基因簇序列作探针在Xoo的基因组中也发现了菌黄素生物合成基因簇部分片段,该基因簇中共有14个开放阅读框,其中3个ORF分别编码酰基载体蛋白(ACP)、脱水酶(DH)和酰基转移酶(AT),且是菌黄素生物合成必需的基因,据此作者首次提出菌黄素可能通过II型聚酮合酶(PKS)途径进行合成。
根据已发表的基因组序列,Cao等 [12] 采用RecET克隆技术直接克隆了Xcc的pig基因簇(Xcc4015-Xcc3998),并实现了在铜绿假单胞菌M18中异源表达菌黄素,由此进一步确定pig基因簇负责菌黄素的生物合成。通过基因敲除作者鉴定了11个核心基因(xanA2B2CDEFGHKLM)是菌黄素生物合成必需的(见图2)。根据生物信息学分析,xanM、xanL、xanC、xanH和xanE分别编码酮基合酶(KS)、链长因子(CLF)、ACP、酮基还原酶(KR)和DH,它们是II型PKS途径中典型元件。该途径中的KS/CLF不同于链霉菌中典型酮基合酶,构成了新的一类KS/CLF元件,因此菌黄素通过特殊的II型PKS途径进行生物合成。Wang等 [17] 鉴定了溶酶杆菌菌黄素类似物的生物合成基因簇,该基因簇中大部分基因与pig基因簇同源,也包含KS、CLF、ACP、KR、DH等典型的II型PKS蛋白,突变这些基因亦导致无菌黄素合成。Zhou等 [23] 发现pig类似基因簇广泛的存在于黄单胞菌科中,例如Xylella fastidiosa、Pseudoxanthomonas spadis、Frateuria aurantia等,且大部分黄单胞菌科细菌能产生黄色素。综合以上,菌黄素或菌黄素结构类似物广泛存在于黄单胞菌科细菌中,且具有保守的生物合成途径,即通过特殊的II型PKS途径进行合成。
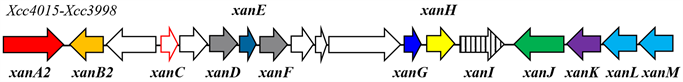
Figure 2. The biosynthesis gene cluster of xanthomonadin in Xcc [12]
图2. 野油菜黄单胞菌菌黄素生物合成基因簇 [12]
4.2. 3-HBA是菌黄素生物合成前体物
早期Poplawsky等 [21] [24] 发现pig基因簇中的xanB2介导一种可扩散信号的产生,命名为DF,并认为DF是调控菌黄素生物合成的关键因子。Chun等 [25] 初步推测DF是丁内酯类化合物,随后Yajima等 [26] ,He等 [18] [27] 的研究结果否定这一推测,并由He等 [18] 重新鉴定了DF为3-羟基苯甲酸(3-HBA)。基于前期报道的菌黄素结构中含有3-羟基苯甲酰基团,He等 [18] 首次提出3-HBA并非一种信号分子,而应该是菌黄素生物合成的前体物。除此之外,还有几条证据支持这一观点 [18] :1) 3-HBA缺失突变株完全丧失菌黄素合成能力,这更像中断了菌黄素合成途径而非中断调控菌黄素合成的信号传导途径;2) 虽然3-HBA缺失突变株在胞外多糖的产生、细胞活力、抗氧化活性、致病性等方面受到影响,但负责以上表型的基因表达水平未受影响,说明3-HBA不参与调控以上基因的表达;3) 突变pig基因簇另一基因Xcc4015也导致菌黄素无法合成但不影响3-HBA的产生,ΔXcc4015菌株呈现的表型与ΔxanB2类似,说明以上表型变化主要是由菌黄素缺失引起的。后期仍需深入的研究进一步证实3-HBA是菌黄素生物合成的前体物,比如通过同位素标记喂养试验。
4.3. XanB2一种新型分支酸酶,负责合成3-HBA
早期多篇研究报道了xanB2是3-HBA产生的关键基因,直至2013年XanB2的生化功能才被阐述。Zhou等 [23] 纯化了Xcc的XanB2蛋白,首次在体外证实XanB2是一种新型的双功能分支酸裂解酶,催化分支酸水解为3-HBA和4-HBA,其中3-HBA是菌黄素生物合成的前体物。作者进一步发现Xcc基因组中并无常见的4-HBA合成酶UbiC,UbiC是辅酶Q生物合成途径中关键酶;且突变xanB2导致辅酶Q显著降低,由此证实XanB2产生的4-HBA主要参与了辅酶Q的生物合成。XanB2也是一类保守存在的分支酸裂解酶,在黄单胞菌及苛养木杆菌(Xylella fastidiosa)、洋葱伯克霍尔德菌(Burkholderia cenocepacia)及Xylophilus ampelinus等细菌中也发现了xanB2的同源蛋白,这也解释了为什么以上细菌也能回补3-HBA缺失突变株菌黄素的产生 [24] 。Schöner等 [28] 在杂草内生菌Azoarcus sp. BH72中发现XanB2的同源蛋白ArcB,且证实与XanB2具有同样的功能。有趣的是,arcB也参与了一种菌黄素类似色素arcuflavin的生物合成,arcuflavin的生物合成基因簇部分基因与pig基因簇同源,也是通过II型PKS或FAS途径合成。
4.4. XanA2和XanC负责激活3-HBA,进一步参与PKS途径
3-HBA作为前体物通过II型PKS途径合成菌黄素的芳香基多烯脂部分,根据典型的PKS生物合成途径,3-HBA需激活为3-HBA-CoA或3-HBA-S-ACP。Cao等 [12] 在Xcc的pig基因簇中鉴定了xanA2 (即Xcc4015)编码AMP连接酶,体外酶活证实XanA2催化两步反应:激活3-HBA腺苷酰化形成3-HBA-AMP,然后把3-HBA转移至xanC编码的ACP的巯基形成3-HBA-S-ACP。XanA2还能激活3-HBA的类似物如4-HBA、3-MHBA、4, 3-AHBA及BA等腺苷酰化。该结果解释了为何在xanB2突变体中外源添加4-HBA、3-MHBA、4,3-AHBA也能诱导菌黄素或菌黄素类色素的合成 [18] 。即4-HBA,3-MHBA,4,3-AHBA等也可能作为前体物参与菌黄素的生物合成。有趣的是4-HBA介导合成的菌黄素为暗黄色,近期我们实验室的研究结果(未发表)显示该暗黄色色素在吸收光谱、色谱分离等方面均存在差异,而造成这种差异的原因还不清楚。
4.5. 菌黄素芳香基多烯链的后修饰过程
菌黄素结构中的芳香环和多烯链上具有溴化修饰,而pig基因簇中有两个基因可能编码卤化酶(xanB1和xanJ),Cao等 [12] 在Xcc中分别或同时敲除xanB1和xanJ均不影响菌黄素的合成,但敲除xanJ影响其菌落颜色变浅且不影响菌黄素产量;Goel等 [22] 在Xoo中敲除xanB1亦不影响菌黄素的产量以及溴化修饰。因此,xanB1或xanJ是否参与菌黄素的溴化修饰还有待进一步阐述。Cao等在Xcc的pig基因簇中鉴定了一个特殊的糖基转移酶(xanK)参与菌黄素的合成,并推测菌黄素整体结构中含有糖基化修饰。除此之外,pig基因簇中含有两个编码溶血磷脂–脂酰转移酶家族蛋白的基因(xanD和xanF)亦参与菌黄素的合成,根据菌黄素特殊的磷脂类结构,我们推测xanD和xanF可能催化芳香基多烯酸与甘油磷酸的酯化反应 [12] 。由于菌黄素结构信息的缺乏,关于菌黄素芳香基多烯链的后修饰过程仍需进一步验证。
综上所述,菌黄素的生物合成主要分为以下4个阶段(见图3):1) 利用XanB2水解莽草酸途径产物分支酸合产生3-HBA和4-HBA,其中3-HBA再通过XanA2激活合成起始单元3-HBA-S-ACP。2) 3-HBA-S-ACP经II型PKS途径加载延伸单元丙二酰-CoA,然后经过酮基还原酶和脱水酶的还原作用形成芳香基多烯酸。3) 芳基多烯酸进一步与甘油或甘油磷酸酯化,生成磷脂类化合物。4) 最后经过糖基化、卤化、甲基化等修饰,合成最终的菌黄素,再经转运蛋白转运至细胞外膜,嵌合于磷脂双分子层。
4.6. 菌黄素与其它代谢产物生物合成途径之间的关联
黄单胞菌能产生多种代谢产物来更好的适应生存环境,包括菌黄素、胞外多糖、胞外酶、DSF家族
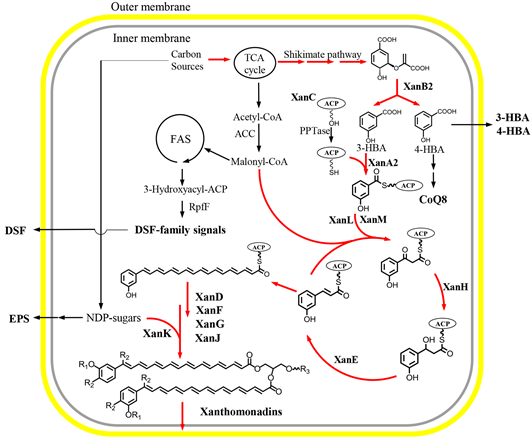
Figure 3. The biosynthesis pathway model of xanthomonadin in Xcc [12] . The starter unit 3-HBA-S-ACP is biosynthesized by XanB2, XanC and XanA2 through a series of sequential reactions that require chorismate, the end-product of the shikimate pathway, as a precursor. The type II PKS consisting KS/CLF, KR, DH and ACP are applied to synthesize the 3-hydroxybenzonyl-actene-ACP intermediate. The aryl polyene is modified with gylcosyltransferase, halogenase, and acyltransferase, then xanthomonadin pigments are located to the outer membrane. R1: H or CH3, R2: H or Br, R3: a very polar moiety. TCA cycle: tricarboxylic acid cycle, FAS: fatty acid synthesis, ACC: acetyl-CoA carboxylase, RpfF: DSF synthetase, EPS: exopolysaccharide, NDP-sugars: nucleoside diphosphate sugars
图3. 野油菜黄单胞菌菌黄素生物合成途径模型图 [12] 。3-HBA首先被3-HBA:ACP连接酶(XanA2)激活连接至ACP上,从而起始下游聚酮合酶的反应,在KS/CLF (XanM/XanL)、KR (XanH)和DH (XanE)的共同作用下形成3-羟基苯–辛烯酰-ACP中间产物。接着在糖基转移酶(XanK)、卤化酶(XanB1或XanJ?)、酰基转移酶(XanD或XanF?)等修饰酶的作用下合成完整的菌黄素,然后菌黄素在转运蛋白的作用下结合至细菌外膜。缩写:TCA:三羧酸循环,FAS:脂肪酸合成酶,ACC:乙酰辅酶A脱羧酶,RfpF:DSF家族信号分子合成酶,NDP-sugar:核苷二磷酸激活的糖单元,R1:H或CH3,R2:H或Br,R3:未知的极性分子。
群体感应信号分子等。Poplawsky等 [29] 研究显示敲除敲除xanB不仅阻止了Xcc菌黄素的合成,还降低了胞外多糖的合成并促进了DSF信号分子的合成。敲除DSF合成酶rpfF使DSF家族信号分子无法合成,且提高了菌黄素的合成。Wang等 [30] 在Xoo中发现,同时敲除rpfC和rpfB能促进DSF信号分子的指数级增长,但胞外多糖和菌黄素的合成都受到抑制。Cao等 [12] 在Xcc中敲除xanH和xanK分别促进了DSF家族信号分子和胞外多糖的合成。以上的结果表明菌黄素、DSF家族信号分子和胞外多糖三者的代谢途径之间具有交互联系。笔者认为这种交互联系可以从以下几个方面解释:1) 这三种代谢产物的生物合成都需要碳源提供前体;2) DSF家族信号分子是通过脂肪酸合成途径来合成 [31] ,它与菌黄素共享丙二酰-CoA作为延伸单元;3) 菌黄素的结构很可能包含糖基化的修饰,它与胞外多糖都需要核苷激活的糖供体提供糖单元(见图3)。菌黄素与DSF家族信号分子、胞外多糖代谢途径之间的交互联系还需要更深入的研究。
5. 展望
近期的研究把菌黄素等含有芳香基多烯链核心结构的代谢产物归为一类,组成芳香基多烯类(Aryl Polyene, APE)代谢产物家族 [32] 。APE家族具有相对保守的生物合成基因簇。目前所报道的APE代谢产物主要有黄单胞菌科细菌产生的菌黄素(类)色素;拟杆菌门细菌产生的flexirubin黄色素 [33] ;根瘤内生菌Azoarcus属细菌产生arcuflavin色素 [28] ;大肠杆菌及费氏弧菌产生的APE化合物 [34] 。通过对原核生物基因组数据库进行分析发现,APE生物合成基因簇分布十分广泛,甚至大于类胡萝卜素生物合成基因簇的分布 [34] 。目前针对APE代谢产物的研究主要集中于新的APE代谢产物的发现及其生物合成机制。如此广泛地存在于细菌中预示着该类代谢产物具有重要的生物学意义。目前的研究显示APE代谢产物可能结合于细菌的外膜上,而外膜主要由脂多糖、磷脂和脂蛋白等物质组成,外膜对革兰氏阴性菌致病性、物质运输、结构稳定性非常重要,因此APE代谢产物在以上方面的生物学功能还需进一步研究。
已有的研究基本阐述了菌黄素的生物合成途径,但仍有疑问亟待解决。溴化修饰是陆生生物中罕见的生化反应,菌黄素的溴化反应机制还不清楚。根据基因簇功能分析,菌黄素可能存在糖基化修饰,然而菌黄素已知的结构中并无糖基团,是否菌黄素完整的结构中存在糖基化修饰仍需进一步阐述。植物受到病原菌侵染使会分泌大量酚类化合物,大部分酚类化合物能抑制细菌生长。菌单胞菌利用3-HBA或其它类似物合成菌黄素对其侵染植物具有重要意义。Wang等 [35] 在甘蓝中检测到3-HBA和4-HBA的存在,且4-HBA含量显著高于3-HBA,为黄单胞菌在植物体内合成菌黄素提供了基础。在植物体内,菌黄素的生物合成与功能鲜有研究。
黄单胞菌是一类十分重要的植物病原细菌,目前主要通过化学防治来应对黄单胞菌侵染。众所周知,化学农药容易使病原菌产生抗药性且带来环境污染等问题。菌黄素是黄单胞菌重要的致病因子,因此可以将菌黄素的生物合成途径作为靶标研发抑制剂。菌黄素生物合成抑制剂不会直接杀死细菌而是降低其在植物表层的活力,因此能减缓细菌耐药性的产生,是新型绿色农药的潜在先导物。
基金项目
国家自然科学基金(No. 31471743 & No. 31772121)。
文章引用
曹雪强,何亚文. 植物病原黄单胞菌菌黄素化学结构、生物学功能和生物合成机制研究进展
Research Progress of Xanthomonadin Chemical Structure, Biological Function and Biosynthesis Mechanism in Phytopathogen Xanthomonas[J]. 微生物前沿, 2018, 07(04): 156-164. https://doi.org/10.12677/AMB.2018.74019
参考文献
- 1. Narsing Rao, M.P., Xiao, M. and Li, W.-J. (2017) Fungal and Bacterial Pigments: Secondary Metabolites with Wide Applications. Frontiers in Microbiology, 8, 1113. https://doi.org/10.3389/fmicb.2017.01113
- 2. Tuli, H.S., Chaudhary, P., Beniwal, V., et al. (2015) Microbial Pigments as Natural Color Sources: Current Trends and Future Perspectives. Journal of Food Science and Technology. 52, 4669-4678. https://doi.org/10.1007/s13197-014-1601-6
- 3. Leyns, F., Marcel De, C., Jean-Guy, S., et al. (1984) The Host Range of the Genus Xanthomonas. Botanical Review, 50, 308-356. https://doi.org/10.1007/BF02862635
- 4. Buttner, D. and Bonas, U. (2010) Regulation and Secretion of Xanthomonas Virulence Factors. FEMS Microbiology Review, 34, 107-133. https://doi.org/10.1111/j.1574-6976.2009.00192.x
- 5. Starr, M.P. and Stephens, W.L. (1964) Pigmentation and Taxonomy of the Genus Xanthomonas. Journal of Bacteriology, 87, 293-302.
- 6. Andrewes, A.G., Jenkins, C.L., Starr, M.P., et al. (1976) Structure of Xanthomonadin I, a Novel Dibrominated Aryl-Polyene Pigment Produced by the Bacterium Xanthomonas juglandis. Tetrahedron Letters, 17, 4023-4024. https://doi.org/10.1016/S0040-4039(00)92565-6
- 7. Stephens, W.L. and Starr, M.P. (1963) Localization of Carotenoid Pigment in the Cytoplasmic Membrane of Xanthomonas juglandis. Journal of Bacteriology, 86, 1070-1074.
- 8. Andrewes, A.G., Hertzberg, S., Liaaen-Jensen, S., et al. (1973) The Xanthomonas “Carotenoids”—Non-Carotenoid Brominated Aryl-Polyene Esters. Acta Chemical Scandinavica, 27, 2383-2395. https://doi.org/10.3891/acta.chem.scand.27-2383
- 9. Aririatu, L.E. and Kester, A.S. (1985) Isolation and Characterization of the Pigment Esters of Xanthomonas juglandis (Campestris). Microbiology, 131, 2047-2052. https://doi.org/10.1099/00221287-131-8-2047
- 10. Dianese, J.C. and Schaad, N.W. (1982) Isolation and Characterization of Inner and Outer Membranes of Xanthomonas campestris pv. Campestris. Phytopathology, 72, 1284-1289. https://doi.org/10.1094/Phyto-72-1284
- 11. Moser, R., Aktas, M. and Narberhaus, F. (2014) Phosphatidylcholine Biosynthesis in Xanthomonas campestris via a Yeast-Like Acylation Pathway. Molecular Microbiology, 91, 736-750. https://doi.org/10.1111/mmi.12492
- 12. Cao, X.Q., Wang, J.Y., Zhou, L., et al. (2018) Biosynthesis of the Yellow Xanthomonadin Pigments Involves an ATP-Dependent 3-Hydroxybenzoic acid:acyl Carrier Protein Ligase and an Unusual Type II Polyketide Synthase Pathway. Molecular Microbiology, 110, 16-32. https://doi.org/10.1111/mmi.14064
- 13. Jenkins, C.L. and Starr, M.P. (1982) The Brominated aryl-polyene (Xanthomonadin) Pigments of Xanthomonas juglandis Protect against Photobiological Damage. Current Microbiology, 7, 323-326. https://doi.org/10.1007/BF01566872
- 14. Rajagopal, L., Sundari, C.S., Balasubramanian, D., et al. (1997) The Bacterial Pigment Xanthomonadin Offers Protection against Photodamage. FEBS Letter, 415, 125-128. https://doi.org/10.1016/S0014-5793(97)01109-5
- 15. 邹华松, 陈功友, 赖志兵, 等. 水稻黄单胞菌黄色素合成相关基因的克隆与鉴定[J]. 微生物学报, 2003, 43(2): 180-188.
- 16. Poplawsky, A.R., Urban, S.C. and Chun, W. (2000) Biological Role of Xanthomonadin Pigments in Xanthomonas campestris pv. campestris. Applied Environmental Microbiology, 66, 5123-5127. https://doi.org/10.1128/AEM.66.12.5123-5127.2000
- 17. Wang, Y., Qian, G., Li, Y., et al. (2013) Biosynthetic Mechanism for Sunscreens of the Biocontrol Agent Lysobacter enzymogenes. PLoS ONE, 8, e66633. https://doi.org/10.1371/journal.pone.0066633
- 18. He, Y.W., Wu, J., Zhou, L., et al. (2011) Xanthomonas campestris Diffusible Factor Is 3-Hydroxybenzoic Acid and Is Associated with Xanthomonadin Biosynthesis, Cell Viability, Antioxidant Activity, and Systemic Invasion. Molecular Plant-Microbe Interaction, 24, 948-957. https://doi.org/10.1094/MPMI-02-11-0031
- 19. Goel, A.K., Rajagopal, L. and Sonti, R.V. (2001) Pigment and Virulence Deficiencies Associated with Mutations in the aroE Gene of Xanthomonas oryzae pv. oryzae. Applied Environmental Microbiology, 67, 245-250. https://doi.org/10.1128/AEM.67.1.245-250.2001
- 20. Poplawsky, A.R., Kawalek, M.D. and Schaad, N.W. (1993) A Xanthomonadin-Encoding Gene Cluster for the Identification of Pathovars of Xanthomonas campestris. Molecular Plant-Microbe Interactions, 6, 545-552. https://doi.org/10.1094/MPMI-6-545
- 21. Poplawsky, A.R. and Chun, W. (1997) pigB Determines a Diffusible Factor Needed for Extracellular Polysaccharide Slime and Xanthomonadin Production in Xanthomonas campestris pv. campestris. Journal of Bacteriology, 179, 439-444. https://doi.org/10.1128/jb.179.2.439-444.1997
- 22. Goel, A.K., Rajagopal, L., Nagesh, N., et al. (2002) Genetic Locus Encoding Functions Involved in Biosynthesis and Outer Membrane Localization of Xanthomonadin in Xanthomonas oryzae pv. oryzae. Journal of Bacteriology, 184, 3539-3548. https://doi.org/10.1128/JB.184.13.3539-3548.2002
- 23. Zhou, L., Wang, J.-Y., Wang, J., et al. (2013) The Diffusible Factor Synthase xanB2 Is a Bifunctional Chorismatase That Links the Shikimate Pathway to Ubiquinone and Xanthomonadins Biosynthetic Pathways. Molecular Microbiology, 87, 80-93. https://doi.org/10.1111/mmi.12084
- 24. Poplawsky, A.R., Walters, D.M., Rouviere, P.E., et al. (2005) A Gene for a Dioxygenase-Like Protein Determines the Production of the df Signal in Xanthomonas campestris pv. campestris. Molecular Plant Pathology, 6, 653-657. https://doi.org/10.1111/j.1364-3703.2005.00307.x
- 25. Chun, W., Cui, J. and Poplawsky, A. (1997) Purification, Characterization and Biological Role of a Pheromone Produced by Xanthomonas campestris pv. campestris. Physiological and Molecular Plant Pathology, 51, 1-14. https://doi.org/10.1006/pmpp.1997.0096
- 26. Yajima, A., Imai, N., Poplawsky, A.R., et al. (2010) Synthesis of a Proposed Structure for the Diffusible Extracellular Factor of Xanthomonas campestris pv. campestris. Tetrahedron Letters, 51, 2074-2077. https://doi.org/10.1016/j.tetlet.2010.02.088
- 27. Zhou, L., Huang, T.W., Wang, J.Y., et al. (2013) The Rice Bacterial Pathogen Xanthomonas oryzae pv. oryzae Produces 3-Hydroxybenzoic Acid and 4-Hydroxybenzoic Acid via XanB2 for Use in Xanthomonadin, Ubiquinone, and Exopolysaccharide Biosynthesis. Molecular Plant-Microbe Interaction, 26, 1239-1248. https://doi.org/10.1094/MPMI-04-13-0112-R
- 28. Schöner, T.A., Fuchs, S.W., Reinhold-Hurek, B., et al. (2014) Identification and Biosynthesis of a Novel Xanthomonadin-Dialkylresorcinol-Hybrid from Azoarcus sp. BH72. PLoS ONE, 9, e90922. https://doi.org/10.1371/journal.pone.0090922
- 29. Poplawsky, A.R., Chun, W., Slater, H., et al. (1998) Synthesis of Extracellular Polysaccharide, Extracellular Enzymes, and Xanthomonadin in Xanthomonas campestris: Evidence for the Involvement of Two Intercellular Regulatory Signals. Molecular Plant-Microbe Interactions, 11, 68-70. https://doi.org/10.1094/MPMI.1998.11.1.68
- 30. Wang, X.Y., Zhou, L., Yang, J., et al. (2016) The rpfB-Dependent Quorum Sensing Signal Turnover System Is Required for Adaptation and Virulence in Rice Bacterial Blight Pathogen Xanthomonas oryzae pv. oryzae. Molecular Plant-Microbe Interaction, 29, 220-230. https://doi.org/10.1094/MPMI-09-15-0206-R
- 31. Zhou, L., Yu, Y., Chen, X., et al. (2015) The Multiple DSF-Family QS Signals Are Synthesized from Carbohydrate and Branched-Chain Amino Acids via the FAS Elongation Cycle. Scientific Reports, 5, Article No. 13294. https://doi.org/10.1038/srep13294
- 32. Schoner, T.A., Gassel, S., Osawa, A., et al. (2016) Aryl Polyenes, a Highly Abundant Class of Bacterial Natural Products, Are Functionally Related to Antioxidative Carotenoids. ChemBioChem, 17, 247-253. https://doi.org/10.1002/cbic.201500474
- 33. Achenbach, H., Kohl, W., Wachter, W., et al. (1978) Investigations of the Pigments from Cytophaga johnsonae Cyj1. Archives of Microbiology, 117, 253-257. https://doi.org/10.1007/BF00738543
- 34. Cimermancic, P., Medema, M.H., Claesen, J., et al. (2014) Insights into Secondary Metabolism from a Global Analysis of Prokaryotic Biosynthetic Gene Clusters. Cell, 158, 412-421. https://doi.org/10.1016/j.cell.2014.06.034
- 35. Wang, J.-Y., Zhou, L., Chen, B., et al. (2015) A Functional 4-Hydroxybenzoate Degradation Pathway in the Phytopathogen Xanthomonas campestris Is Required for Full Pathogenicity. Scientific Reports, 5, Article No. 18456. https://doi.org/10.1038/srep18456