Journal of Organic Chemistry Research
Vol.03 No.01(2015), Article ID:14818,7
pages
10.12677/JOCR.2015.31004
Discussion on Teaching and Learning of the Acid-Base Theory in Inorganic Chemistry and Organic Chemistry
Dingjian Cai, Jiangfei Guo, Baoquan Xu
School of Metallurgy and Chemical Engineering, Jiangxi University of Science and Technology, Ganzhou Jiangxi
Email: 13307076865@126.com
Received: Jan. 24th, 2015; accepted: Feb. 4th, 2015; published: Feb. 10th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In the teaching activities, teaching and learning supplement and interrelate with each other. Teachers focus on teaching, while students focus on learning. In order to cultivate students to master theoretical knowledge and improve the abilities of cognizing, analyzing and solving problems, this paper introduces the application of the acid-base theory in inorganic chemistry and organic chemistry from many aspects.
Keywords:The Acid-Base Theory, Acid-Base Strength and Stability, Electrophilic and Nuclear Reaction, Solubility, The Direction of the Chemical Reaction
刍议酸碱理论在无机化学 和有机化学中的教与学
蔡定建,郭江飞,许宝泉
江西理工大学冶金与化学工程学院,江西 赣州
Email: 13307076865@126.com
收稿日期:2015年1月24日;录用日期:2015年2月4日;发布日期:2015年2月10日

摘 要
在教学活动中,教与学相辅相成,相互关联,教师注重于教,学生注重于学.为了培养学生掌握扎实理论知识,提高认识、分析、解决问题的能力,本文从本质上,通过多个方面分析介绍了酸碱理论在无机化学和有机化学上的应用研究。
关键词 :酸碱理论,酸碱强弱和稳定性,亲电和亲核反应,溶解性,化学反应的方向

1. 酸碱理论的发展情况
自古以来,人们对酸碱的性质逐步有所认识和了解。随着科学技术的发展,人们对酸碱的认识逐步深化。1923年,丹麦化学家J.N.Bronsted和英国化学家T.M.Lowery在研究近代酸碱理论基础上,分别独立地提出了质子理论,又称为Bronsted-Lowry酸碱理论,简而言之,酸是质子的给予体,碱是质子的接受体。1923年,美国化学家G.N.Lewis在根据电子对的配给和接受的研究中提出了酸碱电子理论,又称为Lewis酸碱理论,简言之,酸是电子对的接受体,碱是电子对的给予体[1] 。基于对酸碱电子理论实验和观察现象的研究,1963年,美国化学家R.G.Pearson根据不同酸碱抓电子的松紧程度提出了硬软酸碱理论,亦称HSAB理论,即“软亲软,硬亲硬,软硬交界就不管”,软碱容易与软酸结合,硬碱容易与硬酸结合。而且,近几年来,酸碱理论在化学的许多领域里得到了广泛的应用,我们可以根据酸碱理论来解释无机化学和有机化学中的化合物的酸碱强弱和稳定性,溶解性,化学反应进行的方向等多个方面[2] 。
2. 酸和碱的相对强弱
质子理论的酸碱的强弱是跟酸碱给出质子和接受质子的强力有关。
酸碱的关系如下式表示:

化合物给出质子的能力越大,酸性越强。如: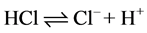 。
。
化合物给出质子的能力越小,酸性越弱。如: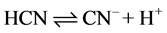 。
。
化合物接受质子的能力越大,碱性越强。如: 。
。
化合物接受质子的能力越小,碱性越弱。如: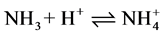 。
。
对于共轭酸碱对来说,他们有着一定的强弱关系,酸越强其共轭碱越弱,碱越强其共轭酸越弱。例如,NH3和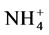 是共轭酸碱对,NH3是弱碱,
是共轭酸碱对,NH3是弱碱,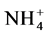 是强酸。HCl和
是强酸。HCl和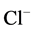 为共轭酸碱对,HCl是强酸,
为共轭酸碱对,HCl是强酸,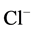 弱碱[3] 。
弱碱[3] 。
3. 非水溶剂中酸碱
质子理论虽然将酸碱的强弱首先取决于物质本身的性质,但是在一定程度上,溶剂的性质也对溶质的酸碱性有着一定的影响,这种影响在非水溶剂中表现的比较明显。
硝酸在水中表现为强酸,但在纯硫酸中表现为接受质子的碱。
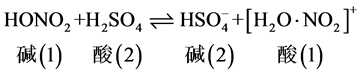
碱(1)和酸(1)是共轭酸碱,HNO3作为碱,其共轭酸是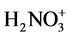 ,继续反应生成
,继续反应生成 离子。
离子。
其总反应式为: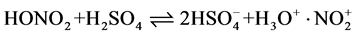 。
。
又如:在水中NH3是弱碱,在非水溶剂液氨,NH3是两性物质,NH3可以给出质子变成酸了。NH3的共轭酸碱是 的共轭碱是
的共轭碱是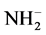 。
。

由上述反应中可以清楚地明白酸碱的相对性,及溶剂的性质对化合物酸碱性的影响[4] 。
4. 酸碱的强弱和稳定性
由酸碱质子理论可知,在水溶剂中,氢卤酸HX在水中能给予质子是酸,水能接受质子是碱。

根据软硬酸碱理论,其中H+是硬酸,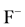 ,
,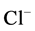 是硬碱,
是硬碱,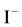 是软碱,即卤素的硬度大小顺序:
是软碱,即卤素的硬度大小顺序: ,即外层电子吸引的越来越松,氢卤酸的稳定性顺序,同卤素气态氢化物的稳定性随原子序数的增加而减弱,HF > HCl > HBr > HI,故而氢卤酸的酸性强弱正好相反,HI > HBr > HCl > HF [5] 。
,即外层电子吸引的越来越松,氢卤酸的稳定性顺序,同卤素气态氢化物的稳定性随原子序数的增加而减弱,HF > HCl > HBr > HI,故而氢卤酸的酸性强弱正好相反,HI > HBr > HCl > HF [5] 。
对于含氧酸H2SO4与HNO3的酸性,H2SO4与HNO3的酸性和稳定性均比H2SO3和HNO2的大,正是由于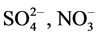 都是硬碱,H+是硬酸,H2SO4和HNO3都是硬酸–硬碱结合形成的化合物,从而导致H2SO4与HNO3的酸性和稳定性比较好。
都是硬碱,H+是硬酸,H2SO4和HNO3都是硬酸–硬碱结合形成的化合物,从而导致H2SO4与HNO3的酸性和稳定性比较好。
有机酸氯乙酸的酸性大于乙酸的酸性,是由于氯原子的电负性大,对电子具有诱导效应,体系中电子云偏向氯原子,加强了化合物给出H+的能力,从而酸性氯乙酸大于乙酸[6] 。

有机化学中,羧酸和苯酚分子均显酸性,-OH的氧原子具有孤对电子可以与C=O或苯环的π键形成P-π共轭,导致与氧原子相连氢原子的电负性减弱,增强了H+的离去,进而显酸性[7] 。


5. 对亲电加成反应的解释
有机物不对称烯烃和不对称试剂进行亲电加成时,产生马氏规则。在有机化学中,亲电试剂需要电子,由酸碱电子理论可知亲核试剂是Lewis酸。如丙烯与作为亲电试剂的Lewis酸HBr和HBrO进行亲电加成反应[8] 。
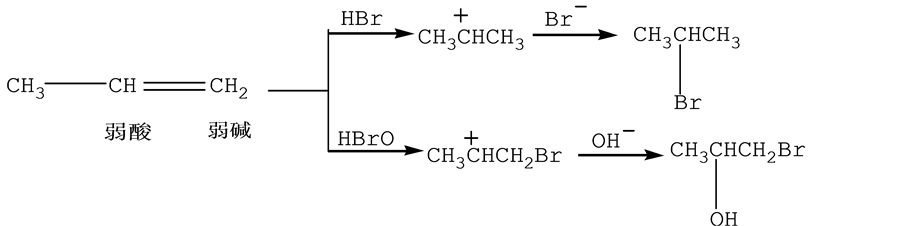
由上面例子可以看出,首先是比碱更强的Lewis酸H+和Br−进攻丙烯生成较强的Lewis酸,从而形成产物。该反应的关键是比较亲电试剂Lewis酸的强弱。然后,生成物也与马氏规则理论相符合。进而我们可以更好地说明酸碱理论对于亲电加成反应是亲电试剂正电性部分首先进攻的现象,也解释了亲电加成反应遵循马氏规则的正负相吸[9] 。
6. 对双分子亲核取代反应的解释
在有机化学中,亲核试剂Nu−带有负电荷或未共用电子对进攻中心碳原子,由酸碱电子理论可知,亲核试剂是Lewis碱。
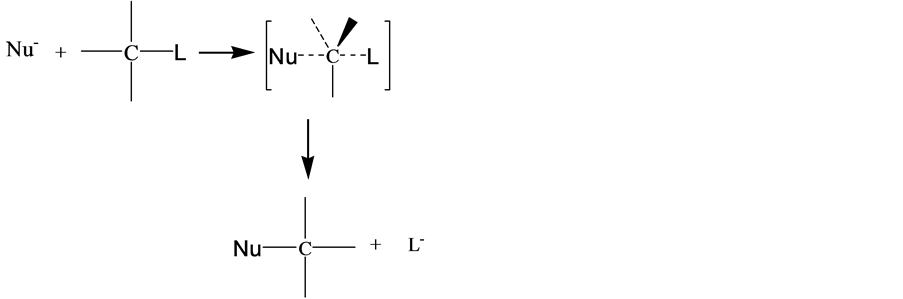
在双分子亲核反应中,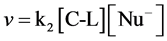 ,
, 的浓度影响着反应速率,亲核试剂的碱性愈强,反应进行的愈快。当亲核试剂OH−进攻时,与中心碳原子发生部分键合。C-L键的断裂和C-OH键的形成同时进行,且两者处于均势时,存在一个过渡态Nu…C…L中间态不稳定,C-L键的断裂和C-OH的形成一步完成,形成产物[10] 。
的浓度影响着反应速率,亲核试剂的碱性愈强,反应进行的愈快。当亲核试剂OH−进攻时,与中心碳原子发生部分键合。C-L键的断裂和C-OH键的形成同时进行,且两者处于均势时,存在一个过渡态Nu…C…L中间态不稳定,C-L键的断裂和C-OH的形成一步完成,形成产物[10] 。
7. 亲电加成反应
有些络合物是化合物相互接近进行相互作用时,电荷发生了转移,从而两者酸碱性彼此加强而络合,叫做电荷转移络合物。烯烃中C=C含有较弱的π键,由于π电子受束缚力较小,流动性大而又极易极化,较易给出电子。根据Lewis酸碱理论,烯烃是Lewis碱。如,烯烃与溴的四氯化碳溶液的反应[11] 。
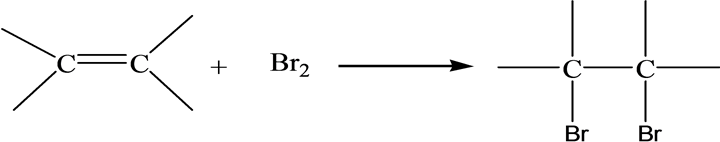
8. 化合物的溶解性
无机化合物的溶解可以理解为溶质和溶剂间的酸碱作用,根据相似相溶的规律,软溶质易溶于软溶剂中,溶剂硬溶质易溶于硬溶剂。如硬溶质的无机盐一般均溶于硬溶剂的水,而且,水为两性溶剂,是离子型化合物的良好溶剂。但当由软–软,硬–硬结合的化合物间的静电引力大,比较稳定,不容易溶于水,如:HgI2,AgSCN,CaCO3,BaSO4等。由软–硬结合的化合物静电引力小,稳定性较差,较易溶于水,如:AgCl,NaHS,LiI,CuCl等。所以,软–硬结合的化合物能溶于水[12] 。
大多数的有机化合物较难溶于水,易溶于有机溶剂。由于有机化合物极性小,为软溶质,水为硬溶剂,苯,四氯化碳等为软溶剂,故大多数有机物难溶于水易溶于有机溶剂。而少数有机化合物溶于硬溶质水,如乙醇。故而,有机物极性越小,越易溶于有机溶剂。所以,由软–软,硬–硬结合的离子型化合物和极性有机物易溶于硬溶剂水;而非极性有机物易溶于软溶剂苯,四氯化碳等[13] 。
9. 醚类络合物的反应
有机物醚类化合物含有孤对电子,是Lewis碱,可以和BF3,AlCl3等缺电子的Lewis酸反应,生成络合物。
乙醚CH3CH2OCH2CH3和乙硫醚CH3CH2SCH2CH3都为Lewis碱。当乙醚CH3CH2OCH2CH3与,AlCl3进行反应,生成络合物,AlCl3-O(CH2CH3)。乙硫醚CH3CH2SCH2CH3也与,AlCl3反应生成络合物AlCl3-S(CH2CH3)。然而,根据软硬酸碱理论,我们知道AlCl3是硬酸,乙醚CH3CH2OCH2CH3是硬碱,乙硫醚CH3CH2SCH2CH3是软碱,所以AlCl3-O(CH2CH3)是硬酸–硬碱结合形成的络合物,比较稳定。而AlCl3-S(CH2CH3)是硬酸–软碱结合形成的络合物,稳定性较差。从而,络合物AlCl3-O(CH2CH3)比AlCl3-S(CH2CH3)稳定[14] 。
10. 预测和解释化学反应方向
酸碱反应的发生,不仅与反应的酸和碱的强度有关,而且也与酸和碱的软度和硬度的性质相关联。所有的反应都向着生成由硬–硬或软–软结合形成稳定化合物方向进行。如下列无机反应,在稀溶液AgF中依次加入NaCl,KBr,及NaI溶液,就会生成沉淀和配离子交替形成的过程:

上述交替过程表明,与软酸Ag+结合的碱的软硬顺序:
从左到右依次硬度逐渐减小, 。
。
根据上述碱的硬度减小可以预测AgCl和NaI的反应方向,
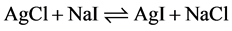
其中AgCl和NaI都是由软–硬结合,不稳定。而AgI和NaCl是由软–软和硬–硬结合而稳定。所以反应方向向右进行[15] 。

有机物甲酮与氨基脲的反应中,硬酸甲酮与硬碱氨基脲反应生成稳定的缩氨脲,故反应方向从左向右进行是很显然的[16] 。
11. 金属催化剂中毒的现象
大家都知道,中毒包括可逆和不可逆两种类型。Fe作为催化剂时易中毒,当与O2和H2O结合易失去活性,但可以再进行活化,恢复催化活性。当与S,CO等结合,金属失去催化活性,不能恢复。这是因为O2和H2O均为硬碱,Fe为软酸,由于软–硬结合形成的络合物不稳定,极易分解,导致Fe恢复催化活性,故而为可逆中毒;而S,CO等为软碱,软–软结合形成的络合物比较稳定,不易分解,Fe不能恢复催化活性,故而为永久中毒。Pt作为催化剂时,低氧化态的P,Se等化合物可以使催化剂中毒。由于Pt是是软酸,低氧化态的P,Se等是软碱,两者结合形成稳定的酸碱络合物,从而金属失去催化活性,为永久中毒[17] 。
12. 结语
由上可知,酸碱理论可以更好地来进行解释和说明许多有机化学和无机化学的化合物的性质和反应现象。在一定程度上,酸碱理论为有机化学与无机化学建立起桥梁,提供一定的交流“平台”,促使了老师的教和学生的学。使有机化学与无机化学联系更加紧密,老师和学生也可以更好地理解化学各方面的性质,为将来化学的研究开辟了一条新的道路。总之,酸碱理论在化学领域中的用途非常广泛,对学好化学具有重要的指导意义。
基金项目
2012年江西省高等学校省级教改课题,赣教高字[2012]82号;2015年度江西理工大学校级教改课题。
文章引用
蔡定建,郭江飞,许宝泉. 刍议酸碱理论在无机化学和有机化学中的教与学
Discussion on Teaching and Learning of the Acid-Base Theory in Inorganic Chemistry and Organic Chemistry[J]. 有机化学研究, 2015, 03(01): 25-31. http://dx.doi.org/10.12677/JOCR.2015.31004
参考文献 (References)
- 1. 大连理工大学无机化学教研室 (2007) 无机化学(第五版). 高等教育出版社, 北京, 5.
- 2. 陈孟阳 (1988) 略论近代酸碱理论的发展. 湘潭大学自然科学学报, 3, 25-28.
- 3. 张小惠 (1990) 对提高《无机化学》课程教学质量的尝试. 江西理工大学学报, 2, 128-130.
- 4. 黄元乔 (2003) Lewis电子论中的软硬酸碱规则. 培训与研究: 湖北教育学院学报, 2, 26-27.
- 5. 戚冠发 (1982) 酸碱概念及其在化学教学中的应用. 辽宁师范大学学报(自然科学版), 4, 35-36
- 6. 邢其毅 (2009) 基础有机化学(第三版)(上册). 高等教育出版社, 北京, 5.
- 7. 杨玉权 (1993) 酸碱理论在有机化学中的广泛应用. 承德民族师专学报, 3, 74-76.
- 8. 熊晚枫, 巢志聪, 蔡定建 (2015) 酸碱理论及其在有机反应中的应用研究. 广东化工, 3, 73-74.
- 9. 戎关镛 (1988) 电子的碱性与物质的酸碱性质. 江西理工大学学报, 1, 94-100.
- 10. 任有达 (1979) 酸碱理论及其在有机化学中的应用. 人民教育出版社, 北京, 9.
- 11. 何成俊 (1994) 软硬酸碱理论在无机化学教学中的应用. 江苏广播电视大学学报, 4, 37-38.
- 12. 刘清福 (1997) 论软硬酸碱原理在有机化学中的应用. 邢台师范高专学报, 4, 119-122.
- 13. 高鸿宾, 编 (2004) 有机化学(第四版). 高等教育出版社, 北京.
- 14. 张玲, 曾春水 (2000) 有机化学中的氧化还原反应浅析. 江西有色金属, 3, 36-37.
- 15. 王舜, 胡茂林 (1999) 软硬酸碱理论及其在无机化学教学中的应用. 湖州师范学院学报, S1, 63-65.
- 16. 吕萍, 王彦广 (2014) 有机反应中的亲核性和碱性. 大学化学, 1, 40-47.
- 17. 陈婉眉 (1987) 略谈软硬酸碱原则在无机化学中的某些应用. 衡阳师范学院学报, 2, 78-80.