Journal of Organic Chemistry Research
Vol.05 No.01(2017), Article ID:19996,13
pages
10.12677/JOCR.2017.51004
Introduction to Fluorescent Dyes and Development of BODIPY Classes
Wen Zhen, Nanxiang Wang, Xin Qi*
College of Material Science and Technology, Nanjing University of Aeronautics and Astronautics, Nanjing Jiangsu

Received: Mar. 8th, 2017; accepted: Mar. 25th, 2017; published: Mar. 28th, 2017

ABSTRACT
Fluorescence spectroscopy and fluorescence imaging are becoming indispensable tools in today’s scientific research. With the rapid development of research, organic fluorescent dyes have been widely used in protein labeling, DNA detection and environmental testing. Because of its excellent photodynamic properties, BODIPY fluorescent dyes are particularly bright in a large number of fluorescent dyes. Fluorescence analysis has the advantages of high selectivity, high sensitivity and high fluorescence quantum yield.
Keywords:Fluorescent Dyes, BODIPY, Structure and Properties, Development Process
荧光染料的简介及BODIPY类的发展历程
甄文,王南翔,祁欣*
南京航空航天大学材料科学与技术学院,江苏 南京
收稿日期:2017年3月8日;录用日期:2017年3月25日;发布日期:2017年3月28日

摘 要
荧光光谱和荧光成像是当今科学研究必不可少的工具。在近几年飞速发展的研究进展中,有机荧光染料已被广泛应用于蛋白质标记、DNA检测和环境检测等领域。BODIPY荧光染料因其独特优良的光动力学性质而在众多荧光染料中显得格外耀眼,并逐渐成为科研工作者的研究焦点。荧光分析法具有高选择性、高灵敏度、高荧光量子产率等优点。
关键词 :荧光染料,BODIPY类,结构和性质,发展历程

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
有机荧光材料 [1] 在生物成像方面是一类应用性很强的发光材料,在近几年飞速发展的研究进展中,有机荧光染料已被广泛应用于标记蛋白质、DNA检测和环境检测等领域 [2] [3] 。有机荧光材料基于单光子激发过程,常以能量较高,波长较短的光激发,发射光具有能量较低,波长较长的特点。高选择性、高灵敏度、高荧光量子产率等都是有机荧光化合物的优点 [4] [5] [6] [7] [8] 。BODIPY荧光染料因其独特优良的光动力学性质而在众多荧光染料中显得格外耀眼,并逐渐成为科研工作者的研究焦点。
2. 荧光染料的简介
荧光染料[9]的种类繁多,其中罗丹明和荧光素是应用最广泛的两种荧光染料,已有大量文献对这两种荧光染料的性能和应用进行了研究和探讨。常见的荧光染料还有香豆素类、芘类、萘酰亚胺类、菁染料、含四吡咯基团的荧光染料、噻嗪和噁嗪类的染料、稀土配合物类荧光染料等:
2.1. 罗丹明和荧光素
荧光素和罗丹明 [10] - [20] 是最常见的两种荧光染料(如图1)。它在水中的溶解性较好,有吸收、发射波长较长(一般>500 nm),光稳定较好,荧光量子产率高等优点。但因为荧光素和罗丹明染料中有羟基和氨基,使得其对pH比较敏感,将这两种染料应用于离子检测或荧光探针中时,要严格控制工作环境的pH [21] 。
2.2. 香豆素
香豆素染料(如图2)本身没有荧光,但它与某些取代基结合后会发出荧光,香豆素染料中不同位置R1、R2、R3与不同取代基结合后,其荧光强度会发生变化。香豆素染料 [22] [23] 的Stokes位移大、光稳定性好、对细胞的穿透能力强,因此香豆素染料可应用于细胞学等生物领域。香豆素染料也有其缺点,
 (a) (b)
(a) (b)
Figure 1. The maternal structure of fluorescein (a) and rhodamine (b)
图1. 荧光素(a)和罗丹明(b)的母体结构
它的最大吸收、发射波长短(<400 nm),碱性溶液中,香豆素染料分子内的不饱和内酯结构容易发生水解,极其不稳定 [24] 。
2.3. 菁染料
菁染料 [25] (如图3)的最大吸收波长较大,l的数值都会超过600 nm,因此,菁染料在近红外区应用于荧光标记效果很理想。同样,通过引入不同的R1、R2基团,对菁染料的母体结构有很大影响,从而改变菁染料的光谱性质。另外,菁染料的荧光量子效率相比其他染料较低,与此同时,多川结构的菁染料容易发生聚集,由此菁染料的应用受到很大限制。
2.4. 芘类染料
芘类染料与香豆素染料类似,芘类染料母体(如图4)荧光性能一般,其母体结构与供电子基团发生共轭时,芘类染料的荧光性能便会加强(荧光量子产率可达50%以上)。芘类染料母体中的四个六元环是共面的,这个结构决定了芘类染料具有积聚效应。积聚效应使芘类染料在470 nm处有荧光发射,基于芘类染料的这个特点,可以利用其来设计荧光探针,目前报道的芘基激缔化合物荧光探针就是利用芘类染料的这一特性制成的 [26] 。芘类染料的这一平面结构特性也可被用作DNA嵌入型探针。芘类染料还具有许多优良的特性,例如:不易受外界酸碱性的影响,较高的光稳定性等。但是它也有不足之处,例如:芘类染料的最大发射波长短(<370 nm),溶解性差,容易受到生物体内各中物质的干扰等。
2.5. 萘酰亚胺类
萘酰亚胺类染料多应用于生物方面的研究,例如与DNA相结合。利用萘酰亚胺类染料的特殊性质,将其转变为DNA嵌入材料,在生物标记等方面的应用性很强 [27] [28] [29] [30] [31] ,并且萘酰亚胺类染料荧光量子效率高,因此,萘酰亚胺类染料可被广泛应用于生物标记物领域。但是这类染料也具有吸收
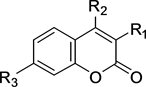
Figure 2. Maternal structure of coumarin
图2. 香豆素的母体结构
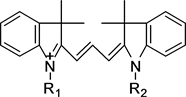
Figure 3. Cyanine dye matrix structure
图3. 菁染料的母体结构
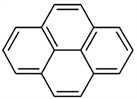
Figure 4. The parent structure of pyrene
图4. 芘类的母体结构
及发射波长较短的问题,在图5中,当R2和R3与母体结构发生共轭,电子云密度变大时,萘酰亚胺母体结构的最大吸收波长变大。此外,萘酰亚胺类染料与其他类型的染料相比,颜色浅,并且e数值低。
2.6. 噻嗪和噁嗪类的染料
其他小分子染料如噻嗪类和噁嗪类(如图6),这些小分子染料具有合成难度低,在近红外区就有最大吸收以及发射等优势,但是这类小分子染料的荧光量子效率低,耐尔蓝 [32] 、耐尔红 [33] 、亚甲基蓝 [34] 、噁嗪 [35] 是这类小分子染料中极具代表性的物质。
2.7. 稀土配合物类荧光染料
荧光强度大的荧光化合物还有稀土(Eu3、Tb3)配合物,它们的光寿命长、Stokes位移大,可以用于荧光标记和时间分辨荧光检测 [36] 。但是稀土配合物类荧光染料也有它的不足之处,许多稀土配合物荧光染料的激发波长较短,一般在紫外或近紫外区。对于一些要求荧光激发波长较长的设备,稀土配合物荧光染料则不能满足其需求。
2.8. 含四吡咯基团的荧光染料
含四吡咯基团的荧光染料(如图7)的激发波长较长,一般都处于红外区,这类荧光染料主要有两种,一种是卟啉,另一种是酞箐。卟啉主要应用于生物科学领域。将荧光染料卟啉与蛋白质、核酸、脂质、糖类、DNA等生物大分子结合,可以对它们的结构和性能进行分析检测,用于判断生物大分子的结构和性能是否发生改变。卟啉与DNA有多种作用方式,例如:静电作用、嵌入作用和堆积作用 [37] 。酞箐的热稳定性强,它主要应用于疾病诊断等生物医学方面 [38] 。但是含四吡咯基团的荧光染料的溶解性差,并且其分子结构较大,因此它在生物应用方面有一定的局限性。
3. BODIPY染料的研究
3.1. BODIPY的结构和性质
近年来,BODIPY染料由于其优良的性质和广阔的应用前景受到了众多科研工作者的广泛关注,因而对BODIPY染料的研究取得了较大的进展 [39] 。BODIPY的结构如图8所示,它的母体结构中,在络合的硼桥键和甲川桥键的共同作用下,将两侧的吡咯环固定在同一个平面上,使整个体系的骨架原子达到极好的共轭状态,为其吸收光能奠定了良好的基础。由于整个体系的结构具有一定的刚性,BODIPY

Figure 5. The parent structure of naphthalimide
图5. 萘酰亚胺的母体结构

Figure 6. Molecular structure of Nile blue, methylene blue and oxazine 750
图6. 耐尔蓝、亚甲基蓝和噁嗪750的分子结构
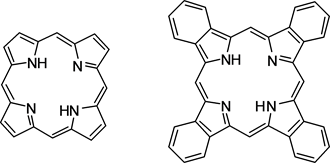
Figure 7. Maternal structure of porphyrin and phthalocyanine
图7. 卟啉和酞箐的母体结构
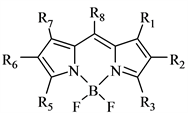
Figure 8. BODIPY dye maternal structure
图8. BODIPY染料的母体结构
类荧光染料具有良好的稳定性、优良的光学性能,主要表现在以下几个方面:
BODIPY的光谱峰宽比较窄,在光学领域和生物学领域进行分析检测时,光谱峰宽较窄,检测灵敏度较高,并且减少了待测样品的用量。测得的结果中,荧光光谱上会出现更为明显的荧光吸收和发射的变化,这样更精确地测得了样品的含量。
在整个BODIPY分子中,并不存在负电荷。因而在溶液中,溶液中的离子无法与缺少电荷的BODIPY分子发生静电作用,这样非常有效的避免了测定时静电作用对测量结果的干扰,使测定过程更加稳定,测得结果更加精准。
BODIPY类荧光染料的光稳定性能非常优越,当它被激发到达激发态时,不会因为很长时间的激发而在分析测定过程中发生激发态的分解或其他变化,这样测得的荧光光谱更加准确可信。
BODIPY分子的荧光量子产率非常高,一般都能达到0.6。其他被修饰过的BODIPY染料,其荧光量子产率甚至接近1.0。一般普通的染料在水溶液中其荧光量子产率会变低,有的甚至被猝灭。对于BODIPY分子来说,在水溶液中其荧光量子产率虽然有所下降,但它仍然能保持较高的荧光量子产率。
由BODIPY的母体结构可知,他的母体结构上的取代基一般不会出现氨基或羧基这类对酸碱敏感的活性基团。因此外界的酸碱度对其影响会大幅度减小,因此BODIPY染料不会轻易变质。
BODIPY类荧光染料对光的感应度很高,并且它还有高的摩尔消光系数,有些经过修饰后的BODIPY染料在水溶液中的溶解度也较高,再加上它在水中不易被猝灭这一优异的性能,使得BODIPY在光学、生物学、分析学领域有着极其广泛的应用。
3.2. BODIPY类荧光染料的发展历程
BODIPY母体结构最初是由德国化学家Treibs, A.和kreuzer, F. H.在1968年合成的,他们合成的BODIPY 类荧光染料 [40] 。另外,他们还合成了BODIPY染料的母体结构。在BODIPY母体结构中,Treibs, A.和kreuzer, F. H.在R1-R7中用不同基团取代得到不同的衍生产物。人们根据Treibs, A.和kreuzer, F. H.的前期探索,对BODIPY类染料做出了多种结构修饰,这大大丰富了BODIPY的种类,使其迅猛发展。
1977年,Vos de Wael和Pardeon J.A.等人 [41] 研究出了BODIPY不同位上被不同取代基取代的BODIPY类染料,研究结果表明:当2,6位上有不同取代基时,会使BODIPY的荧光变化非常明显,有的甚至会增大荧光发射波长。
1985年,Worries H.J.和KoekJ.H.等人 [42] 成功研制出一种水溶性的BODIPY荧光染料,如图9所示,该染料的2位上被磺酸基团取代。水溶性BODIPY荧光染料的合成开拓出BODIPY类染料的发展,使BODIPY类染料的研究具有更广阔的应用前景,吸引了相当多的化学工作者对BODIPY类染料进行探索。
1988年,Haugland R.P.和Kang H.C.等人研制出许多不同种类的BODIPY荧光染料 [43] ,其中贡献最为突出的是在BODIPY类染料母体的1、3位引入苯基,图10所示。苯基的引入增强了母体的共轭性,使这种类型的BODIPY染料的发射波长向长波移动。
1993年,Kang H.C.发表了一篇新的专利 [44] ,该专利主要阐述了约60种长波长的BODIPY染料的合成方法,如图11所示。这类长波长荧光染料的取代位置主要集中在3位以及5位,但这类BODIPY染料也有很多不足之处,例如,它的合成条件困难且方法不易,吸收和发射波长较短,都小于600 nm。
1995年,Kang H.C.和Haugland R.P.等人 [45] 探索出波长更长的BODIPY染料的合成方法,如图12所示。他们使用邻苯二羰基与羟胺反应,得到异吲哚二甲基,然后在三氟化硼乙醚络合物作用下得到产物。这种染料的共轭程度较大且波长更长,其最大吸收波长可达到700 nm左右,几乎达到了近红外光区,非常具有代表性,也因此促进了长波长的BODIPY染料的发展。
1999年,Kelvin Burgess首次使用酰氯与苯环取代的吡咯进行反应,得到了最大吸收波长较长的一类BODIPY染料(图13)。之前合成BODIPY类一直采用醛类化合物,而酰氯的活性比醛类要高,在此反应
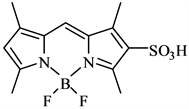
Figure 9. Introduce a sulfonic acid group of BODIPY dye
图9. 引入磺酸基的BODIPY染料

Figure 10. The earliest long wavelength BODIPY dye
图10. 最早的长波长BODIPY类染料
 (a) (b)
(a) (b)
Figure 11. BODIPY dye containing pentane heterocycle (a) and naphthalene ethylene (b)
图11. 含五元杂环(a)和萘乙烯(b)的BODIPY染料
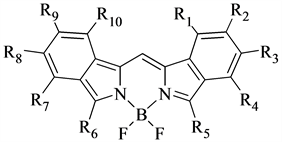
Figure 12. The large conjugated system synthesized by indole
图12. 由吲哚合成的大共轭体系结构

Figure 13. BODIPY dye containing aromatic groups
图13. 含有芳香基团的BODIPY染料
中,酰氯的使用使反应时间有所缩短,反应收率有所提高,后处理也会更简便。
仅在一年之后,Kelvin Burgess的研究小组 [46] 继续探索得出另一系列BODIPY荧光染料的合成方法,合成结构如下图14(a)所示,在此结构中,整个分子结构的刚性大大增加,使得整个分子的共轭程度也大大增加,这类BODIPY染料的最大吸收波长都较大,一般不低于650 nm,这就使得这类BODIPY类染料具有很大的创新性,但是,这类分子的吡咯杂环合成难度大,而且存在荧光量子产率较低的缺点,这就使得这类BODIPY类染料的应用价值不高 [47] [48] 。而Knut [49] 等人探索合成出一种能对Ag2+进行识别的一种BODIPY类荧光分子探针,这类BODIPY荧光化合物含有单氮杂冠醚基团,而且这类BODIPY荧光化合物在与Mg2+和Hg2+结合时,也会使本身的荧光性大大增强。
2005年Yoon等人 [50] 合成出一种能与Cu2+以及Pb2+进行螯合的一种BODIPY分子结构。利用这种BODIPY类染料的性质,便可对Cu2+以及Pb2+进行识别,见图15(a)。Zhao. W等 [51] 合成出一类平面性以及刚性结构都很强的BODIPY染料,这类BODIPY染料是利用其母核的3,5位,对苯环进行固定,这就使得这类染料的最大吸收波长在近红外区,730 nm左右。
2009年,Ikeda等人 [52] 探索出大共轭体系的荧光染料结构的合成方法(图16),其中具有与N、B和O结合而形成的大刚性平面结构,增加了整个母核的共轭体系,因此此类化合物的最大吸收波长较长,并且荧光量子效率高,这种新的合成方法,为后来的化学工作者们所借鉴,拓宽了大共轭结构染料的合成思路。
2010年,Brellier等人 [53] 通过连接NTA的方法(图17),在BODIPY上引入了这种新的基团,这种BODIPY荧光化合物在生物体系中,如细胞、蛋白质,水溶性好,并且在此体系中,对这类BODIPY荧光化合物的光谱性能等并没有什么影响。
同年Mariusz Tasior等人 [54] 成功合成了在细胞上很容易实现成像的被羧酸阴离子和氨基阳离子取代的染料(图18),该染料具备了很好的水溶性,在有机溶剂和水中都显示出良好的光学性质。
2012年,Song Linniu [55] 等人合成了一个系列水溶性的荧光染料,如图19。他们的研究表明了B原子上的取代与荧光染料的荧光量子产率有相关性。通过改性研究,在溶液中的染料可以避免聚集。他
 (a) (b)
(a) (b)
Figure 14. Dye structure of large conjugated structure, rigid conjugate and aza crown ether
图14. 大共轭结构、刚性共轭以及氮杂冠醚的染料结构。(a)刚性共轭结构;(b)含氮杂冠醚结构的探针
 (a) (b)
(a) (b)
Figure 15. Cu2+ and azole fluorescence probe structure
图15. Cu2+及唑系荧光探针结构。(a)检测Cu2+探针结构;(b)唑系探针结构
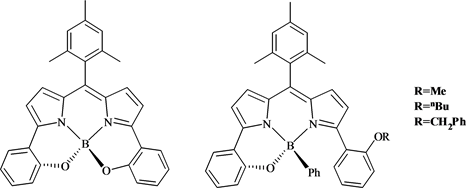 (a) (b)
(a) (b)
Figure 16. Large conjugate rigid planar fluorescent structure
图16. 大共轭刚性平面荧光结构

Figure 17. NTA probe structure
图17. NTA探针结构

Figure 18. Acid anions and amino cation-substituted fluorescent dyes
图18. 酸阴离子和氨基阳离子取代的荧光染料

Figure 19. Water-soluble dye structures
图19. 水溶性染料结构
们同时探索研究了在生理环境下将合成出的一系列水溶性荧光染料用于标记蛋白质、作为理想的荧光探针。
2013年,Anthony Romieu [56] 等人对水溶性的染料进行了归纳和分析,将含有羧基、氨基、磷酸酯基和磺酸基等水溶性基团的染料展开比较,结构如图20,并提出了染料的水溶性与荧光量子产率和分配系数相关的理论,此研究为在生理环境下水溶性的BODIPY染料的应用提供了丰富的理论依据。
2015年,Meimetis L G等人以吡啶催化合成了含有活性酯的BODIPY染料 [57] 。如图21,合成该目标产物以二氯甲烷作为溶剂,室温反应过夜便可得到理想的目标产物。将N-羟基琥珀酰亚胺引入BODIPY结构中生成的活性酯类试剂,是近年来发展应用的一类多功能衍生试剂,与氨基酸衍生化条件温和。与氨基酸衍生时缓冲pH范围宽,因此,成为近几年内应用较为广泛的氨基标示剂之一。该实验,又一次拓展了BODIPY类染料的应用。
4. 总结
近三十年来,科研工作者对有机荧光材料的探索和研究一直在继续。有机荧光染料在现代科学和医学领域,包括材料科学、临床诊断医学、分析和环境化学、生物技术等成为不可或缺的研究工具。基于BODIPY为母体的各种有机荧光材料,由于其高的激发率、高的荧光量子产率以及其对光和化学反应的稳定性而逐渐成为研究的焦点。对BODIPY类荧光化合物进行修饰,拓宽其应用,丰富有机荧光染料的
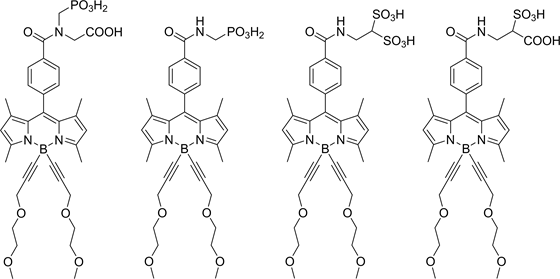
Figure 20. Water soluble dye structure
图20. 水溶性染料结构

Figure 21. BODIPY dye containing active ester
图21. 含有活性酯的BODIPY染料
种类仍然会是今后科学研究的热点。
致谢
江苏省高校优势学科建设工程项目。
文章引用
甄 文,王南翔,祁 欣. 荧光染料的简介及BODIPY类的发展历程
Introduction to Fluorescent Dyes and Development of BODIPY Classes[J]. 有机化学研究, 2017, 05(01): 21-33. http://dx.doi.org/10.12677/JOCR.2017.51004
参考文献 (References)
- 1. 庞卫东. BODIPY荧光染料的合成及性能研究[D]: [硕士学位论文]. 芜湖市: 安徽师范大学, 2013.
- 2. 田茂忠, 彭孝军, 樊江莉, 等. 氟硼二吡咯类阳离子荧光探针的研究进展[J]. 分析化学, 2006, 34: 283-288.
- 3. Xu, Z.C., Kim, S.K., Kim, H.N., et al. (2007) A Naphthalimide-Calixarene as a Two-Faced and Highly Selective Fluorescent Chemosensor for Cu2+ or F−. Tetrahedron Letters, 48, 9151-9154. https://doi.org/10.1016/j.tetlet.2007.10.109
- 4. 龚维. BODIPY类荧光探针在离子检测中的应用[J]. 化学分析计量, 2010, 19(5): 90-92.
- 5. Misra, R., Jadhav, T., Dhokale, B., et al. (2014) Carbazole-BODIPY Conjugates: Design, Synthesis, Structure and Properties. Dalton Trans-actions, 43, 13076-13086. https://doi.org/10.1039/C4DT00983E
- 6. Zhang, L., Li, M., Zhao, C., et al. (2016) A Novel Fluorescent Probe for Discrimination of CYS from GSH: Inspiration from Chemical Ligation. Tetrahedron Let-ters, 57, 578-581. https://doi.org/10.1016/j.tetlet.2015.12.093
- 7. Nguyen, A.L., Bobadova-Parvanova, P., Hop-finger, M., et al. (2015) Synthesis and Reactivity of 4, 4-Dialkoxy-BO- DIPYs: An Experimental and Computational Study. Inorganic Chemistry, 54, 3228-3236. https://doi.org/10.1021/ic502821m
- 8. Volkova, Y., Brizet, B., Harvey, P.D., et al. (2014) High Yield SNAr on 8-halogenophenyl-BODIPY with Cyclic and Acyclic Polyamines. European Journal of Organic Chemistry, 2014, 2268-2274. https://doi.org/10.1002/ejoc.201301900
- 9. 王红萍. 新型BODIPY类荧光染料的合成及性能研究[D]: [硕士学位论文]. 大连: 大连理工大学, 2007.
- 10. Zhang, M., Gao, Y.H. and Li, M.Y. (2007) A Selective Turn-On Fluo-rescent Sensor for Fe(III) and Application to Bioimaging. Tetrahedron Letters, 48, 3709-3712. https://doi.org/10.1016/j.tetlet.2007.03.112
- 11. Mao, J., Wang, L.N., Dou, W., et al. (2007) Tuning the Selectivity of Two Chemosensors to Fe(III) and Cr(III). Organic Letters, 9, 4567-4570. https://doi.org/10.1021/ol7020687
- 12. Zhang, X., Yasuhiro, S. and Takayuki, H. (2007) Cu(II)-Selective Green Flurescence of a Rhodamine-Diacetic Acid Conjugate. Organic Letters, 9, 5038-5042. https://doi.org/10.1021/ol7022714
- 13. Suresh, M., Shrivastav, A. and Mi shra, S. (2008) A Rhodamine-Based Chemosensor that Works in the Biological System. Organic Letters, 10, 3013-3016. https://doi.org/10.1021/ol800976d
- 14. Liu, W., Xu, L., Zhang, H., et al. (2009) Dithiolane Linked Thiorhodamine Dimer for Hg2+ Recognition in Living Cells. Organic-Biomolecular Chemistry, 7, 660-664. https://doi.org/10.1039/b815956d
- 15. Chen, X., Nam, S.W., Jou, M.J., et a1. (2008) Hg2+ Selective Fluorescent and Colorimetric Sensor: Its Crystal Structure and Application to Bioimaging. Organic Letters, 10, 5235-5238. https://doi.org/10.1021/ol8022598
- 16. Zhang, X., Xiao, Y. and Qian, X. (2008) A Ratiometric Fluorescent Probe Based on FRET for Imaging Hg2+ Ions in Living Cells. Angewandte Chemie International Edition, 47, 8025-8029. https://doi.org/10.1002/anie.200803246
- 17. Xin, Q.C., Jia, J. and Hui, M.M. (2007) Characterization of Rhoda-mine B Hydroxyl Amide as a Highly Selective and Sensitive Fluorescence Probe for Copper(II). Analytica Chimical Acta, 8, 1016-1021.
- 18. Winnik, M.A., Pekcan, O. and Croucher, M.D. (1985) Phosphorescence of Naphthalene-Labelled Colloidal Polymer Particles. The α-Methyl Relaxation of One Microphase in a Multicomponent Material. Canadian Journal of Chemistry, 63, 129-133. https://doi.org/10.1139/v85-021
- 19. 孙辉. PH荧光探针的构筑[D]: [硕士学位论文]. 南京: 南京大学, 2011.
- 20. 邵红艳, 张义浜. 传感器技术在环境检测中的应用研究进展[J]. 化学分析计量, 2009, 19(6): 86-89.
- 21. Woodroofe, C.C. and Lippard, S.J. (2003) A Novel Two-Fluorophore to Ratiometric Sensing of Zn2+. Journal of the American Chemical Society, 125, 11458-11459. https://doi.org/10.1021/ja0364930
- 22. Wu, J.S., Liu, W.M., Zhuang, X.Q., et al. (2007) Fluorescence Turn on of Coumar in Derivatives by Metale Ations: A New Signaling Meehanism Based on C = N Isomerization. Organic Letters, 9, 33-36. https://doi.org/10.1021/ol062518z
- 23. 郭媛, 陈康裕, 倪小波, 等. 3-毗咤香豆素类化合物的合成及荧光性质研究[J]. 化学试剂, 2010, 32(8): 673-676.
- 24. Takakusa, H., Kikuchi, K., Urano, Y., et al. (2002) Design and Syn-thesis of an Enzyme-Cleavable Sensor Molecule for Phosphodiesterase Activity Based on Fluorescence Resonance Energy Transfer. Journal of the American Chemical Society, 124, 1653-1657. https://doi.org/10.1021/ja011251q
- 25. Mishra, A., Behera, R.K., Behera, P.K., Mishra, B.K. and Behera, G.B. (2000) Cyanines during the 1900s: A Review. Chemical Reviews, 100, 1973-2012. https://doi.org/10.1021/cr990402t
- 26. Zhang, Y., Yang, R.H., Liu, F., et al. (2006) Fluorescent Sensor for Imid-azole Derivatives Based on Monoer-Dimer Equilibrium of a Zinc Porphyrin Complex in a Polymeric Film. Analytica Chimical Acta, 76, 7336-7345. https://doi.org/10.1021/ac049477+
- 27. Sheng, Y., Ma, J., Liu, S., et al. (2016) Strong and Reversible Circularly Polarized Luminescence Emission of a Chiral 1,8-Naphthalimide Fluorophore Induced by Excimer Emission and Orderly Aggregation. Chemistry—A European Journal, 22, 9519-9522. https://doi.org/10.1002/chem.201600891
- 28. Xu, Z.C., Qian, X.H. and Cui, J.N. (2005) Colorimetrie and Ratiometrie Fluoreseent Chemosensor with a Large Red-Shift in Emission: Cu(II)-Only Sensing by Deprotonation of Secondary Amines as Receptor Conjugated to Naphthalimide Fluorophore. Organic Letters, 7, 3029-3032. https://doi.org/10.1021/ol051131d
- 29. Georgiev, N.I., Dimitrova, M.D., Todorova, Y.D., et al. (2016) Synthesis, Chemosensing Properties and Logic Behaviour of a Novel Ratiometric 1,8-Naphthalimide Probe Based on ICT and PET. Dyes and Pigments, 131, 9-17. https://doi.org/10.1016/j.dyepig.2016.03.051
- 30. Liu, C., Cheng, A.W., Xia, X.K., et al. (2016) Development of a Facile and Sensitive Fluorimetric Derivatization Reagent for Detecting Formaldehyde. Analytical Methods, 8, 2764-2770. https://doi.org/10.1039/C6AY00108D
- 31. Liang, S., Liu, Y., Fu, T., et al. (2016) A Water-Soluble and Biocompatible Polymeric Nanolabel Based on Naphthalimide Grafted Poly (Acrylic Acid) for the Two-Photon Fluorescence Imaging of Living Cells and C. Elegans. Colloids and Surfaces B: Biointerfaces, 148, 293-298. https://doi.org/10.1016/j.colsurfb.2016.09.001
- 32. Chen, Q.Y., Li, D.H., Yang, H.H., et al. (1999) Interaction of a Novel Red-Region Fluorescent Probe, Nile Blue, with DNA and Its Application to Nucleic Acids Assay. Analyst, 124, 901-906. https://doi.org/10.1039/a901174i
- 33. Polverini, E., Cugini, G., Annoni, F., et al. (2006) Molten Globule Formation in Apomyoglobin Monitored by the Fluorescent Probe Nile Red. Biochemistry, 45, 5111-5121. https://doi.org/10.1021/bi051905y
- 34. Hu, Y.J., Liu, Y., Zhao, R.M., et al. (2006) Spectroscopic Studies on the Interaction between Methylene Blue and Bovine Serum Albumin. Journal of Photochemistry and Photobiology A—Chemistry, 179, 324-329. https://doi.org/10.1016/j.jphotochem.2005.08.037
- 35. Kaneta, T., Saito, Y. and Imasaka, T. (1999) Indirect De-tection of Amino-Substituted Polycyclic Aromatic Hydrocarbons in Cyclodextrin-Modified Micellar Electrokinetic Chromatography Combined with Diode Laser-Induced Fluorometry. Journal of Chromatography A, 831, 285-292. https://doi.org/10.1016/S0021-9673(98)00925-X
- 36. Cui, W. and Parker, L.L. (2016) Modular, Antibody-Free Time-Resolved LRET Kinase Assay Enabled by Quantum Dots and Tb3+-Sensitizing Peptides. Scientific Reports, 6, Article No. 28971. https://doi.org/10.1038/srep28971
- 37. Rozas, I. and Senge, M.O. (2016) A Two-Pronged At-tack on DNA: Targeting Guanine Quadruplexes with Nonplanar Porphyrins and DNA-Binding Small Molecules. Future Medicinal Chemistry, 8, 609-612. https://doi.org/10.4155/fmc-2016-0040
- 38. 卢佳惠. 低温亲核取代合成三枝BODIPY荧光结构[D]: [硕士学位论文]. 南京: 南京航空航天大学, 2015.
- 39. 李博, 鲍超, 施柏煊, 等. α和β晶型酞箐铜纳米颗粒的光谱研究[J]. 红外与毫米波学报, 2002, 21(4): 257-260.
- 40. Treibs, A. and Kreuzer, H. (1968) Difluorboryl-Komplexe Di-Und Ttipyrrylmethenen. Justus Liebigs Annalender Chemie, 718, 208-223. https://doi.org/10.1002/jlac.19687180119
- 41. Shah, M.K., Thangraj, M.L. and Soong, L. (1990) Pyrrome-thene-BF2 Complexes as Laser Dyes. Heteroatom Chemistry, 1, 389-399. https://doi.org/10.1002/hc.520010507
- 42. Worries, H.J., Koek, J., Lodder, G., et al. (1985) A Novel Wa-ter-Soluble Fluorescent Probe: Synthesis, Luminescence and Biological Properties of the Sodium Salt of the 4-sulfonato-3,3’,5,5’-tetramethyl-2,2’-pyrromethen-1,1’-BF2 Complex. Journal of the Royal Netherlands Chemical Society, 104, 288-291. https://doi.org/10.1002/recl.19851041104
- 43. Haugland, R.P. and Kang, H.C. (1988) Chemical Reactive Dipyrrometheneboron Dffluoride Dyes. US Patent 4772339.
- 44. Kang, H.C. (1993) Long Wave-length Chemically Reactive Dipyrrometheneboron Difluoride Dyes and Conjugates. WO 93/09185.
- 45. Haugland, R.P. and Kang, H.C. (1995) Dibenzopyrrometheneboron Difluoride Dyes. US Patent 5433896.
- 46. Chert, J., Burghart, A. and Burgess, K. (2000) 4,4-difluoro-4-bora-3a,4a-diaza-s-indacene(BODIPY) Dyes Modified for Extended Conjugation and Restricted Bond Rotations. Journal of Organic Chemistry, 65, 2900-2906. https://doi.org/10.1021/jo991927o
- 47. Chen, J., Burghart, A., Wan, C., et al. (2000) Synthesis and Spectroscopic Properties of 2-ketopyrrole-BF2 Complexes: A New Class of Fluorescent Dye. Tetrahedron Letters, 41, 2303-2307. https://doi.org/10.1016/S0040-4039(00)00166-0
- 48. Chen, J. and Reibenspies, J. (1999) Through-Space C-F Coupling Can Reveal Conformations of Modified BODIPY Dyes. Chemical Communications, 24, 2501-2502. https://doi.org/10.1039/a907559c
- 49. Rurack, K., Kollmannsberger, M., Daub, J., et al. (2000) A Selective and Sensitive Fluoroionophore for Hg (II), Ag (I) and Cu (II) with Virtually Decoupled Fluorophore and Receptor Units. Journal of the American Chemical Society, 122, 968-979. https://doi.org/10.1021/ja992630a
- 50. Qi, X., Eun, J.J., Li, X., et al. (2006) New BODIPY Derivatives as off-On Fluorescent Chemosensor and Fluorescent Chemodosimeter for Cu2+: Cooperative Selectivity Enhancement toward Cu2+. Journal of Organic Chemistry, 71, 2881-2889. https://doi.org/10.1021/jo052542a
- 51. Zhao, W. and Carreira, E.M. (2005) Conformationally Restricted Aza-Bodipy: A Highly Fluorescent, Stable, Near- Infrared-Absorbing Dye. Angewandte Chemie International Edition, 44, 1677-1679. https://doi.org/10.1002/anie.200461868
- 52. Ikeda, C. (2009) Convenient and Highly Efficient Synthesis of Bo-ron-Dipyrrins Bearing an Aryl Boronate Center. Tetrahedron Letters, 50, 3349-3351. https://doi.org/10.1016/j.tetlet.2009.02.094
- 53. Brellier, M., Duportail, G. and Baati, R. (2010) Convenient Syn-thesis of Water-Soluble Nitrilotriacetic Acid (NTA) BODIPY Dyes. Tetrahedron Letters, 51, 1269-1272. https://doi.org/10.1016/j.tetlet.2009.12.126
- 54. Mariusz, T., Julie, M., Frimannsson, D.O., McDonnell, S.O. and O’Shea, D.F. (2010) Water-Solubilised BF2-Chelated Tetraarylazadipyrromethenes. Organic Biomolecular Chemistry, 8, 522-525. https://doi.org/10.1039/B919546G
- 55. Niu, S., Massif, D., Ulrich, G., Renard, P.-Y., Romieu, A. and Ziessel, R. (2012) Water-Soluble Red-Emitting Distyryl-Borondipyrromethene (BODIPY) Dyes for Biolabeling. Chemistry—A European Journal, 18, 7229-7242. https://doi.org/10.1002/chem.201103613
- 56. Romieu, A., Massif, C., Rihn, S., Ulrich, G., Ziesseland, R. and Renard, P. (2013) The First Comparative Study of the Ability of Different Hydrophilic Groups to Water-Solubilise Fluorescent BODIPY Dyes. New Journal of Chemistry, 37, 1016-1027. https://doi.org/10.1039/c3nj41093e
- 57. Meimetis, L.G., Boros, E., Carlson, J.C., et al. (2015) Bioorthogonal Fluorophore Linked DFO-Technology Enabling Facile Chelator Quantification and Multimodal Imaging of Antibodies. Bioconjugate Chemistry, 27, 257-263. https://doi.org/10.1021/acs.bioconjchem.5b00630
NOTES
*通讯作者。