Advances in Applied Mathematics
Vol.
12
No.
05
(
2023
), Article ID:
66276
,
11
pages
10.12677/AAM.2023.125248
一类具有从隐性染病者向显性染病者转化的COVID-19动力学模型
郭德玉,王晓静*,白玉珍,李欣,王丽娜,李佳慧
北京建筑大学理学院,北京
收稿日期:2023年4月28日;录用日期:2023年5月21日;发布日期:2023年5月31日

摘要
本文依据COVID-19的传播规律建立了一类SEAICR传染病模型,计算了模型的控制再生数,证明了模型平衡点的存在性和无病平衡点的局部稳定性,并进行了敏感性分析和数值模拟。研究结果表明:降低隐性感染者向显性感染者的转化率,即尽早发现隐性感染者并对其进行及时的治疗,或者提高隐性感染者比例均可以更好地控制COVID-19的传播。
关键词
COVID-19,敏感性分析,控制再生数,隐性感染者,稳定性

A Dynamics Model of COVID-19 with Transition from the Asymptomatic to the Symptomatic Infected Individuals
Deyu Guo, Xiaojing Wang*, Yuzhen Bai, Xin Li, Lina Wang, Jiahui Li
School of Science, Beijing University of Civil Engineering and Architecture, Beijing
Received: Apr. 28th, 2023; accepted: May 21st, 2023; published: May 31st, 2023

ABSTRACT
According to the transmission mechanism of COVID-19, an SEAICR epidemic model is established, and the control reproduction number of the model is calculated. Then, the existence of the equilibrium and the local stability of the disease-free equilibrium are proved. Furthermore, the sensitivity analysis and numerical simulations are performed. The results indicate that the transmission of COVID-19 can be better controlled by reducing the conversion rate of the asymptomatic infection to the symptomatic infection, that means quickly detection and timely treatment of the asymptomatic infection should be conducted, or increasing the proportion of the asymptomatic infection.
Keywords:COVID-19, Sensitivity Analysis, Control Reproduction Number, Asymptomatic Infection, Stability

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
新冠肺炎病毒感染(COVID-19)是由一种新型冠状病毒(novel coronavirus)感染引起的新发急性呼吸道传染病。主要症状是发热、干咳、乏力等,少数患者伴有鼻塞、流涕、腹泻等上呼吸道和消化道症状,重症病例多在1周后出现呼吸困难,部分重症、危重症患者病程中可表现为中低热,甚至无明显发热。轻型患者仅表现为低热、轻微乏力等,无肺炎表现 [1] 。感染者在首次感染后一般5~6天出现症状,潜伏期通常为2~14天 [2] 。COVID-19的传播途径主要包括直接传播、气溶胶传播和接触传播。自2019年12月发现首例病例以来,根据国家卫生健康委员会公布的数据,截至2023年1月8日,我国共报告503,302例,死亡5272人例。根据WHO报告,截至2023年4月25日,世界卫生组织指出全球约有763,740,140人感染,其中确诊死亡人数达到6,908,554 [3] 。
COVID-19已在全世界212个国家和地区蔓延,给全球公共卫生健康和经济发展产生了很大的影响,已有许多专家学者根据COVID-19的传播规律建立数学模型来研究疫情的发展趋势 [4] - [19] 。文献 [4] 根据流行病学数据估算了COVID-19的再生数,并预测了疾病暴发的高峰期和规模。文献 [5] 使用最大似然估算法估计了COVID-19的基本再生数。Tang等人在文献 [6] 中主要研究了隔离密切接触者的效果,建立了一类SEIASqEqHR传染病模型,计算出了COVID-19在武汉爆发的再生数为6.47。文献 [7] 主要考虑了无症状感染者与已报告和未报告的有症状感染者之间的转移对新冠肺炎传播的影响。文献 [8] 建立了一类SEIDIUQHRD的仓室模型,并对俄罗斯、巴西、印度和其他国家的疫情高峰进行初步预测。Yang等人在文献 [9] 中建立了一类SEIRV的新冠模型,他们主要探讨了环境宿主对其传播的影响。文献 [10] 主要考虑将SEIR模型扩展到包括症状前感染病例(P)、未确定病例(A)和医院病例隔离(H),展示了COVID-19的完整动态,构建了一个SAPHIRE的模型,强调了疫情的两个关键特征:高隐匿性和高传播性对COVID-19传播的影响。文献 [11] 主要考虑漏报和诊断延误的情况下,建立仓室模型并估计了轻、重、危重型COVID-19患者的日床位短缺数量,强调了封锁的时间和强度对遏制COVID-19疫情传播的重要性。文献 [12] 给出了一个随机离散时间传染病模型来评估COVID-19在第二波疫情中复发的风险。Ma等在文献 [13] 中分析了纽约市佩戴医用口罩对COVID-19传播的影响。文献 [14] 研究了沙特阿拉伯COVID-19的最优控制问题。Masandawa等在文献 [15] 中建立了一类SEIHR传播动力学模型,对医院感染COVID-19进行了深入研究。
我国在COVID-19流行期间一直对确诊患者进行严格的隔离治疗,从而切断了他们继续传播的路径,因此有必要把确诊患者作为独立的仓室 [20] 。在COVID-19流行期间出现了大量的隐性感染者 [6] [7] [8] ,他们在病程中不显现症状极大地促进了COVID-19的传播,并且有部分的隐性感染者在病程中转化为显性感染者,但目前很少有文献考虑隐性感染者能够部分转化为显性感染者,所以有必要考虑隐性染病者向显性染病者的转化率对疫情防控的影响,从而能够更准确地描述COVID-19的传播规律和最终规模,以便达到更好的控制效果。
2. 模型建立
我们将总人口N分为六个不同的仓室:易感者(S),潜伏期感染者(E),隐性感染者(A),显性感染者(I),确诊患者(C)和康复者(R)。COVID-19的传播流程图如下(图1):
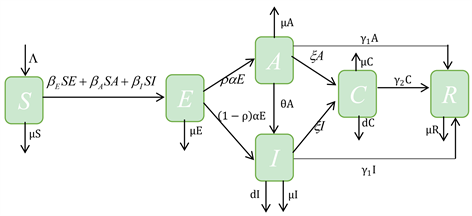
Figure 1. The flow chart of the SEAICR model
图1. SEAICR模型流程图
对应的传播动力学模型为:
(1)
t时刻总人数 。把系统(1)的各方程相加,得
所以 ,故系统(1)的可行域为:
且 是系统(1)的正向不变集。
3. 模型的稳定性分析
令系统(1)的方程右端为0,即:
(2)
当 时,可解得系统(1)存在无病平衡点 ,其中 。
为了研究方便,定义h、f、g分别为: 、 、 。由
, ,
,
可求出模型(1)的控制再生数为:
其生物意义为:第一项表示在单位时间内,一个潜伏期感染者在全部是易感者的人群中能感染 个易
感者,而潜伏期染是 ;第二项表示一个潜伏期感染者以 的比例进入了隐性感染者仓室,在单位时间内能导致 个新增染病者,隐性染病期为 ;第三项表示一个潜伏期感染者以 的比例进入了显性感染者仓室,一个隐性感染者以 的比例进入了显性感染者仓室,他们在单位时间内均能导致 个新增染病者,显性染病期为 。因而,控制再生数为单个的潜伏期、隐性和显性感染者在各自染
病期内引发的新增染病者之和。
定理1 当 时,系统(1)存在唯一的正平衡点 。
证明:当 时,由方程(2)可得如下表达式:
由(2)的第一个方程可得 ,
将(2)的前两个方程相加可得 ,再将 的表达式代入即得 ,
同理可得: ,
,
,
。
因此,当 时,系统(1)存在唯一的正平衡点 ,当 时,系统无正平衡点。证毕。
由于实施了严格的防控和治疗措施,我们可以假设隔离仓室C和恢复者仓室R不会感染易感者,故只需讨论系统(1)如下的子系统(3):
(3)
定理2 当 时,系统(3)的无病平衡点 是局部渐近稳定的。
证明:模型(3)的线性化系统在 处的雅克比矩阵为:
显然 为雅克比矩阵 的一个负特征值,矩阵的另外三个特征值满足方程
展开可得:
(4)
其中:
当 时, , , 。由Routh-Hurwitz判别法可知,方程(4)的根均具有负实部,因此雅克比矩阵 的所有特征根均具有负实部,无病平衡点 是局部渐近稳定的。
敏感性分析对确定影响疾病传播的主要因素有着重要的作用,变量m关于n的敏感性指数定义 [23] 为:
我们将对 的一些参数进行敏感性分析,根据敏感性指数的计算公式可得:
,
,
,
由上述计算结果,我们发现 随着传染力系数 、 、 的增加而增加,但无法直接通过计算来判断p、θ的敏感性,当我们取表1的数值时,用MATLAB计算敏感性指数,结果见表2:
Table 1. Parameters description of the SEAICR Model
表1. SEAICR模型中的参数说明
Table 2. The sensitivity index Υ ς j R c of R c
表2. 的敏感性指数
由此可见 随着隐性感染者的比例p的增加而减少,随着隐性染病者向显性染病者的转化率 的增加而增加,并且对潜伏期感染者的传染力系数 变化最为敏感。
4. 数值模拟
依据我国卫生健康委员会公布的数据,我们选取如下的初值,取值见表3。
Table 3. The initial values of the parameters
表3. 参数初值
图2表示当参数取表2和表3的值时,潜伏期患者 、隐性感染者 、显性感染者 、确诊感染者 、恢复者人数 随时间的变化图。我们构建的COVID-19的传染病模型主要研究部分隐性感染者会转化成显性感染者,没有考虑对密切接触者采取隔离措施的影响,从图2(d)可以看出确诊人数最终会达到五十七万人,而我国实际确诊人数为五十万人,所以对密切接触者采取隔离措施对控制新冠疫情有非常重要的作用。
由图3可知 会随着 的增大而增大,因此可以降低隐性感染者向显性感染者的转化率,即通过对隐性感染者进行干预治疗阻止其向显性感染者转化将会更好地控制疾病。
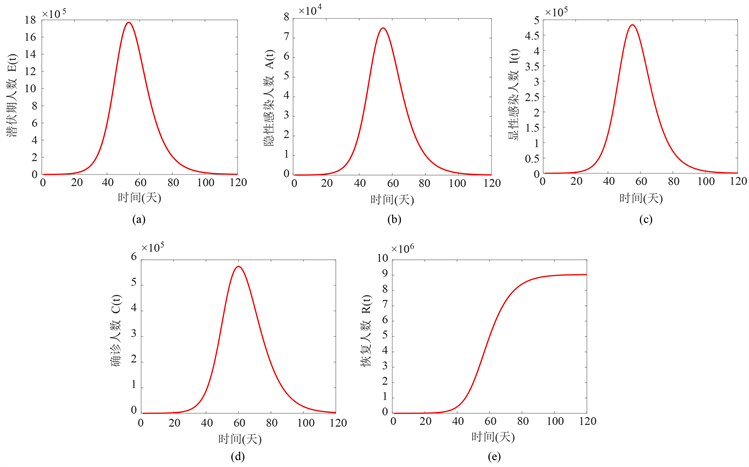
Figure 2. The time series diagrams of , , , , , respectively
图2. , , , , 的时间序列图
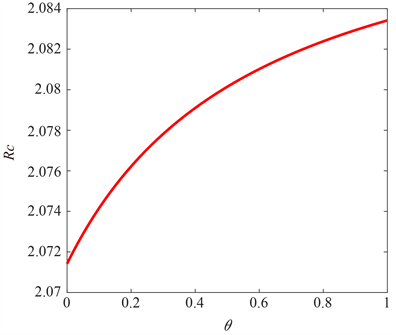
Figure 3. The relationship between and
图3. 控制再生数 与 的关系图
图4表明固定其他参数值,当p从0.1变化到0.8时,即隐性感染者比例越确诊感染者越少,并且随p的增大会推迟疾病到达峰值的时间。
从图5可以看出当θ从0变化到0.7而其他参数值保持不变时,即随着隐性感染者向显性感染者的转化率增大,确诊感染者人数也会增多,并且到达峰值的时间会提前,因此应该减小隐性感染者向显性感染者的转化率,即尽早发现隐性感染者并对其进行治疗以防止其转为显性感染者。
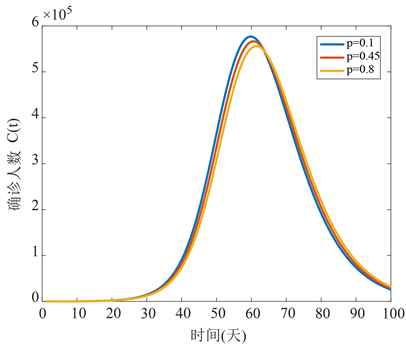
Figure 4. The time series diagram of confirmed infection with different percentage of asymptomatic infection p
图4. 确诊感染者随隐性感染者所占比例p变化时间序列图
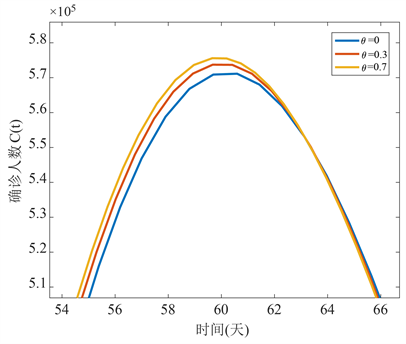
Figure 5. The relationship between the confirmed infection and θ
图5. 确诊感染者随θ变化时间序列图
5. 结论
我们根据COVID-19的传播特点,考虑了部分隐性染病者能够转化成显性染病者,构建了一类COVID-19传染病动力学模型,并对模型的无病平衡点的局部稳定性进行了分析,确定了传染病是否流行的阈值。证明了当控制再生数 时,系统(1)存在唯一的地方病平衡点;当控制再生数 时,系统(1)的无病平衡点是局部渐近稳定的。并对控制再生数进行了敏感性分析,计算结果表明隐性感染者传染率系数对控制再生数最敏感。最后利用我国疫情数据进行了数值模拟,研究结果表明:如果忽略隔离措施,最终确诊人数会达到五十七万人,比实际确诊人数五十万超出14%,因此隔离措施对疫情的防控至关重要。控制再生数 是隐性感染者向显性感染者的转化率 的增函数,并且随着隐性感染者向显性感染者的转化率 的降低确诊人数 也随之减少,因此尽早发现隐性感染者并对其进行及时的治疗能更好地控制COVID-19的传播;此外,隐性感染者所占的比例越高,确诊感染者将会越少,并且会推迟疾病到达峰值的时间。因此,提高隐性感染者比例p有利于COVID-19疫情的防控。
基金项目
北京市教育委员会科研计划项目(SZ202110016008);北京建筑大学研究生教育教学质量提升项目资助(J2023021)和研究生创新项目(PG2023145)。
文章引用
郭德玉,王晓静,白玉珍,李 欣,王丽娜,李佳慧. 一类具有从隐性染病者向显性染病者转化的COVID-19动力学模型
A Dynamics Model of COVID-19 with Transition from the Asymptomatic to the Symptomatic Infected Individuals[J]. 应用数学进展, 2023, 12(05): 2457-2467. https://doi.org/10.12677/AAM.2023.125248
参考文献
- 1. World Health Organization. https://www.who.int/zh/news-room/q-a-detail/coronavirus-disease-covid-19
- 2. Chi-nese Center for Disease Control and Prevention. https://m.chinacdc.cn/jkzt/crb/yl/hrb_11806/jszl/202301/t20230109_263283.html
- 3. World Health Organization. https://www.who.int/emergencies/diseases/novel-coronavirus-2019
- 4. Wu, J.T., Leung, K. and Leung, G.M. (2020) Nowcasting and Forecasting the Potential Domestic and International Spread of the 2019-nCoV Outbreak Origi-nating in Wuhan, China: A Modeling Study. Obstetrical and Gynecological Survey, 75, 399-400. https://doi.org/10.1097/01.ogx.0000688032.41075.a8
- 5. Liu, T., Hu, J., Kang, M., et al. (2020) Transmission Dynamics of 2019 Novel Coronavirus (2019-nCoV). The Lancet. https://doi.org/10.2139/ssrn.3526307
- 6. Tang, B., Wang, X., Li, Q., et al. (2020) Estimation of the Transmission Risk of the 2019-nCoV and Its Implication for Public Health Interventions. Journal of Clinical Medicine, 9, Article No. 462. https://doi.org/10.3390/jcm9020462
- 7. Khoshnaw, S.H.A., Shahzad, M., Ali, M., et al. (2020) A Quantita-tive and Qualitative Analysis of the COVID-19 Pandemic Model. Chaos, Solitons and Fractals, 138, Article ID: 109932. https://doi.org/10.1016/j.chaos.2020.109932
- 8. Nabi, K.N. (2020) Forecasting COVID-19 Pandemic: A Da-ta-Driven Analysis. Chaos, Solitons and Fractals, 139, Article ID: 110046. https://doi.org/10.1016/j.chaos.2020.110046
- 9. Yang, C.Y. and Wang, J. (2020) A Mathematical Model for the Novel Coronavirus Epidemic in Wuhan, China. Mathematical Biosciences and Engineering, 17, 2708-2724. https://doi.org/10.3934/mbe.2020148
- 10. Hao, X.J., Cheng, S.S., Wu, D.G., et al. (2020) Reconstruction of the Full Transmission Dynamics of COVID-19 in Wuhan. Nature, 584, 420-424. https://doi.org/10.1038/s41586-020-2554-8
- 11. Zhuang, Z., Cao, P.H., Zhao, S., et al. (2021) The Shortage of Hospital Beds for COVID-19 and Non-COVID-19 Patients during the Lockdown of Wuhan, China. Annals of Transla-tional Medicine, 9, 200. https://doi.org/10.21037/atm-20-5248
- 12. He, S., Yang, J., He, M., et al. (2021) The Risk of Future Waves of COVID-19: Modeling and Data Analysis. Mathematical Biosciences and Engineering, 18, 5409-5426. https://doi.org/10.3934/mbe.2021274
- 13. Ma, X., Luo, X.F., Li, L., et al. (2022) The Influence of Mask Use on the Spread of COVID-19 during Pandemic in New York City. Results in Physics, 34, Article ID: 105224. https://doi.org/10.1016/j.rinp.2022.105224
- 14. Asamoah, J.K.K., Okyere, E., Abidemi, A., et al. (2022) Optimal Control and Comprehensive Cost-Effectiveness Analysis for COVID-19. Results in Physics, 33, Article ID: 105177. https://doi.org/10.1016/j.rinp.2022.105177
- 15. Masandawa, L., Mirau, S.S., Mbalawata, I.S., et al. (2022) Mod-eling Nosocomial Infection of COVID-19 Transmission Dynamics. Results in Physics, 37, Article ID: 105503. https://doi.org/10.1016/j.rinp.2022.105503
- 16. Li, Q., Guan, X., Wu, P., et al. (2020) Early Transmission Dy-namics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia. New England Journal of Medicine, 382, 1199-1207. https://doi.org/10.1056/NEJMoa2001316
- 17. Chen, Y., Cheng, J., Jiang, Y., et al. (2020) A Time Delay Dynamic System with External Source for the Local Outbreak of 2019-nCoV. Applicable Analysis, 101, 146-157. https://doi.org/10.1080/00036811.2020.1732357
- 18. Yang, Z., Zeng, Z., Wang, K., et al. (2020) Modified SEIR and AI Prediction of the Epidemics Trend of COVID-19 in China under Public Health Interventions. Journal of Thoracic Disease, 12, 165-174. https://doi.org/10.21037/jtd.2020.02.64
- 19. Shen, M., Peng, Z., Xiao, Y., et al. (2020) Modeling the Epidemic Trend of the 2019 Novel Coronavirus Outbreak in China. The Innovation, 1, Article ID: 100048. https://doi.org/10.1016/j.xinn.2020.100048
- 20. 陈慧林, 董慧茹, 郑一男, 等. 考虑到隐性感染人群的潜伏期和发病期均传染的SLICAR模型[J]. 中国卫生统计, 2015, 32(2): 264-266.
- 21. Rong, X.M., Yang, L., Chu, H.D., et al. (2020) Effect of Delay in Diagnosis on Transmission of COVID-19. Mathematical Biosciences and Engineering, 17, 2725-2740. https://doi.org/10.3934/mbe.2020149
- 22. Huang, C., Wang, Y., Li, X., et al. (2020) Clinical Fea-tures of Patients Infected with 2019 Novel Coronavirus in Wuhan, China. The Lancet, 395, 497-506. https://doi.org/10.1016/S0140-6736(20)30183-5
- 23. Nakul, C., James, M.H. and Jim, M.C. (2008) Determining Important Parameters in the Spread of Malaria through the Sensitivity Analysis of a Mathematical Model. Bulletin of Mathematical Biology, 70, 1272-1296. https://doi.org/10.1007/s11538-008-9299-0
- 24. The Information of Population in Wuhan (2020). http://english.wh.gov.cn/whgk_3581/dqrk
- 25. National Health Commission of the People’s Republic of China (2020) Data of Confirmed Cases on COVID-19. http://www.nhc.gov.cn/xcs/xxgzbd/gzbd_index
NOTES
*通讯作者。
