Advances in Clinical Medicine
Vol.
13
No.
11
(
2023
), Article ID:
74791
,
15
pages
10.12677/ACM.2023.13112415
甲状腺乳头状癌患者血清样本代谢组学分析
赵阳1,赵明2,王睿2,张方华3*
1青岛大学医学部,山东 青岛
2青岛大学附属青岛市中心医院甲状腺外科,山东 青岛
3青岛大学附属青岛市中心医院内分泌与代谢性疾病科,山东 青岛
收稿日期:2023年10月6日;录用日期:2023年11月1日;发布日期:2023年11月6日

摘要
目的:分析对比甲状腺乳头状癌(PTC)及健康成人血清样本筛选差异代谢物和异常代谢通路,为PTC的早期诊疗提供新的思路。方法:选取2022年3月至2022年12月就诊于山东省青岛大学附属中心医院经病理确诊的PTC患者的血清样本30例,并收集健康成人血清样本36例,利用超高效液相色谱四极杆飞行时间质谱联用技术,采用主成分分析和偏最小二乘判别分析等方法进行数据处理,筛选差异相关的生物标志物和代谢通路。结果:通过分析筛选获得41种可信差异代谢物,其中22种下调,19种上调,在PTC中,α-溶血磷脂酸、花生四烯酸等呈下降趋势;顺乌头酸、α-亚麻酸等呈上升趋势。筛选出20条代谢通路,分别为氮代谢、赖氨酸降解通路、花生四烯酸代谢通路等。结论:PTC和健康成人组代谢轮廓存在显著差异;糖酵解、氨基酸代谢、脂代谢参与了PTC的病理过程。
关键词
甲状腺乳头状癌,代谢组学,代谢通路,生物标志物

Metabolomics Analysis of Serum Samples from Patients with Papillary Thyroid Cancer
Yang Zhao1, Ming Zhao2, Rui Wang2, Fanghua Zhang3*
1Department of Medicine, Qingdao University, Qingdao Shandong
2Thyroid Surgery Department, Qingdao Cancer Hospital, Affiliated Qingdao Central Hospital of Qingdao University, Qingdao Shandong
3Endocrinology Department, Qingdao Cancer Hospital, Affiliated Qingdao Central Hospital of Qingdao University, Qingdao Shandong
Received: Oct. 6th, 2023; accepted: Nov. 1st, 2023; published: Nov. 6th, 2023

ABSTRACT
Objective: To analyze and compare the differential metabolites and abnormal metabolic pathways in serum samples of papillary thyroid carcinoma (PTC) and healthy adults, and provide new ideas for the early diagnosis and treatment of PTC. Method: Thirty serum samples of PTC patients diagnosed with pathology at the Affiliated Central Hospital of Qingdao University in Shandong Province from March 2022 to December 2022 were selected, and 36 healthy adult serum samples were collected. The data were processed using ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry (UHPLC), principal component analysis (PCA), partial least squares discriminant analysis (PLSA), and differentially correlated biomarkers and metabolic pathways were screened. Result: 41 credible differential metabolites were obtained through analysis and screening, of which 22 were down regulated and 19 were up regulated. In PTC, α-Lysophosphatidic acid and arachidonic acid showed a downward trend; Shunaconitic acid α-Linolenic acid and other substances are showing an upward trend. 20 metabolic pathways were screened, including nitrogen metabolism, lysine degradation pathway, arachidonic acid metabolism pathway, etc. Conclusion: There is a significant difference in metabolic profile between PTC and healthy adult groups; glycolysis, amino acid metabolism, and lipid metabolism are involved in the pathological process of PTC.
Keywords:Thyroid Papillary Carcinoma, Metabolomics, Metabolic Pathways, Biomarkers

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
甲状腺癌(Thyroid Cancer, TC)是内分泌系统中发病率最高的恶性肿瘤,甲状腺乳头状癌(Papillary Thyroid Carcinoma, PTC)是分化型甲状腺癌中最常见的类型 [1] 。近年来,随着诊断技术及生活水平的不断提高,TC的发病率越来越高,根据2020年世界卫生组织国际癌症研究中心发布的癌症发病率和死亡率数据显示全球TC发病率居于第9位 [2] 。美国流行病学调查研究显示,TC已成为女性最常见的癌症 [1] [3] [4] 。国内相关研究也表明,TC的发病率逐渐增加,并逐渐趋于年轻化,在30岁以下的女性TC发病率成为女性癌症发病率第一位。目前TC的发病机制尚不清楚,尽管大部分TC患者经治疗后预后良好,但仍有少部分患者存在远处转移及复发情况,为进一步明确TC发病机制、改善患者预后,需更进一步完善更深入的研究。
近年来,代谢组学(Metabolomics, Metabonomics)研究应用于识别生物标志物以进行癌症早期诊断,这有利于进一步了解癌症发生发展的潜在机制 [5] 。代谢组学是指生物体系因生物刺激、病理生理扰动或遗传信息改变等引起的总体、动态的代谢变化,是继基因组学、转录组学和蛋白质组学之后检测并分析小分子代谢物的学科,通过整合不同的“组学”数据集,了解生物体中发生的复杂过程 [6] 。基因组学代表能够发生、转录组学代表可能发生、蛋白质组学代表即将发生、代谢组学提示已经或正在发生的生物学过程 [7] 。现在这项技术已受到科学界的广泛关注,应用代谢组学对癌症进行探索的同时,也有研究应用代谢组学来确定疾病治疗方法的有效性及药物作用机理,这也为明确癌症发病机制及提供治疗新靶点的发现提供了更多的机会。
本研究主要采用超高效液相色谱四极杆飞行时间质谱联用技术(UHPLC-QTOF-MS)代谢组学方法对PTC及健康人群血清样本进行检测,通过筛选差异代谢物,寻找异常代谢通路,探索TC的潜在生物标记物,为TC的早期诊断、早期治疗提供依据。
2. 资料与方法
2.1. 研究对象
选取2022年3月至2022年12月就诊于山东省青岛大学附属中心医院经病理确诊的PTC患者的血清样本30例,并收集健康成人血清样本36例。最终利用UHPLC-QTOF-MS平台分析PTC血清样本与健康成人血清样本共66例。本研究已经通过青岛大学附属中心医院伦理学委员会审核,所有入组人员均已签署知情同意书。本研究所有过程遵守世界医学伦理协会关于人体标本作为实验样本的声明(赫尔辛基宣言)。
2.2. 纳入及排除标准
纳入:1) 年龄18~65岁;2) 既往无恶性肿瘤病史;3) 术前未曾服用甲状腺激素相关药物;4) 术后均病理确诊;5) 无代谢性、免疫性疾病。
排除:1) 确诊甲状腺癌时,患者已合并其他致命性疾病;2) 妊娠期和哺乳期的女性;3) 缺失完整的临床资料。
2.3. 样本前处理
PTC患者手术前于早晨6点至7点间采集空腹静脉血2 ml,健康成人于门诊早晨8点至9点间采集空腹静脉血2 ml,分别3000 r∙min−1 离心10 min后取血清样本,置于−80℃冰箱冻存待用。用时取出血清标本在4℃解冻,约2小时,移液枪取血清样本40 μL,置1.5 mL离心管中,加入乙腈160 μL,涡旋5 min,高速离心(4℃, 14000 r∙min−1, 15 min)后,上清液移至1.5 mL离心管中,再次高速离心(4℃, 14000 r∙min−1, 15 min)后所得的上清液供LC-QTOF-MS分析。
2.4. 样本分析
以UHPLC-QTOF-MS作为代谢物分离检测平台,研究PTC与健康人群血清的代谢差异,在质谱正及负离子模式下采集数据。
色谱条件:使用ACQUITY-UHPLC超高效液相色谱仪和Q-Exactive组合型四极杆Orbitrap质谱仪型超快速高效液相色谱仪,色谱柱为(100*2.1 mm),柱温40℃,进样器温度为4℃。流动相:流动相A为0.1% (体积分数)甲酸/水(含2 mmol/L甲酸铵),流动相B为0.1% (体积分数)乙腈/水。梯度洗脱:0~1 min,90%→70%A;1~19 min,70%→5%A;19~20 min,5%A。流速:0.4 mL∙min−1,进样量:3 μL。
质谱条件:电喷雾离子源(electrospray ion source, ESI±),采用正负离子模式检测,使用高纯N2辅助喷雾电离与脱溶剂,流速为1.2 L/ min质量扫描范围20~1000 m/z,干燥气温度200℃。
质量控制样品:用于测定进样前仪器及色谱质谱系统和评价试验过程的系统稳定,即66个样品各吸取10 μl至EP管,涡旋混匀,分装成每管200 μl,余步骤同样本预处理。
2.5. 数据统计
在进行原始数据分析之前,需要采用Metaboscape 3.0软件对原始数据进行峰提取、降噪、标准化、导出等预处理,处理后采用单维和多维统计方法相结合的方式对数据进行多角度分析。将数据导入Simca-P14.1软件进行模式多元分析,包括主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)。采用模型参数变量权重值(variable importance in the projection, VIP)对变量进行筛选,VIP > 1的变量被认为对模型有显著贡献。采用参数R2和Q2分别用于评估模型的可解释性和可预测性。利用MetaboAnalyst 4.0数据库对差异代谢物进行代谢通路分析。
数据使用的软件主要有:SPSS 27.0 (SPSS, Chicago, IL)、SIMCA-P 14.1 (Umetrics, Umeå, Sweden)以及Excel (Microsoft, USA)等。
3. 结果
3.1. 患者基本特征
共收集就诊于山东省青岛大学附属中心医院的PTC患者血清样本30例,健康成人血清样本36例,两组基本指标见表1。
Table 1. Basic information of papillary thyroid cancer group and healthy adult group
表1. 甲状腺乳头状癌组及健康成人组基本资料
3.2. QC验证
为了评估实验的可重复性和实验仪器的稳定性,我们对本次实验在正负离子模式下做了8个样本的质量控制样品(quality control, QC) (如图1),即为8份QC样本进行PCA分析后,各个样本在第一主成分的投影结果图,该图提示了8份QC样品的偏差范围均在2SD范围内,说明了整个验仪器的稳定性较好,误差小,实验的数据是稳定可靠的,该实验数据能反应不同组别之间生物学上的差异。
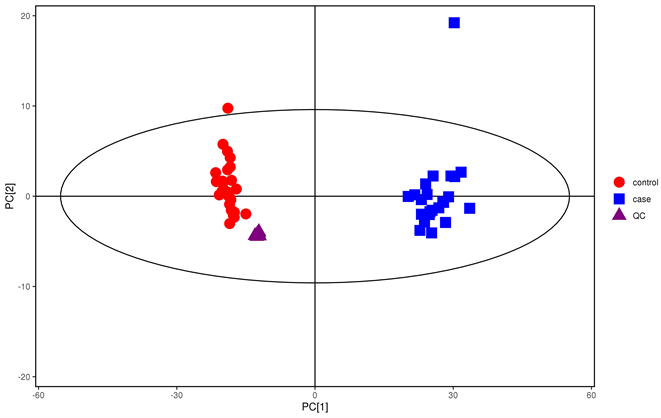
Figure 1. PCA analysis of quality control samples
图1. 质量控制样品PCA分析
3.3. 数据归一化处理
对单个Peak进行过滤以去除噪音,基于相对标准偏差(relative standard deviation,RSD,即变异系数coefficient of variation,CV)对偏离值进行过滤,只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据,对原始数据中的缺失值进行模拟,数值模拟方法为最小值二分之一法进行填补,数据标准化处理,利用内标(internal standard, IS)进行归一化。
3.4. 多元变量统计分析
3.4.1. 火山分析图
分析两组样本间的差异性代谢物时,常用的单变量统计学方法t检验方法分析,火山图中每个点代表一个代谢物,横坐标代表该组对比各物质的倍数变化(取以2为底的对数),纵坐标表示学生t检验的P-value (取以10为底对数的负数),散点大小代表OPLS-DA模型的VIP值,散点越大VIP值越大。散点颜色代表最终的筛选结果,显著上调的代谢物以红色表示,显著下调的代谢物以蓝色表示,非显著差异的代谢物为灰色。以p值 < 0.05,FC > 2 (FC是代谢物相对量在两组间的差异倍数)为标准筛选差异性代谢物物。负离子模式下(NEG)共筛选出88种差异代谢物,其中54种下调,34种上调。正离子模式下(POS)共有90种差异代谢物,其中上调20种,下调70种(如图2)。
3.4.2. 正交偏最小二乘法判别分析(OPLS-DA)
从OPLS-DA得分图的结果可以看出,两组样本区分非常显著,样本基本处于95%置信区间内。通过OPLS-DA分析我们可以筛选出差异代谢物,筛选的标准是VIP值大于1同时满足t检验小于0.05 (如图3)。置换检验随机模型的Q2值均小于原模型的Q2值;Q2的回归线与纵轴的截距小于零;同时随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q2逐渐下降。说明原模型具有良好的稳健性,不存在过拟合现象(如图4)。
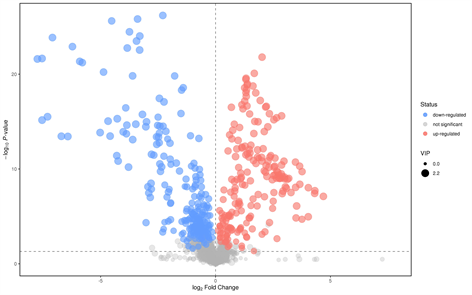 Negative模式下的火山分析图
Negative模式下的火山分析图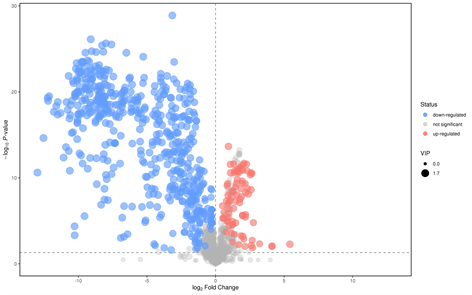 Positive模式下的火山分析图
Positive模式下的火山分析图
Figure 2. Volcano analysis in positive and negative ion mode
图2. 正负离子模式下火山分析图
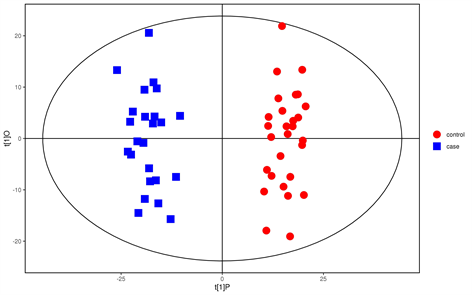
Figure 3. Orthogonal partial least squares method-discriminant analysis
图3. 正交偏最小二乘法–判别分析
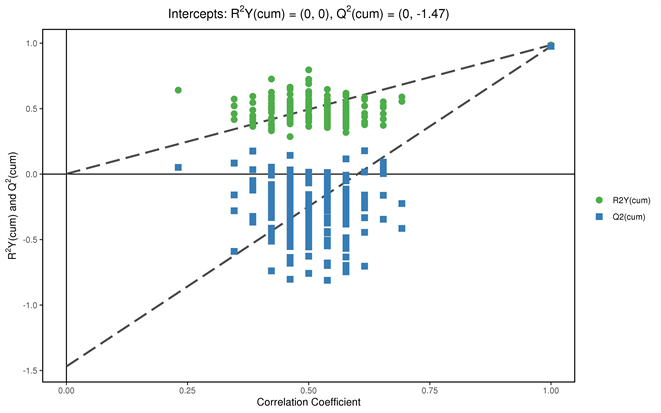
Figure 4. Orthogonal partial least squares-discriminant permutation analysis
图4. 正交偏最小二乘法–判别置换分析
3.4.3. 层次聚类分析
本研究将正负离子模式下PTC和健康成人血清样本中差异代谢物的定量值进行计算欧式距离矩阵,以完全连锁方法对差异代谢物进行聚类,并以热力图进行展示。正离子模式下(如图5),PTC和健康成人样品的代谢物数据呈现出较为明显的聚类,在负离子模式下(如图6)样品的代谢物数据聚类情况基本上可以将两组区分,但情况不如正离子模式下理想,主要原因可能是负离子模式下检测出的PTC和健康成人样品差异代谢物较少。
3.4.4. 主成分分析(PCA)
利用主成分分析(PCA)方法对PTC及健康成人血清样本的代谢物轮廓进行分析。结果所示,两组组间差异较为显著,能够根据两组代谢物信息特征可明显区分,两组间存在明显差异(如图7)。
3.4.5. 和弦分析
通过对差异代谢物进行物质分类来源归属,以斯皮尔曼方法对差异代谢物进行相关计算,最终以和弦图进行可视化展示。图中点大小代表LOG_FOLDCHANGE值大小,点越大,其对应的LOG_FOLDCHANGE值也就越大;点的颜色代表该组对比的差异代谢物来源分类,连线代表对应位置代谢物的相关系数值大小(如图8)。
3.5. 差异代谢物信息
利用多变量统计分析方法,成功构建了用于组间区分的PCA、PLS-DA、OPLS-DA模型,并且确定了两组血清代谢轮廓之间存在的显著性代谢差异。根据差异权重贡献值(VIP)来筛选潜在的差异性代谢物,一般认为VIP > 1.0的变量在模型中区分度较大,可将其对应的代谢物作为潜在得生物标志物。结合VIP > 1.0、曲线下面积AUC > 0.95,且p < 0.05条件获得41种可信差异代谢物,其中22种下调,19种上调,在PTC中,α-溶血磷脂酸、花生四烯酸、粪卟啉III、血栓素b2、棕榈酰–甘油-3-磷酸胆碱、亚甲基–四氢

Figure 5. Under negative ion mode (NEG)
图5. 负离子模式下(NEG)
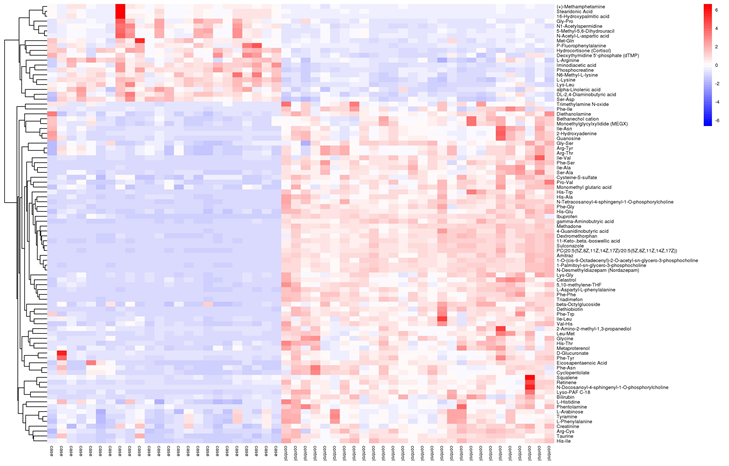
Figure 6. Under positive ion mode (POS)
图6. 正离子模式下(POS)
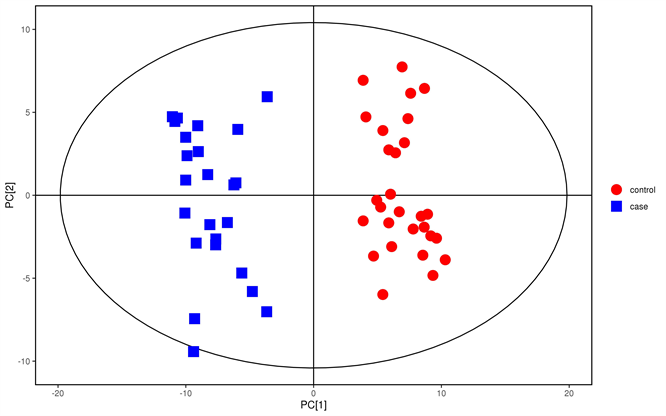 红点:健康成人组,蓝点:PTC组
红点:健康成人组,蓝点:PTC组
Figure 7. Principal component analysis
图7. 主成分分析
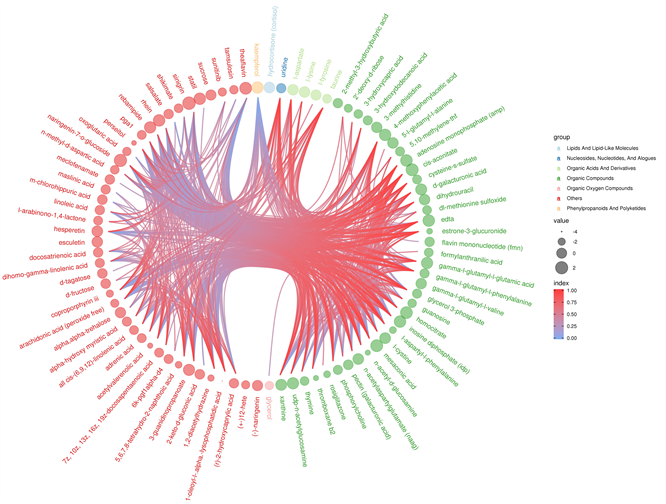
Figure 8. Chord analysis
图8. 和弦分析
叶酸、半胱氨酸-s-硫酸盐、γ-氨基丁二酸、甘氨酸、谷氨酸、组氨酸–苏氨酸、色氨酸、亮氨酸、天冬氨酸–苯丙氨酸、丝氨酸、脯氨酸、肾上腺素酸、磷酰胆碱、大黄酸、血小板活化因子、N-去甲基地西泮、维甲酸呈下降趋势;顺乌头酸、α-亚麻酸、二磷酸肌苷、山奈酚、氨基甲酸、柚皮素7-葡萄糖苷、内源性前列腺素诱导剂、茶黄素、皮质醇、甲基–赖氨酸、磷酸肌酸、天冬氨酸、牛磺酸、酪胺、肌酐、L-精氨酸、半乳糖醛酸、胸腺嘧啶、乳糖呈上升趋势(如表2)。
Table 2. Differential metabolites between PTC and healthy adult groups under positive and negative ion modes
表2. 正负离子模式下PTC与健康成人组差异性代谢物
3.6. 代谢通路分析
根据KEGG数据库,匹配到40条代谢通路,再根据−log(p)值 > 0.5且Pathway impact值大于0.05筛选出20条代谢通路,分别为氮代谢(Nitrogen metabolism)、赖氨酸降解通路(Lysine degradation)、花生四烯酸代谢通路(Arachidonic acid metabolism)、牛磺酸和亚牛磺酸代谢(Taurine and hypotaurine metabolism)、α-亚麻酸代谢(Linoleic acid metabolism)、组氨酸代谢(Histidine metabolism)、初级胆汁酸生物合成(Primary bile acid biosynthesis)、甲烷代谢(Methane Metabolism)、精氨酸和脯氨酸代谢(Arginine and Proline Metabolism)、生物素代谢(Biotin metabolism)、甘氨酸代谢(Glycine metabolism)、丝氨酸代谢(Serine metabolism)、苏氨酸代谢(Threonine metabolism)、戊糖和葡糖醛酸的相互转化(Mutual conversion of pentose and glucuronic acid)、氨酰-tRNA生物合成(Aminoacyl tRNA biosynthesis)、视黄醇代谢(Retinol metabolism)、嘌呤代谢(Purine metabolism)、甘油酯代谢(Glycerolipid metabolism)、甘油磷脂代谢(Glycerophospholipid metabolism)、柠檬酸循环(Citratecycle)等。代谢通路分析的结果以气泡图进行展示,在拓扑分析中的影响因子大小,大小越大影响因子越大;气泡所在纵坐标和气泡颜色表示富集分析的P值(取负自然对数),颜色越深P值越小,富集程度越显著(如图9)。以矩形树图进行展示,矩形树图中每一个方块代表一个代谢通路,方块大小表示该通路在拓扑分析中的影响因子大小,大小越大影响因子越大;方块颜色表示富集分析的P值(取负自然对数),颜色越深P值越小,富集程度越显著(如图10)。
4. 讨论
随着人类基因组测序计划的完成,生命科学研究的重点已转向功能基因组分析。但基因组分析不能随着生物化学状态的变化而提供有价值的终点生物标志物作为诊断信息。代谢组作为转录组和蛋白质组的下游,被认为是基因组学、转录组学和蛋白质组学的补充。代谢组学研究主要是针对肿瘤组织中代谢物的特异性代谢谱进行深入分析,通过研究癌组织的代谢状态,可以产生关于肿瘤组织病理改变的局部信息,并了解癌症的生物学过程。此研究已经应用于癌症的许多方面(如病理生理、诊断、治疗)。研究表明代谢组学可应用于口腔鳞癌 [8] 、肝癌 [9] 、乳腺癌 [10] 的筛查及早期诊断。
TC是最常见的内分泌恶性肿瘤,PTC是最常见的病理类型,占TC的85%~90% [11] 。近年来,TC
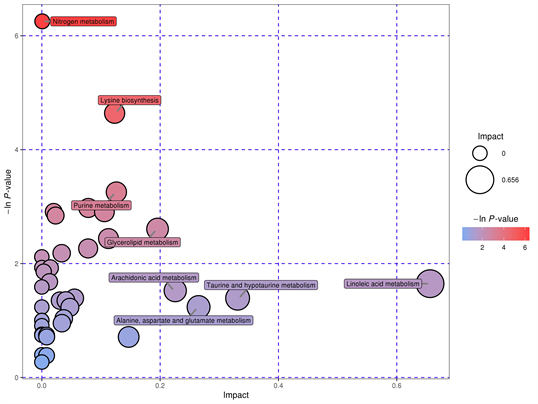
Figure 9. Bubble diagram of metabolic pathway differences
图9. 代谢通路差异气泡图
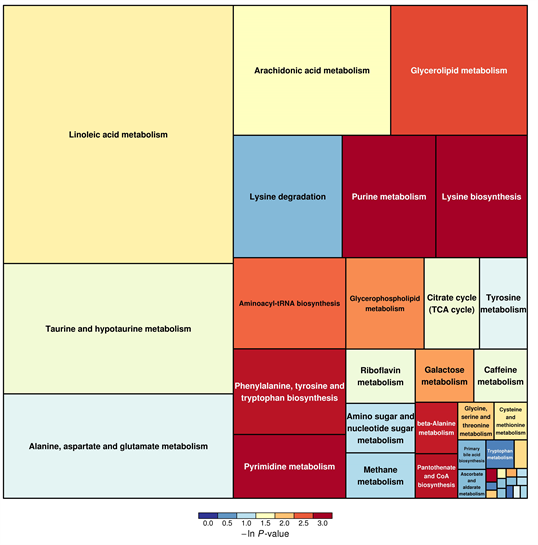
Figure 10. Metabolic pathway differences rectangle tree
图10. 代谢通路差异矩形树
发病率越来越高,现成为所有恶性肿瘤发病率增长最快的肿瘤。尽管TC的死亡率没有随着发病率的增加而增加,但其复发率及难治率呈现上升趋势。为提高治疗效率明确TC的发病机制已成为临床面临的巨大挑战。随着TC分子生物学的发展,分子诊断逐渐进步,TC的发生、发展相关异常代谢已被发现,代谢组学靶向治疗成为研究的热点。
代谢组学的应用分离技术如气相、液相色谱,物质鉴定技术如质谱、核磁共振,本研究使用超高效液相色谱四极杆飞行时间质谱联用技术(UHPLC-QTOF-MS)将分离技术姐物质鉴定技术相结合,各自弥补其缺点,实现高灵敏度及高特异性的特点。本次实验利用UHPLC-QTOF-MS技术研究PTC患者与健康成人对照,分析两组之间的代谢产物之间的变化情况,在POS下二级匹配定性出470+代谢物,在NEG下二级匹配定性出340+代谢物。正离子模式结果和负离子模式结果分别进行一次对比分析,对数据进行预处理,构建模型,进行PCA分析和OPLS-DA得到差异代谢物,通过PCA图可以发现两组无特定的聚集趋势,分散趋势明显,证明两组之间存在明显差异,OPLS-DA模型图证明模型构建良好,无过拟合情况。分析提示PTC和健康对照组人群血浆代谢物精确区分开来,共筛选出差异代谢物91个,上调20个,下调71个。再结合VIP > 1.0、曲线下面积AUC > 0.95,且p < 0.05条件获得41种差异代谢物,其中22种下调,19种上调。进行KEGG通路分析,提示PTC发生发展机制与糖代谢、脂肪代谢及氨基酸代谢密切相关。
葡萄糖代谢作为生理平衡的基础,其代谢异常是癌症发生的标志之一 [12] 。代谢组学提示具有无限增殖能力及恶性表型的肿瘤细胞表现出特有的糖代谢重塑 [13] 。肿瘤细胞分化周期短、生长速度快的前提是需要更多能量。癌细胞代谢的特点在于糖酵解的增加和三羧酸循环的抑制,由于肿瘤细胞具有Warburg效应,即癌细胞即使在氧气非常充足的情况下,通常依靠无氧酵解功能,在乳酸脱氢酶的作用下转化为乳酸而迅速获能。异常糖酵解通过改变转运体、交换器、质子泵的活性产生大量乳酸维持癌细胞生存环境 [14] [15] 。本研究结果显示PTC组与健康组相比乳酸、半乳糖醛酸、顺乌头酸表达上调。甲状腺癌组织较正常组织光谱中更高含量的乳酸和乙酰胆碱,Paolo等 [16] 人研究与本研究结果一致,甲状腺癌组织较正常组织光谱中更高含量的乳酸。因此进一步研究乳糖代谢在甲状腺癌的作用是必要的。
癌细胞中的脂代谢重新编码刺激癌细胞增殖、迁移可能是通过甘油三酯、胆固醇的合成及分解代谢途径进行的 [17] ,癌细胞通过脂滴形式储存能量,过多的脂滴进一步分解为游离脂肪酸 [18] 。随着年龄的增长,人体代谢能力降低,产生的碱性物质能力下降,大量游离脂肪酸的产生,未能及时得到中和,使人体内环境的酸碱平衡得到破坏,无法恢复到稳定状态,高PH环境适宜癌细胞生存。有研究表明,黑色素瘤 [19] 、卵巢癌 [20] 、前列腺癌 [21] 和结直肠癌 [22] 的进展与脂质代谢相关。本研究提示PTC组与健康组相比α-溶血磷脂酸、花生四烯酸、棕榈酰–甘油-3-磷酸胆碱、磷酰胆碱、α-亚麻酸代谢产物异常,花生四烯酸及α-亚麻酸等代谢通路异常,需大量基础研究进一步验证脂代谢与甲状腺癌发生发展的相关性。在PTC组大黄酸明显下调,大黄酸代谢通路异常,已研究证明大黄酸对结直肠癌 [23] 、乳腺癌 [24] 、口腔癌 [25] 都有一定的抑制作用,目前甲状腺癌与大黄酸相关研究暂未报道。
在肿瘤的增殖过程中需要大量的氨基酸作为合成蛋白质的底物。例如,精氨酸、天冬氨酸和谷氨酰胺的合成代谢已成为许多癌症治疗的研究靶点,精氨酸琥珀酸合成酶是此代谢途径的关键酶,研究证明精氨酸琥珀酸合成酶参与黑色素瘤、前列腺癌、肝细胞癌的发生,通过抑制该酶可作为一种选择性地杀死癌细胞的潜在疗法 [26] 。L-精氨酸的代谢调节促进了中枢记忆样T细胞表型的形成,体外(人)和体内(小鼠模型)的存活能力和抗肿瘤活性都增强了 [27] 。牛磺酸,一种氨基磺酸,被发现在体外少突胶质细胞分化过程中显著升高,在PTC中的含量增加。牛磺酸被认为是膀胱癌的一种可能的生物标志物 [28] 。有研究使用四种不同的代谢组学工具与传统的生化技术相结合证明结肠癌的生物标记物N1,N12-二乙酰精胺,是多胺代谢的代谢终产物 [29] ,并且此产物已在证明与肺癌 [30] 、乳腺癌 [31] 及膀胱癌 [32] 的发生息息相关。也有证据表明,癌症利用细胞外基质衍生的氨基酸来支持新陈代谢,特别是脯氨酸 [33] 。本研究提示PTC组中甘氨酸、谷氨酸、组氨酸–苏氨酸、色氨酸、亮氨酸、天冬氨酸–苯丙氨酸、丝氨酸、脯氨酸、甲基–赖氨酸、天冬氨酸、酪胺、L-精氨酸、胸腺嘧啶表达异常,氮代谢、赖氨酸降解代谢、组氨酸代谢、牛磺酸和亚牛磺酸代谢通路等均异常。
总之代谢组学是不断发展的研究领域,有许多成功的案例表明,它的力量从生物标记物的发现延伸到了解表型背后的机制,代谢组学与基因组学、蛋白质组学等技术相结合,这些技术为微生物区系做出巨大贡献。PTC发病机制尚未明确,我们通过代谢组学确定了PTC的代谢特征,部分糖代谢、脂代谢、氨基酸代谢及其代谢产物的异常可能为PTC发病机制的探索提供新思路,也可能为其治疗提供新的靶点及方向。
文章引用
赵 阳,赵 明,王 睿,张方华. 甲状腺乳头状癌患者血清样本代谢组学分析
Metabolomics Analysis of Serum Samples from Patients with Papillary Thyroid Cancer[J]. 临床医学进展, 2023, 13(11): 17230-17244. https://doi.org/10.12677/ACM.2023.13112415
参考文献
- 1. Haymart, M.R. (2021) Progress and Challenges in Thyroid Cancer Management. Endocrine Practice, 27, 1260-1263. https://doi.org/10.1016/j.eprac.2021.09.006
- 2. Chen, D.W., Lang, B.H.H., Mcleod, D.S.A., Newbold, K. and Haymart, M.R. (2023) Thyroid Cancer. The Lancet, 401, 1531-1544. https://doi.org/10.1016/S0140-6736(23)00020-X
- 3. Haugen, B.R., Alexander, E.K., Bible, K.C., et al. (2016) 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thy-roid Cancer. Thyroid, 26, 1-133. https://doi.org/10.1089/thy.2015.0020
- 4. Pizzato, M., Li, M., Vignat, J., et al. (2022) The Epidemiological Land-scape of Thyroid Cancer Worldwide: GLOBOCAN Estimates for Incidence and Mortality Rates in 2020. The Lancet Diabetes and Endocrinology, 10, 264-272. https://doi.org/10.1016/S2213-8587(22)00035-3
- 5. Bauermeister, A., Mannochio-Russo, H., Costa-Lotufo, L.V., Jarmusch, A.K. and Dorrestein, P.C. (2022) Mass Spectrometry-Based Metabolomics in Microbiome Investigations. Nature Reviews Microbiology, 20, 143-160. https://doi.org/10.1038/s41579-021-00621-9
- 6. Anwardeen, N.R., Diboun, I., Mokrab, Y., Althani, A.A. and Elrayess, M.A. (2023) Statistical Methods and Resources for Biomarker Discovery Using Metabolomics. BMC Bioin-formatics, 24, Article No. 250. https://doi.org/10.1186/s12859-023-05383-0
- 7. Chacko, S., Haseeb, Y.B. and Haseeb, S. (2022) Metabolomics Work Flow and Analytics in Systems Biology. Current Molecular Medicine, 22, 870-881. https://doi.org/10.2174/1566524022666211217102105
- 8. Chen, X. and Yu, D. (2019) Metabolomics Study of Oral Cancers. Metabolomics, 15, Article No. 22. https://doi.org/10.1007/s11306-019-1483-8
- 9. Ganesan, R., Yoon, S.J. and Suk, K.T. (2022) Microbiome and Metabolomics in Liver Cancer: Scientific Technology. International Journal of Molecular Sciences, 24, Article 537. https://doi.org/10.3390/ijms24010537
- 10. Xiao, Y., Ma, D., Yang, Y.S., et al. (2022) Comprehensive Metabo-lomics Expands Precision Medicine for Triple-Negative Breast Cancer. Cell Research, 32, 477-490. https://doi.org/10.1038/s41422-022-00614-0
- 11. Li, M., Dal Maso, L. and Vaccarella, S. (2020) Global Trends in Thyroid Cancer Incidence and the Impact of Overdiagnosis. The Lancet Diabetes and Endocrinology, 8, 468-470. https://doi.org/10.1016/S2213-8587(20)30115-7
- 12. Kodama, M. and Nakayama, K.I. (2020) A Second War-burg-Like Effect in Cancer Metabolism: The Metabolic Shift of Glutamine-Derived Nitrogen: A Shift in Gluta-mine-Derived Nitrogen Metabolism from Glutaminolysis to De Novo Nucleotide Biosynthesis Contributes to Malignant Evolution of Cancer. BioEssays, 42, e2000169. https://doi.org/10.1002/bies.202000169
- 13. Arguello, R.J., Combes, A.J., Char, R., et al. (2020) SCENITH: A Flow Cytometry-Based Method to Functionally Profile Energy Metabolism with Single-Cell Resolution. Cell Metabolism, 32, 1063-1075. https://doi.org/10.1016/j.cmet.2020.11.007
- 14. Feng, J., Li, J., Wu, L., et al. (2020) Emerging Roles and the Reg-ulation of Aerobic Glycolysis in Hepatocellular Carcinoma. Journal of Experimental & Clinical Cancer Research, 39, Article No. 126. https://doi.org/10.1186/s13046-020-01629-4
- 15. Cao, L., Wu, J., Qu, X., et al. (2020) Glycometabolic Rear-rangements—Aerobic Glycolysis in Pancreatic Cancer: Causes, Characteristics and Clinical Applications. Journal of Ex-perimental & Clinical Cancer Research, 39, Article No. 267. https://doi.org/10.1186/s13046-020-01765-x
- 16. Miccoli, P., Torregrossa, L., Shintu, L., et al. (2012) Metabo-lomics Approach to Thyroid Nodules: A High-Resolution Magic-Angle Spinning Nuclear Magnetic Resonance-Based Study. Surgery, 152, 1118-1124. https://doi.org/10.1016/j.surg.2012.08.037
- 17. Bian, X., Liu, R., Meng, Y., et al. (2021) Lipid Metabolism and Cancer. Journal of Experimental Medicine, 218, e20201606. https://doi.org/10.1084/jem.20201606
- 18. Li, D. and Li, Y. (2020) The Interaction between Ferroptosis and Lipid Metabolism in Cancer. Signal Transduction and Targeted Therapy, 5, Article No. 108. https://doi.org/10.1038/s41392-020-00216-5
- 19. Arslanbaeva, L., Tosi, G., Ravazzolo, M., et al. (2022) UBIAD1 and CoQ10 Protect Melanoma Cells from Lipid Peroxidation-Mediated Cell Death. Redox Biology, 51, Article ID: 102272. https://doi.org/10.1016/j.redox.2022.102272
- 20. Lin, F., Li, X., Wang, X., et al. (2022) Stanniocalcin 1 Promotes Metastasis, Lipid Metabolism and Cisplatin Chemoresistance via the FOXC2/ITGB6 Signaling Axis in Ovarian Cancer. Journal of Experimental & Clinical Cancer Research, 41, Article No. 129. https://doi.org/10.1186/s13046-022-02315-3
- 21. Ippolito, L., Comito, G., Parri, M., et al. (2022) Lactate Rewires Lipid Metabolism and Sustains a Metabolic-Epigenetic Axis in Prostate Cancer. Cancer Research, 82, 1267-1282. https://doi.org/10.1158/0008-5472.CAN-21-0914
- 22. Zhu, Y., Gu, L., Lin, X., et al. (2020) Dynamic Regulation of ME1 Phosphorylation and Acetylation Affects Lipid Metabolism and Colorectal Tumorigenesis. Molecular Cell, 77, 138-149. https://doi.org/10.1016/j.molcel.2019.10.015
- 23. Zhang, H., Yi, J.K., Huang, H., et al. (2021) Rhein Suppresses Colorectal Cancer Cell Growth by Inhibiting the mTOR Pathway in vitro and in vivo. Cancers, 13, Article 2176. https://doi.org/10.3390/cancers13092176
- 24. Wang, S., Fu, J.L., Hao, H.F., et al. (2021) Metabolic Repro-gramming by Traditional Chinese Medicine and Its Role in Effective Cancer Therapy. Pharmacological Research, 170, Article ID: 105728. https://doi.org/10.1016/j.phrs.2021.105728
- 25. Zhang, H., Ma, L., Kim, E., et al. (2023) Rhein Induces Oral Can-cer Cell Apoptosis and ROS via Suppresse AKT/mTOR Signaling Pathway in vitro and in vivo. International Journal of Molecular Sciences, 24, Article 8507. https://doi.org/10.3390/ijms24108507
- 26. Gupta, S., Sahu, D., Bomalaski, J.S., et al. (2018) Argininosuccinate Synthetase-1 (ASS1) Loss in High-Grade Neuroendocrine Carcinomas of the Urinary Bladder: Implications for Targeted Therapy with ADI-PEG 20. Endocrine Pathology, 29, 236-241. https://doi.org/10.1007/s12022-018-9516-9
- 27. Matos, A., Carvalho, M., Bicho, M. and Ribeiro, R. (2021) Argi-nine and Arginases Modulate Metabolism, Tumor Microenvironment and Prostate Cancer Progression. Nutrients, 13, Article 4503. https://doi.org/10.3390/nu13124503
- 28. Yuan, J.B., Gu, L., Chen, L., Yin, Y. And Fan, B.Y. (2021) Annexin A8 Regulated by lncRNA-TUG1/miR-140-3p Axis Promotes Bladder Cancer Progression and Metastasis. Mo-lecular Therapy-Oncolytics, 22, 36-51. https://doi.org/10.1016/j.omto.2021.04.008
- 29. Johnson, C.H., Dejea, C.M., Edler, D., et al. (2015) Metabolism Links Bacterial Biofilms and Colon Carcinogenesis. Cell Metabolism, 21, 891-897. https://doi.org/10.1016/j.cmet.2015.04.011
- 30. Wikoff, W.R., Hanash, S., Defelice, B., et al. (2015) Diacetyl-spermine Is a Novel Prediagnostic Serum Biomarker for Non-Small-Cell Lung Cancer and Has Additive Performance with Pro-Surfactant Protein B. Journal of Clinical Oncology, 33, 3880-3886. https://doi.org/10.1200/JCO.2015.61.7779
- 31. Umemori, Y., Ohe, Y., Kuribayashi, K., et al. (2010) Evaluating the Utility of N1, N12-Diacetylspermine and N1, N8-Diacetylspermidine in Urine as Tumor Markers for Breast and Col-orectal Cancers. Clinica Chimica Acta, 411, 1894-1899. https://doi.org/10.1016/j.cca.2010.07.018
- 32. Zhu, Y., Piao, C., Zhang, Z., et al. (2022) The Potential Role of c-MYC and Polyamine Metabolism in Multiple Drug Resistance in Bladder Cancer Investigated by Metabonomics. Genomics, 114, 125-137.
- 33. Geng, P., Qin, W. and Xu, G. (2021) Proline Metabolism in Cancer. Amino Acids, 53, 1769-1777. https://doi.org/10.1007/s00726-021-03060-1
NOTES
*通讯作者。
