Botanical Research
Vol.06 No.02(2017), Article ID:20003,8
pages
10.12677/BR.2017.62009
Research Progress of Anthocyanin from Lonicera caerulea
Nan Yang, Jie Cui
Department of Chemical Engineering and Chemistry, Harbin Institute of Technology, Harbin Heilongjiang

Received: Mar. 8th, 2017; accepted: Mar. 25th, 2017; published: Mar. 28th, 2017

ABSTRACT
Lonicera caerulea is a kind of natural, green and wild edible berry and has high nutritional value, medicinal value and commercial value. In this paper, the research status and commonly used methods of anthocyanin in Lonicera caerulea and its main functional active ingredient were in- troduced. The functional activity, extraction and isolation technology and development status and prospect of anthocyanin were studied in detail. It provides an important theoretical basis for the further study and deep development of Lonicera caerulea.
Keywords:Plant, Lonicera caerulea, Anthocyanin, Functional Activity, Extraction and Separation
蓝靛果忍冬花青苷研究进展
杨楠,崔杰
哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨
收稿日期:2017年3月8日;录用日期:2017年3月25日;发布日期:2017年3月28日

摘 要
蓝靛果忍冬作为一种纯天然、绿色、野生的可食用浆果,具有极高的营养价值、药用价值和商业价值。文章介绍了蓝靛果忍冬及其主要功能活性成分花青苷的研究概况及常用的研究方法,重点阐述了蓝靛果忍冬花青苷的功能活性、提取和分离技术和开发现状及前景。为蓝靛果忍冬的深入研究和深度开发提供重要的理论依据。
关键词 :植物,蓝靛果,花青苷,功能活性,提取和分离

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
蓝靛果忍冬(Lonicera caerulea)又名蓝靛果、羊奶子、黑瞎子果、山茄子等,忍冬科(Caprifoliaceae)、忍冬属(Lonicera Linn)。因其潜在的营养价值、药用价值和商用价值,具有极为广阔的国内外市场和开发利用前景。相关研究表明蓝靛果花青苷抗氧化能力与其含量呈现一定的相关性 [1] 。与此同时,我国丰富的蓝靛果资源和相关技术的快速发展也为蓝靛果及其花青苷的进一步开发和利用提供了广阔和优质的平台。
2. 蓝靛果忍冬概述
2.1. 蓝靛果忍冬资源分布
蓝靛果忍冬原种产于欧洲,主要分布在欧洲、亚洲和美洲。在我国境内主要分布在吉林省长白山、黑龙江省大兴安岭东部山区,因此也被誉为“北大荒严寒下的宠儿”。此外,在内蒙古、华北、西北和四川等地也有分布。在国外主要分布于俄罗斯远东地区、日本及朝鲜北部等地。蓝靛果忍冬的休眠期很短,所以在温暖地区一般不能栽植,海拔2600~3500米地势的河岸、沼泽灌木或高山林下是它最适宜的生长环境。
2.2. 蓝靛果忍冬生物学特征
蓝靛果忍冬树高1~2 m,落叶灌木,幼枝被毛,老枝棕色,冬芽叉开,叶稀卵形,两面疏生短硬毛,花冠外面有柔毛,花柱无毛,果蓝黑色,稍被白粉,5~6月开花,7~9月结果。果实呈椭圆形或长圆形,果粒长10 mm左右,短径6~8 mm,是林区野生动物的采食对象 [2] 。雌蕊先熟是蓝靛果忍冬固有的特征,并且可以自花结实,但单一品种自花授粉形成的果实不饱满、无种子。蓝靛果果实见图1。
2.3. 蓝靛果忍冬在食品生产中的开发现状及前景
俄罗斯最早在20世纪60年代将蓝靛果开发成为宇航员专用的饮料。正是由于蓝靛果的果实出汁率高、安全无毒、具有极高的营养价值,它被誉为“饮料之王”。目前以它作为原料的保健饮品已悄然进入市场,虽尚未形成大气候,但已成为人们追求的新型饮品。东北地区建设了很多以蓝靛果为主要原料的酒厂,如吉林的蓝宝酒业公司、著名的黑龙江勃利蓝靛果酒厂等。
杨占江公开了一种开胃型蓝莓蓝靛果复合果酒及其制备方法,其发明所提供的蓝莓蓝靛果复合果酒,酒精度为4%~12%(V/V),含糖量为8%~24% (W/W)。该饮品清心爽口、风味纯正、营养丰富,具有开胃健脾的效果 [3] 。薛桂新对不同蓝莓添加量的蓝靛果蓝莓复合果酒进行了研制,实验表明10%蓝莓添加量的复合果酒在陈酿期间抗氧化能力最好 [4] 。刘艳霞等人以牛乳、蓝靛果为主要原料,以感官评分为指标,通过单因素试验和正交实验确定了蓝靛果酸奶的最佳工艺条件。所得的蓝靛果酸奶产品色泽均匀一

Figure 1. The fruit of Lonicera caerulea
图1. 蓝靛果果实
致、呈微玫瑰红色、口感细腻润滑、酸甜适度、组织细腻 [5] 。程兆宇等人以蓝靛果、钙果为主要原料,开发出一种天然复合饮料。该饮料具有抗疲劳功效,兼有蓝靛果和钙果的香味、色泽 [6] 。越来越多以蓝靛果为原料的产品开发不仅扩大了以营养保健为主导的市场,同时也为蓝靛果的深加工提供了经验。
蓝靛果的美好前景值得国内外具有远见卓识的科研人员对其进行深入的研究和开发。进一步开发利用蓝靛果资源可从以下几方面入手:1) 改进现有产品线的生产工艺,使之更加高效化、科学化和产业化,使特种果品资源变成经济优势。2) 进一步做好蓝靛果深加工的研究工作,开发出符合消费者需求的保健食品、营养滋补品、功能食品和药品等系列产品,打造出企业的名牌产品。3) 深入研究蓝靛果生长的分子调控机制及遗传改良,为培育出高产、优质的蓝靛果品种提供理论和技术支持。
3. 蓝靛果忍冬花青苷研究概述
3.1. 植物花青苷研究概述
花青苷不仅是果实成熟的标志,作为植物的二级代谢产物,它在生理上也扮演着极其重要的角色。
3.1.1. 植物花青苷的结构及种类
花青苷(anthocyanin,又名花色素苷)是花青素(anthocyanidin,又名花色素)与一个或多个葡萄糖、乳糖、鼠李糖、阿拉伯糖等通过糖苷键形成的。目前已知天然存在的花青苷有250多种。
受到生物内在因素和外界环境(农艺措施、光质和光强、温度、加工等)的共同影响,不同果实品种中花青苷种类和含量也不同。并且在果实发育过程中, 花青苷含量也会随之发生变化。
褚衍亮等鉴定了樟树果的花青苷组分,其中花青苷的主要组分为芍药色素-3-阿拉伯糖苷、芍药色素-3-木糖苷和芍药色素-3-葡萄糖苷或它们的衍生物 [7] 。Xie, S等人对葡萄中六种花青苷进行了定性和定量 [8] 。赵佳等人鉴定了八个不同品种及种类的蓝靛果忍冬果实花青苷的结构及其含量。分别为矢车菊3,5-二葡萄糖苷、矢车菊-3-葡萄糖苷、矢车菊-芸香糖苷、天竺葵-3-葡萄糖苷、芍药-3-葡萄糖苷、芍药-3-芸香糖苷、矢车菊-(丙酮基)-己糖苷以及矢车菊衍生物 [9] 。Ana B.Cerezo等人研究表明Camarosa草莓中的主要花青苷是天竺葵素-3-葡萄糖苷,同时还检测到天竺葵色素-3-芦丁糖苷和天竺葵色素、矢车菊色素衍生物等 [10] 。
花青素是水溶性的植物色素,属黄酮类化合物。自然条件下,花青素主要以花青苷的形式存在,游离状态的花青素极少见。其基本分子结构见图2。它可随着细胞液的酸碱改变颜色,细胞液呈酸性则偏红,碱性则偏蓝。目前已知的花青素超过550种,其中92%是植物中的天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛色素及锦葵色素这六种 [11] ,六种常见花青素结构见表1。
3.1.2. 植物花青苷生物合成代谢途径及转运
植物花青苷合成代谢途径是类黄酮途径的一个分支,由通过细胞色素单加氧酶P450固定在内质网上的多酶复合体催化完成,其时空合成机制目前已有深入的研究 [12] 。
在少数植物中,花青苷以游离态均匀分布在液泡中,但大多数是聚集在花青素液泡包涵体(anthocyanic vacuolar inclusions,AVIs)中。目前已知主要的转运途径是通过谷胱甘肽转移酶(GST)使谷胱甘肽与花青苷相连,依赖ATP的ABC型转运体运送至液泡膜上。
3.1.3. 参与花青苷合成相关基因研究
与植物花青苷合成有关的基因可分为两类: 一类是结构基因,编码代谢途径中所需的酶;另一类是调节基因,其编码的转录因子负责调节结构基因的表达强度和程式。
1) 结构基因。植物花青苷合成途径中的关键酶基因包括:苯丙氨酸解氨酶(PAL)、查耳酮合成酶(CHS)、查耳酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、类黄酮3'-羟化酶(F3'H)、类黄酮3',5'-羟化酶(F3'5'H)、二氢黄酮醇-4-还原酶(DFR)、花色素合酶(ANS)、类黄酮3-O-糖基转移酶(3GT)等 [13] 。
2) 调节基因。在许多植物物种中,花青苷合成受转录因子复合物调节。已鉴定了3类参与花青苷合成调控的转录因子:R2R3-MYB蛋白、MYC家族的bHLH蛋白、WD40蛋白。调节花青苷的R2R3-MYB基因已从许多观赏类植物和经济作物中分离出来,如葡萄VvMybA1,番茄ANT1,苹果MdMYB10,非

Figure 2. The basic molecular structure of anthocyanins
图2. 花青素基本分子结构
Table 1. Six kinds of common anthocyanins
表1. 六种常见花青素
注:R1和R2分别表示在图1所示结构上不同基团的取代情况
洲菊GMYB10,兰花OgMYB1,龙胆2GtMYB3,梨PyMYB10,百合LhMYB12,海棠McMYB10和桃PpMYB10.1 [14] 。
对许多植物的研究发现,MYB、bHLH和WD40这三类调控因子在调控过程中存在交互作用,并形成MBW(MYB-bHLH-WD40)复合体,共同应答于植物组织中特异性状的调控。花青苷相关的MYB和bHLH之间相互作用的实例包括拟南芥PAP1,PAP2,MYB113和MYB114和TT8,矮牵牛AN2和AN1,苹果MdMYB10和MdbHLH33,荔枝LcMYB1和LcbHLH1,LcbHLH3等。表2列出了部分在不同的植物中不同类型转录因子的作用方式。
研究表明,多数调节基因对花青苷途径的调控是在结构基因转录水平上的调控,并且多数的调控是转录激活,只有少数几种调节基因为转录抑制调控。
3.2. 蓝靛果忍冬花青苷的功能活性研究
研究显示,蓝靛果相较于其他产品有很突出的抗氧化活性。其果实中含有大量的花青苷,具有清除自由基 [19] 、抗衰老、抗炎症、抗肿瘤 [20] 、抗异变、改善视力、预防和治疗心血管疾病 [21] 、提高免疫力等多种生理活性功能 [22] 。
王振宇等人研究发现,蓝靛果提取物对DPPH∙和∙OH、O2∙均具有一定清除作用,且与浓度呈量效关系,对∙OH清除效果明显优于VC、VE [23] 。赵海田等人的抗氧化能力研究得出,蓝靛果忍冬多酚ABTS自由基清除率达到89%、羟基自由基清除率达91%、超氧阴离子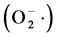 清除率达90%、DPPH自由基清除率达70%。蓝靛果花青苷对于脂质过氧化也具有一定的抑制作用。因此蓝靛果花青苷可以调节细胞氧化还原和凋亡信号转导,抑制线粒体凋亡信号途径 [24] 。
清除率达90%、DPPH自由基清除率达70%。蓝靛果花青苷对于脂质过氧化也具有一定的抑制作用。因此蓝靛果花青苷可以调节细胞氧化还原和凋亡信号转导,抑制线粒体凋亡信号途径 [24] 。
欧盟研究已证实花青苷对人体有积极正面的作用,如花青苷有助于明显降低心脏病、心血管疾病和肥胖症的风险、可显著增加糖耐量(意味着预防糖尿病)。考虑到花青苷极佳的着色能力及生理活性,未来可能有以下的发展趋势:1) 通过基因工程技术操作可以修饰或改造多种植物的花色,较短时间内培育出稳定遗传的新品种、新类型;2) 研究发现类黄酮是花粉粒外壁一个重要的组成成分,导入花青苷基因将可能有利于种子和花粉的传播;3) 在饮食和医疗方面,通过花青苷代谢的分子调控和遗传改良,提高果蔬中花青苷的含量将成为未来花青苷研究领域的热点方向。
3.3. 蓝靛果忍冬花青苷的稳定性及影响因素研究
生物内在因素和外界环境因素共同作用产生的多种信号刺激、传导、作用到转录因子,转录因子控制结构基因的表达,这些因素构成极其复杂的调控网络,最终实现果实花青苷含量的变化。
3.3.1. 外界环境因素
影响蓝靛果忍冬花青苷含量的外界因素有很多,主要有光、温度、pH、氧化剂及还原剂、金属离子等。
王端荣等人以提取出的蓝靛果忍冬花青苷为原料,发现蓝靛果忍冬花青苷的光稳定性较弱,最好避
Table 2. The different modes of transcription of different types of plants
表2. 部分不同的植物中不同类型转录因子的作用方式
光储存;糖和盐对其性质影响较小;过氧化氢对蓝靛果花青苷具有明显的破坏作用;随着亚硫酸钠浓度的增加,溶液吸光度值逐渐升高,表明花青苷的还原性较强;Fe3+和Cu2+容易使蓝靛果忍冬花青苷褪色,而Ca2+、Zn2+、Mg2+离子则无明显影响 [25] 。张冬雪的研究还得出Al3+对蓝靛果花青苷有一定增色作用的结论 [26] 。吕闻明的稳定性研究表明,当温度达60℃以上,花青苷降解明显;酸性环境中花青苷稳定显著高于碱性环境;抗坏血酸可以起到保护花青苷的作用,但久置后反而促使花色的分解 [27] 。当前研究主要集中于光照和温度对蓝靛果花青苷稳定性的影响 [28] ,其他的环境因子如水分、风速等影响果实花青苷的生物合成及分子调控机制有待进一步研究。
3.3.2. 生物内在因素
植物激素等能够影响调节基因从而改变花青苷的生物合成。脱落酸和乙烯是与果实成熟最相关的植物激素,对果实花青苷的生物合成有重要影响。已有研究表明在拟南芥中,乙烯可以抑制光或者糖诱导的花青苷积累,在葡萄、樱桃中,外源乙烯和脱落酸及细胞分裂素可以促进果实花青苷的积累。但是针对细胞分裂素,缺乏其在果实成熟相关的花青苷生物合成中作用机制的研究 [29] 。
激素对蓝靛果花青苷积累的影响研究目前仍旧处在起步阶段,试图建立蓝靛果花青苷含量与内源激素种类和含量在蓝靛果不同生长阶段的相互关系将有希望成为花青苷研究领域一个新的突破口。
3.4. 蓝靛果忍冬花青苷研究方法
3.4.1. 蓝靛果忍冬花青苷提取方法
蓝靛果忍冬花青苷的提取是研究其生理功能活性的基础,对蓝靛果的进一步开发和利用具有十分重要的实际意义。目前,常见的提取方法有以下几种。
1) 溶剂萃取法。花青苷结合有糖基,因此具有一定的极性,最常用的提取剂是甲醇或乙醇水溶液,且通常会添加少量的酸(如盐酸或乙酸)。此外,丙酮水溶液也可用于花青苷的提取且丙酮水溶液浓缩所需温度低,回收更方便,可避免果胶带来的影响。但丙酮水溶液提取率相对较低,一般仅为甲醇水溶液提取率的二分之一,且会使某些花青苷单体结构发生明显改变。结合安全性等因素综合考量,食品工业中主要采用乙醇水溶液作为花青苷提取剂。
2) 超声波辅助萃取法。该法是利用“空化作用”产生的冲击力,促进目标物质与载体分离,加速溶出到溶剂中。相对于溶剂萃取法,该法具有廉价、简便、高效等特点。
3) 微波辅助萃取法。微波可以强化溶剂萃取效率,加速溶剂对固体样品中目标萃取物(主要是有机化合物)的萃取。此法具有操作方便、加热均匀和高效快速等优点。微波萃取现已用于挥发油、生物碱、黄酮、单宁、等多种天然化合物的提取。
除以上四种常见方法,还有超临界流体萃取法、酶法辅助萃取法、超高压辅助萃取法等。在实际应用中,往往是多种方法综合使用,以达到最佳的提取效果。
杨玲采用超声辅助溶剂萃取法提取蓝靛果中的抗氧化物质,以蓝靛果提取物清除DPPH能力作响应值。响应面试验得到的最佳试验条件为:提取剂为52%乙醇、液料比26:1、超声温度52℃、超声功率160 W [19] 。张冬雪等人的研究表明溶剂萃取法提取蓝靛果色素的最佳条件为:无水乙醇为提取溶剂(调整pH值为6)、料液比为1:5、提取温度 25℃、提取时间2 h;通过超声单因素试验及正交试验分析,确定最终超声法提取蓝靛果色素的最佳提取条件为:超声固液比为1:8、超声温度20℃、超声时间30 min、超声功率70 W。两种方法比较得出超声法辅助萃取蓝靛果花青苷的提取率更高、时间更短 [26] 。
3.4.2. 蓝靛果忍冬花青苷纯化方法及分离鉴定技术
结构的鉴定对于花青苷的研究和应用方面有着很重要的作用,同时分离与鉴定技术的联用为活性成分的研究和鉴定提供了有利条件。目前纯化花青苷主要是柱层析法,分离鉴定常用的方法有光谱法和高效液相色谱及联用技术。
1) 柱层析法。大孔吸附树脂是一类不含交换基团的大孔结构的高分子聚合物吸附剂,根据被吸附物质的极性和相对分子质量大小,以及在不同溶剂中的溶解度差异,可以大量、迅速地选择性吸附和解吸附化学成分,达到有机化合物的分离和提纯 [30] 。
赵海田等人采用AB-8型大孔树脂,50%乙醇(HCl调pH值至3.0)为洗脱剂,径高比1:15,洗脱流速1.5 BV/h,洗脱剂用量4.0 BV对蓝靛果花青苷进行纯化,所得蓝靛果花青苷色价为79.68与粗提物(色价3.58)相比,纯化倍数为22.26 [24] 。刘敬华等人利用响应面法对蓝靛果花青苷的纯化工艺进行优化。分析了AB-8、X-5、D101、NKA-9、NKA五种树脂,发现非极性的大孔树脂X-5对花青苷的纯化效果较好并确定纯化蓝靛果花青苷的最优工艺参数为:上样浓度为2.5 mg/mL,径长比为1:25,洗脱剂乙醇的浓度为70%,洗脱流速为3 mL/min [31] 。
2) 光谱法。针对蓝靛果中不同花青苷的检测,应用最广的光谱法是紫外-可见分光光度法。该法是根据物质分子对波长为200~780 nm这一范围的电磁波的吸收特性所建立起来的一种定性、定量和结构分析方法。由于操作简单、准确度高、重现性好,被广泛应用于生物活性物质的分析 [32] 。王艺菲等人利用pH示差法分别在530 nm和700 nm下检测吉林长白山地区和疆阿尔泰地区的野生株系。测得吉林长白山地区的10株野生蓝靛果忍冬的总花青苷平均值为411.30 mg/100 g,新疆阿尔泰地区的10株野生阿尔泰忍冬的总花青苷平均值为403.28 mg/100g [33] 。
3) 高效液相色谱法(HPLC)及联用技术。高效液相色谱作为一种常用的分离手段,在提取植物酚类化合物的研究中起着重要的作用。质谱法具有快速灵敏、样品用量少、结构信息直观的特点,因此得到越来越广泛的应用。吕闻明等人利用HPLC技术检测到蓝靛果忍冬含量最高为矢车菊素-3-葡萄糖苷,达6.21 mg/g。其次依次为:二甲花翠素-3-5-葡萄糖苷、花翠素-3-5-葡萄糖苷、甲基花翠素-3-5-葡萄糖苷 [27] 。Wang Y, Zhu J, Meng X等人针对一种野生型蓝靛果和三种培育条件下的蓝靛果进行实验,利用HPLC法检测到16种花青苷。同样发现矢车菊素-3-葡萄糖苷是所研究品种中最主要的花青苷,矢车菊素-3-乙酰己糖苷和芍药苷-3-乙酰己糖苷这两种酰基化花青苷首次在蓝靛果浆果提取物中被发现 [34] 。
此外,质谱、气质联用、核磁共振等技术的综合使用在花青苷鉴定领域也有较广泛的应用。
4. 展望
具有“果中之王”美称的蓝靛果是继蓝莓之后的“第三代”功能性蓝色果品之一。其高含量的花青苷不仅具有很高的食用价值,也具有较高的医疗保健作用。过去几十年各国学者对蓝靛果的研究主要集中在花青苷的功能活性及生理作用机制、提取及分离鉴定技术等方面,并且取得了可喜的成果,但是高含量花青苷的蓝靛果品种选育、蓝靛果成熟过程中,花青苷的分子调控机制等若干关键领域仍有待进一步探索。
文章引用
杨楠,崔杰. 蓝靛果忍冬花青苷研究进展
Research Progress of Anthocyanin from Lonicera caerulea[J]. 植物学研究, 2017, 06(02): 55-62. http://dx.doi.org/10.12677/BR.2017.62009
参考文献 (References)
- 1. Hwang, S.J., Yoon, W.B., Lee, O., et al. (2014) Radical-Scavenging-Linked Antioxidant Activities of Extracts from Black Chokeberry and Blueberry Cultivated in Korea. Food Chemistry, 146, 71-77. https://doi.org/10.1016/j.foodchem.2013.09.035
- 2. 王红梅. 蓝靛果忍冬资源的开发与利用[J]. 防护林科技, 2014, 133(10): 91-92.
- 3. 杨占江. 一种开胃型蓝莓蓝靛果复合果酒及其制备方法[P]. 中国, 发明专利, C12G3/02. 2012-02-08.
- 4. 薛桂新. 蓝靛果蓝莓复合果酒抗氧化能力的研究[J]. 中国酿造, 2014, 15(12): 112-115.
- 5. 刘艳霞, 于长龙. 蓝靛果酸奶的研制[J]. 北方园艺, 2013, 8(2): 113-115.
- 6. 程兆宇, 房磊. 蓝靛果钙果抗疲劳饮料的研制[J]. 食品研究与开发, 2015, 2(20): 63-66.
- 7. 褚衍亮, 王娜. 樟树果花色苷组分鉴定及抑菌防腐研究[J]. 安徽农业科学, 2010, 33(20): 10907-10909.
- 8. Xie, S., Song, C., Wang, X., et al. (2015) Tissue-Specific Expression Analysis of Anthocyanin Biosynthetic Genes in White- and Red-Fleshed Grape Cultivars. Molecules, 20, 22767-22780. https://doi.org/10.3390/molecules201219883
- 9. 赵佳. 蓝果忍冬酚类物质的提取, 鉴定及抗氧化性研究[D]: [硕士学位论文]. 中国: 东北农业大学, 2010.
- 10. Cerezo, A.B., Cuevas, E., Winterhalter, P., et al. (2010) Isolation, Identification, and Antioxidant Activity of Anthocyanin Compounds in Camarosa Strawberry. Food Chemistry, 123, 574-582. https://doi.org/10.1016/j.foodchem.2010.04.073
- 11. 葛翠莲, 黄春辉, 徐小彪. 果实花青素生物合成研究进展[J]. 园艺学报, 2012, 39(9): 1655-1664.
- 12. 石少川, 高亦珂, 张秀海, 等. 植物花青素生物合成相关基因的研究及应用[J]. 植物研究, 2011, 5(31): 633-640.
- 13. 彭玉帅, 王如峰, 张陆军. 花青素生物合成的关键酶及其调控因子[J]. 中草药, 2014, 45(1): 131-136.
- 14. Sun, S., Gugger, P.F., Wang, Q., et al. (2016) Identification of a R2R3-MYB Gene Regulating Anthocyanin Biosynthesis and Relationships between Its Variation and Flower Color Difference in Lotus. Peer, 4, 17.
- 15. Spelt, C., Quattrocchio, F., Mol, J.N.M., et al. (2000) Anthocyanin1 of Petunia Encodes a Basic Helix-Loop-Helix Protein That Directly Activates Transcription of Structural Anthocyanin Genes. The Plant Cell, 12, 1619-1631. https://doi.org/10.1105/tpc.12.9.1619
- 16. Shoeva, O., Gordeeva, E. and Khlestkina, E. (2014) The Regulation of Anthocyanin Synthesis in the Wheat Pericarp. Molecules, 19, 20266-20279. https://doi.org/10.3390/molecules191220266
- 17. 梁平, 宋洪元. 植物花青素生物合成转录调控研究进展[J]. 南方农业学报, 2014, 6(8): 1375-1379.
- 18. Liu, S. and Feng, X.F. (2013) The MrWD40-1 Gene of Chinese Bayberry (Myrica rubra) Interacts with MYB and bHLH to Enhance Anthocyanin Accumulation. Plant Molecular Biology Reporter, 6, 1474-1484.
- 19. 杨玲. 蓝靛果提取物抗氧化及抗癌作用的研究[D]: [硕士学位论文]. 中国: 东北林业大学, 2009.
- 20. 刘奕琳, 王振宇. 蓝靛果花色苷乙醇洗脱物抗癌活性的研究[J]. 食品工业科技, 2012, 33(19): 159-161.
- 21. 王恩福, 包怡红. 蓝靛果提取物调节血脂功能特性的研究[J]. 食品与机械, 2010(1): 81-82.
- 22. 刘德江, 杜汉军, 申健. 蓝靛果花色苷研究进展[J]. 内蒙古农业科技, 2012(4): 44-45.
- 23. 王振宇, 杨玲. 蓝靛果乙醇提取物体外抗氧化活性研究[J]. 食品工业科技, 2009, 12(107): 162-164.
- 24. 赵海田. 蓝靛果花色苷结构表征及对辐射诱导氧化损伤防护机制[D]: [博士学位论文]. 哈尔滨: 哈尔滨工业大学, 2012.
- 25. 王瑞荣, 张文君, 周旭泽. 蓝靛果忍冬色素性质的研究[J]. 北方园艺, 2011, 5(24): 41-42.
- 26. 张冬雪. 蓝靛果色素提取条件对比, 稳定性及应用研究[D]: [硕士学位论文]. 北京: 中国农业科学院, 2012.
- 27. 吕闻明. 蓝靛果忍冬酚类物质提取及抗氧化性研究[D]: [硕士学位论文]. 长春市: 吉林大学, 2012.
- 28. Zhang, H., Li, W., Wang, H., et al. (2016) Transcriptome Profiling of Light-Regulated Anthocyanin Biosynthesis in the Pericarp of Litchi. Frontiers in Plant Science, 7, 112-118. https://doi.org/10.3389/fpls.2016.00963
- 29. 王华, 李茂福, 杨媛, 等. 果实花青素生物合成分子机制研究进展[J]. 植物生理学报, 2015, 4(1): 29-43.
- 30. 吕玉姣, 曹清丽, 林强. 原花青素提取, 分离纯化方法研究进展[J]. 化学世界, 2014, 55(10): 628-631.
- 31. 刘敬华, 王振宇, 邓心蕊. 响应面分析法优化蓝靛果花色苷纯化工艺研究[J]. 食品工业科技, 2013, 3(18): 280- 283.
- 32. 宋德群, 孟宪军, 王晨阳, 等. 蓝莓花色苷的pH示差法测定[J]. 沈阳农业大学学报, 2013(2): 231-233.
- 33. 王艺菲, 辛秀兰, 陈亮, 等. pH示差法测定不同种类蓝果忍冬总花色苷含量[J]. 食品研究与开发, 2014, 45(7): 75-78.
- 34. Wang, Y., Zhu, J., Meng, X., et al. (2016) Comparison of Polyphenol, Anthocyanin and Antioxidant Capacity in Four Varieties of Lonicera caerulea Berry Extracts. Food Chemistry, 197, 522-529. https://doi.org/10.1016/j.foodchem.2015.11.006
