Botanical Research
Vol.
10
No.
06
(
2021
), Article ID:
46686
,
11
pages
10.12677/BR.2021.106097
ALS以及ALS抑制剂类除草剂的研究进展
张红磊*,李军玲*,张融雪,郭彦丽,苏京平,孙玥,佟卉,刘燕清,王胜军,刘学军#
天津市农作物研究所,天津市农作物遗传育种重点实验室,天津
收稿日期:2021年10月16日;录用日期:2021年11月16日;发布日期:2021年11月24日

摘要
使用除草剂是根除作物田里杂草的有效方法,其中以乙酰乳酸合成酶(acetolactate synthetase, ALS)为靶标的除草剂在杂草防治方面有很好的应用价值。本文对乙酰乳酸合成酶的结构、ALS抑制剂类除草剂种类、抗除草剂植物抗性机理、抗ALS抑制剂类除草剂作物的研究进展进行了综合概括。
关键词
乙酰乳酸合成酶,ALS抑制剂类除草剂,抗性机理,抗ALS抑制剂类除草剂作物

Research Progress of ALS and ALS Inhibitors Herbicides
Honglei Zhang*, Junling Li#, Rongxue Zhang, Yanli Guo, Jingping Su, Yue Sun, Hui Tong, Yanqing Liu, Shengjun Wang, Xuejun Liu#
Tianjin Key Laboratory of Crop Genetics and Breeding, Tianjin Crop Research Institute, Tianjin
Received: Oct. 16th, 2021; accepted: Nov. 16th, 2021; published: Nov. 24th, 2021

ABSTRACT
The use of herbicides is an effective method to eradicate weeds in crop fields, among which the herbicides targeted by acetolactate synthetase (ALS) are of great value in weed control. In this paper, research progress of the structure of acetolactate synthetase, the types of ALS inhibitor herbicides, the mechanism of herbicide resistance, and crops of herbicide resistant to ALS inhibitors were summarized.
Keywords:Acetolactate Synthetase, ALS Inhibitor Herbicides, Resistance Mechanism, Crops of Herbicide Resistant to ALS Inhibitors

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
我国农业结构性的改革迫使我国的作物生产急需向规模化、轻简化方向发展。常规的化学除草剂对作物田中的恶性杂草以及在分类学和生理学上与作物本身十分相似的杂草,如油菜田的野生芥菜和臭草,水稻田的稗草和赤米稻,小麦田的雀麦和山羊草等无计可施。为了解决这一问题,乙酰乳酸合成酶(ALS)抑制剂类剂除草剂的相继开被开发和推广使用。乙酰乳酸合成酶(ALS)抑制剂类剂除草剂具有高效、杀草谱广、高选择性和对人畜高度安全等优点。乙酰乳酸合成酶(ALS)抑制剂类剂除草剂之所以对人畜高度安全是因为乙酰乳酸合成酶(acetolactate synthetase, ALS, EC 2.2.1.6)是只在植物和微生物体内催化支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)生物合成。因此越来越多的学者对ALS以及ALS抑制剂类除草剂进行研究,笔者简要概括了乙酰乳酸合成酶的结构、ALS抑制剂类除草剂种类、抗除草剂植物抗性机理、抗ALS抑制剂类除草作物以及优缺点的研究进展。
田间杂草严重影响作物产量和品质,使用除草剂是防除田间杂草的有效手段。除草剂类型种类繁多,其中最大一类是乙酰乳酸合成酶抑制剂类除草剂,靶标是乙酰乳酸合成酶(acetolactate synthase, ALS)。ALS是支链氨基酸合成(缬氨酸、亮氨酸和异亮氨酸)关键酶,只存在植物和微生物体内,而人和动物体内不存在,因此是理想的除草剂靶标酶,对ALS结构、ALS抑制剂研发、ALS抑制剂作用机制等研究众多。当面临在分类学和生理学上与作物本身十分相似的杂草时,如油菜田的野生芥菜和臭草,水稻田的稗草和赤米稻,小麦田的雀麦和山羊草等,常规除草剂就丧失了选择性因而无法防除此类杂草。因此科研人员通过诱变技术开发了抗除草剂作物,使得除草剂有更强选择性因而能够继续使用。笔者简要概括了乙酰乳酸合成酶的结构、ALS抑制剂类除草剂种类、抗除草剂植物抗性机理、抗ALS抑制剂类除草作物以及优缺点的研究进展。
2. 乙酰乳酸合成酶的概述
Umbarger是乙酰乳酸合成酶的发现者,他是在大肠杆菌中发现乙酰乳酸合成酶的,此酶是在支链氨基酸生物合成中发挥作用的,它是一个催化乙酰乳酸生物合成的酶 [1]。该酶主要催化丙酮酸生成乙酰乳酸,或者催化丙酮酸和2-酮丁酸生成2-乙酰基-2-羟基丁酸,这两个产物分别经过一系列反应之后即可获得支链氨基酸。有3个不可缺少的辅助因子——黄素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD)、焦磷酸硫胺素(thiamine pyrophosphate, TPP)和1个二价金属离子 [2] 来维持ALS活性。TPP在ALS催化的反应中主要是形成1个与ALS结合的反应中间体羟乙基-TPP,黄素腺嘌呤(FAD)在ALS参与的催化反应中,它可以防止羟乙基-TPP中间产物的质子化 [3];ALS同一些依赖TPP的酶一样,也需要1个金属离子诸如Mg2+的辅助 [4]。以ALS为靶标的除草剂就作用于此处,使得蛋白质的合成受阻,进一步阻碍细胞的相应生理活动,停止细胞生长与增殖,最终达到杀死个体的目的 [5]。
2.1. 乙酰乳酸合成酶的晶体结构
多年来,人们一直致力于乙酰乳酸合成酶的研究,在细菌、真菌、藻类、植物中已经发现多种ALS酶。大肠杆菌中的ALS酶中包含两个大亚基和两个小亚基 [6],它是一个四聚体。原核生物大肠杆菌中的ALS晶体结构与真核生物中ALS晶体结构有很大的区别。而属于真核生物的酵母的ALS晶体结构主要由二聚体、2分子FAD、2分子TPP、2个Mg2+、3个磷酸根、2个K+以及325个结晶水 [7] 组成。
2.2.1. 催化活性中心整体结构
真核生物酵母ALS晶体的每个单体都包括α结构域(85-269)、β结构域(28-458)和γ结构域(473-643) [8] 这3个结构域,见图1。它的结构中心区包括2个α螺旋结构域和2个γ转角结构域,而β结构域位于末端,主要用于稳定二聚体结合部位 [9]。

Figure 1. Monomeric structure of ALS crystal of yeast [10]
图1. 酵母ALS晶体的单体结构 [10]
真核生物酵母的ALS晶体的活性部位有2个,这2个活性部位位于酶的相对两侧,每一个活性部位都连接着两个单体的氨基酸残基 [11]。而TPP嵌入到2个单体活性部位的内侧,其焦磷酸部分则与,镁离子以及γ转角结构域的氨基酸残基相互作用,直接作用包括磷酸根中的氧原子和His500、Asp550、Ser552和Asn577的侧链原子间及Gln499,His500,Ala551和Ser552的主链原子间的氢键。TPP的双环结构和一个单体的Tyrl13、Gly115、Glu139、Thrl62和Prol65,另一单体的Met525和Met555以范得华力相互作用,见图2。
从对ALS晶体结构的研究中,我们得知了其活性部位的位置,了解了ALS与底物的结合方式,为ALS基因定向改造找到了切入点,同时为研究ALS与以ALS为靶标的除草剂关系打下了基础。
2.2.2. ALS基因的研究
早在上个世纪70、80年代,科学家们对生物体内的ALS基因已有详细研究。Lawther等 [12] 首先在大肠杆菌中克隆到ALS基因。随后Falco等 [13] 在酵母中也发现并克隆到了其ALS基因。世界各国科学家都花费了大量精力去研究各物种中的ALS基因,到目前为止,可在GenBank中搜索到与ALS基因相关的核苷酸、氨基酸序列及预测蛋白质信息多达上千条,它们至少来源于50个不同的生物种类,但多以真菌、细菌、藻类为主,其中也包含大量的植物ALS基因信息。通过近几年的研究,人们对不同物种的ALS基因有了较深入的了解,一个生物体中可能存在多个与ALS基因同源性很高的基因,但不是每个基因都具有功能 [13]。不同物种之间ALS基因的序列差异比较大,按照其序列比较相似度大体可将其分为低等生物如细菌、藻类和高等生物如植物。每一类之间其核苷酸序列的相似性比较高,通常在60%左右。在当前的研究中,属于真核生物的酵母的ALS基因研究比较早、比较完善。在酵母体内只存在1个具有功能的ALS基因 [13],酵母是较为高等的微生物,因此人们通过克隆酵母的ALS基因,之后设计基因探针,将拟南芥和烟草基因组文库作为研究基础,相继筛选到了植物体内的ALS基因 [14]。拟南芥中ALS基因的发现和克隆具有非常重要的意义,为人们发掘植物特别是农作物体内ALS基因提供了极大的方便。从此,人们对植物特别是农作物ALS基因的研究不断的深入,Wiersma等 [15] 以拟南芥的ALS基因作为探针,通过Southern杂交分析芸苔属的多个种的ALS基因,发现该物种存在一个以上的ALS基因。李汝刚 [16] 研究发现芸苔属亚种间和品种间的ALS基因也存在颇为广泛的遗传变异。

Figure 2. Cofactor binding site [3]
图2. 辅因子结合部位 [3]
3. 以ALS为靶标的除草剂概述
杜邦公司于20世纪70年代成功开发了第1个磺酰脲类乙酰乳酸合成酶抑制剂氯磺隆,这一事件在杂草防治技术和除草剂的发展中具有重要的意义。农田除草剂的用量随着该类除草剂的成功开发已从每公顷数千克缩减为几克至几十克。因为此类除草剂选择性强、杀草谱广、对哺乳动物毒性低、生物活性高,所以开发以ALS为靶标的除草剂成为之后除草剂的主要发展方向。目前以ALS为靶标的除草剂主要有磺酰脲类(Sulfonylureas, SUs)、咪唑啉酮类(imidazolinones, IMIs)、嘧啶水杨酸类(pyrimidinylsalicylidacids, PTB)、三唑并嘧啶类(triazolopyrimidines, TPs)、磺酰胺基羰基三唑啉酮类(sulfonylaminocarbonyltriazolinones, SCT)。
3.1. 以ALS为靶标的除草剂类型
3.1.1. 磺酰脲类
磺酰脲类除草剂是在上个世纪70年代由美国杜邦公司首先成功开发。该类除草剂化学结构上由脲桥、芳基、杂环(图3)三个部分组成,这三个部分对于除草剂活性的确定都起到了相当重要的作用。
磺酰脲类除草剂酰脲类除草剂从成功开发到2008年为止,其销售额已达到18亿美元,主要的品种见表1。就目前来说,磺酰脲类除草剂仍在世界上占据主导地位,其商品化的品种大概有40种,而且不断涌现着结构新颖的品种。新品种的创新点主要是在结构上的变化:芳环及其取代基、杂环。这些结构的改造导致了一系列新品种的开发 [18]。其主要的新品种既包括碘甲磺隆、甲磺胺磺隆、甲酰胺磺隆以及三氟啶磺隆,又包括IK I1145 (韩国化学所开发)和三氟甲磺隆(巴斯夫公司开发)等。当然我国也研制了一些磺酰脲类除草剂,这些除草剂包括甲硫嘧磺隆(湖南化工研究院研制)以及单嘧磺酯和单嘧磺隆(南开大学元素有机所创制)等 [19]。
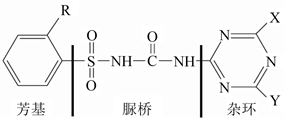
Figure 3. Molecular structure diagram of sulfonylurea herbicides [17]
图3. 磺酰脲类除草剂分子式结构图 [17]
Table 1. Main varieties of sulfonylurea herbicides [17]
表1. 磺酰脲类除草剂的主要品种 [17]
3.1.2. 咪唑啉酮类
20世纪80年代初美国氰胺公司成功开发了咪唑啉酮类除草剂。此类除草剂选择性强、杀草谱广、活性高。其化学结构包括酸、主链与咪唑啉酮环(图4)这三个部分。由于此类除草剂具有特殊的功效而受到国内外的广泛重视,主要的品种见表2。虽然在2008年其他除草剂品种的兴起,导致世界范围内咪唑啉酮类除草剂的销售额有所下降,但是仍达3.2亿美元左右。此类除草剂中只有咪草烟(咪唑乙烟酸)在中国广泛使用。
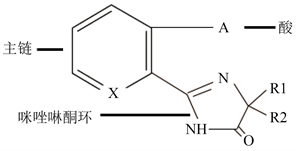
Figure 4. Molecular structure diagram of imidazolinone herbicides [17]
图4. 咪唑啉酮类除草剂分子式结构图 [17]
Table 2. Main species of imidazolinone herbicides [17]
表2. 咪唑啉酮类除草剂的主要品种 [17]
3.1.3. 嘧啶水杨酸类
嘧啶水杨酸类除草剂是在磺酰脲的含氮杂环上引入芳氧苯氧基而形成的。有研究表明在磺酰脲的含氮杂环上引入芳氧苯氧基之后,就对阔叶杂草具有活性,在此基础上,取代芳氧苯氧基及其N-芳杂环类似物以及嘧啶衍生物得到了系统的研究,最终高活性嘧啶水杨酸类除草剂得以开发利用(表3) [20]。此类除草剂具有良好的环境相容性,除了表中所列的品种还包括以下几种:稻田稗草特效除草剂KIH-2023和KIH-6127 (日本组合化学公司开发)、吡唑啉类、双嘧啶吡唑啉酮类、吡唑嘧啶磺酰胺和噻唑嘧啶磺酰胺等。以上几种也表现出很好的除草剂活性。因为它们在市场占有的份额不大,所以不再赘述。
Table 3. Main varieties of pyrimidine salicylic acid herbicides [17]
表3. 嘧啶水杨酸类除草剂的主要品种 [17]
3.1.4. 三唑并嘧啶类
美国陶氏公司于1989年成功开发三唑并嘧啶磺酰胺类化合物并申请了除草活性专利。三唑嘧啶类除草剂是由磺酰脲类化合物衍生而来的,主要是通过分子重排与结构修饰而形成的一类新型除草剂。其结构中含有三唑嘧啶环,三唑并嘧啶类除草剂其是继磺酰脲与咪唑啉酮之后的第三类的ALS抑制剂,主要品种见表4。
Table 4. Main varieties of triazolopyrimidine herbicides [17]
表4. 三唑并嘧啶类除草剂的主要品种 [17]
3.1.5. 磺酰胺基羰基三唑啉酮类
磺酰胺基羰基三唑啉酮类除草剂是由陶氏益农公司开发的,其活性和杀草谱均可与磺酰脲类除草剂相比拟,它是磺酰脲类除草剂合成的中间产物。其重要品种与高活性化合物如表5所示。
Table 5. Main varieties of sulfonyl amino carbonyl triazolinones (adapted from [21] )
表5. 磺酰胺基羰基三唑啉酮类除草剂的主要品种(改自 [21] )
4. 抗除草剂植物的抗性机理
植物对ALS类除草剂的抗性主要包括靶标抗性和非靶标抗性。
1) 靶标抗性:
靶标抗性是指通过靶标蛋白的表达活性升高或靶标蛋白与除草剂结合位点的结构改变而获得的抗性。以ALS为靶标的除草剂使植物抗性产生的主要原因是氨基酸的替换。不同位点氨基酸的替换以及氨基酸替换方式导致产生的抗性效应和交叉抗性均有较大差异。目前已知的ALS基因产生抗性突变的位点(以拟南芥ALS氨基酸序列作为参比)主要包括以下8个位点:Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653和Gly654。在这8个位点当中,能使植物对磺酰脲类除草剂产生抗性的氨基酸位点是Pro197、Ala205和Trp574这3个位点。而Ala122、Ser653和Gly654 [22] - [27] 位点的氨基酸替换致使植物对咪唑啉酮类除草剂产生抗性。
2) 非靶标抗性:
非靶标抗性是指通过表达调控促进代谢作用而引起植物对除草剂产生抗性。有研究表明4种以上的酶系统包括细胞色素P450酶、谷胱甘肽转移酶、葡萄糖基转移酶和ABC转运蛋白参与了植物对ALS抑制剂类除草剂的代谢作用。例如:CYP81A6是一种新的水稻细胞色素P450酶 [28],其导致植物对苄嘧磺隆和吡嘧磺隆有抗性;此外CYP72A31也是一种新的水稻细胞色素P450酶 [29],它能够使植物代谢双草醚。
5. 抗ALS抑制剂类除草剂作物
随着以ALS为靶标的除草剂品种的发展,对于抗靶标为ALS除草剂作物的开发研究也日益增多。研究比较多的是抗咪唑啉酮类作物和抗磺酰脲类作物。抗咪唑啉酮作物大多都是122位脯氨酸、574位色氨酸与653位赖氨酸突变,而抗磺酰脲类作物大都是197位丝氨酸、205位丙氨酸与574位色氨酸突变,利用传统育种技术而成而非转基因,其抗性原理是靶点突变,从而降低ALS对咪唑啉酮类除草剂 [22] 和磺酰脲类除草剂的敏感性。
抗咪唑啉酮玉米的研究是从1982年开始的,主要采用组织培养与花粉诱变方法进行选育;组织培养是将杂交种A188 × B73的愈伤组织放在小于40%咪唑啉酮酸浓度的琼脂培养基中进行多次选择,最终选出了能在比初始培养咪唑啉酮酸浓度高300倍的培养基中生长的细胞系,之后导入到普通玉米品种中。这样培养出的抗咪唑啉酮玉米于1992年在美国商业种植。花粉诱变也是获得抗性玉米的方法,用1%甲磺酸乙酯处理玉米自交系UE95新鲜花粉粒,所得植株生长至成熟,收获种子,用咪唑乙烟酸处理植株,其中有9株抗性提高了660倍,以此方法所选出的抗性玉米已经商品化 [30] [31] [32] [33]。其主要的突变位点是Ala122、Ala155和Ser653 [34]。这3个位点的突变导致玉米对抗咪唑啉酮除草剂有抗性,而Trp574位点突变使玉米对咪唑啉酮、磺酰脲类、三唑并嘧啶类、嘧啶水杨酸类都有抗性。
抗咪唑啉酮除草剂小麦是通过种子诱变而成,共分4个阶段:1) 种子诱变;2) 种子浸于除草剂中;3) 芽前除草剂处理;4) 筛选与选择抗除草剂突变体。首先将冬小麦品种Fidel的种子吸涨1天,用叠氮化钠诱变2 h,M2种子用咪唑乙烟酸处理,然后再进行芽前处理。最终从中选出4个抗性品系FS1、FS2、FS3与FS4,将其作为选育抗咪唑啉酮的材料,2001年抗性小麦首次商品化。另外,用甲磺酸乙酯处理春小麦品种Teal的种子,M2植株喷洒甲氧咪草烟,从中选出了具有中等至高度抗性水平的6个品系1A、9A、10A、11A、15A与16A。冬小麦含有1个单一的ALS基因便具有抗性,而春小麦则需两个纯合的抗性ALS基因才能获得充足的抗性 [35] [36]。抗咪唑啉酮除草剂的小麦突变位点主要是Ser653 [34]。
抗咪唑啉酮类除草剂的水稻也是通过诱变种子得到的。它是用甲磺酸乙酯诱变水稻品种AS3510,M2植株喷洒咪唑乙烟酸,选出具有抗性的突变系93AS3510,从中选出两个抗性品种CL121与CL141,并于2001年在美国商业化种植;此外,用甲磺酸乙酯使水稻品种Cypress诱变,M2植株喷洒灭草烟或甲基咪草烟,存活的12个植株具有抗性,在7个重要的抗性品系中,选出两个抗咪唑啉酮除草剂品种CL161与XL8并于2003年首次商品化种植 [37]。抗咪唑啉酮除草剂的水稻突变位点主要是Trp574 [38] 和Ser653 [34]。
对于抗ALS类除草剂的油菜的研究最早是Swanson等通过小孢子诱变筛选出两个抗咪唑啉酮类除草剂油菜突变体PM1和PM2,PM1是BnALS1的Ser-653-Asp替换,只对咪唑啉酮类除草剂有抗性;PM2是BnALS3的Trp-574-Leu替换生;而PM2同时对咪唑啉酮类除草剂和磺酰脲类类除草剂有抗性。2004年我国江苏农科院浦惠明课题组发现了自然突变的油菜材料M9,研究发现其BnALS1蛋白的Ser653替换成Asp,它对咪唑啉酮类除草剂有抗性。浦惠明课题组还利用诱变剂甲基磺酸乙酯(EMS)处理甘蓝型油菜,获得了抗磺酰脲类除草剂突变体M343 [39],突变位点是BnALS3蛋白Trp-574-Leu。目前已发现抗咪唑啉酮类除草剂的油菜突变位点主要是Trp574和Ser653 [40]。
6. 常规作物用药与抗ALS抑制剂类除草剂作物用药的优缺点
抗ALS抑制剂类除草剂作物用药与常规作物相比有以下几个方面的优点:1) 用药的种类更加广泛;2) 同一种除草剂的致死剂量更高。然而长期使用单一或一类除草剂也会导致抗性杂草的出现,因此急需开发更高效安全的除草剂或者培育出抗性更强的作物。
7. 展望
虽然ALS抑制剂类除草剂活性高、杀草谱广、选择性强、使用方便、对人畜无害,但是任何一种除草剂都会因长期大量的使用而产生抗药性,所以也迫切地需新型ALS抑制剂的开发利用。此外可以利用ALS抑制剂不同亚家族之间的抑制作用机制差异开发抗除草剂作物,延长现有ALS抑制剂类除草剂的产品寿命,例如一般来说,抗咪唑啉酮类除草剂的杂草或者作物对磺酰脲类除草剂没有抗性,反之亦然。
此外ALS抑制剂类除草剂长期使用也会对作物造成药害,制约后茬作物的种植,尤其是咪唑啉酮类除草剂,土壤残留期较长,如果不采取一定措施,对后茬作物影响非常严重。我们可以筛选高活性的微生物新菌种降解土壤中残留ALS抑制剂类除草剂。
目前研究较多的是ALS抑制剂类除草剂的靶标抗性,而对其非靶标抗性研究较少,仅在水稻中有个别报道。加强对ALS抑制剂类除草剂代谢抗性的研究不仅能够指导除草剂安全使用,而且能为创制出更多类型除草剂抗性作物提供参考。
基金项目
国家体系天津试验站(CARS-01-49);天津市农业科学院青年创新项目重点项目(2019007)。
文章引用
张红磊,李军玲,张融雪,郭彦丽,苏京平,孙 玥,佟 卉,刘燕清,王胜军,刘学军. ALS以及ALS抑制剂类除草剂的研究进展
Research Progress of ALS and ALS Inhibitors Herbicides[J]. 植物学研究, 2021, 10(06): 781-791. https://doi.org/10.12677/BR.2021.106097
参考文献
- 1. Umbarger, H.E. and Brown, B. (1958) Isoleucine and Valine Metabolism in Escherichia coli VIII. The Formation of Acetolactate. Journal of Biological Chemistry, 233, 1156-1160. https://doi.org/10.1016/S0021-9258(19)77358-X
- 2. Chipman, D., Barak, Z. and Schloss, J.V. (1998) Biosynthesis of 2-Aceto-2-Hydroxy Acids: Acetolactate Synthases and Acetohydroxyacid Synthases. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1385, 401-419. https://doi.org/10.1016/S0167-4838(98)00083-1
- 3. 黄新发. 除草剂靶标乙酰乳酸合成酶对抑制剂敏感性及其分子机理的初步研究[D]: [硕士学位论文]. 杭州: 浙江大学, 2003.
- 4. Duggleby, R.G. (2006) Domain Relationships in Thiamine Diphosphate-Dependent Enzymes. Accounts of Chemical Research, 39, 550-557. https://doi.org/10.1021/ar068022z
- 5. 宋贵生, 冯德江, 等. 水稻乙酰乳酸合成酶基因的克隆和功能分析[J]. 中国农业科技导报, 2007, 9(3): 66-72.
- 6. Andrews, T.J. and Whitney, S.M. (2003) Manipulating Ribulose Bisphosphate Carboxylase/Oxygenase in the Chloroplasts of Higher Plants. Archives of Biochemistry and Biophysics, 414, 159-169. https://doi.org/10.1016/S0003-9861(03)00100-0
- 7. Hasson, M.S. and Muscate, A. (1998) The Crystal Structure of Benzoylformate Decarboxylase at 1.6 Å Resolution: Diversity of Catalytic Residues in Thiam Indiphosphate-Dependent Enzyme. Biochemistry, 37, 9918-9930. https://doi.org/10.1021/bi973047e
- 8. Pang, S.S., Duggleby, R.G. and Guddat, L.W. (2002) Crystal Structure of Yeast Acetohydroxyacid Synthase: A Target for Herbicidal Inhibitors. Journal of Molecular Biology, 317, 249-262. https://doi.org/10.1006/jmbi.2001.5419
- 9. McCourt, J.A. and Duggleby, R.G. (2006) Acetohydroxyacid Synthase and Its Role in the Biosynthetic Pathway for Branched-Chain Amino Acids. Amino Acids, 31, 173-210. https://doi.org/10.1007/s00726-005-0297-3
- 10. 郑培忠, 沈健英. 新型乙酰乳酸合成酶(ALS)抑制剂作用机理的研究进展[J]. 杂草科学, 2009(2): 1-2.
- 11. Hawkins, C.F. and Borges, A. (1989) A Common Structural Motif in Thiamin Pyrophosphate-Binding Enzymes. FEBS Letters, 204, 430-434.
- 12. Lawther, R.P. and Nichols, B. (1979) The Nucleotide Sequence Preeeding and Including of the ilvE Gene of the ilvGEDA Operon of Esehierchia coli K12. Nucleic Aeids Research, 7, 2289-2301. https://doi.org/10.1093/nar/7.8.2289
- 13. Falco, S.C. and Dumas, K.S. (1985) Genetic Analysis of Mutants of Saccharomyces cerevisiae Resistant to the Herbicide Sulfometuron Methyl. Genetics, 109, 21-35. https://doi.org/10.1093/genetics/109.1.21
- 14. Mourad, G., Pandey, B. and King, J. (1993) Isolation and Genetic Analysis of a Triazolopyrimidine-Resistant Mutant of Arabidopsis. Journal of Heredity, 84, 91-96. https://doi.org/10.1093/oxfordjournals.jhered.a111307
- 15. Wiersma, P.A., Schmiemann, M.G., Condie, J.A., et al. (1989) Isolation, Expression and Phylogenetic Inheritance of an Acetolactate Synthase Gene from Brassica napus. Molecular and General Genetics MGG, 219, 413-420. https://doi.org/10.1007/BF00259614
- 16. 李汝刚, Mcferso, J.R., Kresovich, S. 乙酰乳酸合成酶基因在芸苔属栽培种内的遗传变异[J]. 生物多样性, 1998, 6(1): 6-12.
- 17. 郑培忠, 沈健英. 乙酰乳酸合成酶抑制剂的种类及其耐药性研究进展[J]. 杂草科学, 2009(2): 5-6.
- 18. 苏少泉. 靶标ALS除草剂品种的开发与问题[J]. 农药译丛, 1994, 16(4): 17-24.
- 19. 张一宾. 抑制乙酰乳酸合成酶(ALS)除草剂世界市场及品种发展概述[J]. 现代农药, 2005, 4(6): 28-31.
- 20. 苏少泉. 新的ALS抑制剂——嘧啶水杨酸类除草剂[J]. 农药译丛, 1997, 19(3): 14-18.
- 21. 苏少泉. 新的乙酰乳酸合成酶抑制剂——磺酰胺类除草剂[J]. 农药译丛, 1997, 19(5): 21-22.
- 22. Lyu, J.Y., Huang, Q.X., Sun, Y.Y., Qu, G.P., Guo, Y., Zhang, X.J., Zhao, H.X. and Hu, S.W. (2018) Male Sterility of an AHAS-Mutant Induced by Tribenuron-Methyl Solution Correlated with the Decrease of AHAS Activity in Brassica napus L. Frontiers in Plant Science, 9, Article No. 1014. https://doi.org/10.3389/fpls.2018.01014
- 23. Li, H.T., Li, J.J., Zhao, B., Wang, J., Yi, L.C., Liu, C., Wu, J.S., King, G.J. and Liu, K.D. (2015) Generation and Characterization of Tribenuron-Methyl Herbicide-Resistant Rapeseed (Brasscia napus) for Hybrid Seed Production Using Chemically Induced Male Sterility. Theoretical and Applied Genetics, 128, 107-118. https://doi.org/10.1007/s00122-014-2415-7
- 24. Piao, Z.Z., Wang, W., Wei, Y.N., Francesco, Z., Wan, C.Z., Bai, J.J., Wu, S.W., Wang, X.Q. and Fang, J. (2018) Characterization of an Acetohydroxy Acid Synthase Mutant Conferring Tolerance to Imidazolinone Herbicides in Rice (Oryza sativa). Planta, 247, 693-703. https://doi.org/10.1007/s00425-017-2817-2
- 25. Han, H., Yu, Q., Purba, E., Li, M., Walsh, M., Friesen, S. and Powles, S.B. (2012) A Novel Amino Acid Substitution Ala-122-Tyr in ALS Confers High-Level and Broad Resistance across ALS-Inhibiting Herbicides. Pest Management Science, 68, 1164-1170. https://doi.org/10.1002/ps.3278
- 26. Tranel, P.J., Wright, T.R. and Heap, I.M. (2021) Mutations in Herbi-cide-Resistant Weeds to ALS Inhibitors. The International Herbicide-Resistant Weed Database. http://www.weedscience.com
- 27. Murphy, B.P. and Tranel, P.J. (2019) Target-Site Mutations Conferring Herbicide Resistance. Plants, 8, Article No. 382. https://doi.org/10.3390/plants8100382
- 28. Pan, G., Zhang, X.Y., Liu, K.D., Zhang, J.W., Wu, X.Z., Zhu, J. and Tu, J.M. (2006) Map-Based Cloning of a Novel Rice Cytochrome P450 Gene CYP81A6 That Confers Resistance to Two Different Classes of Herbicides. Plant Molecular Biology, 61, 933-943. https://doi.org/10.1007/s11103-006-0058-z
- 29. Saika, H., Horita, J., Taguchi-Shiobara, F., et al. (2014) A Novel Rice Cytochrome P450 Gene, CYP72A31, Confers Tolerance to Acetolactate Synthase-Inhibiting Herbicides in Rice and Arabidopsis. Plant Physiology, 166, 1232-1240. https://doi.org/10.1104/pp.113.231266
- 30. Bailey, W.A. and Wilcut, J.W. (2003) Tolerance of Imidazoli-none-Resistant Corn (Zea mays) to Diclosulam. Weed Technology, 17, 60-64. https://doi.org/10.1614/0890-037X(2003)017[0060:TOIRCZ]2.0.CO;2
- 31. Currie, R.S., Kwon, C.S. and Penmer, D. (1995) Magnitude of Imazethapyr Resistance of Corn (Zea mays) Hybrids with Altered Acetolactate Synthase. Weed Science, 43, 578-582. https://doi.org/10.1017/S0043174500081674
- 32. Newhouse, K., Singh, B., Shaner, D., et al. (1991) Mutations in Corn (Zea mays L.) Conferring Resistance to Imidazolinone Herbicides. Theoretical and Applied Genetics, 83, 65-70. https://doi.org/10.1007/BF00229227
- 33. Al-Khatib, K. and Miller, J.F. (2000) Registration of Four Genetic Stocks of Sunflower Resistant to Imidazolinone Herbicides. Crop Science, 40, 869-870.
- 34. 沈晓霞, 倪长春. 咪唑啉酮类除草剂耐受性作物的过去, 现状和将来(上) [J]. 世界农药, 2005, 27(5): 9-13.
- 35. Newhouse, K., Smith, W.A., Starrett, M.A., et al. (1992) Tolerance to Imidazolinone Herbicides in Wheat. Plant Physiology, 100, 882-886. https://doi.org/10.1104/pp.100.2.882
- 36. Pozniak, C.J., Birk, I.T., O’Donoughue, L.S., et al. (2004) Physiological and Molecular Characterization of Mutation-Derived Imidazolinone Resistance in Spring Wheat. Crop Science, 44, 1434-1443. https://doi.org/10.2135/cropsci2004.1434
- 37. Webster, E.P. and Masson, J.A. (2001) Acetolactate Syn-thase-Inhibiting Herbicides on Imidazolinone-Tolerant Rice. Weed Science, 49, 652-657. https://doi.org/10.1614/0043-1745(2001)049[0652:ASIHOI]2.0.CO;2
- 38. 陈竹锋, 王承旭, 唐晓艳, 邓兴旺. 水稻抗除草剂蛋白及其在植物育种中的应用[P]. 中国专利, CN201210037789.9. 2012-02-20.
- 39. 浦惠明, 胡茂龙, 高建芹, 龙卫华, 张洁夫, 陈松, 陈锋, 付三雄, 周晓婴, 戚存扣. 一种基于ALS靶酶的抗除草剂油菜定向选育方法[P]. 中国专利, CN201310054645.9. 2013-02-21.
- 40. 胡茂龙, 程丽, 郭月, 龙卫华, 高建芹, 浦惠明, 张洁夫, 陈松. 油菜抗咪唑啉酮类除草剂基因标记的开发与应用[J]. 作物学报, 2020, 46(10): 1639-1646.
NOTES
*并列第一作者。
#通讯作者。
