Hans Journal of Soil Science
Vol.
07
No.
01
(
2019
), Article ID:
28192
,
11
pages
10.12677/HJSS.2019.71005
Effects of Submerged Macrophyte Potamogeton crispus L. and Sediment Anaerobic Level on Porewater Properties of Heavy Metal Contaminated Sediment
Yangyu Song, Juan Wu, Shuiping Cheng*
Key Laboratory of Yangtze River Water Environment of Ministry of Education, Tongji University, Shanghai

Received: Nov. 30th, 2018; accepted: Dec. 19th, 2018; published: Dec. 26th, 2018

ABSTRACT
The anoxic condition in sediment resulted from exhaustion of oxygen by the decomposition of organic pollutants accumulated in the sediment notably affects porewater properties of the sediment, and the biogeochemical behaviors of metals, thereby alters the phytoremediation effect of the metal polluted sediment. With simulating different levels of sediment anoxia by adding different dose of sucrose into the sediment, we investigated the effects of redox condition and submerged macrophyte Potamogeton crispus L. on the physicochemical parameters of porewater and releasing potential of metals in sediment. The results indicated that the sediment anoxic treatments reduced the oxidation-reduction potential (ORP) in sediment and the pH of porewater, conversely improved the total organic carbon (TOC) concentration in porewater. The effects of sediment redox condition on the reactivity of metals are specific. Sediment anoxia increased the concentration of Fe, Mn and Cr in porewater, especially for Fe and Mn, which had a mean concentration in the sever sediment anoxic treatment as high as 15.4 and 4.0 times of that in the non-anoxia treatment. However, sediment anoxia showed somewhat inhibitive effect on the release of Ni and Zn during the initial phase of the experimental duration (0 - 56 days), which became negligible thereafter. The concentration of Cu in porewater was not affected by the redox condition of sediment. Although the Potamogeton crispus L. could significantly change the concentrations of TOC and Fe in the porewater, the effect on other metal elements was limited.
Keywords:Submerged Macrophyte, Sediment Anaerobic Level, Physicochemical Property, Releasing of Heavy Metals
菹草(Potamogeton crispus L.)和底泥厌氧水平对重金属污染底泥间隙水性质的影响
宋阳煜,吴娟,成水平*
同济大学,长江水环境教育部重点实验室,上海

收稿日期:2018年11月30日;录用日期:2018年12月19日;发布日期:2018年12月26日

摘 要
有机物降解消耗溶解氧导致的厌氧环境会显著影响底泥间隙水理化性质和重金属的生物地球化学特征,从而改变重金属污染底泥的植物修复效果。本研究通过向底泥中投加不同量的蔗糖,模拟不同的底泥氧化还原环境,探讨底泥氧化还原环境和沉水植物菹草(Potamogeton crispus L.)对底泥间隙水理化性质和底泥金属元素释放的影响。结果表明,底泥厌氧处理显著降低了底泥氧化还原电位(ORP)和间隙水的pH,提高了间隙水中总有机碳(TOC)的浓度。底泥厌氧条件对不同金属活性的影响有很大差异。厌氧条件会显著增加底泥间隙水中Fe、Mn和Cr元素的浓度,其中对Fe和Mn的作用最为明显。重度厌氧条件下间隙水中Fe和Mn的平均浓度可达到为非厌氧对照组的15.4和4.0倍。在实验前期(0~56天),厌氧环境抑制了底泥中Ni和Zn的释放,但试验后期影响不显著。从整个试验阶段来看,厌氧环境对底泥间隙水中Cu的影响不显著。沉水植物菹草虽能有效改善底泥厌氧环境,显著降低底泥间隙水TOC和Fe浓度,但对其它金属元素的影响是有限的。
关键词 :沉水植物,底泥厌氧水平,理化性质,重金属释放

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
重金属和类金属(例如Cr,Ni,Cu,Zn,As,Cd,Hg和Pb)是重要的环境污染物,释放到环境中会通过食物链对生物体产生各种毒性作用。许多重金属的单质形式和可溶性盐形式都是高毒性的,即使微量存在于大气,土壤和水中,也会对生物体造成严重的健康危害 [1] 。有研究表明 [2] 进入河流的污染物中只有1%以下能溶解于水中,绝大部分污染物会沉积在河流沉积物中。纳入水体的重金属大部分在物理沉淀、化学吸附等作用下迅速由水相转入固相,沉积于底泥中。在环境条件如pH、氧化还原环境、生物作用和水动力作用发生变化时就能通过一系列物理、化学和生物过程重新释放而进入间隙水中,造成二次污染。特别是底泥及泥–水界面的pH、ORP和Fe、Mn、S等元素的氧化还原变化对底泥重金属元素的释放过程起到关键性作用 [3] [4] 。在富营养化的大背景下,水体和底质中有机质积累水平较高,这些有机质的化学或生物分解会耗竭底质中的溶解氧和其它电子受体,加之上覆水体溶解氧向底质的补充扩散速率很慢,使其氧化还原电位下降并维持在较低水平,底泥呈厌氧状态。底泥厌氧环境会显著影响底泥其它理化性质,同时也会改变重金属的生物地球化学特征,从而对其由底泥向间隙水的释放产生影响。
植物修复是一种低成本和环境友好的修复技术 [5] 。越来越多的研究和实践表明,在控制外源污染的前提下,以水生植被的重建为基础,利用植物修复作用,是解决目前底泥重金属污染的有效之选。作为水生态系统的重要组成部分,水生植物尤其是沉水植物,可以通过根际释氧改变根际底质的氧化还原性质,进而影响重金属的移动性和生物有效性 [6] [7] 。同时,富营养化水体中底泥的厌氧环境会显著影响金属元素在底泥与间隙水之间的平衡,从而改变植物修复效果。尽管利用植物修复重金属污染的报道已有很多,但底泥厌氧环境对重金属污染底泥的植物修复效果的影响仍有不确定之处。
本研究以合肥市南淝河的底泥为研究对象,利用蔗糖分解模拟底泥厌氧环境,种植沉水植物菹草(Potamogeton crispus L.)模拟植物修复,研究底泥氧化还原环境下底泥间隙水理化性质的变化,分别探讨底泥氧化还原环境和厌氧胁迫下沉水植物对污染底泥重金属释放的影响,以期为重金属污染底泥的植物修复提供理论依据和参考。
2. 实验材料与方法
2.1. 实验材料
本实验采用18个长 × 宽 × 高 = 35 cm × 35 cm × 60 cm的玻璃缸为植物种植池。每个缸内放置20 cm × 20 cm × 15 cm的PVC塑料盒,用于盛装底泥。实验用底泥采集自合肥市南淝河。底泥过0.85 mm孔径筛,去除大颗粒杂质。实验底泥泥质特征指标见表1。
Table 1. Chemical characteristics of the sediment
表1. 底泥泥质特征指标
实验前用减重法测定底泥的含水率,并向底泥中投加配置成溶液的NiSO4∙7H2O、K2Cr2O7、CuSO4和ZnCl2。参考GB15618-1995中土壤环境质理三级标准值和芮胜阳的实验结果 [8] ,投加的Ni、Cr、Cu、Zn量分别为250、600、270和300 mg/kg (底泥干重)。搅拌均匀后将底泥静置2周测定实验初始值,测得重金属Ni、Cr、Cu、Zn的质量分数分别为262.9、613.1、303.0、456.6 mg/kg (底泥干重)。实验用菹草石芽购自湖北荆州的洪湖绿水特产公司,选用状态良好和大小一致的石芽清洗干净用于实验。
2.2. 实验方法
采用向底泥中添加蔗糖的方式模拟底泥厌氧环境 [9] 。蔗糖的投加量为底泥干重的0%,0.5%和1%,分别模拟底泥非厌氧、轻度厌氧和重度厌氧水平。投加方法具体为:先分别将20 mL混有不同蔗糖质量分数的热琼脂溶液倒入PVC盒内静置,待琼脂凝固后每个盒内加入3.5 kg底泥,底泥厚度约为6cm。在底泥厚度的一半处,水平安装间隙水取样器(Rhizon CSS,Rhizosphere Research Products,荷兰),取样器连接有20 mL注射器,可抽取孔隙水。图1为装置示意图。
每个PVC盒植入菹草石芽,种植密度为16株每盒。另设置不种菹草石芽的PVC盒为对照组,即实验共设置3个底泥厌氧水平 × 2个有无植物处理 = 6个处理组,分别为:0% + C组(非厌氧对照组)、0.5% + C组(轻度厌氧对照组)、1% + C组(重度厌氧对照组)、0% + P组(非厌氧植物组)、0.5% + P组(轻度厌氧植物组)和1% + P组(重度厌氧植物组)。每个处理有3个重复。将每个塑料盒置于一个玻璃缸中,沿缸壁加满自来水(自来水经实验测定重金属、有机质含量极低,对实验无影响),尽量避免对底泥的扰动。
Figure 1. Sketch diagram of device
图1. 装置示意图
实验时间为2017年11月23日至2018年4月11日,周期为138天。实验过程中对环境光照照度和水下温度进行记录,其平均值分别为10.5 ± 6.2℃和8699 ± 31,43lx。实验期间用自来水及时补充玻璃缸中上覆水。
由于底泥间隙水易被氧化不稳定,其氧化还原电位用电极法原位测定来表征。实验期间采集底泥间隙水,测定其中pH值和TOC浓度,其中TOC采用高温催化燃烧氧化法测量,同时采用硝酸-双氧水消法消解间隙水样品,用电子耦合等离子发射发法(Inductively Coupled Plasma-Atomic Emission Spectrometry, ICP-AES)测定Fe和Mn元素的浓度,并用电感耦合等离子体质谱仪(ICP-MS)测定Cr、Cu、Ni和Zn元素的浓度。底泥间隙水理化指标和金属元素浓度每两周测定一次。
2.3. 数据处理
用SPSS 23.0软件进行统计分析。以底泥厌氧条件和菹草的有无作为两个因素,时间作为协变量对底泥间隙水pH、ORP、TOC和金属元素浓度进行双因素方差分析(Two-Way ANOVA),同时分析间隙水金属元素含量与底泥理化性质之间的Pearson相关性。方差分析前进行正态性分布和方差齐性检验,以满足其条件。p < 0.05表明具有显著性差异。
3. 结果
3.1. 底泥理化性质的变化
图2(a)所示为各处理组底泥间隙水pH的变化情况,可知pH值随时间有一定波动,大致趋势是42天前下降,随后又呈上升趋势,在实验结束时各处理组的pH值趋于一致。双因素方差分析结果表明(表2),底泥厌氧处理对间隙水pH有显著性影响(p < 0.01),底泥厌氧水平越高,pH值越低。整个实验周期中三个厌氧处理的间隙水pH平均值分别为6.87 ± 0.10、6.65 ± 0.11和6.44 ± 0.18。菹草对底泥间隙水pH的影响不显著(p > 0.05)。
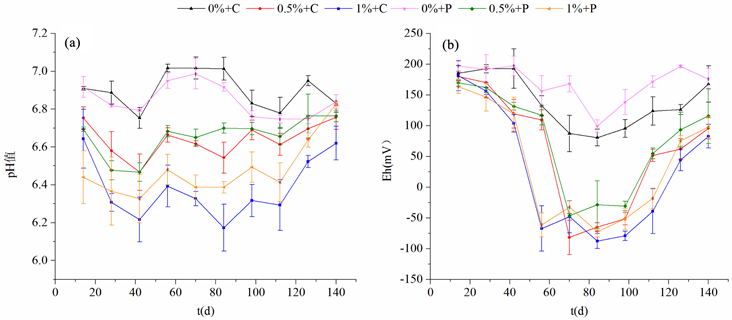
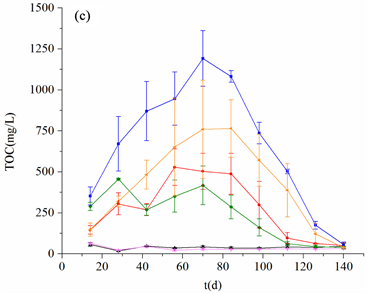
Figure 2. Variation of Eh, pH and TOC of porewater from the non- and vegetated sediment in the three sediment anoxia treatments
图2. 不同厌氧处理种植和未种菹草的底泥Eh、间隙水pH值和TOC的变化情况
Table 2. Summary of the two-way ANOVAs for the physicochemical variables and metal concentrations in porewater with anoxic treatment and the presence of Potamogeton crispus L. as the two factors
表2. 底泥厌氧环境和菹草对底泥间隙水理化性质与金属元素浓度影响的双因素方差分析结果
aNS表示差异不显著(p > 0.05)。
图2(b)所示为各处理组底泥Eh的时间变化曲线。厌氧处理组的底泥Eh呈现明显的先下降后上升的趋势,轻度厌氧对照组和轻度厌氧植物组底泥Eh在实验第70天左右达到最低值,重度厌氧对照组和重度厌氧植物组在实验第84天左右达到最低值。方差分析结果表明,底泥厌氧处理对底泥Eh的影响极显著(p < 0.01),随着底泥厌氧水平的提高,Eh依次下降。以Eh较低的第84天为例,三个底泥厌氧处理组的Eh平均值分别为90.02 ± 34.13 mV、−46.75 ± 42.65 mV和−79.97 ± 16.99 mV。与pH值相似,菹草对底泥Eh的影响也不显著(p > 0.05)。
底泥厌氧处理中间隙水的TOC质量浓度均有先升高后降低的趋势,在第70天左右分别达到最大值,重度厌氧对照组TOC质量浓度高达1191.42 ± 170.00 mg/L (图2(c))。底泥厌氧处理对间隙水TOC的影响极为显著(p < 0.01),间隙水TOC浓度随着底泥厌氧水平的增加而升高。轻度和重度厌氧对照组间隙水TOC平均值分别为非厌氧对照组的5.84和14.90倍。此外,底泥厌氧环境下种植菹草的底泥间隙水中TOC的质量浓度显著低于未种菹草的对照组(p < 0.01)。
3.2. 间隙水中金属Fe和Mn浓度的变化
同TOC的时间变化趋势相似,底泥厌氧处理组间隙水中Fe含量均呈现先上升后下降的趋势,在第70天时升至最大值,然后逐渐降低,在实验结束时与非厌氧条件下的处理组趋于一致(图3(a))。在整个实验过程中,轻度和重度厌氧对照组间隙水Fe质量浓度的平均值分别比非厌氧对照组高52.79和102.26 mg/L。同时种植菹草的底泥间隙水中Fe质量浓度明显低于未种植物的对照组(p < 0.01)。轻度和重度厌氧植物组分别比同厌氧水平的对照组间隙水Fe质量浓度低10.15和42.37 mg/L。

Figure 3. Variation of Fe and Mn concentration in porewater from the non- and vegetated sediment in the three sediment anoxia treatments
图3. 不同厌氧处理种植和未种菹草的底泥间隙水中Fe和Mn浓度的时间变化情况
间隙水中Mn与Fe的浓度变化呈显著性正相关关系(表2)。轻度和重度厌氧条件下,间隙水Mn含量也呈现先上升后下降的趋势,在第70天时Mn质量浓度分别达到最大值(18.1 mg/L和28.7 mg/L),然后逐渐降低。底泥厌氧处理对间隙水Mn浓度的影响也呈极显著水平(p < 0.01),Mn浓度随厌氧水平的增加而上升。本研究中植物的有无对间隙水Mn浓度影响不显著(p > 0.05)。
3.3. 间隙水中重金属Ni、Cr、Cu和Zn浓度的变化
除Zn之外,间隙水中其它三种金属元素浓度的变化整体呈下降趋势(图4)。在实验开始第56天后,各处理Ni、Cr和Cu的浓度降低到一定水平,各处理组平均值分别在15.32 μg/L、0.029 mg/L和0.74 μg/L附近波动。底泥氧化还原条件对间隙水中Cr和Ni浓度的影响是极为显著的(表2,p < 0.01),其中Cr浓度随底泥厌氧水平的增加而升高,三个厌氧处理的平均浓度分别为22.69 ± 16.41 mg/L、24.17 ± 15.79 mg/L和34.38 ± 25.42 mg/L。与Cr相反,底泥厌氧处理条件下(轻度和重度厌氧水平)的间隙水Ni平均浓度分别为0.080 ± 0.112 mg/L和0.094 ± 0.133 mg/L,反而低于非厌氧处理的0.164 ± 0.172 mg/L。方差分析结果表明,底泥厌氧条件未对间隙水Cu的浓度变化产生明显影响(p > 0.05),各处理组间隙水Cu含量差异很小,从第56天起所有实验组间隙水Cu质量浓度均低于0.002 mg/L以下。Zn的时间变化趋势与其它三种金属元素不同,它的浓度在112天后有一个明显回升的过程,各处理平均值在实验结束时(第140天)达到0.12 ± 0.03 mg/L,甚至高于实验开始时(第14天)的0.099 ± 0.023 mg/L。对于Zn来说,底泥厌氧水平未对其浓度产生整体影响(p > 0.05),但在前56天内,非厌氧处理间隙水中的Zn含量呈现小幅升高后逐渐降低,其平均值明显高于厌氧处理。本研究中植物的有无对不同厌氧水平下底泥间隙水中重金属Ni、Cr、Cu、Zn的质量分数无显著性影响(p > 0.05)。

Figure 4. Variation of concentration of Ni, Cr, Cu and Zn in porewater from the non- and vegetated sediment in the three sediment anoxic treatments
图4. 不同厌氧处理中种植和未种菹草的底泥间隙水中Ni、Cr、Cu和Zn浓度的时间变化情况
表3所示为底泥间隙水理化性质与金属元素浓度指标之间的Pearson相关系数,仅有Fe、Mn和Cr的浓度与底泥pH呈显著性负相关,与TOC呈显著性正相关。Zn与pH呈正相关关系,与TOC呈显著性负相关,而Cu和Ni与pH、TOC均无明显相关性。底泥ORP与间隙水Fe和Mn浓度呈显著性负相关关系,而与Cu、Ni和Zn浓度却呈正相关关系。
Table 3. The correlations between the of physicochemical variables and metal concentrations in porewater
表3. 底泥间隙水理化性质与金属元素浓度指标之间的相关性
*表示0.05水平显著,**表示0.01水平显著。
4. 讨论
蔗糖降解产生的有机酸是导致厌氧处理组间隙水pH较低的主要原因,重度厌氧处理间隙水pH在第84天达到最低值,可能是外源蔗糖被固定在琼脂中,其释放需要一个过程。蔗糖逐渐释放进入间隙水并分解成小分子有机物使间隙水中TOC质量分数升高,同时其降解过程中不断消耗氧气和其它电子受体,进而导致底泥ORP不断降低。而非厌氧对照组和植物组因未添加蔗糖,底泥ORP变化不如厌氧处理组显著,前期ORP出现小幅度降低可能是因为实验开始前,搅拌混匀底泥的过程使底泥中溶解氧质量分数增加,后逐渐被好氧微生物消耗。另外,沉水植物在生长过程中,一方面其根系的输氧作用能够增加根系周围的溶解氧 [10] ,使水生植物的根际形成氧化态的微环境,氧化蔗糖及其产生的有机酸,进而抵消一部分有机酸对pH的降低作用。另一方面,植物根系本身脱落的细胞和根际分泌物的分解过程会改变根际底泥pH。此外,外源糖分解产物既可以作为植物细胞进行大分子合成的底物,另一方面也可以作为影响植物碳代谢关键酶活性的分子信号,加速植物的碳代谢 [11] ,从而降低间隙水中TOC的质量分数。Elisa也通过苦草种植对比实验发现沉水植物能调节水体有机负荷和其它理化参数 [12] 。除了植物本身对底泥有机污染物的去除有显著的作用外,植物的根际作用促进了根际微生物的生长,提高了微生物的数量和活性,对底泥中的重金属有一定的积累能力,对有机物也可以达到较好的去除效果。虽然多项研究指出湿地植物可以通过根际泌氧(ROL)影响底泥的pH和ORP等环境因素,从而改变金属的移动性 [13] [14] [15] ,但本研究结果说明菹草通过根系释氧改变根际氧化还原环境的作用没有那么显著,这可能与菹草的根系生物量较少有关。
通过分析发现底泥厌氧水平越高底泥间隙水Fe含量越高,与Wu的实验结果一致 [16] 。这是因为在缺氧或厌氧的环境下,底泥样品中可还原态即铁锰氧化物结合态Fe被部分还原并以Fe2+的形式进入间隙水 [17] [18] 。同时,厌氧条件下较低的pH和ORP会抑制铁细菌将Fe2+转化为Fe3+ [19] ,而Fe2+不易形成沉淀,造成间隙水中Fe浓度升高。陈庆锋 [20] 等研究表明,当处于浸润状态的土被还原后,铁和锰被还原成可溶的二价铁和二价锰,容易渗出土壤,使土壤孔隙水中Fe2+和Mn2+的浓度升高。同时固定在铁锰氧化物上的重金属被转化为移动性更强的形态,并释放到底泥间隙水中。而水生植物根系分泌的氧气进入厌氧性底质中会氧化Fe (II)生成铁氧化 [21] 沉积在根系表面形成铁锰胶膜,影响其它金属元素的迁移和转化 [4] 。
研究表明,pH是控制底泥重金属释放的最为关键因素之一,一般酸性条件容易加速底泥中重金属的释放过程 [22] [23] 。但本次研究中底泥厌氧环境下间隙水中Ni和实验前期Zn的含量低于非厌氧环境,其结果与Ho的实验结果相反 [3] 。一方面可能因为底泥厌氧环境下间隙水pH较低,H+可以通过离子交换作用使金属离子从矿物质表面解吸,也可以通过溶解矿物的方式使吸附于表面或包含于矿物质内的金属释放 [24] ,另一方面厌氧条件下硫离子与重金属结合 [25] ,生成的硫化物溶解度低,导致厌氧条件下间隙水中Ni、Zn含量反而降低。也有学者通过土壤柱淋溶实验中发现土壤Ni溶出和pH之间的呈正相关,而土壤浸出液的pH在很小的范围内变化,这表明对Ni的溶出起主要作用的可能不是化学因素,而是可溶性Ni和碱性组分在物理性水浸出作用下发生共溶出作用 [26] 。Zn含量在实验后期有回升,可能是因为实验后期环境温度明显上升,根据分子热运动理论,温度升高有利于底泥中重金属向水相的迁移;而且,与其它金属元素相比,Zn与底泥吸附亲和力较弱,其吸附-溶出平衡更容易受外界条件影响而被打破,具有较强的交换溶出能力 [27] [28] 。与Ni、Zn、Cr相比,Cu的浓度变化相对稳定,这与其赋存形态以及溶度积有关 [29] 。Cu2+对有机物具有很高的亲和力,可与Fe2+、Fe3+、Al3+和Ca2+等离子共同与含多电子基团的有机物结合,形成稳定的络合物 [30] [31] ,一般在相对极端的条件下才会大量释放 [32] 。Zong-ling Ren [33] 等还发现Cu能够和金属氧化物(如Fe/Mn氧化物)形成内层配合物,或者和酚类基团等土壤有机质的高亲和性位点紧密结合,最终导致间隙水中Cu2+的溶出很少,受环境因素的影响也较弱。作为元素周期表中的相邻元素Cu和Zn虽然物理化学性质相近,但二者溶出规律差异明显。从原子结构上看,Cu作为一种瞬变金属,离子半径小,空轨道容易与表面官能团复合 [28] ,其最外层电子[3d94s0]接受一个电子成为稳定的[3d104s0]结构,与Zn相比有更高的稳定性 [34] 。
底泥间隙水中的金属浓度是评估该金属移动性和可利用性的重要依据 [35] 。底泥中金属元素的释放机制较为复杂,取决于金属元素本身的物理化学性质,以及底泥中其它物质的共同作用。Younis等 [25] 发现在氧化性沉积物中,金属元素的生物可利用性主要取决于金属离子与有机碳、Fe/Mn氢氧化物的结合机制;而在厌氧沉积物中,二价金属离子的有效性与环境中的酸挥发性硫化物(AVS)含量有关。虽然菹草根系能影响底泥理化性质,并对某些金属元素的释放有一定的抑制作用,但本实验结果说明其影响是有限的(表2)。
5. 结论
1) 底泥间隙水的pH和ORP与底泥的厌氧程度呈负相关,而TOC呈相反趋势,表明本研究采用的蔗糖模拟不同底泥厌氧水平的方法是合适的。
2) 厌氧条件对底泥金属元素释放的影响因金属种类的不同存在很大的差异。对于Fe、Mn和Cr,底泥厌氧条件明显促进了其释放,而对Ni的作用正好相反,对Cu和Zn的影响不明显。
3) 植物修复可以一定程度上改变根际环境,影响厌氧条件下底泥间隙水的理化性质和重金属的释放,尤其对降低间隙水中TOC和Fe的含量效果显著,但本研究采用的菹草根系较为细小,对重金属元素释放的影响有限。
基金项目
本研究由国家自然科学基金(5177080361)资助。
文章引用
宋阳煜,吴 娟,成水平. 菹草(Potamogeton crispus L.)和底泥厌氧水平对重金属污染底泥间隙水性质的影响
Effects of Submerged Macrophyte Potamogeton crispus L. and Sediment Anaerobic Level on Porewater Properties of Heavy Metal Contaminated Sediment[J]. 土壤科学, 2019, 07(01): 33-43. https://doi.org/10.12677/HJSS.2019.71005
参考文献
- 1. Sakakibara, M., Ohmori, Y., Ha, N.T.H., et al. (2011) Phytoremediation of Heavy Metal-Contaminated Water and Sediment by Eleocharis acicularis. Acta Hydrochimica Et Hydrobiologica, 39, 735-741.
- 2. 耿雅妮. 河流重金属污染研究进展[J]. 中国农学通报, 2012, 28(11): 262-265.
- 3. Ho, H.H., Swennen, R., Cappuyns, V., et al. (2012) Potential Release of Selected Trace Elements (As, Cd, Cu, Mn, Pb and Zn) from Sediments in Cam River-Mouth (Vietnam) under Influence of pH and Oxidation. Science of the Total Environment, 435, 487-498. https://doi.org/10.1016/j.scitotenv.2012.07.048
- 4. Xu, Y., Sun, X., Zhang, Q., et al. (2018) Iron Plaque Formation and Heavy Metal Uptake in Spartina alterniflora at Different Tidal Levels and Waterlogging Conditions. Ecotoxicology & Environmental Safety, 153, 91. https://doi.org/10.1016/j.ecoenv.2018.02.008
- 5. Doni, S., Macci, C., Peruzzi, E., et al. (2015) Heavy Metal Distribution in a Sediment Phytoremediation System at Pilot Scale. Ecological Engineering, 81, 146-157. https://doi.org/10.1016/j.ecoleng.2015.04.049
- 6. Bert, V., Seuntjens, P., Dejonghe, W., et al. (2009) Phytoremediation as a Management Option for Contaminated Sediments in Tidal Marshes, Flood Control Areas and Dredged Sediment Landfill Sites. En-vironmental Science and Pollution Research, 16, 745-764. https://doi.org/10.1007/s11356-009-0205-6
- 7. Ali, H., Khan, E. and Sajad, M.A. (2009) Phytoremediation of Heavy Metals—Concepts and Applications. Chemosphere, 91, 869-881. https://doi.org/10.1016/j.chemosphere.2013.01.075
- 8. 芮胜阳, 吴娟, 崔娜欣, 等. 底泥氧化还原环境对苦草(Vallisneria natans)生理生态及重金属元素摄取的影响[J]. 生态与农村环境学报, 2017, 33(3): 260-264.
- 9. Wu, J., Cui, N. and Cheng, S. (2013) Effects of Sediment Anoxia on Growth and Root Respiratory Metabolism of Iris pseudacorus: Implications for Vegetation Restoration of Eutrophic Waters in China. Ecological Engineering, 53, 194-199. https://doi.org/10.1016/j.ecoleng.2012.12.043
- 10. Sorrell, B.K. and Dromgoole, F.I. (1987) Oxygen Transport in the Submerged Freshwater Macrophyte Egeria densa Planch. I. Oxygen Production, Storage and Release. Aquatic Botany, 28, 63-80. https://doi.org/10.1016/0304-3770(87)90056-8
- 11. Le, V.Q., Samson, G. and Desjardins, Y. (2001) Opposite Effects of Ex-ogenous Sucrose on Growth, Photosynthesis and Carbonmetabolism of in Vitro Plantlets of Tomato (L-esculentum Mill.) Grown under Two Levels of Irradiances and CO2 Concentration. Journal of Plant Physiology, 158, 599-605. https://doi.org/10.1078/0176-1617-00315
- 12. Soana, E., Naldi, M. and Bartoli, M. (2012) Effects of increasing Organic Matter Loads on Pore Water Features of Vegetated (Vallisneria spiralis, L.) and Plant-Free Sediments. Ecological Engineering, 47, 141-145. https://doi.org/10.1016/j.ecoleng.2012.06.016
- 13. Yang, J.X., Yong, L. and Zhi-Hong, Y.E. (2012) Root-Induced Changes of pH, Eh, Fe(Ⅱ) and Fractions of Pb and Zn in Rhizosphere Soils of Four Wetland Plants with Different Radial Oxygen Losses. Pedosphere, 22, 518-527. https://doi.org/10.1016/S1002-0160(12)60036-8
- 14. Armstrong, J., Armstrong, W. and Beckett, P.M. (2010) Phragmites australis: Venturi- and Humidity-Induced Pressure Flows Enhance Rhizome Aeration and Rhizosphere Oxidation. New Phytologist, 120, 197-207. https://doi.org/10.1111/j.1469-8137.1992.tb05655.x
- 15. Wright, D.J. and Otte, M.L. (1999) Wetland Plant Effects on the Bio-geochemistry of Metals beyond the Rhizosphere. Biology & Environment Proceedings of the Royal Irish Academy, 99, 3-10.
- 16. Wu, J., Dai, Y., Rui, S., et al. (2015) Acclimation of Hydrilla verticillata to Sediment Anoxia in Vegetation Restoration in Eutrophic Waters. Ecotoxicology, 24, 2181-2189. https://doi.org/10.1007/s10646-015-1549-y
- 17. 刘国锋, 何俊, 范成新, 等. 藻源性黑水团环境效应: 对水–沉积物界面处Fe、Mn、S循环影响[J]. 环境科学, 2010, 31(11): 2652-2660.
- 18. 申秋实, 范成新, 王兆德, 等. 湖泛水体沉积物–水界面Fe2+/ΣS2?迁移特征及其意义[J]. 湖泊科学, 2016(6): 1175-1184.
- 19. 魏志勇, 王亚娥, 李杰, 等. pH, DO及铁细菌对Fe2+氧化的影响研究[J]. 重庆环境科学, 2013, 35(3): 14-17.
- 20. 陈庆锋, 单保庆, 马君健, 等. 暴雨型湿地孔隙水中铁锰的时空变化特征[J]. 环境科学, 2011, 32(5): 1340-1345.
- 21. Emerson, D., Fleming, E.J. and Mcbeth, J.M. (2010) Iron-Oxidizing Bacteria: An Environmental and Genomic Perspective. Annual Review of Microbiology, 64, 561-583. https://doi.org/10.1146/annurev.micro.112408.134208
- 22. 李鹏, 曾光明, 蒋敏, 等. pH值对霞湾港沉积物重金属Zn、Cu释放的影响[J]. 环境工程学报, 2010(11): 2425-2428.
- 23. Moberly, J.G., Staven, A., Sani, R.K., et al. (2010) Influence of pH and Inorganic Phosphate on Toxicity of Zinc to Arthrobacter sp. Isolated from Heavy-Metal-Contaminated Sediments. Environmental Science & Technology, 44, 7302. https://doi.org/10.1021/es100117f
- 24. Mclaughlin, M.J., Lambrechts, R.M., Smolders, E., et al. (1998) Effects of Sulfate on Cadmium Uptake by Swiss Chard: II. Effects Due to Sulfate Addition to Soil. Plant and Soil, 202, 217-222. https://doi.org/10.1023/A:1004381413048
- 25. Younis, A.M., Elzokm, G.M. and Okbah, M.A. (2014) Spatial Variation of Acid-Volatile Sulfide and Simultaneously Extracted Metals in Egyptian Mediterranean Sea Lagoon Sediments. Environmental Mon-itoring & Assessment, 186, 3567-3579. https://doi.org/10.1007/s10661-014-3639-3
- 26. Ashworth, D.J. and Alloway, B.J. (2004) Soil Mobility of Sewage Sludge-Derived Dissolved Organic Matter, Copper, Nickel and Zinc. Environmental Pollution, 27, 137-144. https://doi.org/10.1016/S0269-7491(03)00237-9
- 27. 叶裕中. 沉积底泥中重金属的释放[J]. 环境化学, 1990, 9(5): 27-33.
- 28. Gunawardana, C., Goonetilleke, A. and Egodawatta, P. (2013) Adsorption of Heavy Metals by Road Deposited Solids. Water Science & Technology: A Journal of the International Association on Water Pollution Research, 67, 2622. https://doi.org/10.2166/wst.2013.171
- 29. Simpson, S.L., Ward, D., Strom, D., et al. (2012) Oxidation of Acid-Volatile Sulfide in Surface Sediments Increases the Release and Toxicity of Copper to the Benthic Amphipod Melita plumulosa. Chemosphere, 88, 953-961. https://doi.org/10.1016/j.chemosphere.2012.03.026
- 30. Huiming, L.I., Qian, X., Wei, H.U., et al. (2013) Chemical Speciation and Human Health Risk of Trace Metals in Urban Street Dusts from a Metropolitan City, Nanjing, SE China. Science of the Total Environment, 456-457, 212-221.
- 31. Sundaray, S.K., Nayak, B.B., Lin, S., et al. (2011) Geochemical Speciation and Risk Assess-ment of Heavy Metals in the River Estuarine Sediments—A Case Study: Mahanadi Basin, India. Journal of Hazardous Materials, 186, 1837. https://doi.org/10.1016/j.jhazmat.2010.12.081
- 32. Zhang, J., Hua, P. and Krebs, P. (2015) The Chemical Fractionation and Potential Source Identification of Cu, Zn and Cd on Urban Watershed. Water Science & Technology: A Journal of the International Association on Water Pollution Research, 72, 1428. https://doi.org/10.2166/wst.2015.355
- 33. Ren, Z.L., Sivry, Y., Dai, J., et al. (2016) Exploring Cd, Cu, Pb, and Zn Dynamic Speciation in Mining and Smelting-Contaminated Soils with Stable Isotopic Exchange Kinetics. Applied Geochemistry, 64, 157-163. https://doi.org/10.1016/j.apgeochem.2015.09.007
- 34. Zhang, J., Hua, P. and Krebs, P. (2016) The Influence of Dissolved Or-ganic Matter and Surfactant on the Desorption of Cu and Zn from Road-Deposited Sediment. Chemosphere, 150, 63-67. https://doi.org/10.1016/j.chemosphere.2016.02.015
- 35. Cappuyns, V., Swennen, R. and Verhulst, J. (2006) Assessment of Heavy Metal Mobility in Dredged Sediments: Porewater Analysis, Single and Sequential Extractions. Journal of Soil Contamination, 15, 169-186.
NOTES
*通讯作者。
