Advances in Clinical Medicine
Vol.
12
No.
01
(
2022
), Article ID:
48234
,
13
pages
10.12677/ACM.2022.121058
基于网络药理学和分子对接探讨金银花改善2型糖尿病的潜在机制
刘昕宇1*,赵蕙琛1,张钟文2,孙露1,张玉超1,刘元涛3#
1青岛大学医学院附属青岛市市立医院,山东 青岛
2山东第一医科大学第一附属医院,山东 济南
3山东大学齐鲁医院(青岛),山东 青岛
收稿日期:2021年12月21日;录用日期:2022年1月11日;发布日期:2022年1月25日

摘要
目的:运用网络药理学和分子对接的方法探讨金银花改善2型糖尿病(type 2 diabetes mellitus, T2DM)的潜在机制。方法:通过检索中药系统药理学数据库与分析平台(TCMSP)获得金银花的有效成分及活性靶点,通过比对人类基因数据库(GeneCards)归纳总结金银花中具有治疗作用的核心靶点,运用String10.5构建核心靶点相互作用网络图。Cytoscape3.6.1软件绘制成分–靶点和蛋白质相互作用网络图。使用DAVID6.8数据库对核心靶点进行基因本体(GO)分析和基因百科全书(KEGG)通路富集分析。AutoDockTools1.5.6进行分子对接验证关键成分与核心靶点的结合活性。结果:获得金银花有效成分17种,活性靶点204个,与T2DM相关的靶点68个。其中,槲皮素、山奈酚、木犀草素、β-谷甾醇和豆甾醇可能是金银花改善T2DM的主要活性成分,TNF、AKT1、IL6、MAPK1、VEGFA可能是治疗的关键靶点,HIF-1、TNF、PI3K-AKT、FoXO信号通路可能与改善T2DM相关。分子对接结果显示,主要活性成分与关键靶点结合良好。结论:网络药理学和分子对接在研究金银花改善T2DM的作用机制中发挥作用,并为进一步探索提供理论参考。
关键词
金银花,2型糖尿病,网络药理学,分子对接,靶点预测,信号通路

Potential Mechanism of Honeysuckle in the Improving of Type 2 Diabetes Mellitus Based on Network Pharmacology and Molecular Docking
Xinyu Liu1*, Huichen Zhao1, Zhongwen Zhang2, Lu Sun1, Yuchao Zhang1, Yuantao Liu3#
1Qingdao Municipal Hospital Affiliated to Medical School of Qingdao University, Qingdao Shandong
2The First Hospital Affiliated with Shandong First Medical University, Jinan Shandong
3Qilu Hospital of Shandong University (Qingdao), Qingdao Shandong
Received: Dec. 21st, 2021; accepted: Jan. 11th, 2022; published: Jan. 25th, 2022

ABSTRACT
Objective: To explore the potential mechanism of Honeysuckle in improving type 2 diabetes mellitus (T2DM) based on network pharmacology and molecular docking. Methods: The effective components and active targets of Honeysuckle were obtained by using the traditional Chinese medicine systems pharmacology database and analysis platform (TCMSP). By comparing with the human gene database (GeneCards), the core targets with therapeutic effect in Honeysuckle were summarized. And the String10.5 was used to construct target interaction network. Cytoscape3.6.1 software was used to plot the component-target network and protein interaction network. Gene Ontology (GO) analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analysis of the core targets were performed by using the David6.8 database. AutoDockTools1.5.6 conducted molecular docking to verify the binding activity between key components and core targets. Result: 17 active components, 204 active targets and 68 targets related to type 2 diabetes were obtained from Honeysuckle. Quercetin, Kaempferol, Luteolin, β-sitosterol and Stigmasterol may be the main active components of Honeysuckle in improving T2DM. TNF, AKT1, IL6, MAPK1 and VEGFA may be the key targets of treatment. HIF-1, TNF, PI3K-AKT and FoXO signaling pathways may be related to the improvement of T2DM. The results of molecular docking showed that the main active components were well combined with the key targets. Conclusions: Network pharmacology and molecular docking play roles in exploring the potential mechanism of Honeysuckle in improving T2DM, and provide theoretical reference for further research.
Keywords:Honeysuckle, Type 2 Diabetes Mellitus, Network Pharmacology, Molecular Docking, Target Prediction, Signal Pathway

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
糖尿病(diabetes mellitus)是以慢性高血糖为主要特征的代谢性疾病,按发病机制可以分为1型和2型 [1]。2型糖尿病(Type 2 diabetes mellitus, T2DM)具有缓慢性、进行性、异质性、多因素等特点,特点是胰岛素抵抗以及胰岛素分泌紊乱 [2]。其严重的并发症包括大血管、视网膜、周围神经和肾脏病变等,严重威胁着人类健康,影响人们的生活质量。糖尿病的经典药“二甲双胍”属于双胍类药物,来源于山羊豆/法国丁香 [3];有心肾获益的钠–葡萄糖协同转运蛋白2 (Sodium glucose cotransporter 2, SGLT-2)抑制剂类的发现是因为在苹果皮中找到了一种天然抑制钠–葡萄糖协同转运蛋白分子的糖苷衍生物——根皮苷 [4]。我国古代对糖尿病的记载可追溯到《黄帝内经》,《素问·奇病论》中有记载:“肥者令人内热,甘者令人中满,故其气上溢,转为消渴”,因此“消渴”一词由此出现,而后逐渐用“消渴症”一词来描述糖尿病 [5]。我国对治疗糖尿病有丰富的经验,不仅有《黄帝内经》《伤寒杂病论》等关于治疗糖尿病古代医籍,而且一些特色的中医治疗方法如中药食材、针灸、药浴等都卓有成效 [6]。金银花别称忍冬,是我国的一味传统中药,最早记录于《名医别录》。对于金银花的药理研究多集中在抗炎、抗病毒、调节免疫等方面 [7] [8] [9]。目前有报道金银花对降血糖、改善2型糖尿病具有较好的效果 [10],但对于具体机制研究还较少。网络药理学作为药理学的新分支,可以将药物网络和生物网络整合在一起,能够揭示更复杂的药理学规律,被广泛用于中药研究 [11]。本研究基于网络药理学的研究方法,分析金银花改善2型糖尿病的潜在作用机制,旨在为进一步研究提供科学依据。
2. 材料与方法
2.1. 金银花有效成分及活性靶点的筛选
在中药系统药理学数据库与分析平台(TCMSP, https://www.tcmspw.com/)中,以“金银花”为关键词检索化合物,设置口服生物利用度(Oral bioavailability, OB) ≥ 30%和药物相似性(Drug-likeness, DL) ≥ 0.18 [12],筛选出符合条件的金银花有效成分。利用TCMSP数据库中化合物靶点识别功能,获取有效成分分别对应的活性靶点,删除无对应靶点的成分。利用Uniprot数据库(http://www.uniprot.org/) Uniprot-KB功能,限定物种为“Homo sapiens”,检索已证实的靶点对应的基因名称,去除未检索到的靶点,得到金银花的靶点基因。
2.2. 2型糖尿病靶点的筛选
基于人类基因数据库(GeneCards, https://www.genecards.org/),检索关键词“Type 2 diabetes”,获得2型糖尿病的靶点基因,根据“Relevance score”从高到低排序,筛选出得分较高的靶点。
2.3. 金银花–2型糖尿病潜在作用靶点筛选
将金银花和2型糖尿病的靶点分别于Venny平台进行映射,得到二者交集,即金银花与2型糖尿病的潜在作用靶点。
2.4. “金银花–有效成分–活性靶点”网络图及蛋白相互作用网络图(PPI)的构建
利用Cytoscape3.7.1软件构建“金银花单药–有效成分–活性靶点”网络图,利用软件中的“Analyze Network”计算各活性成分的度值(Degree),度值越大代表该成分越重要。根据度值进行排布。将获得的药物–疾病共同作用靶点导入到String10.5平台(https://string-db.org/)中,限定物种为“Homo sapiens”,最高置信度设置为0.900,去除游离节点并导出“TSV”文件。利用Cytoscape3.7.1软件中的“AnalyzeNetwork”计算各节点的度值(Degree),按照度值大小进一步绘制并可视化PPI网络,筛选出关键靶点。
2.5. GO和KEGG富集分析
将交集基因导入生物学信息注释数据库6.8 (DAVID 6.8, https://david.ncifcrf.gov/),限定物种为“Homo sapiens”,进行基因本体(GO)分析和基因百科全书(KGEE)通路富集分析。根据P值由低到高排序,筛选出排名前10的GO结果和排名前20的KEGG结果,利用R语言将分析结果导出为柱状图和气泡图。
2.6. 分子对接
选取Degree值排名前三的药物有效成分作为配体,在Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取小分子配体的2D结构,利用OpenBabel2.4.1软件进行格式转换。在PPI网络中选取Degree值排名前三的关键靶点作为受体,于RCSB PDB数据库(https://www.rcsb.org/)中获取蛋白质的3D结构,运用AutoDockTools1.5.6进行分子对接,Pymol对对接结果进行可视化分析。
3. 结果
3.1. 金银花有效成分及活性靶点的获取
在TCMSP数据库中检索到金银花的236种成分,筛选后共得到17种有效成分(见表1)。17种化学成分对应204个作用靶点。“金银花有效成分–靶点”网络图如图1所示。该网络包括222个节点和428条边。节点代表金银花有效成分及对应的活性靶点,边代表二者的相互作用关系。度值前5的成分为槲皮素(Quercetin)、山奈酚(Kaempferol)、木犀草素(Luteolin)、β-谷甾醇(Beta-sitosterol)、豆甾醇(Stigmasterol)。说明以上5种成分可能是金银花与2型糖尿病相关的主要有效成分。
Table 1. 17 active compounds information of Honeysuckle
表1. 金银花中17种活性化合物的基本信息
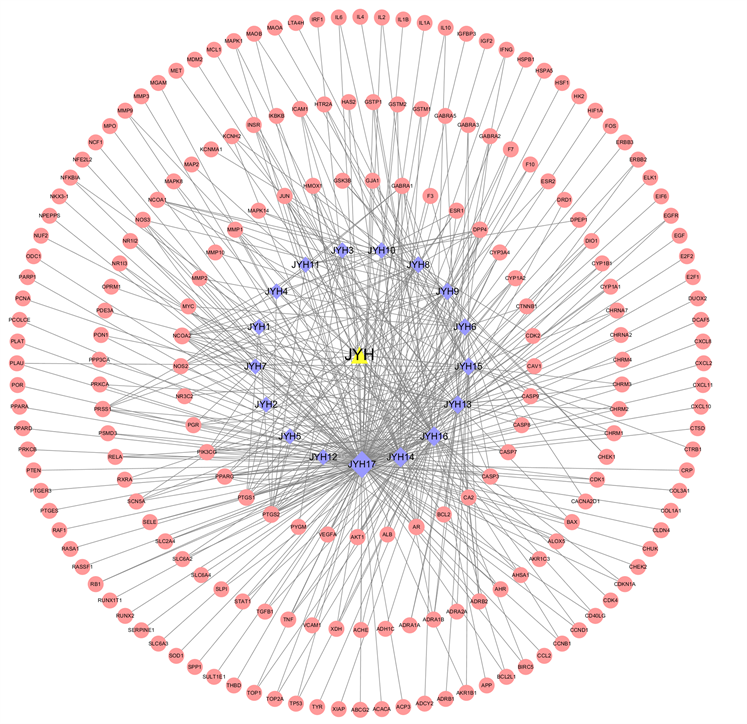 图注:黄色三角形为药物,红色圆形为基因,紫色菱形为活性成分,菱形越大、连线越多,代表该活性成分越重要。
图注:黄色三角形为药物,红色圆形为基因,紫色菱形为活性成分,菱形越大、连线越多,代表该活性成分越重要。
Figure 1. Honeysuckle-active component-target network
图1. 金银花–有效成分–活性靶点网络图
3.2. 2型糖尿病靶点及交集靶点的获取
共得到386个相关性得分较高的疾病靶点。将筛选出的204个药物靶点映射到386个疾病靶点,获得68个共同作用靶点,即为金银花治疗2型糖尿病的潜在靶点(见图2)。
3.3. 金银花-2型糖尿病靶点相互作用网络的构建及关键靶点的筛选
通过String构建出蛋白质相互作用网络图(见图3)。68个靶点中,有59个可以发生蛋白质相互作用,产生59个节点和245条边,平均度值为8.07。其中大于平均度值(Degree > 8)的靶点有27个(见表2),排名靠前的TNF、AKT1、IL6、MAPK1、VEGFA可认为是金银花治疗2型糖尿病的潜在关键靶点。
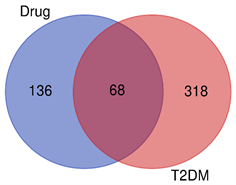 图注:紫圈代表药物靶点,红圈代表疾病靶点,交集部分为共同靶点。
图注:紫圈代表药物靶点,红圈代表疾病靶点,交集部分为共同靶点。
Figure 2. Venn diagram of targets between Honeysuckle and T2DM
图2. 金银花药物靶点与T2DM疾病靶点韦恩图
 图注:图中圆圈颜色及大小均按照Degree值进行排列,Degree值越大,颜色越深,形状相应也大,该基因的作用也越明显。
图注:图中圆圈颜色及大小均按照Degree值进行排列,Degree值越大,颜色越深,形状相应也大,该基因的作用也越明显。
Figure 3. Drug-disease target protein interaction network
图3. 药物–疾病靶标蛋白相互作用网络(PPI)
Table 2. Topological analysis of the active target of Honeysuckle
表2. 金银花发挥作用靶点的拓扑学分析
3.4. GO分析和KEGG富集分析
对金银花-2型糖尿病的共同靶点进行GO分析,根据P值筛选出排名前10的生物学功能条目,将生物学过程(Biological process, BP)、分子功能(Molecular function, MF)、细胞组分(Cellular component, CC)结果绘制成条形图(见图4)。从图中可以看出,金银花可能通过多种途径调节2型糖尿病,其中关系最密切的生物学过程包括对药物的反应、一氧化氮生物合成过程的正调控、凋亡过程的负调控、RNA聚合酶Ⅱ启动子转录的正调控、DNA模板转录正调控和基因表达的正调控等。对金银花-2型糖尿病的共同靶点进行KEGG富集分析,同样根据P值绘制气泡图(见图5),可看出靶点主要集中在HIF-1信号通路、TNF信号通路、PI3K-AKT信号通路、FoXO信号通路。
 图注:绿色代表生物学过程;紫色代表细胞组分;橙色代表分子功能。横坐标代表基因数目,纵坐标代表GO通路名称,线条越长,表明相关靶点数量越多。
图注:绿色代表生物学过程;紫色代表细胞组分;橙色代表分子功能。横坐标代表基因数目,纵坐标代表GO通路名称,线条越长,表明相关靶点数量越多。
Figure 4. GO analysis of potential targets of Honeysuckle and T2DM
图4. 金银花-T2DM潜在靶点的GO分析
 图注:横坐标为富集分数,纵坐标代表KEGG通路名称,气泡越大代表该条目富集的基因数越多,气泡颜色越红则代表富集程度越显著。
图注:横坐标为富集分数,纵坐标代表KEGG通路名称,气泡越大代表该条目富集的基因数越多,气泡颜色越红则代表富集程度越显著。
Figure 5. KEGG pathway analysis of potential targets of Honeysuckle and T2DM
图5. 金银花-T2DM潜在靶点的KEGG通路分析
3.5. 分子对接结果
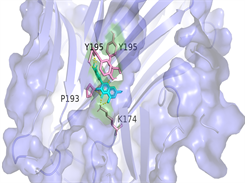
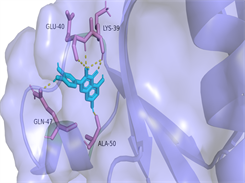
选取度值排名前三位的槲皮素、山奈酚、木犀草素,分别和排名前三位的关键靶点TNF、AKT1、IL6进行10次半柔性对接,其中结合能绝对值最高的对接结果如表3。将对接结果导入Pymol进行3D可视化(见图6)。小分子槲皮素、山奈酚、木犀草素和TNF、AKT1、IL6蛋白的结合能均小于−5 kcal·mol−1,表明它们具有良好的结合活性,说明金银花的主要成分可以通过调节这些关键靶点来改善2型糖尿病。
Table 3. Molecule docking results of small molecule and target
表3. 小分子和靶点分子对接结果
表注:结合能越低,说明配体与受体结合越稳定。
 Quercetin-TNF
Quercetin-TNF
 Quercetin-AKT1
Quercetin-AKT1
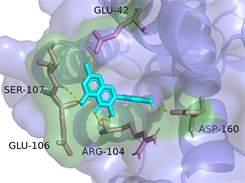 Quercetin-IL6
Quercetin-IL6
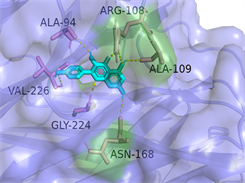 Kaempferol-TNF
Kaempferol-TNF
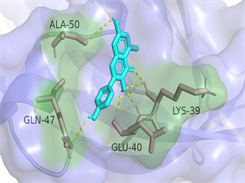 Kaempferol-AKT1
Kaempferol-AKT1
 Kaempferol-IL6
Kaempferol-IL6
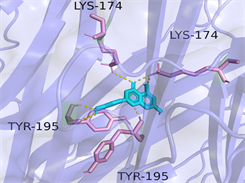 Luteolin-TNF
Luteolin-TNF
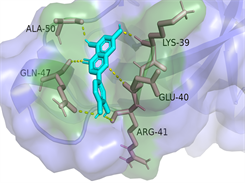 Luteolin-AKT1
Luteolin-AKT1
 Luteolin-IL6图注:对接图中棒状3D结构代表小分子配体,不规则形3D结构为蛋白分子,特定文字编码的为氨基酸。
Luteolin-IL6图注:对接图中棒状3D结构代表小分子配体,不规则形3D结构为蛋白分子,特定文字编码的为氨基酸。
Figure 6. 3D image of Quercetin, Kaempferol and Luteolin docking with TNF, AKT, IL6 target molecules
图6. 槲皮素、山奈酚、木犀草素与TNF、AKT1、IL6靶点分子对接复合物三维图
4. 讨论
我国是糖尿病大国,糖尿病患者的数量正以惊人的速度增加,其中2型糖尿病约占糖尿病总人口的95%,引起的一系列并发症对人类健康产生巨大挑战 [13]。中药可以从多方面改善2型糖尿病。例如,中药可以通过改善氧化应激、下调有害细胞因子如肿瘤坏死因子、促进脂联素等有益细胞因子达到防治目的 [14]。金银花是我国一味传统药材,有关金银花的药用价值可追溯到3000年前。《明仪别露》《神农本草津》《本草纲目》中记载了金银花具有清热解毒、祛风祛湿的疗效 [15]。现代药理学也证明了金银花具有降血糖的活性。Xiangmei Zhao [16] 等人通过动物实验验证金银花中四种多糖成分均具有显著降糖作用。但是目前对金银花改善2型糖尿病的机制鲜有报道。
本文利用网络药理学的方法,在TCMSP数据库中,检索到金银花的有效成分17种。根据绘制的“金银花–有效成分–靶点”网络图,可发现作用靶点数量排名前五的活性成分分别是:槲皮素、山奈酚、木犀草素、β-谷甾醇、豆甾醇。槲皮素可以通过恢复胰岛素分泌、促进胰岛再生、保护胰腺免受氧化应激来改善2型糖尿病大鼠的高血糖、高血脂 [17]。同时进一步的研究发现,MAPK (丝裂原活化蛋白激酶)信号通路参与了槲皮素诱导的胰岛素分泌 [18]。山奈酚是一种存在于多种植物中的天然黄酮类化合物,具有抗氧化、抗癌、改善糖尿病等作用 [19],其可以通过抑制丙酮酸羧化酶和葡萄糖-6-磷酸酶的活性来抑制肝脏糖异生并且激活AKT (蛋白激酶B)通路改善糖代谢 [20]。木犀草素可以通过激活高脂饮食喂养的小鼠脂肪组织巨噬细胞中的AMPK1 (腺苷酸活化蛋白激酶1)信号来降低肥胖相关的胰岛素抵抗 [21],还可以通过抑制NF-κB (核因子-κB)介导的炎症反应来改善糖尿病心肌病 [22],同时也可以改善糖尿病肾病 [23]。Shyamaladevi Babu [24] 等人研究发现,β-谷甾醇能激活大鼠脂肪组织中胰岛素受体和GLUT4 (葡萄糖转运蛋白4)来改善胰岛素抵抗,而且这种激活是通过调控IRS (胰岛素受体底物)/AKT信号通路来实现的。Jialin Wang [25] 的体内外研究实验均证明,豆甾醇能够增强GLUT4表达和易位来改善胰岛素抵抗。基于这些发现,金银花有可能成为治疗T2DM的有效药物。
PPI网络结果显示,金银花改善2型糖尿病有效活性成分关键靶点包括TNF、AKT1、IL6、MAPK1、VEGFA。TNF (肿瘤坏死因子)是一种炎性因子,其可以通过降低IRS酪氨酸和AKT磷酸化导致胰岛素抵抗 [26],同时TNF可以激活多种信号通路如NF-κB、c-Jun N-末端激酶、MAPK信号通路从而触发促炎作用,使葡萄糖摄取受损并最终导致胰岛素抵抗 [27]。IL-6 (白介素6) 升高是T2DM的独立预测炎症因子,IL-6可以通过减少IRS酪氨酸磷酸化、抑制PI3K (磷脂酰肌醇-3-激酶)活性、促进β细胞凋亡等参与胰岛素抵抗 [28]。MAPK家族又称丝裂原活化蛋白激酶家族,可以被多种细胞外信号激活,参与机体多种生理过程。MAPK被激活后可以参与转录因子、蛋白激酶磷酸化,进而调节胰岛素基因表达 [29]。同时有研究发现,MAPK家族也是诱发胰岛素抵抗的核心介质,这些激酶与肥胖和糖尿病的发展有关 [30]。激活MAPK1可以促进脂肪分解、抑制棕榈树诱导的胰岛素抵抗 [31],但同时MAPK1也可以介导棕榈酸诱导的胰岛素抵抗 [32]。VEGFA是血管内皮生长因子,参与血管生成与修复。Henrik Wagner [33] 发现VEGFA通路激活可改善胰岛素敏感性并且改善血糖,这可能与VEGFA促进血管生成有关。
GO分析中细胞组分包括细胞外区、胞质、膜筏、质膜等,存在酶结合、蛋白质结合、细胞因子活性、转录因子结合等分子功能,涉及到药物反应、一氧化氮生物合成过程的正调控、凋亡过程的负调控、RNA聚合酶II启动子转录的正调控等生物进程。
KEGG分析发现,金银花改善2型糖尿病不仅包括上述的TNF信号通路,HIF-1信号通路、PI3K-AKT信号通路、FoXO信号通路也发挥重要作用。胰岛素是体内唯一降糖激素,主要通过PI3K-AKT通路发挥降糖作用。胰岛素与胰岛素受体结合后,IRS酪氨酸发生磷酸化,进而逐级激活PI3K-AKT通路 [34],活化的AKT促进GLUT4转位,使GLUT4从储存囊泡易位到质膜进而发挥降糖作用 [35] [36]。当机体对胰岛素的敏感性降低时,此时发生胰岛素抵抗,导致2型糖尿病。炎症因子、自由基、IRS自身障碍、GLUT4突变、脂联素减少均可能与胰岛素抵抗有关 [37]。HIF-1 (缺氧诱导因子-1)信号通路的激活可能与肥胖和胰岛素抵抗有关 [38]。当机体处于缺氧、高糖、氧化应激状态时,HIF-1可激活SOCS3 (细胞因子信号传导抑制因子3),SOCS3通过抑制IRS酪氨酸磷酸化或抑制脂联素表达从而抑制胰岛素信号通路 [39]。FoXO (叉头盒O)是一种促炎症转录因子,FoXO通路过度激活可导致IL-6、TNF-α的产生显著增加,进而诱导胰岛素抵抗 [40]。同时有研究表明,肝脏中FoXO的缺失可以改善胰岛素受体和胰岛素受体底物敏感性,从而改善胰岛素抵抗 [41]。结合分子对接研究结果,金银花改善2型糖尿病的关键成分槲皮素、山奈酚、木犀草素可以与TNF、AKT1、IL6这几种靶蛋白较稳定地结合,故金银花有效成分可能是通过调节这些靶点发挥作用。
5. 总结
综上所述,本文基于网络药理学和分子对接的方法,发现金银花改善2型糖尿病的主要成分可能是槲皮素、山奈酚、木犀草素、β-谷甾醇和豆甾醇等,主要靶点为TNF、AKT1、IL6、MAPK1、VEGFA,涉及到HIF-1、TNF、PI3K-AKT、FoXO等多个信号通路。表明金银花可通过多化合物、多靶点、多通路发挥作用,可为进一步研究金银花治疗2型糖尿病的分子机制提供一定的参考。
文章引用
刘昕宇,赵蕙琛,张钟文,孙 露,张玉超,刘元涛. 基于网络药理学和分子对接探讨金银花改善2型糖尿病的潜在机制
Potential Mechanism of Honeysuckle in the Improving of Type 2 Diabetes Mellitus Based on Network Pharmacology and Molecular Docking[J]. 临床医学进展, 2022, 12(01): 381-393. https://doi.org/10.12677/ACM.2022.121058
参考文献
- 1. Petersmann, A., Muller-Wieland, D., Muller, U.A., et al. (2019) Definition, Classification and Diagnosis of Diabetes Mellitus. Experimental and Clinical Endocrinology & Diabetes, 127, S1-S7. https://doi.org/10.1055/a-1018-9078
- 2. Landgraf, R., Aberle, J., Birkenfeld, A.L., et al. (2019) Therapy of Type 2 Diabetes. Experimental and Clinical Endocrinology & Diabetes, 127, S73-S92. https://doi.org/10.1055/a-1018-9106
- 3. Bailey, C.J. (2017) Metformin: Historical Overview. Diabetologia, 60, 1566-1576. https://doi.org/10.1007/s00125-017-4318-z
- 4. Mudaliar, S., Polidori, D., Zambrowicz, B. and Henry, R.R. (2015) Sodium-Glucose Cotransporter Inhibitors: Effects on Renal and Intestinal Glucose Transport: From Bench to Bedside. Diabetes Care, 38, 2344-2353. https://doi.org/10.2337/dc15-0642
- 5. 孙孝忠. 《黄帝内经》对糖尿病的认识[J]. 光明中医, 2011, 26(7): 1313-1314.
- 6. 闫寒冰. 中医药防治糖尿病及其并发症的研究[J]. 中国医药指南, 2020, 18(25): 38-39+42.
- 7. Lin, B., Cai, B. and Wang, H. (2019) Honeysuckle Extract Relieves Ovalbumin-Induced Allergic Rhinitis by Inhibiting AR-Induced Inflammation and Autoimmunity. Bioscience Reports, 39, BSR20190673. https://doi.org/10.1042/BSR20190673
- 8. Huang, Y., Liu, H., Sun, X., et al. (2019) Honeysuckle-Derived microRNA2911 Directly Inhibits Varicella-Zoster Virus Replication by Targeting IE62 Gene. Journal of NeuroVirology, 25, 457-463. https://doi.org/10.1007/s13365-019-00741-2
- 9. 毛淑敏, 许家珍, 焦方文, 等. 金银花多糖对免疫低下小鼠免疫功能的影响[J]. 辽宁中医药大学学报, 2016, 18(2): 18-20.
- 10. 梁湘樱, 张红杰, 朱凌云, 等. 金银花提取物对小鼠肝脏和人肝细胞PGC-1α表达及胰岛素抵抗的影响[J]. 中国糖尿病杂志, 2011, 19(3): 197-200.
- 11. 周文霞, 程肖蕊, 张永祥. 网络药理学: 认识药物及发现药物的新理念[J]. 中国药理学与毒理学杂志, 2012, 26(1): 4-9.
- 12. 杨金伟, 喻嵘, 吴勇军, 等. 基于网络药理学探讨肾气丸干预2型糖尿病的分子机制及关键作用通路的验证[J]. 北京中医药大学学报, 2021, 44(1): 60-68.
- 13. Pang, G.M., Li, F.X., Yan, Y., et al. (2019) Herbal Medicine in the Treatment of Patients with Type 2 Diabetes Mellitus. Chinese Medical Journal, 132, 78-85. https://doi.org/10.1097/CM9.0000000000000006
- 14. Heng, X.P., Li, X.J., Li, L., et al. (2020) Therapy to Obese Type 2 Diabetes Mellitus: How Far Will We Go down the Wrong Road? Chinese Journal of Integrative Medicine, 26, 62-71. https://doi.org/10.1007/s11655-018-3053-8
- 15. Shang, X., Pan, H., Li, M., et al. (2011) Lonicera japonica Thunb.: Ethnopharmacology, Phytochemistry and Pharmacology of an Important Traditional Chinese Medicine. Journal of Ethnopharmacology, 138, 1-21. https://doi.org/10.1016/j.jep.2011.08.016
- 16. Zhao, X., Wang, D., Qin, L., et al. (2018) Comparative Investigation for Hypoglycemic Effects of Polysaccharides from Four Substitutes of Lonicera japonica in Chinese Medicine. International Journal of Biological Macromolecules, 109, 12-20. https://doi.org/10.1016/j.ijbiomac.2017.12.073
- 17. Jaishree, V. and Narsimha, S. (2020) Swertiamarin and Quercetin Combination Ameliorates Hyperglycemia, Hyperlipidemia and Oxidative Stress in Streptozotocin-Induced Type 2 Diabetes Mellitus in Wistar Rats. Biomedicine & Pharmacotherapy, 130, Article ID: 110561. https://doi.org/10.1016/j.biopha.2020.110561
- 18. Zhuang, M., Qiu, H., Li, P., et al. (2018) Islet Protection and Amelioration of Type 2 Diabetes Mellitus by Treatment with Quercetin from the Flowers of Edgeworthia gardneri. Drug Design, Development and Therapy, 12, 955-966. https://doi.org/10.2147/DDDT.S153898
- 19. Imran, M., Rauf, A., Shah, Z.A., et al. (2019) Chemo-Preventive and Therapeutic Effect of the Dietary Flavonoid Kaempferol: A Comprehensive Review. Phytotherapy Research, 33, 263-275. https://doi.org/10.1002/ptr.6227
- 20. Alkhalidy, H., Moore, W., Wang, A., et al. (2018) Kaempferol Ameliorates Hyperglycemia through Suppressing Hepatic Gluconeogenesis and Enhancing Hepatic Insulin Sensitivity in Diet-Induced Obese Mice. The Journal of Nutritional Biochemistry, 58, 90-101. https://doi.org/10.1016/j.jnutbio.2018.04.014
- 21. Zhang, L., Han, Y.J., Zhang, X., et al. (2016) Luteolin Reduces Obesity-Associated Insulin Resistance in Mice by Activating AMPKalpha1 Signalling in Adipose Tissue Macrophages. Diabetologia, 59, 2219-2228. https://doi.org/10.1007/s00125-016-4039-8
- 22. Li, L., Luo, W., Qian, Y., et al. (2019) Luteolin Protects against Diabetic Cardiomyopathy by Inhibiting NF-Kappab-Mediated Inflammation and Activating the Nrf2-Mediated Antioxidant Responses. Phytomedicine, 59, Article ID: 152774. https://doi.org/10.1016/j.phymed.2018.11.034
- 23. Zhang, M., He, L., Liu, J., Zhou, L., et al. (2021) Luteolin Attenuates Diabetic Nephropathy through Suppressing Inflammatory Response and Oxidative Stress by Inhibiting STAT3 Pathway. Experimental and Clinical Endocrinology & Diabetes, 129, 729-739. https://doi.org/10.1055/a-0998-7985
- 24. Babu, S., Krishnan, M., Rajagopal, P., et al. (2020) Beta-Sitosterol Attenuates Insulin Resistance in Adipose Tissue via IRS-1/AKt Mediated Insulin Signaling in High Fat Diet and Sucrose Induced Type-2 Diabetic Rats. European Journal of Pharmacology, 873, Article ID: 173004. https://doi.org/10.1016/j.ejphar.2020.173004
- 25. Wang, J., Huang, M., Yang, J., et al. (2017) Anti-Diabetic Activity of Stigmasterol from Soybean Oil by Targeting the GLUT4 Glucose Transporter. Food & Nutrition Research, 61, Article ID: 1364117. https://doi.org/10.1080/16546628.2017.1364117
- 26. Son, M. and Wu, J. (2019) Egg White Hydrolysate and Peptide Reverse Insulin Resistance Associated with Tumor Necrosis Factor-α (TNF-α) Stimulated Mitogen-Activated Protein Kinase (MAPK) Pathway in Skeletal Muscle Cells. European Journal of Nutrition, 58, 1961-1969. https://doi.org/10.1007/s00394-018-1753-7
- 27. Huang, S., Xu, Y., Peng, W.F., et al. (2019) Asymmetric Dimethylarginine Targets MAPK Pathway to Regulate Insulin Resistance in Liver by Activating Inflammation Factors. Journal of Cellular Biochemistry, 120, 7474-7481. https://doi.org/10.1002/jcb.28021
- 28. Akbari, M. and Hassan-Zadeh, V. (2018) Il-6 Signalling Pathways and the Development of Type 2 Diabetes. Inflammopharmacology, 26, 685-698. https://doi.org/10.1007/s10787-018-0458-0
- 29. Eblen, S.T. (2018) Extracellular-Regulated Kinases: Signaling from RAS to ERK Substrates to Control Biological Outcomes. Advances in Cancer Research, 138, 99-142. https://doi.org/10.1016/bs.acr.2018.02.004
- 30. Kassouf, T. and Sumara, G. (2020) Impact of Conventional and Atypical MAPKs on the Development of Metabolic Diseases. Biomolecules, 10, 1256. https://doi.org/10.3390/biom10091256
- 31. Zong, J., Li, S., Wang, Y., et al. (2019) Bromodomain-Containing Protein 2 Promotes Lipolysis via ERK/HSL Signalling Pathway in White Adipose Tissue of Mice. General and Comparative Endocrinology, 281, 105-116. https://doi.org/10.1016/j.ygcen.2019.05.011
- 32. Zhao, Y., Ma, S., Hu, X., et al. (2020) JAB1 Promotes Palmitate-Induced Insulin Resistance via ERK Pathway in Hepatocytes. Journal of Physiology and Biochemistry, 76, 655-662. https://doi.org/10.1007/s13105-020-00770-0
- 33. Wagner, H., Fischer, H., Degerblad, M., et al. (2016) Improvement of Insulin Sensitivity in Response to Exercise Training in Type 2 Diabetes Mellitus Is Associated with Vascular Endothelial Growth Factor a Expression. Diabetes & Vascular Disease Research, 13, 361-366. https://doi.org/10.1177/1479164116651391
- 34. Titchenell, P.M., Lazar, M.A. and Birnbaum, M.J. (2017) Unraveling the Regulation of Hepatic Metabolism by Insulin. Trends in Endocrinology & Metabolism, 28, 497-505. https://doi.org/10.1016/j.tem.2017.03.003
- 35. 王璐, 傅力. Glut4在调控骨骼肌葡萄糖转运中的作用研究进展[J]. 中国运动医学杂志, 2020, 39(4): 326-329.
- 36. Huang, X., Liu, G., Guo, J., et al. (2018) The PI3K/AKT Pathway in Obesity and Type 2 Diabetes. International Journal of Biological Sciences, 14, 1483-1496. https://doi.org/10.7150/ijbs.27173
- 37. Yaribeygi, H., Farrokhi, F.R., Butler, A.E., et al. (2019) Insulin Resistance: Review of the Underlying Molecular Mechanisms. Journal of Cellular Physiology, 234, 8152-8161. https://doi.org/10.1002/jcp.27603
- 38. Gonzalez, F.J., Xie, C. and Jiang, C. (2018) The Role of Hypoxia-Inducible Factors in Metabolic Diseases. Nature Reviews Endocrinology, 15, 21-32. https://doi.org/10.1038/s41574-018-0096-z
- 39. Jiang, C., Kim, J.H., Li, F., et al. (2013) Hypoxia-Inducible Factor 1alpha Regulates a SOCS3-STAT3-Adiponectin Signal Transduction Pathway in Adipocytes. Journal of Biological Chemistry, 288, 3844-3857. https://doi.org/10.1074/jbc.M112.426338
- 40. Kim, D.H., Lee, B., Lee, J., et al. (2019) FoXO6-Mediated IL-1beta Induces Hepatic Insulin Resistance and Age-Related Inflammation via theTF/PAR2 Pathway in Aging and Diabetic Mice. Redox Biology, 24, Article ID: 101184. https://doi.org/10.1016/j.redox.2019.101184
- 41. Garcia Whitlock, A.E., Sostre-Colon, J., Gavin, M., et al. (2021) Loss of FoXO Transcription Factors in the Liver Mitigates Stress-Induced Hyperglycemia. Molecular Metabolism, 51, Article ID: 101246. https://doi.org/10.1016/j.molmet.2021.101246
