Advances in Analytical Chemistry
Vol.
13
No.
02
(
2023
), Article ID:
65139
,
9
pages
10.12677/AAC.2023.132016
基于还原型半抗体构建新型冠状病毒检测的 电化学免疫传感器
徐安安,陈亚芳,周诗梦,赵如良,朱晓霞*
南通大学公共卫生学院,江苏 南通
收稿日期:2023年4月9日;录用日期:2023年4月29日;发布日期:2023年5月11日

摘要
新型冠状病毒(SARS-CoV-2)抗原快速检测作为基于核酸的分子生物学检测方法的有益补充,有效提高了SARS-CoV-2筛查的效率。本研究以丝网印刷碳电极为基础电极,纳米金沉积电极表面,SARS-CoV-2核衣壳蛋白包被半抗体通过Au-S自组装功能化电极,SARS-CoV-2核衣壳蛋白检测半抗体和辣根过氧化双标记纳米金作为放大元。循环伏安法和阻抗谱法表征电极逐步修饰过程,建立SARS-CoV-2电化学免疫检测方法:检测范围0.05~50 pg/mL,最低检测限为9.04 fg/mL,与全抗体建立的检测方法相比,检测限降低了10倍。批内和批间差异系数均小于9.3%,另外在血清样本中的加标回收率可达86%~109.4%。以上结果表明所构建的电化学免疫分析方法对COVID-19诊断具有重要意义。
关键词
还原型半抗体,新型冠状病毒核衣壳蛋白,电化学免疫传感器,灵敏度

Development of Electrochemical Immunosensor for SARS-CoV-2 Detection Using Reduced Half-Antibody Fragments
Anan Xu, Yafang Chen, Shimeng Zhou, Ruliang Zhao, Xiaoxia Zhu*
School of Public Health, Nantong University, Nantong Jiangsu
Received: Apr. 9th, 2023; accepted: Apr. 29th, 2023; published: May 11th, 2023

ABSTRACT
Rapid antigen tests for diagnosis of SARS-CoV-2 are broadly employed for screening approaches, and have potential to be used as alternatives to standard laboratory-based molecular assays. Here, the electrochemical immune-sensor was constructed on screen-printed carbon electrode deposited with gold nanoparticles, and the half-antibody specific SARS-CoV-2 nucleocapsid protein was self-assembly via Au-S bond formation. The modified SPCEs was characterized with cyclic voltammetry (CV) and electrochemical impedance spectroscopy (EIS). The signal was amplified with gold nanoparticles (AuNPs) dual-modified with detecting half-antibody fragments and horseradish peroxidase (HRP). With a sandwich immunoassay format, the obtained electrochemical responses were proportional to the SARS-CoV-2 level in the sample. The proposed assay had a dynamic range for SARS-CoV-2 NP quantification of 0.05~50 pg/mL. With a detection limit of 9.04 fg/mL, which was almost 10-fold lower than that obtained using AuNPs/SPCE electrode vs. conventional whole antibody. Both the intra- and inter-assay coefficients of variation were less than 9.3%. Moreover, the recovery rates are found to range from 86% to 109.4% in the spiked samples. The results show that the proposed electrochemical immunoassay is a highly promising approach for COVID-19 diagnosis.
Keywords:Reduced Half Antibody Fragments, SARS-CoV-2 Nuleocapsid Protein, Electrochemical Immunosensor, Sensitivity

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
COVID-19是一种新兴的高度传染性疾病。新型冠状病毒(SARS-CoV-2)感染的临床症状主要以发热、干咳、乏力为主;重症多发生呼吸困难,快速进展为急性呼吸窘迫综合征,脓毒症休克,甚至出现代谢性酸中毒和出凝血功能障碍等,严重危害人体健康,已成为全球公共卫生问题和社会经济负担 [1] [2] 。及时对患者进行SARS-CoV-2检测对病情诊断和后续治疗十分关键。
基于核酸的分子生物学检测方法是目前病毒实验室检测的金标方法。其中,实时荧光定量PCR (Real-Time Fluorescent Quantitative PCR, qPCR)技术因其灵敏度高、特异性强等特点,是目前SARS-CoV-2检测最常用的手段之一 [3] [4] 。但是,基于核酸的分子检测仍存在很多缺点,如:检测成本高、检测耗时长且周转期长;专业性强,实时荧光定量PCR技术步骤繁琐,需要专业人员(持证上岗)和专业的PCR仪器;检测要求高,标准及规范的基因扩增实验室设置标准分区,各区通风良好,保证整个PCR实验过程中试剂和标本免受气溶胶的污染 [5] [6] 。因此,很难向发展中国家的人们提供大规模检测。
基于抗原抗体反应的免疫学分析技术具有检测特异性高和周转时间快等优势,可快速、简便地对症状疑似人员、自我检测需求的人员或从事高风险人员进行筛查,足以弥补实时荧光定量PCR技术的不足,能够作为基于核酸的分子生物学检测方法的有益补充 [7] 。目前,SARS-CoV-2抗原检测已成为SARS-CoV-2感染诊断的有效参考依据,显著缓解了SARS-CoV-2感染大规模人群筛查的压力,有效提高了SARS-CoV-2筛查的效率 [8] 。
免疫传感器是一种生物传感器,它因将传统的免疫分析和生物传感技术融为一体,不仅减少了分析时间,提高了灵敏度和测试精度,还简化了抗原检测过程,应用前景广泛 [9] [10] 。因此,开发用于SARS-CoV-2抗原检测的免疫传感器进一步提高SARS-CoV-2筛查的效率。然而到目前为止,报道过的各种SARS-CoV-2传感器除了电极本身电化学性能的差异,还会存在因抗体固定不稳定或因抗体的随机固定导致的抗体活性降低等问题,这些都严重影响了传感器的检测性能 [11] 。因此,本研究目的是提供一种基于还原型半抗体定向共价修饰电化学免疫传感器的制备方法,通过夹心法对新型冠状病毒抗原的检测,以解决现有用于SARS-CoV-2抗原检测的免疫传感器存在的缺陷。
2. 实验部分
2.1. 实验试剂与仪器
SARS-CoV-2核衣壳蛋白标准品(Nucleocapsid,N蛋白(NP),纯度 > 96%)、SARS-CoV-2 N蛋白抗体Ab1和Ab2,安源医药科技(上海)有限公司;HAuCl4、EDTA、2-巯基乙胺盐酸盐、柠檬酸钠、辣根过氧化物酶(HRP)、K3[Fe(CN)6]、K4[Fe(CN)6]、KCl、酪蛋白,上海国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒、磷酸盐缓冲液(PBS, 100 mM,pH 7.0)和Tris-HCl缓冲液(0.1 M, pH 8.0)、磷酸–柠檬酸底物缓冲液(0.1 M,pH 5.0),上海碧云天生物技术有限公司;丝网印刷碳电极,广州钰芯传感科技有限公司;Centricon Y-30超滤管,美国Millipore公司;试验用水为Millipore超纯水(18.2 MΩ∙cm)。
电化学测试采用CHI 660D电化学工作站(上海辰华仪器有限公司),三电极系统:参比电极为银/氯化银电极,辅助电极为铂丝电极。所有电化学实验均在室温条件下进行。
2.2. 工作电极的准备及修饰
将丝网印刷炭电极电极(d = 3.0 mm)在无水乙醇和纯水中分别超声清洗5~10 min,氮气吹干;将上述清洗过的丝网印刷电极表面滴加30 μL的HAuCl4 (6.5 mM),扫描范围为−1.5~0.5 V,扫速50 mV/s,扫描10次,纳米金(AuNPs)电沉积于SPCEs电极表面;氮气吹掉表面残余的HAuCl4,用超纯水冲洗电极表面,N2吹干,即得到AuNPs/SPCEs电极,避光保存备用。
2.3. 半抗体HAb1的制备
通过还原法制备新型冠状病毒N蛋白(NP)的半抗体,具体操作如下 [11] :新型冠状病毒核衣壳蛋白抗体(Ab1)和新型冠状病毒N蛋白检测抗体(Ab2)分别用含10 mM EDTA的PBS分别稀释至1.0 mg/mL,抗体溶液边搅拌边逐滴滴加三(2-羧乙基)膦盐酸盐(TCEP)至终浓度为100 mM,混合液在37℃避光搅拌反应1.5 h后,用Centricon Y-30超滤离心进行纯化,最后将纯化的半抗体HAb1和HAb2保存在含有10 mM EDTA的PBS (10 mM, pH 7.4),BCA法测定半抗体浓度,即得可用于本实验的HAb1和HAb2。
2.4. 纳米金及纳米金双标记
24 mL柠檬酸钠(2.2 mM)溶液加热至沸腾,迅速加入1 mL HAuCl4溶液(6.5 mM);继续边搅拌边加热15 min,溶液颜色由灰变紫再变成红色;4℃,13000 rpm离心20 min收集纳米金,用超纯水洗涤3次,最后定容使纳米金溶液吸光值为1.0。
HRP和HAb2双标记纳米金颗粒 [12] ,取1 mL纳米金溶液用0.2 mol/L K2CO3调节pH至8.5~9.0,边搅拌边加入1~10 μg还原型半抗体HAb2和1~10 μg HRP,避光,室温搅拌反应30 min,静置2 h,加入100 μL 3% BSA室温继续搅拌反应30 min,4℃ 13000 rpm离心20 min收集HRP-AuNP-HAb2复合物,PBS洗涤3次后并溶于100 μL PBS溶液中。
2.5. 电化学免疫传感器的制备
用含有10 mM EDTA的PBS (10 mM,pH 7.4)稀释还原型半抗体HAb1至10~100 μg/mL,取3 μL HAb1涂滴于AuNPs/SPCEs电极表面,密封容器中37℃避光孵育2~4 h,吹掉电极表面残留液,取6 μL 1 mM的2-巯基乙醇(MCH)溶液滴涂电极表面,电极在密封容器里37℃孵育1 h,PBST清洗电极表面,晾干,即得MCH/HAb1/AuNPs/SPCEs电极,将所述电化学免疫传感器置于4℃保存备用。
2.6. SARS-CoV-2的测定
用TRIS-HCl缓冲液(0.1M, pH 8.0)稀释SARS-CoV-2NP标准品至浓度为0.05、0.1、0.5、1、5、20和50 pg/mL,得到梯度浓度的NP抗原稀释液;将3.0 µL梯度浓度的NP稀释液分别滴加在上述所制备的电极上,37℃孵育60 min,氮气吹干工作电极表面残留液,PBST充分洗涤;取3.0 µL HRP-AuNP-HAb2滴加到电极,室温孵育60 min,PBST充分洗涤即为待检测的工作电极。以所述工作电极与参比电极和对电极构成三电极体系,将30 µL磷酸–柠檬酸缓冲液(0.1M, pH 5.0)含TMB-H2O2 (TMB 0.8 mM, H2O2 2.0 mM)检测液滴加在待检测的工作电极后;于电压范围0~−0.4V下对待检测的工作电极进行差分脉冲伏安。根据获得的电流响应值与不同浓度的NP建立的标准曲线。
3. 实验结果
3.1. 电极修饰原理
本研究基于夹心法构建SARS-CoV-2 NP检测的电化学免疫传感器。SARS-CoV-2 NP还原型半抗体通过Au-S定向共价修饰纳米金沉积的电极表面,得到取向有序的生物活性膜层,保证了抗体的免疫活性,利用抗原抗体反应测试电化学电流响应实现对SARS-CoV-2 NP定量分析。电极修饰过程的原理如图1所示。
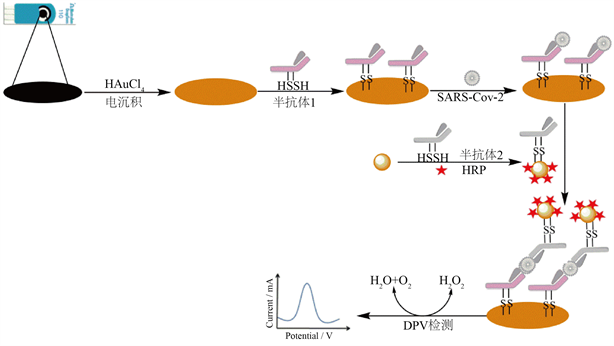
Figure 1. Schematic representation of the modification of SPCEs
图1. 电极修饰示意图
3.2. 循环伏安表征
循环伏安扫描法表征电极的修饰过程,曲线a~e依次为SPCE裸电极、AuNPs沉积、修饰50 μg/mL HAb1、1 mM MCH封闭、吸附NP 抗原的电极。图2是在0.1 mol/L PBS (pH 7. 0)溶液中以100 mV/s速度从−0.4到0.6 V区间内循环扫描得到的CV图。由图可见,曲线a可以看到明显的一对可逆的氧化还原峰;曲线b为AuNPs/SPCE电极,与曲线a相比经AuNPs修饰,氧化还原峰电流显著增加,这是由于AuNPs具有良好的导电性,在电化学反应中促进了电子转移,从而起到放大电流信号的作用。然而,曲线c峰电流响应减少,这是由于固定抗体后,HAb1会阻碍电子的传递。MCH封闭电极上非特异性吸附位点后,电极的氧化还原峰电流进一步减少。最后,SARS-CoV-2 NP抗原与电极孵育后,由于抗原抗体复合物的形成,峰电流明显降低(曲线e),说明电化学传感界面构建成功。
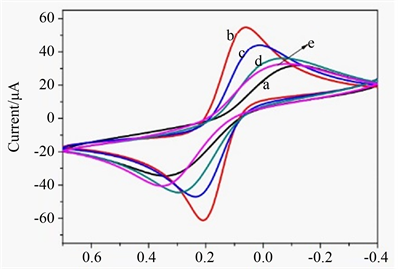 a~e: SPCEs, AuNP/SPCEs, HAb1/AuNPs/SPCEs, MCH/HAb1/ AuNPs/SPCEs, NP/BSA/HAb1/AuNPs/SPCEs.
a~e: SPCEs, AuNP/SPCEs, HAb1/AuNPs/SPCEs, MCH/HAb1/ AuNPs/SPCEs, NP/BSA/HAb1/AuNPs/SPCEs.
Figure 2. Cyclic voltammograms of stepwise-modified electrodes
图2. 不同修饰电极的循环伏安图
3.3. 电化学阻抗谱表征
进一步采用阻抗谱表征电极的修饰过程。检测液为含5 mmol/L [Fe(CN)6]3−/4−的0.1 mol/L KCl溶液,并于频率范围为0.1~10000 HZ、振幅0.005、开路电压−0.08 V下获得电极修饰过程的电化学阻抗谱图(图3)。同3.2曲线a~e分别依次为SPCEs裸电极、AuNPs沉积、修饰50 μg/mL HAb1、1 mM MCH封闭、吸附NP 抗原的电极。可以看到SPCEs最大半圆,表明电子转移电阻高。修饰AuNPs后半圆的直径显著减少,表明AuNPs显著增强电荷转移。随着电极进一步修饰,半圆部分的直径依次增加。表明电极已被成功修饰。曲线d和e分别代表MCH封闭和SARS-CoV-2 NP反应后的曲线,半圆直径进一步增加,表明阻抗也进一步增加,这与蛋白质疏水层干扰导电界面的电荷转移结果一致, 表明SARS-CoV-2 NP抗原与半抗体成功结合,传感器构建成功。
3.4. 传感器的标准曲线及检出限
优化的实验条件下,在0.05~50 pg/mL浓度范围内DPV响应电流随着SARS-CoV-2 NP抗原浓度的增大而增大(图4),这是因为NP浓度越大,电极表面吸附HRP越多,DPV氧化峰电流值越大。图5可见,DPV响应电流变化值(∆I)与SARS-CoV-2 NP抗原浓度的拟合线性回归方程为:ΔI = 24.0 Log[NP] + 53.8 (NP代表SARS-CoV-2 NP) (R2 = 0.9802, n = 5),计算得到最低检测限对数为9.04 fg/mL (S/N = 3)。同样条件下,将SARS-CoV-2 NP半抗体替换成SARS-CoV-2 NP全抗体,在0.05~50 pg/mL范围内响应电流随SARS-CoV-2 NP抗原浓度变化而变化(图6),DPV氧化峰电流与SARS-CoV-2 NP浓度的对数间拟合线性回归方程为:ΔI = 15.78 Log[NP] + 33.14 (NP代表SARS-CoV-2 NP) (R2 = 0.9502, n = 5),计算得到最低检测限为0.018 pg/mL (S/N = 3),其最低检测限是半抗体检测的5倍,表明抗体定向固定则有利于提高电化学免疫分析的灵敏度。
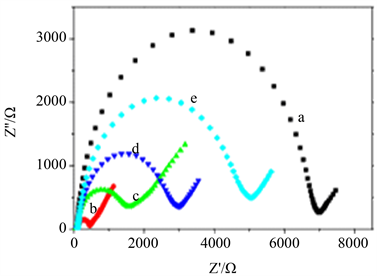 a~e: SPCE, AuNP/SPCEs, HAb1/AuNPs/SPCEs, MCH/HAb1/ AuNPs/SPCEs, NP/MCH/ HAb1/AuNPs/SPCEs.
a~e: SPCE, AuNP/SPCEs, HAb1/AuNPs/SPCEs, MCH/HAb1/ AuNPs/SPCEs, NP/MCH/ HAb1/AuNPs/SPCEs.
Figure 3. Impedance spectra for the functionalized SPCE
图3. 修饰电极的电化学阻抗图谱
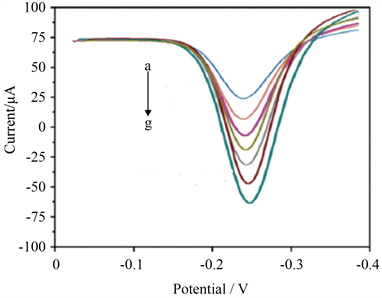 a~g: 0.05, 0.1, 0.5, 1.0, 5.0, 20.0, 50.0 pg/mL.
a~g: 0.05, 0.1, 0.5, 1.0, 5.0, 20.0, 50.0 pg/mL.
Figure 4. DPV responses of the modified electrode after incubation with different concentrations of NP
图4. 不同浓度新型冠状病毒NP结合电极的差分脉冲伏安响应图
3.5. 传感器的选择性
为了考察该传感器的选择性和特异性,将传感器置于含5 pg/mL SARS-CoV-2 NP标准溶液中反应1 h,进行DPV检测。同样的,把传感器置于其他蛋白溶液中,如甲型流感病毒核衣壳蛋白(Flu A NP)和乙型流感病毒核衣壳蛋白(Flu B NP)、SARS-CoV-2刺突蛋白(SARS-CoV-2 SP)等蛋白,进行DPV检测,比较所得的相应电流值,结果如图7所示,当甲型流感病毒和乙型流感病毒核衣壳蛋白、SARS-CoV-2刺突蛋白达到1ng/mL时,测得的电流值非常小,接近背景信号,可以混略,表面此传感器具有较好的选择性。
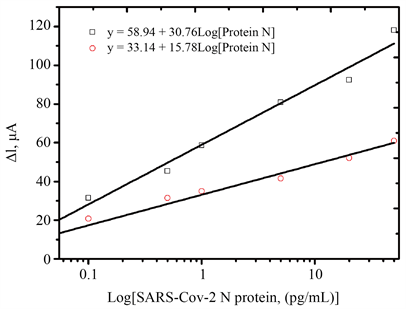
Figure 5. Standard curves of SARS-CoV-2 NP by electrochemical immunosensor (□: half antibody; ○: whole antibody)
图5. SARS-CoV-2 NP的校准曲线 (□:半抗体;○:全抗体)
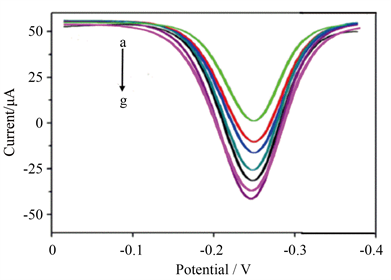 a~g: 0.05, 0.1, 0.5, 1.0, 5.0, 20.0, 50.0 pg/mL.
a~g: 0.05, 0.1, 0.5, 1.0, 5.0, 20.0, 50.0 pg/mL.
Figure 6. DPV curves of the modified electrode with different concentration of SARS-CoV-2 NP
图6. 不同浓度SARS-CoV-2 NP结合电极的差分脉冲伏安响应图
3.6. 样品的分析
SARS-CoV-2的培养上清用裂解液裂解后用Tris-HCl (10 mM, pH8.0)稀释4个不同浓度(1000×、2000×、4000×和8000×)后分别测定5次,所测得浓度的批内相对标准偏差(RSD)为6.2%,5.4%,5.8%和7.5%,批间RSD为7.5%,6.8%,5.7%和9.5%,表明本方法具有较好的重现性。
回收率是用来评价准确度的重要指标之一。回收率 = 实际检测结果/理论添加量 × 100%。血清中测得的添加回收率结果见表1 (重复三次),回收率为86%~109.4%之间,变异系数小于9.2%,回收率不等于100%可能是由于误差和基质效应引起的。表明建立的电化学免疫分析方法用于SARS-CoV-2的检测具有可靠性好、准确度高等优点。
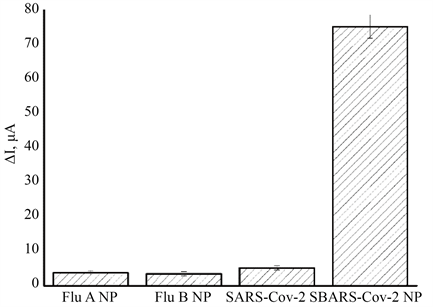
Figure 7. DPV response of the electrochemical immmunosensor after incubation with Flu A NP, Flu B NP, SARS-CoV-2 SP and SARS-CoV-2 NP
图7. 传感器对Flu A NP, Flu B NP, SARS-CoV-2 SP and SARS-CoV-2 NP等蛋白的DPV响应
Table 1. Recoveries of SARS-Cov-2 NP spiked to blood serum samples with the proposed electrochemical immunosensor
表1. 新型冠状病毒NP添加到血清样本中的添加回收试验
4. 结论
本研究通过纳米金电沉积修饰在丝网印刷工作电极表面,SARS-CoV-2 NP的半抗体通过Au-S定向共价自组装金电极表面,抗原抗体反应后通过测试电化学电流响应实现对SARS-CoV-2的定量分析。与现有的SPCEs构建的免疫传感器相比,本发明所述的电化学免疫传感器,不仅具有纳米金的高比表面和高导电性,而且半抗体Fc区域-SH通过Au-S共价固定金表面,得到取向有序的生物活性膜层,保证了抗体的免疫活性,进而有效提高电化学免疫传感器检测新型冠状病毒抗原的灵敏度,增加窗口期检出率,因此其在生物医药应用中也具有一定的发展潜力。
基金项目
南通市科技创新计划(MSZ20173, JCZ20021),大学生创新训练计划项目(202210304131Y)。
文章引用
徐安安,陈亚芳,周诗梦,赵如良,朱晓霞. 基于还原型半抗体构建新型冠状病毒检测的电化学免疫传感器
Development of Electrochemical Immunosensor for SARS-CoV-2 Detection Using Reduced Half-Antibody Fragments[J]. 分析化学进展, 2023, 13(02): 134-142. https://doi.org/10.12677/AAC.2023.132016
参考文献
- 1. Dai, J., Sang, X., Menhas, R., Xu, X., Khurshid, S., Mahmood, S., Weng, Y., Huang, J., Cai, Y., Shahzad, B., Gul, M., Saqib, Z.A. and Alam, M.N. (2021) The Influence of COVID-19 Pandemic on Physical Health-Psychological Health, Physical Activity, and Overall Well-Being: The Mediating Role of Emotional Regulation. Frontiers in Psychology, 12, 667461.
https://doi.org/10.3389/fpsyg.2021.667461 - 2. 刘力. 新型冠状病毒SARS-CoV-2: 高致病性及其防治[J]. 基础医学与临床, 2020, 40(4): 433-439.
- 3. 杨小红, 郑志东, 王垂佳, 等. 2019新型冠状病毒SARS-CoV-2的实时定量PCR检测[J]. 中华检验医学杂志, 2020, 42(6): 537-540.
- 4. Kortela, E., Kirjavainen, V., Ahava, M.J., Jokiranta, S.T., But, A., Lindahl, A., Jaaskelainen, A.E., Jaaskelainen, A.J., Jarvinen, A., Jokela, P., Kallio-Kokko, H., Loginov, R., Mannonen, L. and Kekäläinen, E. (2021) Real-Life Clinical Sensitivity of SARS-CoV-2 RT-PCR Test in Symptomatic Patients. PLOS ONE, 16, e0251661.
https://doi.org/10.1371/journal.pone.0251661 - 5. Farfan, M.J., Torres, J.P., O’ryan, M., Olivares, M., Gallardo, P., Lastra, J. and Salas, C. (2020) Optimizing RT-PCR Detection of SARS-CoV-2 for Developing Countries Using Pool Testing. Revista Chilena de Infectología, 37, 276-280.
https://doi.org/10.4067/s0716-10182020000300276 - 6. 张丽珊, 陈忠正, 梁志坤. COVID-19检测技术的优点和局限性[J]. 生物工程学报, 2022, 38(9): 3141-3156.
- 7. Wang, D., He, S., Wang, X., Yan, Y., Liu, J., Wu, S., Liu, S., Lei, Y., Chen, M., Li, L., Zhang L., Hu, X., Zheng, X, Bai, J., Zhang, Y., Zhang, Y., Song, M. and Tang, Y. (2020) Rapid Lateral Flow Immunoassay for the Fluorescence Detection of SARS-CoV-2 RNA. Nature Biomedical Engineering, 4, 1150-1158.
https://doi.org/10.1038/s41551-020-00655-z - 8. Möckel, M., Corman, V.M., Stegemann, M.S., Hofmann, J., Stein, A., Jones, T.C., Gastmeier, P., Seybold, J., Offermann, R., Bachmann, U., Lindner, T., Bauer, W., Drosten, C., Rosen, A. and Somasundaram, R. (2021) SARS-CoV-2 Antigen Rapid Immunoassay for Diagnosis of COVID-19 in the Emergency Department. Biomarkers, 26, 213-220.
https://doi.org/10.1080/1354750X.2021.1876769 - 9. Ranjan, P., Singhal, A., Yadav, S., Kumar, N., Murali, S., Sanghi, S. and Khan, R. (2021) Rapid Diagnosis of SARS- CoV-2 Using Potential Point-of-Care Electrochemical Immunosensor: Toward the Future Prospects. International Reviews of Immunology, 40, 126-142.
https://doi.org/10.1080/08830185.2021.1872566 - 10. Samper, I.C., McMahon, C.J., Schenkel, M.S., Clark, K.M., Khamcharoen, W., Anderson, L.B., Terry, J.S., Galichotte, E.B., EveL, G.D.M., Geiss, B.J., Dandy, D.S. and Henry, C.S. (2022) Electrochemical Immunoassay for the Detection of SARS-CoV-2 Nucleocapsid Protein in Nasopharyngeal Samples. Analytical Chemistry, 94, 4712-4719.
https://doi.org/10.1021/acs.analchem.1c04966 - 11. Kırali, K., Brimo, N. and Serdaroğlu, D.Ç. (2022) Antibody Immobilization Techniques in Mass Sensitive Immunosensor: Enhanced Sensitivity through Limited Mass Load. Current Analytical Chemistry, 18, 529-545.
https://doi.org/10.2174/1573411016999201120090551 - 12. Li, F., Zhang, Y., Liu, J. and He, J. (2018). Luminol, Horseradish Peroxidase and Antibody Ternary Codified Gold Nanoparticles for a Label-Free Homogenous Chemiluminescent Immunoassay. Analytical Methods, 10, 722-729.
https://doi.org/10.1039/C7AY02743E
NOTES
*通讯作者。
