Hans Journal of Food and Nutrition Science
Vol.
08
No.
02
(
2019
), Article ID:
30425
,
13
pages
10.12677/HJFNS.2019.82019
Optimization of Different Extraction Processes of Jujube Polysaccharides and Comparison of Their Immunological Activities
Jiale Liu, Dechun Huang, Shujie Cheng, Chongjiang Cao, Guitang Chen*
College of Engineering, China Pharmaceutical University, Nanjing Jiangsu
Received: Apr. 30th, 2019; accepted: May 17th, 2019; published: May 27th, 2019

ABSTRACT
In order to explore the effects of different extraction processes on the extraction and bioactivity of jujube polysaccharides, jujube polysaccharides were extracted by hot water extraction, ultrasonic ice bath extraction and enzymatic extraction, and the best extraction techniques were optimized. We performed different extraction methods for the analysis of immunological activity. The results showed that the optimum extraction conditions for hot water extraction were as follows: liquid to solid ratio of 25:1 (mL/g), extraction temperature of 90˚C, extraction time of 2 h, at which time the extraction rate of jujube polysaccharide was 54.27% ± 2.64%. The optimal process of ice bath extraction method is: liquid to material ratio 25:1 (mL/g), ultrasonic power 300 W, ultrasonic time 20 min; under the optimal extraction conditions, the extraction rate of jujube polysaccharide is 56.93 ± 2.79%; the best enzyme extraction process is: 0.5% mixed enzyme (pectinase:papain = 1:1), enzymatic hydrolysis time 2 h, enzymatic hydrolysis temperature 40˚C, liquid to material ratio 25:1 (mL/g), pH 4.0; at this time, the extraction rate of jujube polysaccharide was 55.22% ± 2.54%. Comparing the three different methods, the extraction rate of polysaccharide obtained by ultrasonic method is the highest. In addition, MTT and immune factor release experiments showed that all the three processes were toxic to RAW264.7 macrophages, but promoted the release of immune factors. The polysaccharide extracted by hot water extraction method had the strongest immunological activity.
Keywords:Jujube Polysaccharide, Extraction Process, Immunological Activity
枣多糖不同提取工艺优化及其免疫活性初探
刘佳乐,黄德春,程抒劼,曹崇江,陈贵堂*
中国药科大学工学院,江苏 南京

收稿日期:2019年4月30日;录用日期:2019年5月17日;发布日期:2019年5月27日

摘 要
为探究不同提取工艺对枣多糖提取效果及生物活性的影响,采用热水浸提法、超声冰浴提取法以及酶解提取法提取枣多糖,优化出各自最佳提取工艺,并比较三种提取方法提取的枣多糖的免疫活性。结果表明:热水浸提法的最优提取条件为:液料比25:1 (mL/g),提取温度90℃,提取时间2 h,此时枣多糖的提取率为54.27% ± 2.64%;超声冰浴提取法的最优工艺为:液料比25:1 (mL/g),超声功率300 W,超声时间20 min,在最优提取条件下枣多糖提取率为56.93% ± 2.79%;酶解法的最优提取工艺为:0.5%混合酶(果胶酶:木瓜蛋白酶 = 1:1),酶解时间2 h,酶解温度40℃,液料比25:1 (mL/g),pH 4.0,此时枣多糖的提取率为55.22% ± 2.54%。对比三种不同方法可知,超声法得到的多糖提取率最高。另外,MTT以及促进免疫因子释放实验表明,三种工艺均对RAW264.7巨噬细胞有一定的毒性,但促进细胞的免疫因子释放,其中热水浸提法提取的多糖免疫活性最强。
关键词 :枣多糖,提取工艺,免疫活性

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
枣(Zizyp husjujuba Mill.)为鼠李科枣,属植物枣树的果实 [1] ,又称为红枣、干枣、中华枣、大枣等。枣树在我国分布极其广泛,北起内蒙,南至两广,西至新疆,东到沿海各省,产区主要分布在山西、陕西、河南、河北、山东五省 [2] 。据研究分析,红枣中含有丰富的有机酸、维生素和钙、铁、锌、钾、硒等矿物质和微量元素 [3] ,还含有多糖 [4] 、总酚类化合物 [5] 、环磷酸腺苷(CAMP) [6] 类等生物活性成分 [7] 。由于枣中含多种活性成分,具有抗肿瘤 [8] [9] 、抗氧化 [10] [11] 、保肝护肝 [12] [13] 、增强免疫功能 [14] [15] 等特点。
在多糖的提取研究中,目前多采用热水浸提取法、超声波法、酶提取法、微波提取法等提取方法 [16] - [21] 。研究表明,即使同种原料,采用不同提取方法所得的多糖,其结构、性质、以及生物活性等均有不同。比如,徐丛玥 [22] 等人研究不同提取方法对米邦塔仙人掌粗多糖体外抗氧化活性的影响中,酶法以及超声波法提取的多糖各项体外抗氧化指标的活性均高于热水提法;高行恩 [23] 等人采用水提法、超声法、微波法、酶法4种提取方法制备了山药多糖中,就总还原力、DPPH∙清除能力、∙OH清除能力而言,酶法制备的多糖抗氧化能力最好;王雪 [24] 等人采用水提法、酶解法、超声波法、超声波–酶法、微波法和微波–酶法六种提取方法提取蛹虫草基质多糖,其中超声波–酶法所得蛹虫草基质多糖的得率最高、黏度最低、抗氧化活性也最强,且不同的提取方法提取的多糖活性不同。
因此,本文采用热水浸提提取、超声冰浴提取以及酶解提取三种方法提取枣多糖,对比分析不同提取方法对枣多糖提取率的影响,并对其免疫活性进行初步探究,为枣多糖的深入开发利用提供一定的理论依据。
2. 材料与仪器
2.1. 材料与试剂
枣粉:沧州新疆大枣(若羌灰枣),购于沧州益生源食品有限公司(50 ℃干燥,粉碎过筛70目备用);木瓜蛋白酶纤维素酶(1800 U/mg)、果胶酶(1000 U/mg):上海金穗生物科技有限公司;木瓜蛋白酶(3 U/mg):阿拉丁试剂(上海)有限公司;考马斯亮蓝G250:国药集团化学试剂有限公司;小牛血清:Gibco公司;DMEM/F12 (1:1)培养液:HyClone公司;MTT:江苏凯基生物技术股份有限公司;脂多糖(LPS):上海源叶生物科技有限公司;一氧化氮检测试剂盒、过氧化氢检测试剂盒:Beyotime公司,其余实验试剂均为国产分析纯。
2.2. 仪器
TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;HH-42恒温水浴锅:常州国华电器有限公司;LXJ-IIB离心机:上海安亭科学仪器厂;JY-92IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;SHJ-4水浴恒温磁力搅拌器:常州亚特实验仪器有限公司;GZX-9070电热鼓风干燥箱:上海博讯实业有限公司医疗设备厂;PD-1C-50真空冷冻干燥机:北京博医康实验仪器有限公司;DZF-6050真空干燥箱:上海博讯实业有限公司医疗设备厂;ATX224分析天平:日本岛津仪器公司;RE-5205旋转蒸发器:上海亚荣生化仪器厂;Elx800TM酶标仪:美国BioTek公司;CO2生化培养箱:赛默飞世尔科技(中国)有限公司。
3. 实验方法
3.1. 枣多糖含量的测定
称取经100℃干燥24 h 后的葡萄糖10.0 mg,蒸馏水定容至100 mL的容量瓶中,得浓度为100 μg/mL母液,分别移取0.2、0.4、0.6、0.8、1.0 mL标准溶液于具塞试管中,加水补至2.0 mL,分别加入质量分数为5%的苯酚溶液l mL,摇匀,滴加浓硫酸5 mL,摇匀静置5 min,待溶液冷却30min,于490 nm处测定吸光度,以空白溶液为参比,葡萄糖标准品浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,得到得回归方程:y = 9.7657x + 0.0354,相关系数( R2 = 0.999)。
然后,根据多糖提取率计算公式(1),等到枣多糖的含量,公式如下:
(1)
注:A为苯酚硫酸法测定的吸光度值;V为枣多糖溶液定容后的体积/mL;m为称取枣的原料质量/g。
3.2. 热水浸提法提取枣多糖
以提取温度、液料比、提取时间为影响因素,考察各自对枣多糖提取率的影响:
1) 提取温度对提取率的影响
称取一定量的枣粉,在固定提取时间2 h,液料比20:1 (mL/g)条件下,考察提取温度50℃、60℃、70℃、80℃、90℃、100℃对枣多糖提取率的影响。
2) 液料比对提取率的影响
称取一定量的枣粉,在固定提取时间为2 h,提取温度90℃的条件下,考察液料比10:1,15:1,20:1,25:1,30:1,35:1对枣多糖提取率的影响。
3 )提取时间对提取率的影响
称取一定量的枣粉,在固定液料比为25:1 (mL/g),提取温度90℃的条件下,考察提取时间1,1.5,2,2.5,3,3.5 h对枣多糖提取率的影响。
在单因素实验的基础上,选定提取温度A (℃)、提取时间B (h)、液料比C (mL/g) 3个考察因素,采用正交试验分析,优化出枣多糖提取的最优提取工艺参数,并得出各因素间相互作用对枣多糖的影响,见热水浸提法正交试验因素水平设计表1。
3.3. 超声波冰浴法提取枣多糖
在冰浴的恒定条件下,忽略超声温度的影响,以超声时间、液料比、超声功率为影响因素,考察各自对枣多糖提取率的影响:
1) 超声时间对提取率的影响
称取一定量的枣粉,在固定超声功率200 W,液料比20:1 (mL/g)条件下,考察连续超声时间5、10、15、20、25、30 min对枣多糖提取率的影响。
2) 液料比对提取率的影响
称取一定量的枣粉,在连续超声时间20 min,超声功率200 W的条件下,考察液料比10:1,15:1,20:1,25:1,30:1,35:1对枣多糖提取率的影响。
3) 超声功率对提取率的影响
称取一定量的枣粉,在液料比25:1 (mL/g),连续超声时间20 min的条件下,考察超声功率100、200、300、400、500、600 W对枣多糖提取率的影响。
在单因素实验的基础上,选定超声功率A (W)、超声时间B (min)、液料比C (mL/g) 3个考察因素,采用正交试验分析,优化出枣多糖提取的最优提取工艺参数,并得出各因素间相互作用对枣多糖的影响,表2为超声波冰浴提取法正交试验因素水平设计。
3.4. 酶解法提取枣多糖
称取一定量的枣粉,在固定液料比为25:1 (mL/g),温度50℃,pH 5,分别加含0.5%枣质量的果胶酶、纤维素酶、混合酶1 (纤维素酶:木瓜蛋白酶 = 1:1)、混合酶2 (果胶酶:木瓜蛋白酶 = 1:1)、混合酶3 (果胶酶:纤维素:木瓜蛋白酶 = 1:1:1),保温2 h,升温至100℃,灭酶10 min。选择出影响多糖提取最大的酶选择。然后,在固定温度50℃,pH 5,酶解时间1 h,液料比25:1的条件下,确定最佳的加酶量(0.1%, 0.3%, 0.5%, 0.7%, 0.9%)。
以酶解温度、pH、液料比、酶解时间为影响因素,考察各自对枣多糖提取率的影响:
1) 酶解温度对提取率的影响
称取一定量的枣粉,在固定pH 5、酶解时间1 h,液料比25:1 (mL/g)的条件下,考察酶解温度40℃、50℃、60℃、70℃、80℃对枣多糖提取率的影响。
2) pH对提取率的影响
称取一定量的枣粉,在酶解温度50℃、酶解时间1 h,液料比25:1 (mL/g)的条件下,考察pH为4、5、6、7、8对枣多糖提取率的影响。
3) 液料比对提取率的影响
称取一定量的枣粉,在pH 5、酶解时间1 h,酶解温度50℃的条件下,考察液料比(mL/g)为15:1,20:1,25:1,30:1,35:1对枣多糖提取率的影响。
4) 提取时间对提取率的影响
称取一定量的枣粉,在pH 5、酶解温度50℃,液料比25:1 (mL/g)的条件下,考察提取时间为0.5,1,1.5,2,2.5 h对枣多糖提取率的影响。
在单因素实验的基础上,选定pHA、酶解温度B (℃)、料液比C (mL/g)以及酶解时间D (h) 4个考察因素,采用正交试验分析,优化出枣多糖提取的最优提取工艺参数,并得出各因素间相互作用对枣多糖的影响,表4为酶解条件正交试验因素水平设计。
3.5. MTT毒性试验
参照苏娣等人的实验方法 [25] ,取生长良好的处于对数生长期的RAW 264.7巨噬细胞,调整细胞浓度为2 × 104个/mL,接种于96孔板,每孔加入细胞悬浮液100 μL,在5% CO2,37℃的培养箱中进行培养12 h,待细胞贴壁后,吸弃孔内上清液,用PBS洗去未贴壁细胞后,每孔加入经前面最佳三大工艺提取下提取的已经除蛋白的多糖干品配制成不同浓度的不同工艺多糖溶液(10, 30, 50, 70, 100 µg/mL),空白对照组加入100 µL的DMEM完全培养液。每组设6个平行,置于37℃、5% CO2的培养箱中进行培养24 h。培养结束后每孔加20 µL新鲜配制的5 mg/mL的MTT溶液,继续培养4 h,弃去上清液,每孔加入150 µL DMSO溶解沉淀,恒温振荡培养箱摇匀15 min,用酶标仪在490 nm下测定各孔OD值,独立批次细胞试验重复3次。
3.6. 枣多糖对RAW264.7巨噬细胞分泌免疫调节因子的影响
具体方法同2.7,除了加MTT溶液以及DMSO溶液,取每孔的上清液进行测定。按NO和H2O2检测试剂盒说明书的方法去测定上清液中的NO和H2O2含量。
3.7. 数据处理
实验数据以x ± s表示,采用SPSS19软件进行方差分析。
4. 结果与分析
4.1. 热水浸提法
热水浸提法各因素对枣多糖提取率的影响,如图1。
由图A可知,在固定液料比20:1 (mL/g)、提取时间2 h,枣多糖提取率随温度的升高而不断升高,其原因是高温使枣植物细胞发生破裂,细胞内多糖类活性物质不断溶出,当温度超过90℃时,枣多糖提取率没有明显升高,溶出影响多糖产出的其他物质,因此选取提取温度90℃为最佳。
由图B可知,在固定提取温度90℃、液料比20:1 (mL/g),随提取时间的不断增加,枣多糖的提取率随之升高,当时间为2 h时,提取率达到最高,随着提取时间的增加,枣中酚类、枣醇以及挥发油等杂质相继溶出,枣多糖的溶出相应被影响,从而使得枣多糖的提取率下降,故选取2 h为最佳提取时间。
由图C可知,在固定提取温度90℃、提取时间2 h条件下,枣多糖提取率随液料比的增加而上升,当液料比达到25:1 (mL/g)时,枣多糖提取率为53.49%,随着液料比的不断升高,枣多糖提取率下降,故选取液料比25:1 (mL/g)为最佳液料比。
另外,由表1可直观的看出,最佳试验条件为提取时间2 h,提取温度90℃,液料比25:1 (mL/g),即A2B2C2,且影响热水浸提法提取枣多糖的工艺顺序:液料比C < 提取时间B < 提起温度A,对最优实验条件进行3组平行实验验证,在最优条件下,枣多糖的提取率为54.27% ± 2.64%。

Figure 1. Effect of extraction temperature (A), extraction time (B) and liquid-to-liquid ratio (C) on the extraction rate of jujube polysaccharides
图1. 提取温度(A)、提取时间(B)、液料比(C)对枣多糖提取率的影响
Table 1. Orthogonal test results analysis table (L9(33))
表1. 正交试验结果分析表(L9(33))
4.2. 超声波冰浴提取法
超声冰浴提取法各因素对枣多糖提取率的影响,如下图2。

Figure 2. Effect of ultrasonic power (A), ultrasonic time (B) and liquid-to-liquid ratio (C) on the extraction rate of jujube polysaccharide
图2. 超声功率(A)、超声时间(B)、液料比(C)对枣多糖提取率的影响
从图A可看出,在超声时间20 min、液料比25:1 (mL/g)条件下,超声功率在100~300 W时,枣多糖提取率随超声功率的增加而不断升高,当超声功率大于300 W时,溶液中枣多糖溶出速率小于分解速率,使得枣多糖提取率呈下降趋势,故选取300 W作为最佳超声功率。
从图B可看出,当固定超声200 W、液料比20:1 (mL/g)时,枣多糖的提取率随着超声时间的增加呈先增后降的趋势,其原因为枣多糖溶出速率随超声时间的增加呈先增后减,而随着超声时间增加,多糖在溶液中分解速率不断增大。当超声时间超过20 min时,枣多糖提取率开始下降。因此,选取20 min为最佳超声时间。
从图C可看出,在固定超声功率200 W、超声时间20 min条件下,随着液料比的不断升高,枣多糖提取率也随之增加,当液料比超过30:1 (mL/g)时,枣多糖提取率开始趋于平衡,但是略有下降,则选取30:1 (mL/g)为最佳超声液料比。
另外,根据表2正交试验结果分析表所示,最佳提取工艺条件为:超声时间20 min、超声功率300 W、液料比25:1 (mL/g),即A2B2C2 ,且影响超声提取枣多糖的工艺顺序:液料比C < 超声时间B < 超声功率A,对最优实验条件进行3组平行实验验证,此时枣多糖的提取率为56.93% ± 2.79%。
Table 2. Orthogonal test results analysis table (L9(33))
表2. 正交试验结果分析表(L9(33))
4.3. 酶解提取法
1) 酶组合优化实验结果,如表3所示,我们可以得到最佳的酶组合方案为混合酶2,其枣多糖提取率最高为52.74% ± 4.15%。
另外,由图3可知,在液料比25:1 (mL/g)、酶解温度50 ℃、酶解时间2 h,pH 5条件下,随着酶的增加量,枣多糖提取率呈现出先升高后趋向于平衡,说明酶解效率已经达到饱和状态,因此选取加酶量为0.5%为最佳。
Table 3. Effect of enzyme combination on polysaccharide extraction rate
表3. 酶组合对于多糖提取率的影响

Figure 3. Effect of enzyme combination on polysaccharide extraction rate
图3. 加酶量对枣多糖的提取率影响
2) 酶解法中各因素对枣多糖提取率的影响,如图4。
由图A可知,在酶解时间2 h、液料比25:1 (mL/g)、pH值5.0条件下,酶解温度在40℃~50℃时,枣多糖提取率不断增加,当温度继续增加时,提取率开始下降,当温度超过70℃时,枣多糖提取率呈上升趋势,其原因可能为复合酶在超过70℃条件下全部失活,此时因为温度的上升使得提取率开始有所升高,因此选取50 ℃为最佳酶解温度。
由图B可知,在酶解温度50℃、pH值5.0、液料比25:1 (mL/g)条件下,枣多糖提取率随酶解时间的增加而增加,当酶解时间超过2.0 h时,枣多糖的提取率趋于下降,可能是溶出其他除多糖外的杂质,因此选取酶解时间2.0 h为最佳。
由图C可知,在酶解时间1 h、酶解温度50℃、pH值5.0条件下,当液料比15:1~25:1 (mL/g)时,枣多糖提取率不断增加,当液料比继续增加时,使得复合酶和底物在溶液中的浓度同时下降,两者间酶解时相互接触几率下降,使得提取率开始下降,因此选取25:1 (mL/g)为最佳液料比。
由图D可知,在液料比25:1 (mL/g)、酶解温度50℃、酶解时间2 h条件下,随着pH值的变化,枣多糖提取率呈现出先升高后下降,pH值低或高都会影响复合酶的生物活性,因此选取pH5.0为最佳pH。
另外,根据表4正交试验结果分析表所示,最佳酶解法提取工艺条件为:酶解温度50℃、酶解时间2 h、液料比25:1 (mL/g)、pH4,即A2B2C2D1 ,且影响酶解提取枣多糖的工艺顺序:提取时间B < pH值D < 料液比C < 酶解温度A,对最优实验条件进行3组平行实验验证,此时枣多糖的提取率为55.22% ± 2.54%。

Figure 4. Effect of enzymatic hydrolysis temperature (A), enzymatic hydrolysis time (B), liquid-to-liquid ratio (C) and pH (D) on the extraction rate of jujube polysaccharides
图4. 酶解温度(A)、酶解时间(B)、液料比(C)、pH (D)对枣多糖提取率的影响
Table 4. Orthogonal test design and results analysis of enzymatic extraction of jujube polysaccharides
表4. 酶法提取枣多糖正交试验设计与结果分析
4.4. MTT毒性试验
MTT实验表明,枣多糖可以对RAW264.7产生毒性,对于细胞生长抑制作用,并且不同提取方法的枣多糖的免疫活性并不相同,结果如图5所示。可见,酶解提取枣多糖无论低中高浓度的多糖对RAW264.7细胞生长几乎没有什么毒性,而水浴在中高的多糖浓度下高于超声冰浴提取枣多糖。由此,在一定程度上,酶解法提取而来的枣多糖毒性最小,其他两种一般。该实验结果表明不同方法提取的多糖结构或包含的活性基团不同,对于不同的细胞的作用机理性质不一样,对于细胞的毒性也有所差异 [26] [27] 。
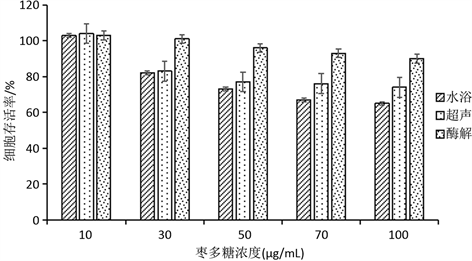
Figure 5. MTT toxicity experiment
图5. MTT毒性实验
4.5. 枣多糖对RAW264.7巨噬细胞分泌免疫调节因子的影响
促进RAW264.7巨噬细胞的分泌免疫调节因子是表明多糖类具有免疫活性的重要标志之一 [28] [29] [30] 。如图6所示,三种工艺在10 μg/mL低浓度的条件下,均对RAW264.7细胞分泌NO以及H2O2具有明显的促进作用,而在50 μg/mL、100 μg/mL中高浓度下具有一定的促进作用。另外,在促进RAW264.7细胞分泌NO以及H2O2的情况下,水浴的促进作用比较明显,而超声以及酶解工艺提取的枣多糖中使得枣多糖中活性发生改变,对于MTT毒性不一样,对于促进细胞分泌免疫因子活性有所不同,而且高浓度下酶解提取多糖对于RAW264.7抑制分泌免疫调节因子的释放。
5. 结论
通过三种不同提取方法的条件优化比较,结果表明:超声冰浴法的枣多糖提取率最高,是由于超声比酶解、热水浸提法破碎细胞效果更加好,使细胞中的多糖更容易分离出来,进入到溶液中。但是超声处理的过程始终是在冰水浴中进行,温度较低,不利于多糖的溶出,如果温度可以控制的话,可以进一

Figure 6. Effect of jujube polysaccharide on secretion of immunoregulatory factors by RAW264.7 macrophages
图6. 枣多糖对RAW264.7巨噬细胞分泌免疫调节因子的影响
步提高多糖提取率。通过三种方法的提取率的比较,为以后枣多糖的大量提取提供了可靠依据。不同提取方法对枣多糖的化学组成和溶解性等理化性质以及免疫活性有显著的影响,不同提取方法所得多糖的分离纯化、结构表征及其免疫活性的关系有待进一步深入研究。另外上述MTT以及免疫因子的释放结果表明,虽然枣多糖对于细胞具有一定的毒性,但是可以促进免疫因子的释放,表明枣多糖是一种良好的免疫增强剂,在医药和保健品等方面具有一定的开发潜力和应用前景。
基金项目
国家重点研发计划“现代食品加工及粮食收储运技术与装备”重点专项(2017YFD0400203)。
文章引用
刘佳乐,黄德春,程抒劼,曹崇江,陈贵堂. 枣多糖不同提取工艺优化及其免疫活性初探
Optimization of Different Extraction Processes of Jujube Polysaccharides and Comparison of Their Immunological Activities[J]. 食品与营养科学, 2019, 08(02): 142-154. https://doi.org/10.12677/HJFNS.2019.82019
参考文献
- 1. Gao, Q., Wu, C. and Wang, M. (2013) The Jujube (Ziziphus Jujuba Mill.) Fruit: A Review of Current Knoeledge of Fruit Composition and Health Benefits. Journal of agricultural and food chemistry, 61, 3351-3363. https://doi.org/10.1021/jf4007032
- 2. 雷昌贵, 陈锦屏, 卢大新. 红枣的营养成分及其保健功能[J]. 现代生物医学进展, 2006, 6(3): 56-57.
- 3. Li, J.W., Fan, L.P., Ding, S.D. and Ding, X.-L. (2007) Nutritional Composition of Five Cultivars of Chinese Jujube. Food Chemistry, 103, 454-460. https://doi.org/10.1016/j.foodchem.2006.08.016
- 4. Wang, D.-Y., Zhao, Y., Jiao, Y.-D., et al. (2012) Antioxidative and Hepatoprotective Effects of the Polysaccharides from Zizyphus jujube cv. Shaanbeitanzao. Carbohydrate Polymers, 88, 1453-1459. https://doi.org/10.1016/j.carbpol.2012.02.046
- 5. Cheng, D., Zhu, C.-Q., Cao, J.-K. and Jiang, W. (2012) The Protective Effects of Polyphenols from Jujube Peel (Ziziphus jujube Mill) on Isoproterenol-Induced Myocardial Ischemia and Aluminum-Induced Oxidative Damage in Rats. Food and Chetrcical Toxicology, 50, 1302-1308. https://doi.org/10.1016/j.fct.2012.01.026
- 6. Pareek, S. (2012) Nutritional Composition of Jujube Fruit. Emirates Journal of Food and Agriculture, 25, 463-470. https://doi.org/10.9755/ejfa.v25i6.15552
- 7. 刘世军, 唐志书, 崔春利, 等. 大枣化学成分的研究进展[J]. 云南中医学院学报, 2015, 38(3): 96-98.
- 8. 张园, 张信文, 陈光英. 五环三菇类化合物抗肿瘤作用的研究进展明[J]. 海南师范大学学报, 2011, 24(1): 92-95.
- 9. 辛娟. 大枣多糖提取与丹皮酚胂衍生物联合抗肿瘤的体内外实验研究[D]: [硕士学位论文]. 重庆: 重庆大学, 2005.
- 10. 吴娜, 杨洁, 许海燕, 等. 若羌大枣多糖的分离纯化及抗氧化活性的研究[J]. 天然产物研究与开发, 2009, 21(2): 319-323+345.
- 11. 袁亚娜, 张平平, 何庆峰, 吴海清, 樊秀花, 张立金. 冬枣黄酮的分析及体外抗氧化活性[J]. 食品科学, 2013, 34(17): 70-73.
- 12. 苗明三, 苗艳艳, 魏荣锐. 大枣多糖对CCl4所致大、小鼠肝损伤模型的保护作用[J]. 中华中医药杂志, 2011, 26(9): 1997-2000.
- 13. Siwla, N.J. (2012) Research and Clinical Applications of Ren Shen (Ginseng). American Journal of Traditional Chinese Veterinary Medicine, 7, 178-180.
- 14. 郎杰. 酸枣多糖的提取及对免疫功能影响的初探[J]. 食品研究与开发, 2013, 34(4): 35-36+69.
- 15. Zhao, Z.H., Liu, M.J. and Tu, P.F. (2008) Characterization of Water Soluble Polysaccharides from Organs of Chinese Jujube (Ziziphus jujuba Mill. cv. Dongzao). European Food Research and Technology, 226, 985-989. https://doi.org/10.1007/s00217-007-0620-1
- 16. 柳杨, 罗瑞明. 长枣多糖水提工艺参数的响应面分析及优化[J]. 食品与机械, 2010, 26(5): 128-130.
- 17. 李进伟, 丁霄霖. 超声波提取金丝小枣多糖的工艺研究[J]. 林产化学与工业, 2006, 26(3): 73-76.
- 18. 姚瑞琪, 刘海英, 牛鹏飞, 等. 超声辅助提取大枣多糖及柱前衍生高效液相分析[J]. 西北农林科技大学学报(自然科学版), 2007, 35(12): 162-166.
- 19. 廉宜君, 李炳奇, 刘红, 等. 复合酶辅助超声波提取沙枣多糖的工艺研究[J]. 中国中医药信息杂志, 2009, 16(6): 47-48.
- 20. 李新明, 张永茂, 张俊, 等. 响应面法优化骏枣多糖的微波提取工艺研究[J]. 北方园艺, 2011(9): 49-52.
- 21. 姜晓燕, 胡云峰, 崔翰元. 酶法提取灵武长枣多糖及抗氧化作用的研究[J]. 食品工业, 2009, 30(6): 31-33.
- 22. 徐丛玥, 林款, 梁征, 等. 不同提取方法对米邦塔仙人掌粗多糖体外抗氧化性的影响[J]. 食品工业科技, 2018, 39(3): 56-60.
- 23. 高行恩, 王洪新. 不同提取方法对山药多糖含量及其体外抗氧化活性的影响[J]. 食品与发酵工业, 2015, 41(7): 256-262.
- 24. 王雪, 池明兰, 华春, 等. 不同提取方法对蛹虫草基质多糖的特性研究[J]. 食品工业科技, 2015, 36(9): 49-52+56.
- 25. 苏娣, 张芸, 等. 毛蕊花糖对巨噬细胞 RAW264.7的免疫调节作用[J]. 食品科学, 2013, 34(7): 250-253.
- 26. 王小倩, 纪桂元, 蒋卓勤. 染料木黄酮对脂多糖诱导的RAW264.7细胞炎症因子、腺苷酸激活蛋白激酶磷酸化的影响[J]. 营养学报, 2012, 34(2): 177-180.
- 27. 丛媛媛, 阿地力•阿不力孜, 帕丽达•阿不力孜, 等. 维药阿里红多糖的提取及免疫活性研究[J]. 中国现代应用药学, 2010, 27(7): 569-571.
- 28. 吴迪, 张劲松, 等. 不同产地猴头菌子实体粗多糖特征及其刺激巨噬细胞产生NO的活性[J]. 食用菌学报, 2011, 18(4): 59-62.
- 29. 刘伟, 等. 层迭灵芝子实体的体外抗肿瘤及免疫活性[J]. 微生物学通报, 2018, 45(4): 819-824.
- 30. 肖懿慧. IL-1β通过过氧化氢双相调节大鼠主动脉平滑肌细胞大电导钙敏感钾通道活性研究[J]. 心脏杂志, 2018, 30(6): 631-635.
