Botanical Research
Vol.06 No.02(2017), Article ID:20004,8
pages
10.12677/BR.2017.62010
Study on the Distribution of Polysaccharide, Polyphenols, and Flavonoids from Different Organs of Rattan
Qin Cao, Yinnan Sun, Kui Yang, Jinde Sun, Chunhui Ma*
College of Material Science and Engineering, Northeast Forestry University, Harbin Heilongjiang

Received: Mar. 6th, 2017; accepted: Mar. 25th, 2017; published: Mar. 28th, 2017

ABSTRACT
In this study, Rattan (palm cane) as the raw material, the different parts of Rattan plant were extracted by homogenate-assisted extraction, and then extracted by water heating stirring extraction and reflux extraction with 80% ethanol, respectively. The extraction yields of aqueous extractives and alcohol extractives from different parts of Rattan, and polysaccharides, polyphenols and flavonoids content in aqueous extractives and alcohol extractives were determined. And the details of the homogenate-assisted extraction mechanism were interpreted. The experimental results showed that the polysaccharide content in the pericarp (29.31%) and sarcocarp (7.27%) was the highest, and in the tender stems (12.14%) was less, and in sheath, blade, and rattan stem were 2.91%, 1.87% and 1.99%, respectively. However, the polyphenols and flavonoids content in alcohol extractives was higher, which in the pericarp (polyphenols 5.33%, flavonoids 4.67%) and sarcocarp (polyphenols 5.22%, flavonoids 4.64%) was the highest, and followed by blade (polyphenols 3.35%, flavonoids 2.92%), sheath (polyphenols 2.68%, flavonoids 2.37%), and tender stems (polyphenols 1.97%, flavonoids 1.83%), and in the rattan stem (polyphenols 0.55%, flavonoids 0.47%) was the least.
Keywords:Rattan (Palm), Polysaccharides, Polyphenols, Flavonoids, Homogenate
棕榈藤不同部位中多糖、多酚、黄酮类化合物的分布研究
曹琴,孙殷楠,杨奎,孙晋德,马春慧*
东北林业大学材料科学与工程学院,黑龙江 哈尔滨

收稿日期:2017年3月6日;录用日期:2017年3月25日;发布日期:2017年3月28日

摘 要
本研究以棕榈藤为原料,对其各部位(包括棕榈藤果皮与果肉、棕榈藤嫩茎、棕榈藤叶鞘和叶片、棕榈藤藤茎)进行匀浆辅助提取后,分别采用水加热搅拌提取和80%乙醇回流提取,然后对水提取物和醇提取物中的多糖、多酚及黄酮类化合物进行测定,从而研究多糖、多酚及黄酮类化合物在棕榈藤植物的不同部位中的分布情况。本文还对匀浆辅助萃取的机理进行了阐释。实验结果表明:糖类化合物多分布于果实与嫩茎中,果皮与果肉中含多糖29.31%和7.27%,嫩茎中含多糖12.14%,叶鞘、叶片和藤茎中的多糖含量分别为2.91%、1.87%和1.99%。多酚和黄酮类化合物多分布于果实中,果皮(多酚5.33%,黄酮4.67%)略高于果肉(多酚5.22%,黄酮4.64%),其次是叶片(多酚3.35%,黄酮2.92%)、叶鞘(多酚2.68%,黄酮2.37%)和嫩茎(多酚1.97%,黄酮1.83%),藤茎中含量最少(多酚0.55%,黄酮0.47%)。
关键词 :棕榈藤,多糖,多酚,黄酮,匀浆

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
棕榈藤属(Rattan)棕榈科(Palmae)植物属种子植物门被子植物亚门单子叶植物纲的初生目(Principes),攀援带刺植物 [1] 。是世界热带地区最重要的代表科之一,主要分布在热带美洲、热带亚洲和太平洋及附近岛屿,热带非洲也有少量分布,目前全世界共存约210余属2800~3000种左右 [2] 。棕榈科植物因其种类繁多、形态各异、具有其他树种无可媲美的优点,而被世界各地广泛种植和利用 [3] ,因其质地柔软被称为“绿色金子” [1] 。目前,我国广东、广西、海南、云南及福建等省有自然分布,也有人工栽培 [4] 。我国对于棕榈藤的研究主要是材性研究,棕榈藤藤材是仅次于木材和竹材的,非常重要的非木材林产品,对替代木材和保护森林资源发挥着重要作用。藤材的利用可在一定程度上保护树木,而且,棕榈藤能够在维持天然生态环境的条件下,提供与伴生树木相同甚至更多的使用效益 [5] 。
国内对于棕榈藤植物的药理作用研究甚少,本草纲目中早有记载,棕榈藤成熟果实,又称棕笋,其气味苦、涩、平、无毒 [6] 。有文献报道棕榈成熟果实水–醇提取物具有显著降低血糖的药理作用 [7] 。而对于棕榈藤植物化学成分分析的研究几乎没有。
本实验的目的是研究在棕榈藤植物的不同部位中,多糖、多酚及黄酮类化合物的分布情况,如棕榈藤果实包括果皮与果肉、棕榈藤嫩茎、棕榈藤叶鞘和叶片、棕榈藤藤茎。将棕榈藤各器官进行匀浆辅助提取后,分别采用蒸馏水加热搅拌提取和80%乙醇回流提取,然后对水提取物和醇提取物中的多糖、多酚及黄酮类化合物进行测定,不仅分析了多糖、多酚及黄酮类化合物在棕榈藤植物的不同部位中的分布情况,还对匀浆辅助萃取的机理进行了详尽的阐释。
2. 实验
2.1. 材料与仪器
棕榈藤资源采摘自海南省,将各部位(包括棕榈藤果皮与果肉、棕榈藤嫩茎、棕榈藤叶鞘和叶片、棕榈藤藤茎)人工分离后,未经粉碎风干后作为有效成分的提取原料。
HANUO-JJ2型匀浆机(上海汉诺仪器有限公司),KQ-250DB型超声机(昆山超声设备有限公司),RE-52A型旋转蒸发水浴槽(上海青浦沪西仪器厂),SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司),UV-2600岛津紫外可见分光光度计(Shimadzu,日本)。
葡萄糖、没食子酸、芦丁对照品购自中国药品生物制品检定所,纯度均大于98%;其余试剂均为国产分析纯。
2.2. 实验方法
2.2.1. 棕榈藤多糖的测定方法
本研究采用苯酚—硫酸法测定棕榈藤提取物中多糖的含量 [8] 。准确称取棕榈藤水提取物5.0 mg,加入5.0 mL蒸馏水充分溶解后吸取0.2 mL的样品液,用蒸馏水补至2.0 mL,然后加入质量分数为6%的苯酚溶液1.0 mL及浓硫酸5.0 mL,摇匀后室温放置20 min以后于490 nm处测定吸光值A490。
标准曲线的制备:准确称取标准葡萄糖20.0 mg于500 mL容量瓶中,加蒸馏水定容至刻度为葡萄糖储备液,分别吸取上述储备液0.4、0.6、0.8、1.0、1.2、1.4、1.6及1.8 mL,分别以蒸馏水补至2.0 mL,然后分别加入6%苯酚溶液1.0 mL及浓硫酸5.0 mL,摇匀冷却,室温放置20 min以后于490 nm测定吸光值,以2.0 mL蒸馏水按同样显色操作为空白,横坐标为葡萄糖的浓度,纵坐标为吸光值,绘制标准曲线。按照标准曲线计算棕榈藤水提取物中多糖的葡萄糖当量。
2.2.2. 棕榈藤多酚的测定方法
本研究采用福林酚显色法测定棕榈藤提取物中多酚的含量 [9] 。以没食子酸为标准品。精密称取没食子酸5.0 mg用80%乙醇完全溶解后定容至100 mL为标准储备液,分别移取标准储备液0.00、0.10、0.20、0.30、0.40、0.50 mL置于10 mL具塞试管中,再分别加入2.5 mL超纯水,0.5 mL福林试剂和7.5%Na2CO3溶液1.5 mL,充分混匀后在45℃水浴反应1.5 h后在765 nm处测其吸光值。用80%乙醇将棕榈藤醇提取物配制成0.1 mg/mL溶液依照上述方法显色后在765 nm处测吸光值,依据没食子酸标准曲线计算多酚的质量浓度,并计算出提取物中总多酚的没食子酸当量。
2.2.3. 棕榈藤黄酮的测定方法
本研究以芦丁为标准品测定棕榈藤提取物中总黄酮的含量 [10] 。精密称取芦丁标准品10.0 mg,以80%乙醇完全溶解后定容至100 mL作为标准储备液,分别精密吸取0.00,0.50,1.00,1.50,2.00,2.50 mL的芦丁标准储备液置于10 mL具塞试管中,再分别加入2.5、2.0、1.5、1.0、0.5和0 mL 80%乙醇溶液,再分别加入质量分数为5%的NaNO2溶液0.15 mL,摇匀后反应6 min,再分别加入10%Al(NO3)3水溶液0.15 mL,摇匀放置6 min;然后分别加入4%的NaOH水溶液2.00 mL,摇匀后静置15 min,以2.5 mL蒸馏水为空白,在510 nm处测定吸光度,线性回归。用80%乙醇将棕榈藤醇提取物配制成2.5 mg/mL溶液,依照上述方法显色后在510 nm处测定吸光值,依据芦丁标准曲线计算醇提取物中总黄酮的质量浓度,并计算出提取物中总黄酮的芦丁当量。
2.2.4. 棕榈藤水提物的制备方法
将棕榈藤原料(绝干) 100.0 g以料液比1:30 g/mL加入蒸馏水进行匀浆处理3 min,匀浆辅助提取采用HANUO-JJ2匀浆机(上海汗诺仪器有限公司),功率为200 W,然后将原料和提取液在95℃水浴中搅拌提取3 h,然后冷却至室温后过滤,减压浓缩水提取液至干,得棕榈藤水提取物。依据1.2.1~1.2.3项所述,测定水提物中多糖、多酚和总黄酮的含量。
2.2.5. 棕榈藤醇提物的制备方法
将棕榈藤原料(绝干)100.0 g以料液比1:30加入80%乙醇溶液进行匀浆处理3 min,匀浆辅助提取采用HANUO-JJ2匀浆机(上海汗诺仪器有限公司),功率为200 W,然后将原料和提取液在95℃水浴中搅拌回流提取3 h,然后冷却至室温后过滤,减压浓缩醇提取液至干,得棕榈藤醇提取物。依据1.2.1~1.2.3项所述,测定水提物中多糖、多酚和总黄酮的含量。
2.2.6. 棕榈藤加热提取方法
将棕榈藤原料(绝干) 100.0 g以料液比1:30分别加入蒸馏水80%乙醇溶液在95℃水浴中搅拌回流提取6 h,然后冷却至室温后过滤,减压浓缩提取液至干,分别得棕榈藤水提取物和醇提取物。依据1.2.1~1.2.3项所述,测定水提物中多糖、多酚和总黄酮的含量。作为与匀浆辅助的对比方法。棕榈藤各器官原料包括棕榈藤果皮与果肉、棕榈藤嫩茎、棕榈藤叶鞘和叶片、棕榈藤藤茎,各部位处理方式相同。
3. 结果与分析
3.1. 棕榈藤水提取物和醇提取物的得率
本实验采用蒸馏水和80%乙醇分别作为提取溶剂,对棕榈藤的不同部位进行萃取,萃取前分别辅助以匀浆萃取,萃取完成后将所得的水提液或醇提液减压浓缩后60℃真空干燥,分别得到水提取物和醇提取物的质量(m),与提取所用原料的绝干质量(M)的比值,乘以100% 即为水提取物或醇提取物的得率。
如图1所示,水提物的得率较高,而醇提物的得率较低,说明棕榈藤植物中的水溶性成分较多,其中果皮水溶性成分的得率为49.81%,接近50%,嫩茎的水溶性成分的得率也较高,为36.25%,果肉、叶鞘、叶片和藤茎的水溶性成分得率分别为14.85%、8.02%、7.53%和2.86%。棕榈藤嫩茎的醇溶性成分的得率最高,为9.25%,果皮、叶片、果肉和叶鞘的醇溶性成分得率分别为4.98%、4.43%、2.41%和2.39%,藤茎的醇溶性成分得率最低,为0.23%。
3.2. 棕榈藤中多酚、黄酮、多糖的分布情况
本实验分别对棕榈藤不同部位所得的水提取物和醇提取物中,总多酚、总黄酮和总多糖的含量进行了测定,以期了解总多酚、总黄酮和总多糖在棕榈藤植物中的分布情况,总多酚、总黄酮和总多糖分别在水提取物和醇提取物中的得率。提取物中有效物质的含量(m)与提取所用原料的绝干质量(M)的比值,乘以100% 即为提取物中有效物质的得率。
如图2所示,多糖多溶于水提物中,而多酚与黄酮类化合物多溶于醇提物中。多糖类化合物多分布于果实与嫩茎中,果皮与果肉中含多糖29.31%和7.27%,嫩茎中含多糖12.14%,叶鞘、叶片和藤茎中的多糖含量分别为2.91%、1.87%和1.99%。果实(种子)是储存营养物质的主要场所,营养物质包括:碳水化合物、半纤维素、蛋白质和脂肪等,所以糖类化合物的含量比较高;而嫩茎是生长最快的部位,需要更多的能量,所以糖类化合物的积累量也较高。而多酚和黄酮多分布于果实与叶片中,植物多酚又称为植物单宁,多为黄烷醇和黄酮醇等母核结构的聚合物,植物黄酮主要包括以色原酮和色原烯等母核结构的化合物,二者颜色众多,多存在于植物体内颜色鲜艳的器官,如果实(种子)和叶片等。如图3所示,棕榈藤的多酚和黄酮类化合物多分布于果实中,果皮(多酚5.33%,黄酮4.67%)略高于果肉(多酚5.22%,黄酮4.64%),其次是叶片(多酚3.35%,黄酮2.92%)、叶鞘(多酚2.68%,黄酮2.37%)和嫩茎(多酚1.97%,

Figure 1. Extraction yields of aqueous- and alcohol-extractives from different parts of Rattan
图1. 棕榈藤不同部位水提物与醇提物的得率

Figure 2. Effective compounds content in aqueous extractives from different parts of Rattan
图2. 棕榈藤不同部位水提取物中有效成分的含量
黄酮1.83%),藤茎中含量最少(多酚0.55%,黄酮0.47%)。
3.3. 匀浆辅助提取与非匀浆提取效果的对比
通过以上实验数据可知,果皮提取物中的多酚、多糖和黄酮化合物的含量都比较高,为了研究匀浆辅助方法的萃取效果,本实验选择棕榈藤果皮为原料,依2.2.4和2.2.5项所述方法,制备棕榈藤果皮的匀浆辅助加热法萃取的水提取物和醇提取物;依2.2.6项所述方法,制备棕榈藤果皮的非匀浆加热萃取的水提取物和醇提取物,测定各提取物中总多酚、总黄酮和总多糖的含量,以期比较匀浆辅助法在萃取过程中的贡献。
如图4所示,经过匀浆3 min前处理的提取物得率明显高于未经匀浆处理的提取物得率,匀浆辅助处理后水提物中多糖、多酚与黄酮类化合物的得率分别为29.31%、5.33%和4.67%;而未经匀浆预处理的水提物中多糖、多酚与黄酮类化合物的得率分别为19.23%、2.62%和2.31%;匀浆辅助处理后醇提物中多糖、多酚与黄酮类化合物的得率分别为29.31%、5.33%和4.67%;而未经匀浆预处理的水提物中多糖、多酚与黄酮类化合物的得率分别为1.92%、2.62%和2.31%;因为在匀浆的过程中不仅使物料得到充
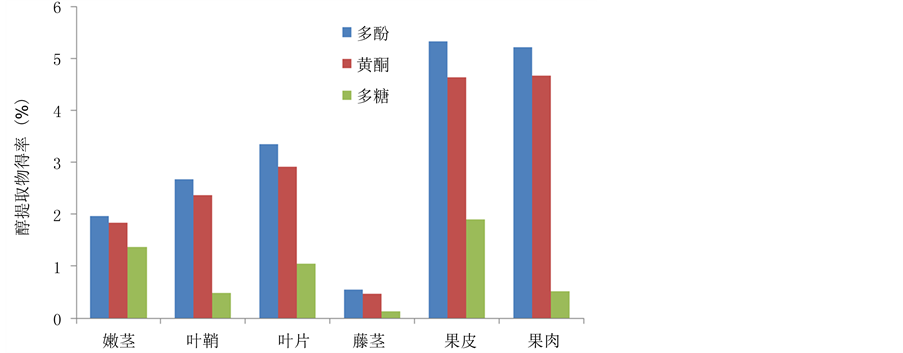
Figure 3. Effective compounds content in alcohol extractives from different parts of Rattan
图 3. 棕榈藤不同部位醇提取物中有效成分的含量

Figure 4. Compared the effective compounds yield of homogenate-assisted extraction with that of non-homogenate-assisted extraction
图 4. 匀浆辅助提取与非匀浆提取有效成分提取率的比较
分粉碎,可以增加后续升温提取过程中溶剂的渗入与有效物质的溶出,而且还大大缩短了升温萃取的时间,经过匀浆3 min前处理的物料,加热萃取的时间为3 h,而未经匀浆处理的物料,加热萃取的时间为6 h。
3.4. 匀浆辅助萃取机理分析
从植物细胞中提取天然产物是获得生物活性成分最直接的方式,避免了化学合成所带来的副产物复杂,毒性未知和生产成本高等问题。从植物细胞中提取生物活性成分主要是利用天然产物与有机溶剂的“相似相溶”原理,使有机溶剂渗透入细胞壁,与活性成分相溶后,再迅速溶出。
植物细胞壁是存在于植物细胞外围的一层厚壁,由胞间层,初生壁,次生壁三部分构成,主要参与维持细胞的形态、增强细胞的机械强度,因此在提取的过程中,采用具有机械强度的方法使细胞壁破裂,加速了有机溶剂渗入细胞内部,提高目标产物的提取率。
匀浆萃取就是一种借助于外来机械剪切力的固-液萃取方式,在湍动的有机溶剂中将物料粉碎,有利于细胞壁和细胞膜的破裂,原料无需进行粉碎预处理,不但降低了原料预处理的能耗,而且避免了在粉碎过程中由于摩擦而使物料局部升温,破坏热敏性活性成分。而且匀浆萃取在室温条件下进行,无需加热,一般用于萃取室温易挥发,热敏性较差的活性物质,如茄尼醇 [11] 、植物多酚 [12] 等。
匀浆提取过程机理示意图如图5所示,在固体物料和有机溶剂所组成的固–液萃取体系中,将植物细胞的微观结构具体分为三部分,细胞壁、细胞膜和细胞质,细胞外部形成一个固–液的界面,在界面上形成一层液体膜。在匀浆萃取过程中,在机械剪切力的作用下,固体原料的粒径不断减小,粒径越小,固体颗粒与溶剂接触的比表面积越大,细胞壁和细胞膜的破裂使溶剂能够更快速地渗入到固体内部,溶质溶解于溶剂后,溶有溶质的溶液扩散至固体表面。此外,在匀浆处理的过程中伴随着溶剂的高速湍动,溶液的湍动越强烈,固-液两相的边界层越薄,也就在固体颗粒表面形成了一层薄薄的液膜,高速湍动的溶剂将扩散至固体表面的溶液迅速稀释,降低固体表面溶液的浓度,细胞外部溶剂的更新加快,也加快了内部溶液扩散至固体表面的速度,提高了有效成分的溶出速率。但在匀浆处理的过程中,匀浆时间过长使原料粒径过小,造成杂质的溶出量增加,给后续的分离纯化带来困难。本实验对匀浆萃取的时间进行了优化,以有效成分的提取率为指标,匀浆萃取3 min为最佳。
综上所述,匀浆萃取实质上是一种溶剂强化浸取的过程,既是物料粉碎的过程,又是物料与溶剂充分混合的过程,因此实质上是一种强化固–液传质的过程。粉碎可使较大的固体颗粒变小,同时使大部分的组织破坏,使细胞内的目标成分充分地释放到有机溶剂中;颗粒变小则相应增大固相与液相接触的比表面积,扩大了液体膜的总面积,因此缩短了溶剂渗入到固体内部的时间,提高了传质速率,使物料中的有效成分与溶剂中的浓度短时间内趋于平衡,达到了强化浸取的目的 [13] 。
4. 结论
本研究以棕榈藤为原料,采用匀浆辅助萃取的方法对棕榈藤各部位(包括棕榈藤果皮与果肉、棕榈藤

Figure 5. Mechanism schematic diagram of homogenate-assisted extraction process
图 5. 匀浆提取过程机理示意图
嫩茎、棕榈藤叶鞘和叶片、棕榈藤藤茎)进行处理后,分别采用水加热搅拌提取法和80%乙醇回流提取法进行提取,然后对所得水提取物和醇提取物中的多糖、多酚及黄酮类化合物的含量进行测定,从而研究多糖、多酚及黄酮类化合物在棕榈藤植物不同部位中的分布情况。本文还对匀浆辅助萃取的机理进行了详尽的阐释。实验结果表明:糖类化合物多分布于果实与嫩茎中,果皮与果肉中含多糖29.31%和7.27%,嫩茎中含多糖12.14%,叶鞘、叶片和藤茎中的多糖含量分别为2.91%、1.87%和1.99%。多酚和黄酮类化合物多分布于果实中,果皮(多酚5.33%,黄酮4.67%)略高于果肉(多酚5.22%,黄酮4.64%),其次是叶片(多酚3.35%,黄酮2.92%)、叶鞘(多酚2.68%,黄酮2.37%)和嫩茎(多酚1.97%,黄酮1.83%),藤茎中含量最少(多酚0.55%,黄酮0.47%)。
致谢
作者感谢中央高校基本科研业务费专项资金项目(2572016BB01)和东北林业大学大学生创新训练项目(201610225028)的资助。
文章引用
曹琴,孙殷楠,杨奎,晋德,马春慧. 棕榈藤不同部位中多糖、多酚、黄酮类化合物的分布研究
Study on the Distribution of Polysaccharide, Polyphenols, and Flavonoids from Different Organs of Rattan[J]. 植物学研究, 2017, 06(02): 63-70. http://dx.doi.org/10.12677/BR.2017.62010
参考文献 (References)
- 1. Mohan Ram, H.Y. and Tandon, R. (1997) Bamboo and Rattans: From Riches to Rags. Proceedings of the Indian National Science Academy, 63, 245-267.
- 2. 钟如松, 何洁英, 伍有声, 等. 引种棕榈图谱[M]. 合肥: 安徽科学技术出版社, 2004: 355.
- 3. 林秀香, 陈振东. 我国棕榈科植物的研究进展[J]. 热带作物学报, 2007, 28(3): 115-119.
- 4. 竺肇华. 中国热带地区竹藤发展[M]. 北京: 中国林业出版社, 2001.
- 5. 许煌灿, 尹光天, 孙清鹏, 等. 棕榈藤的研究和发展[J]. 林业科学, 2002, 38(2): 135-143.
- 6. 李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1977: 750-751.
- 7. 刘善庭, 李建美, 王清, 辛勤, 林丽文, 李军, 于江, 杨静, 梁玉记, 齐汝霞. 棕榈果实水–醇提取物的药理研究[J]. 济宁医学院学报, 2003, 26(1): 36-37.
- 8. 王艳, 茹仙古丽·哈斯木, 韩艳春, 阿孜古丽·伊明, 阿依吐伦·斯马义. 苯酚-硫酸法测定维吾尔药核桃分心木多糖的含量[J]. 亚太传统医药, 2012, 8(2): 35-37.
- 9. 詹莉莉, 章程辉, 常刚, 叶俊松, 潘晓威. 福林酚比色法测定露兜簕果实中的总多酚[J]. 广东农业科学, 2013(4): 77-80.
- 10. 钟文, 翟瑶, 卢永昌. 藏药宽筋藤中总黄酮和芦丁含量的测定[J]. 湖北农业科学, 2013(9): 2151-2170.
- 11. 祖元刚, 赵春建, 李春英, 史权, 焦琰. 鲜法匀浆萃取烟叶中茄尼醇的研究[J]. 高校化学工程学报, 2005, 19(6): 757-761.
- 12. 刘晓芳, 刘满红, 张荣来, 黄桂文. 双水相–匀浆萃取法提取芒果核多酚工艺研究[J]. 云南民族大学学报: 自然科学版, 2015, 24(2): 144-146.
- 13. 史权. 鲜芽匀浆空化高效提取10-羟基喜树碱和喜树碱创新技术研究[D]: [博士学位论文]. 哈尔滨: 东北林业大学, 2004.
NOTES
*通讯作者。