International Journal of Ecology
Vol.
12
No.
02
(
2023
), Article ID:
65556
,
11
pages
10.12677/IJE.2023.122020
生物炭内源磷和外源磷的释放及对铅的吸附
李辉婷1,杨洁2,王燕2,管静2,陆诗磊2,周美姣1
1常州建筑科学研究院集团股份有限公司,江苏 常州
2安徽理工大学地球与环境学院,安徽 淮南
3青山绿水(江苏)检验检测有限公司,江苏 常州
收稿日期:2023年4月10日;录用日期:2023年5月10日;发布日期:2023年5月19日

摘要
文章以小麦秸秆制备不同磷含量的改性生物炭,探究其对重金属Pb2+的吸附机理与磷释放特征之间的关系。利用元素分析、XPS对生物炭的元素组成和官能团结构进行分析;探究固液比、电解质强度和有机酸对磷释放的影响。结果表明:四种生物炭P含量在2.53 mg∙g−1~10.82 mg∙g−1范围,且制备的生物炭均为碱性(pH > 9)。生物炭的磷素累积释放表明生物炭内源磷的释放是持续渐进的过程。固液比、电解质强度、有机酸等环境因素对生物炭中磷的释放特征产生一定影响。溶液pH升高能够促进生物炭对重金属Pb的吸附,当溶液pH从3升至6时,生物炭对Pb的吸附效率由(6.49%~13.28%)提升至(92.26%~99.47%)。为磷酸盐改性生物炭用作缓释磷肥和重金属钝化剂提供理论依据。
关键词
生物炭,磷酸氢二钠,吸附,铅

Release of Inherent-P and Laden-P from Biochar and Adsorption on Lead
Huiting Li1, Jie Yang2, Yan Wang2, Jing Guan2, Shilei Lu2, Meijiao Zhou1
1Changzhou Building Research Institute Group Co., LTD, Changzhou Jiangsu
2School of Earth and Environment, Anhui University of Science and Technology, Huainan Anhui
3Qingshan Lushui (Jiangsu) Inspection and Testing Co., LTD, Changzhou Jiangsu
Received: Apr. 10th, 2023; accepted: May 10th, 2023; published: May 19th, 2023

ABSTRACT
Modified biochar with different phosphorus contents was prepared from wheat straw to explore the relationship between the adsorption mechanism of heavy metal Pb2+ and the characteristics of phosphorus release. Elemental composition and functional group structure of biochar were analyzed by elemental analysis and XPS. The effects of solid-liquid ratio, electrolyte strength and organic acids on phosphorus release were investigated. The results showed that the P content of the four biochars ranged from 2.53 mg·g−1 to 10.82 mg·g−1, and all the biochars prepared were alkaline (pH > 9). The cumulative phosphorus release process of biochar indicates that the endogenous phosphorus release of biochar is a continuous and gradual process. The solid-liquid ratio, electrolyte strength, organic acids and other environmental factors have certain effects on the release characteristics of phosphorus from biochars. When the pH of solution increases from 3 to 6, the adsorption efficiency of Pb by biochar increases from (6.49%~13.28%) to (92.26%~99.47%). It provides theoretical basis for phosphate modified biochar to be used as slow release phosphate fertilizer and heavy metal passivator.
Keywords:Biochar, Na2HPO4, Adsorption, Lead

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
磷循环是生物循环中必不可少的营养成分,也是植物生长的重要元素 [1] 。根据目前的一些研究报告,磷矿作为一种不可再生资源和生产磷的重要材料,随着社会生产的使用而面临越来越匮乏的局面 [2] ,因此,农业生产急需一种磷基合成肥料的替代品。此外,全球每年小麦秸秆产量超过5亿吨,其中一小部分缺乏合理工业应用而被烧毁,造成环境污染;大部分用于农业生产再利用,回收秸秆中所含N、P、K肥 [3] 。
目前,生物炭作为生物质废弃物在限氧条件下通过热解技术(500℃~800℃)生成的富碳物质,已被应用于土壤环境,用以提高土壤的养分保持效果和作物产量 [4] [5] 。热解过程的温度和原料种类对生物炭中重金属Pb、N和P的形态和含量都有较大影响,污泥生物炭中P的含量可高达30.5 mg/g [6] 。因此,有文献探究表明生物炭中固有的磷可以作为营养元素供给植物,磷的化学形态和金属离子结合形态会影响生物炭中磷的释放特征和存在形态 [7] [8] 。因此,生物炭中磷的赋存特性对植物养分吸收及对重金属Pb的钝化作用具有重要影响 [9] 。
为了更好地评价生物炭的环境应用价值,必须考虑生物炭的物理化学特性、表面性质和环境应用因素。Wolfram [10] 研究了阳离子和溶液初始pH对生物炭中磷释放的影响,结果表明:当溶液pH > 7.5或溶液中钙离子过量时,均可抑制生物炭中磷的释放能力。生物炭作为碱性物质增加土壤pH值,并在生物炭周围产生pH梯度,也可能会影响生物炭中的磷释放。此外,上覆水导致的土壤缺氧条件会促进生物炭中Fe/Al-P的溶解 [11] 。MnO2改性猪粪生物炭对Pb2+和Cd2+ [12] 具有良好的吸附效果。因此,探讨不同环境因素对生物炭磷在土壤环境中的释放能力,及对重金属Pb的吸附能力具有至关重要的研究意义。
因此,本实验以一组未施加磷肥的小麦田为对照,另一组小麦施加一定量磷肥,成熟收割后利用对照小麦秸秆(CKBM)、高磷小麦秸秆(HPBM)分别来制备内源对照生物炭(CKBC)、内源高磷生物炭(HPBC);此外,向对照小麦秸秆(CKBM)中添加磷酸氢二钠(Na2HPO4),来制备与HPBC磷含量为一倍、两倍关系的外源1:1磷改性生物炭(1EPBC)、外源1:2磷改性生物炭(2EPBC),负载磷酸盐改性生物炭材料能够增加重金属的吸附选择性和容量,来研究内源磷和外源磷生物炭对重金属Pb的吸附效率。本研究的目的如下:(1) 研究生物炭在环境中的累积释放能力;(2) 考察环境因素对P释放的影响;(3) 探究pH对生物炭吸附重金属Pb的影响。研究结果为磷改性生物炭去除废水中重金属Pb提供数据和理论支持。
2. 材料和方法
2.1. 生物炭的制备
用去离子水清洗对照小麦秸秆(CKBM)和高磷小麦秸秆(HPBM),去除灰尘和杂质,然后置于105℃烘箱中4小时烘干,将烘干后的小麦秸秆剪切成2 cm左右放入坩埚中压实,盖上坩埚盖,置于马弗炉内,通入高纯度氮气,在缺氧环境下热解2 h (热解温度T: 500℃,升温速率v: 10℃/min),制备内源对照生物炭(CKBC)、内源高磷生物炭(HPBC)。根据Tan [13] 研究表明磷酸盐对生物炭具有良好的修饰效果,因此本研究将CKBM作为原材料,利用Na2HPO4溶液制备总磷是HPBC含量1倍和2倍的外源磷生物炭:1:1磷改性生物炭(1EPBC)和1:2磷改性生物炭(2EPBC)。
2.2. 生物炭的理化性质分析
采用德国elementar公司生产的vario macro cube型有机元素分析仪对四种小麦秸秆生物炭的C、H、O、N、P元素进行分析。采用美国(Thermo)生产的ESCALAB 250 XI型X射线光电子能谱仪定量分析生物炭含氧官能团,X射线源为Al Kα、功率为100 W、束斑直径为500 μm,真空度 < 1.0 × 10−9 pa、能量范围:0~1200 e V、扫描步长1 e V、通能100.0 e V。用XPSPEAK及Avantage对谱图进行分析。
2.3. 物炭中磷累积释放
向50 mL离心管中加入0.2 g生物炭和20 mL浓度为0.01 M的NaNO3溶液,以160 r/min振速振荡24 h,离心后用0.45 μm的微孔滤膜过滤,于4℃温度下保存上清液。将剩余生物炭残渣反复补加电解质溶液重复提取六次。每个样品做3个平行,用紫外分光光度计于700 nm处检测溶液中磷的释放情况。
2.4. 环境因素对生物炭中磷释放的影响
生物炭对于生态环境具有良好的修复钝化作用,但同时也会受到环境中各种因素的调控和影响,因此探究溶液初始pH、固液比、离子强度、有机酸等环境条件对生物炭吸附性能的影响具有积极意义。
1) 溶液初始pH:用0.1 mol/L的NaOH/HCl将Pb溶液(c = 100 mg/L)的pH调至2、3、4、5、6 、7,称取0.03 g生物炭加入30 ml已调节pH后的Pb溶液。
2) 固液比:分别设置1:100/1:200/1:400/1:600/1:800/1:1000的固液比,称取相应质量的生物炭加入8 ml浓度为0.01 M的NaNO3溶液。
3) 离子强度:将NaNO3电解质浓度分别调至0.001/0.01/0.1/0.5 mol/L,并用移液管量取20 mL不同浓度NaNO3溶液置于50 mL离心管中,再称入0.05 g生物炭。
4) 有机酸:分别设置浓度为30 mg/L的草酸、柠檬酸、腐殖酸(HA)溶液,并用移液管量取20 mL不同小分子有机酸置于50 mL离心管中,再称入0.05 g生物炭。
以160 r/min振速振荡24 h后离心,经0.45 μm滤膜过滤,并于4℃温度下保存上清液。每个样品做2个平行,用原子吸收分光光度计和紫外分光光度计分别测定溶液中Pb2+和平衡溶液pH。
3. 结果与讨论
3.1. 生物炭的基本性质
表1所列为土壤、生物质及生物炭的全磷、pH基本性质。利用HF-HNO3-HClO4消解法,测得CK土壤(CK Soil)、HP土壤(HP Soil)总磷含量分别为0.40 mg/g、0.82 mg/g,CKBM、HPBM、1EPBM、2EPBM四种小麦秸秆总磷含量分别为1.101 mg/g、2.069 mg/g、2.457 mg/g、4.936 mg/g。CKBM、HPBM相较于土壤中磷含量分别提高了175.25%、152.32%,这主要由于磷是植物生长的重要营养元素,土壤具有较高的阴离子交换能力,施加磷肥会提高作物对磷的吸收和累积 [14] 。CKBC、HPBC、1EPBC、2EPBC四种生物炭全磷含量分别达到了2.527 mg/g、4.710 mg/g、5.235 mg/g、10.821 mg/g,1EPBC与HPBC全磷含量大致相同,2EPBC全磷约为1EPBC的两倍,符合预期生物炭磷改性要求;热解后的生物炭磷含量分别提高了129.52%、127.76%、111.52%、119.23%,是由于在高温条件下,生物质中的水分、有机质、纤维热解灰化,使得生物炭中的磷元素富集 [15] 。
CK Soil、HP Soil两种土壤的pH分别为5.40、5.34,土壤呈酸性。CKBC、HPBC、1EPBC、2EPBC四种生物炭pH分别为9.45、9.56、9.66、9.69 (pH > 9)。由于生物质高温热解使得大量矿物质和碱金属与有机质分离,挥发物质逸出,而难降解的阳离子和可交换态离子冷凝使得pH升高 [16] ,pH升高会影响生物炭表面基团的质子化程度,增加更多的吸附位点,还会影响金属离子的形态,是生物炭吸附重金属的重要因素 [17] 。
Table 1. pH and total phosphorus of soil, biomass and biochar
表1. 土壤、生物质及生物炭的pH、全磷
注:-为末检验。
3.2. 生物炭的元素组成
Table 2. Properties and elemental analysis of wheat straw biochar
表2. 小麦秸秆生物炭元素分析
四种生物炭均由小麦秸秆在400℃条件下热解2 h制备而成,各元素组成较为相似,各元素组成及占比见表2。生物质热解过程是木质素、纤维素脱水的过程,不稳定脂肪族化合物逐渐降低,芳香结构不断形成,四种生物炭中C元素占比最高,O元素次之,其他元素占比较少。生物质在低温条件下热解制备的生物炭由于不完全碳化,含有不完全碳化和高度碳化的有机碳,随着生物质碳化温度的升高,碳形态从“橡胶态”向“玻璃态”转变,生物炭的含碳量也随之增高 [18] 。例如常西亮 [19] 在200~600℃条件下制备的生物炭的碳含量从63.63%上升至79.49%。高温热解制备的生物炭O/C占比较高,表明生物炭的疏水性较强,此外Spokas [20] 研究表明O/C与阳离子交换量关系呈显著正相关;而H/C占比较低,表明热解温度越高,木质素和纤维素脱水程度越高,生物质碳化越完全、芳香性越高 [21] ,有利于生物炭的土壤调节功能和固碳能力。
3.3. 生物炭的XPS分析
用X-射线光电子能谱(XPS)对内源磷与外源磷生物炭中官能团的进行了分析,四种生物炭的表面结构极为相似,见图1,对C1s进行分封处理后,共得到4个特征峰,分别是284.8 eV处C-C/C = C;287.10eV处C = O和288.60 eV处O = C-OH,可知中C元素和O元素含量较高,生物炭中含有丰富的含氧官能团 [22] ,CKBC、HPBC、1EPBC、2EPBC四种生物炭的C-C/C = C含量分别为:64.03%、67.45%、69.69%和71.88%,可知,随着生物炭负载磷含量的增多,生物炭的石墨化程度越来越高、疏水性越强,而C = O和O = C-OH的比例相对减少,含氧官能团参与吸附的比例更小 [23] 。

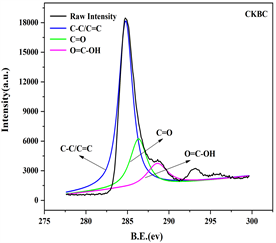
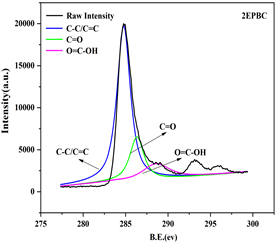

Figure 1. XPS spectra analysis of biochar
图1. 生物炭XPS图谱分析
3.4. 生物炭中磷累积释放特征
生物炭磷素累积释放如图2所示。在生物炭磷累积释放的整个过程中,磷酸盐化合物的累积提取量随着提取次数的增加而增多,且释放速度放缓并趋向平坦,四种生物炭的磷酸盐释放量顺序为:CKBC < HPBC ≈ 1EPBC < 2EPBC,其中CKBC释放能力最弱,1EPBC释放能力略强于HPBC,2EPBC的释放能力最强且是HPBC的两倍左右,与生物炭中磷的添加量表现出平行关系。
四种生物炭六次提取出的磷酸盐总量分别为:1.915、2.738、3.054、5.20,分别浸出了总磷的75.78%、58.13%、58.33%、48.05%。可知磷在生物炭中具有较高的保留率,表明P在环境中释放是持续而渐进的过程,可能会持续几个季节,具有一定的环境效应,为磷改性生物炭制备缓释磷肥提供依据 [24] [25] [26] 。
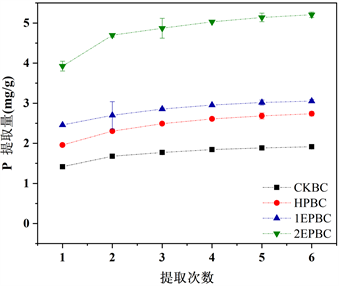
Figure 2. Cumulative release of phosphorus from biochar
图2. 生物炭中磷素的累积释放
3.5. 固液比对P释放的影响
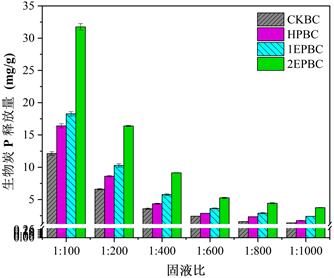
Figure 3. Effects of different solid-liquid ratios on P release of biochar
图3. 不同固液比对生物炭P释放的影响
CKBC、HPBC、1EPBC、2EPBC四种生物炭在0.01 mol/L的NaNO3电解质溶液环境下,按照不同的固液比从1:100增加到1:1000,内源磷和外源磷生物炭磷的释放情况如图3所示。四种生物炭在1:100的固液比条件下均达到磷的最大释放量,分别为12.12 mg/L、16.408 mg/L、18.273 mg/L、31.744 mg/L;在1:1000的固液比条件下的释放量都为最低,分别为1.381 mg/L、1.73 mg/L、2.401 mg/L、3.742 mg/L;随着固液比从1:100增至1:1000,溶液中磷的释放量先快速降低再缓慢释放,这种现象可能由于当溶液中磷浓度较高时,体系处于饱和状态,溶液中解析的磷酸盐会再次被生物炭吸附,且与生物炭吸附位点上的磷发生竞争吸附;而当溶液中P含量较低时,体系处于不饱和状态,溶液的稀释促进生物炭中P更多的释放 [27] 。此外还发现,增加生物炭的剂量实际上降低了P的释放效率,四种生物炭在1:1000的固液比条件下磷的释放效率分别为0.547 mg/g、1.688 mg/g、2.342 mg/g、3.719 mg/g,而在1:100固液比条件下磷的释放效率分别为0.434 mg/g、1.560 mg/g、1.818 mg/g、3.163 mg/g,因此,在较小的固液比条件下,生物炭在溶液中磷的释放量最高,但是磷的释放效率最低 [28] [29] 。
3.6. 离子强度对磷释放的影响
与去离子水溶液相比,NaNO3电解质溶液可以显著提升生物炭内源磷与外源磷在溶液中的释放能力,但生物炭内源磷与外源磷释放不受溶液中电解质强度的显著影响。如图4所示,CKBC、HPBC、1EPBC、2EPBC四种生物炭在去离子水溶液中的释放量分别为0.409 mg/g、0.935 mg/g、1.169 mg/g、4.212 mg/g,当NaNO3电解质强度从0.001 mol/L升至0.5 mol/L,各生物炭中磷释放量分别为 CKBC (1.372~1.564 mg/g)、HPBC (1.950~3.027 mg/g)、1EPBC (2.256~2.677 mg/g)、2EPBC (8.452~9.704 mg/g),可知,NaNO3电解质对四种生物炭中磷的释放量均显著提高了2倍左右,但是电解质强度对磷酸释放的促进作用并不显著。离子强度影响磷改性生物炭释放能力主要因素有:① 电解质的加入压缩了双电层的厚度,减小了生物炭与磷酸盐之间的静电作用,从而促进主要以静电作用吸附在生物炭上的磷酸的释放 [30] [31] ;② 生物炭对磷的释放能力受NaNO3电解质离子强度的影响不大,表明增加NO3−浓度不会由于静电排斥作用而促进磷酸的释放,NO3−与磷酸并没有显著竞争关系 [32] [33] 。
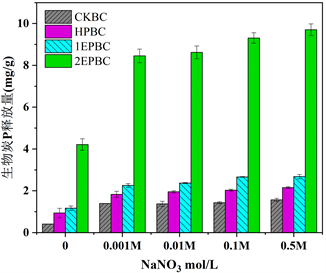
Figure 4. Effects of ion strength on the release of phosphorus from biochar
图4. 离子强度对生物炭中磷释放的影响
3.7. 有机酸对磷释放的影响
研究了腐殖酸(HA)、草酸和柠檬酸三种有机酸对生物炭内源磷和外源磷释放的影响,结果表明与去离子水相比,有机酸对四种生物炭内源磷和外源磷释放均有一定程度的促进作用,并且促进效果大致相当,如图5所示。HA、草酸、柠檬酸对于CKBC磷酸盐释放的增加量在0.253~0.406范围、HPBC增加量在0.281~0.458范围、1EPBC增加量在0.395~0.689范围、2EPBC增加量在0.686~0.728范围,四种生物炭在任意有机酸条件下均有如下释放特征:CKBC的磷酸盐释放能力最弱、1EPBC的释放能力略强于HPBC,2EPBC释放能力最强且大致为HPBC释放量的两倍。由此可知HA、草酸、柠檬酸对生物炭内源磷和外源磷的释放具有促进作用,这主要是因为:首先,有机酸可以增加生物炭表面的负电荷和含氧官能团(如−OH、−COOH等)的数量,与磷酸盐产生竞争吸附,促进磷酸盐从生物炭表面释放 [34] ,其次,有机酸的吸附会占据生物炭内部孔隙,阻塞溶液中解析的磷酸盐重新附着在生物炭孔隙通道,从而抑制P的再吸附过程 [35] ,最后,有机酸的加入增加体系有机酸根阴离子的含量,与磷酸盐竞争吸附生物炭表面的活性点位,从而提升磷的释放能力 [36] 。
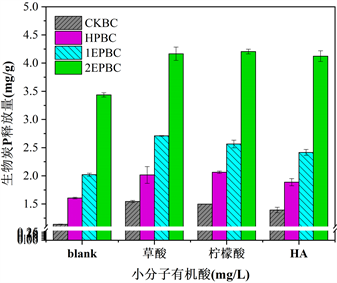
Figure 5. Effects of different organic acids on P release of biochar
图5. 不同有机酸对生物炭P释放的影响
3.8. 溶液初始pH对生物炭吸附Pb的影响
初始pH通过影响生物炭表面电荷、重金属离子化程度来改变Pb2+在溶液中的沉淀作用和离子交换。在低pH环境溶液中,大量的H+不仅与Pb2+竞争生物炭上的吸附点位,还能够使基团质子化带正电荷产生静电排斥,抑制生物炭对重金属Pb的吸附能力 [17] [37] 。如图6所示,探究四种生物炭在溶液pH为2~6范围时对重金属Pb的吸附情况。随着溶液pH的升高,生物炭对重金属Pb的吸附能力也随之增加(图6(a)),当pH从3升至6时,CKBC、HPBC、1EPBC、2EPBC四种生物炭对重金属Pb的吸附效率从(6.49%~13.28%)急剧提升至(92.26%~99.47%)。这主要是由于随着溶液pH上升,生物炭的zeta电位变负,有利于对阳离子的吸附;其次,溶液pH升高,H3O+和H+离子浓度降低以及含氧官能团(如−COOH)的去质子化导致生物炭表面带有更多的负电荷,因此可以通过静电作用吸附更多的铅 [38] ;此外在较高pH条件下Pb(OH)2的形成也是铅吸附的重要原因,因此从弱酸到中性条件有利于Pb的去除 [39] 。
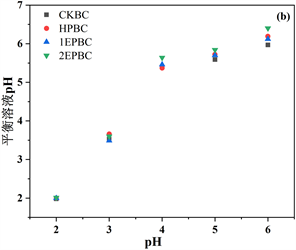
Figure 6. Effects of pH on the adsorption of Pb2+ by biochar adsorption capacity of Pb2+ at different pH (a); pH of the solution at equilibrium (b)
图6. pH对生物炭吸附Pb2+的影响不同pH下Pb2+的吸附量(a);溶液平衡时的pH (b)
为了解Pb吸附过程的变化情况,反应体系的酸度未受控制,且对平衡溶液后的pH进行测定(图6(b))。四种生物炭混合液pH在原溶液pH基础上略有上升,且四种生物炭在各pH溶液环境下pH的提升范围分别为:pH = 2 (1.32~1.53),pH = 3 (4.64~5.22),pH = 4(4.12~4.64),pH = 5 (3.15~3.69),pH = 6 (2.16~2.63)。添加Pb离子前后的生物炭混合溶液pH显著提升,这可能是由于当生物炭吸附重金属Pb时,表面会发生络合反应和离子交换作用 [40] ,从而使得溶液pH有一定程度的提高。
4. 结论
(1) C、H、O、N、P是生物炭主要元素组成,含氧官能团(−OH、−COOH、C = O)丰富;生物炭发达的孔隙结构和比表面积使得Na2HPO4附着在孔隙之中,有助于将重金属Pb吸附在生物炭内外层的活性位点上,形成稳定的磷酸盐沉淀;此外,生物炭磷酸盐含量越多,石墨化程度越高。
(2) 由磷素累积分析可知,随着提取次数的增加,生物炭表现出前期快速释放而后期缓慢溶出两个阶段,为磷改性生物炭作为缓释磷肥提供依据。当溶液pH从3升至6时,生物炭对Pb的吸附效率从(6.49%~13.28%)提升至(92.26%~99.47%),溶液pH升高促使官能团去质子化、H3O+和H+浓度降低,提高生物炭对重金属的吸附能力,此外较高pH环境下导致Pb (OH)2的生成也是Pb吸附的重要原因。
(3)增加生物炭添加量会促进溶液磷酸盐的释放,但投加过量会导致生物炭成团聚集而降低释放效率;NaNO3能够促进生物炭中磷的释放但不受离子强度的显著影响;HA、草酸和柠檬酸可占据生物炭的孔隙结构,与磷酸根离子竞争生物炭表面的活性点位从而促进磷酸盐在溶液中的释放。
项目基金
基于智慧联动的化感物质强化农村黑臭水体生态修复研究与应用示范(CE20215018);定喷助渗多相抽提技术研究及其在低渗透污染场地中的应用(BE2021639)。
文章引用
李辉婷,杨 洁,王 燕,管 静,陆诗磊,周美姣. 生物炭内源磷和外源磷的释放及对铅的吸附
Release of Inherent-P and Laden-P from Biochar and Adsorption on Lead[J]. 世界生态学, 2023, 12(02): 164-174. https://doi.org/10.12677/IJE.2023.122020
参考文献
- 1. Chu, Q., Xu, S., Xue, L., et al. (2020) Bentonite Hydrochar Composites Mitigate Ammonia Volatilization from Paddy Soil and Improve Nitrogen Use Efficiency. Science of the Total Environment, 718, Article ID: 137301. https://doi.org/10.1016/j.scitotenv.2020.137301
- 2. Jing-Cheng H., Fangze S., Ping L., et al. (2021) Coupling Bayesian-Monte Carlo Simulations with Substance Flow Analysis for Efficient Pollutant Management: A Case Study of Phosphorus Flows in China. Resources, Conservation & Recycling, 169, Article ID: 105550. https://doi.org/10.1016/j.resconrec.2021.105550
- 3. Zhang, Y., Ghaly, A.E. and Li, B. (2012) Physical Properties of Wheat Straw Varieties Cultivated under Different Climatic and Soil Conditions in Three Continents. American Journal of Engineering & Applied Sciences, 5, 98-106. https://doi.org/10.3844/ajeassp.2012.98.106
- 4. Zeng, D., et al. (2014) Wheat Straw and Its Biochar Had Con-trasting Effects on Soil C and N Cycling Two Growing Seasons after Addition to a Black Chernozemic Soil Planted to Barley. Biology and Fertility of Soils, 50, 1291-1299. https://doi.org/10.1007/s00374-014-0943-6
- 5. Cong, W., et al. (2018) Effects of Biochar Amendment on Net Greenhouse Gas Emissions and Soil Fertility in a Double Rice Cropping System: A 4-Year Field Experiment. Agricul-ture, Ecosystems & Environment, 262, 83-96. https://doi.org/10.1016/j.agee.2018.04.017
- 6. Qian, T., Zhang, X., Hu, J., et al. (2013) Effects of Environmental Conditions on the Release of Phosphorus from Biochar. Chemosphere, 93, 2069-2075. https://doi.org/10.1016/j.chemosphere.2013.07.041
- 7. Mcdowell, R.W., Condron, L.M., Mahieu, N., et al. (2002) Analysis of Potentially Mobile Phosphorus in Arable Soils Using Solid State Nuclear Magnetic Resonance. Journal of Environmental Quality, 31, 450-456. https://doi.org/10.2134/jeq2002.4500
- 8. Mcdowell, R.W. and Sharpley, A.N. (2003) Phosphorus Solubility and Release Kinetics as a Function of Soil Test P Concentration. Geoderma, 112, 143-154. https://doi.org/10.1016/S0016-7061(02)00301-4
- 9. Joseph, S., et al. (2014) Phosphorus Reclamation through Hydrothermal Carbonization of Animal Manures. Environmental Science & Technology: ES&T, 48, 10323-10329. https://doi.org/10.1021/es501872k
- 10. Wolfram, B., Shepherd, J.G., Heal, K.V., et al. (2018) Spatial and Tem-poral Microscale pH Change at the Soil-Biochar Interface. Geoderma, 331, 50-52. https://doi.org/10.1016/j.geoderma.2018.06.016
- 11. Li, H., Li, Y., Xu, Y., et al. (2020) Biochar Phosphorus Fer-tilizer Effects on Soil Phosphorus Availability. Chemosphere, 244, Article ID: 125471. https://doi.org/10.1016/j.chemosphere.2019.125471
- 12. Xu, X., Cao, X. and Zhao, L. (2013) Comparison of Rice Husk- and Dairy Manure-Derived Biochars for Simultaneously Removing Heavy Metals from Aqueous Solutions: Role of Mineral Components in Biochars. Chemosphere, 92, 955-961. https://doi.org/10.1016/j.chemosphere.2013.03.009
- 13. Tan, C., Zhou, Z., Han, R., et al. (2015) Adsorption of Cadmium by Biochar Derived from Municipal Sewage Sludge: Impact Factors and Adsorption Mechanism. Chemo-sphere, 134, 286-293. https://doi.org/10.1016/j.chemosphere.2015.04.052
- 14. Zied, E.E.A. (2018) Phosphorus Dynamics and Corn Growth under Applications of Corn Stalks Biochar in a Clay Soil. Arabian Journal of Geosciences, 11, 379. https://doi.org/10.1007/s12517-018-3719-8
- 15. Ahmad, M., Usman, A.R.A., Al-Faraj, A.S., et al. (2018) Phos-phorus-Loaded Biochar Changes Soil Heavy Metals Availability and Uptake Potential of Maize (Zea mays L.) Plants. Chemosphere, 194, 327-339. https://doi.org/10.1016/j.chemosphere.2017.11.156
- 16. Cao, X. and Harris W. (2010) Properties of Dairy-Manure-Derived Biochar Pertinent to Its Potential Use in Remediation. Bioresource Technology, 101, 5222-5228. https://doi.org/10.1016/j.biortech.2010.02.052
- 17. Lu, H., Zhang, W., Yang, Y., et al. (2012) Relative Distribution of Pb2+ Sorption Mechanisms by Sludge-Derived Biochar. Water Research, 46, 854-862. https://doi.org/10.1016/j.watres.2011.11.058
- 18. Huang, W. and Chen, B. (2010) Interaction Mechanisms of Organic Contaminants with Burned Straw Ash Charcoal. Journal of Environmental Sciences, 22, 1586-1594. https://doi.org/10.1016/S1001-0742(09)60293-X
- 19. 常西亮, 胡雪菲, 蒋煜峰, 等. 不同温度下小麦秸秆生物炭的制备及表征[J]. 环境科学与技术, 2017, 40(4): 24-29.
- 20. Spokas, K.A., Novak, J.M. and Venterea, R.T. (2012) Biochar’s Role as an Alternative N-Fertilizer: Ammonia Capture. Plant and Soil, 350, 35-42. https://doi.org/10.1007/s11104-011-0930-8
- 21. 吴诗雪, 王欣, 陈灿, 等. 凤眼莲、稻草和污泥制备生物炭的特性表征与环境影响解析[J]. 环境科学学报, 2015, 35(12): 4021-4032.
- 22. 郭文娟. 生物炭对镉污染土壤的修复效应及其环境影响行为[D]: [硕士学位论文]. 北京: 中国农业科学院, 2013.
- 23. Ghaffar, A., Ghosh, S., Li, F., et al. (2015) Effect of Biochar Aging on Surface Characteristics and Adsorption Behavior of Dialkyl Phthalates. Envi-ronmental Pollution, 206, 502-509. https://doi.org/10.1016/j.envpol.2015.08.001
- 24. Angst, T., et al. (2013) Es-tablishing Release Dynamics for Plant Nutrients from Biochar. GCB Bioenergy, 5, 221-226. https://doi.org/10.1111/gcbb.12023
- 25. 郑春荣, 陈怀满, 周东美, 等. 土壤中积累态磷的化学耗竭[J]. 应用生态学报, 2002, 13(5): 559-563.
- 26. Song, J.F., Liu, X.P., Sun, J.B., et al. (2015) Sustained Release and the Kinetics of Phosphorus from Dark Brown Forest Soils by Organic Acids. Journal of Beijing Forestry University, 2015, 37(10): 1-8.
- 27. Luo, F., Song, J., Dong, M.G., et al. (2014) Characterization of Contaminants in Rapeseed Cake-Derived Biochars and Evaluation of Their Suitability for Soil Improvement. Research of Environmental Sciences, 27, 1292-1297.
- 28. 沈露露, 范玉超, 张雪, 等. 水稻秸秆生物炭中铜和镉的形态分布及释放特性[J]. 环境科学研究, 2020, 33(9): 2148-2155.
- 29. Chen, X., Chen, G., Chen, L., et al. (2011) Adsorption of Copper and Zinc by Biochars Produced from Pyrolysis of Hardwood and Corn Straw in Aqueous Solution. Bioresource Technology, 102, 8877-8884. https://doi.org/10.1016/j.biortech.2011.06.078
- 30. 郭文娟, 梁学峰, 林大松, 等. 土壤重金属钝化修复剂生物炭对镉的吸附特性研究[J]. 环境科学, 2013, 34(9): 3716-3721.
- 31. Borgnino, L. (2013) Experimental Determination of the Colloidal Stability of Fe(III)-Montmorillonite: Effects of Organic Matter, Ionic Strength and pH Conditions. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 423, 178-187. https://doi.org/10.1016/j.colsurfa.2013.01.065
- 32. Chowdhury, I., Mansukhani, N.D., Guiney, L.M., et al. (2015) Aggregation and Stability of Reduced Graphene Oxide: Complex Roles of Divalent Cations, pH, and Natural Organic Matter. Environmental Science & Technology, 49, 10886-10893. https://doi.org/10.1021/acs.est.5b01866
- 33. Zhou, Q., et al. (2018) Adsorption of Cu(II) and Cd(II) from Aqueous Solutions by Ferromanganese Binary Oxide-Biochar Composites. Science of the Total Environment, 615, 115-122. https://doi.org/10.1016/j.scitotenv.2017.09.220
- 34. Cha, J.S., Park, S.H., Jung, S.-C., et al. (2016) Production and Utilization of Biochar: A Review. Journal of Industrial and Engineering Chemistry, 40, 1-15. https://doi.org/10.1016/j.jiec.2016.06.002
- 35. 周丹丹, 屈芳舟, 吴敏, 等. 植物根际分泌有机酸对生物炭吸附Pb(II)的影响[J]. 中国环境科学, 2019, 39(3): 1199-1207.
- 36. Qin, J., Li, Q., Liu, Y., et al. (2020) Biochar-Driven Reduction of As(V) and Cr(VI): Effects of Pyrolysis Temperature and Low-Molecular-Weight Organic Acids. Ecotoxicology and Environmental Safety, 201, Article ID: 110873. https://doi.org/10.1016/j.ecoenv.2020.110873
- 37. Huang, L.B., et al. (2016) Copper and Zinc Adsorption by Softwood and Hardwood Biochars under Elevated Sulphate-Induced Salinity and Acidic pH Conditions. Chemosphere: Environmental Toxicology and Risk Assessment, 142, 64-71. https://doi.org/10.1016/j.chemosphere.2015.06.079
- 38. Tan, Z., Yuan, S., Hong, M., et al. (2019) Mechanism of Negative Surface Charge Formation on Biochar and Its Effect on the Fixation of Soil Cd. Journal of Hazardous Mate-rials, 384, Article ID: 121370. https://doi.org/10.1016/j.jhazmat.2019.121370
- 39. Yuan, S., Hong, M., Li, H., et al. (2020) Contributions and Mechanisms of Components in Modified Biochar to Adsorb Cadmium in Aqueous Solution. Science of the Total En-vironment, 733, Article ID: 139320. https://doi.org/10.1016/j.scitotenv.2020.139320
- 40. Gao, R., Fu, Q., Hu, H., et al. (2019) Highly-Effective Re-moval of Pb by Co-Pyrolysis Biochar Derived from Rape Straw and Orthophosphate. Journal of Hazardous Materials, 371, 191-197. https://doi.org/10.1016/j.jhazmat.2019.02.079
