Software Engineering and Applications
Vol.
11
No.
04
(
2022
), Article ID:
54383
,
10
pages
10.12677/SEA.2022.114075
基于可穿戴设备的血糖数据采集、处理和预测研究综述
刘赛赛,杨观赐
贵州大学现代制造技术教育部重点实验室,贵州 贵阳
收稿日期:2022年6月15日;录用日期:2022年7月27日;发布日期:2022年8月4日

摘要
随着我国人口老龄化形式日益严峻,糖尿病已经成为危害老年人身体健康的重要因素,而血糖检测是血糖管控的重要手段,目前,基于可穿戴设备采集血糖数据,利用人工智能技术实现血糖预测是未来发展的趋势。本文首先从血糖数据采集方式展开综述,分别介绍了侵入式和接触式采集的特点,其次论述了可穿戴设备血糖数据预处理方法,并分析了其优缺点,然后对国内外血糖预测技术进行总结,最后探讨了基于可穿戴设备的血糖数据采集、处理和预测技术所面临的问题以及未来的发展趋势。
关键词
可穿戴设备,血糖数据采集,血糖数据预处理,血糖预测

A Review of Research on Blood Glucose Data Collection, Processing and Prediction Based on Wearable Devices
Saisai Liu, Guanci Yang
Key Laboratory of Advanced Manufacturing Technology of the Ministry of Education, Guizhou University, Guiyang Guizhou
Received: Jun. 15th, 2022; accepted: Jul. 27th, 2022; published: Aug. 4th, 2022

ABSTRACT
With the increasingly severe form of population aging in my country, diabetes has become an important factor that endangers the health of the elderly, and blood sugar detection is an important means of blood glucose control. Based on wearable devices to collect blood glucose data and use artificial intelligence technology to achieve blood glucose prediction is the future development trend. This paper firstly summarizes the methods of blood glucose data collection, introduces the characteristics of invasive and contact collection, and then discusses the preprocessing method of blood glucose data of wearable devices, and analyzes its advantages and disadvantages, and then summarizes the domestic and foreign blood glucose prediction technologies, and finally discusses the problems and future development trends of blood glucose data collection, processing and prediction technology based on wearable devices.
Keywords:Wearable Device, Blood Glucose Data Collection, Blood Glucose Data Preprocessing, Blood Glucose Prediction

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来,随着传感器技术的发展,血糖检测方式发生巨大改变,具体表现为,1) 由单点检测变为连续动态检测,即有便携式血糖检测设备血糖检测变为可穿戴设备连续血糖监测;2) 由直接检测变为间接检测,即由直接取血检测变为由组织液,体液等其他生理信号进行预测。与血糖检测技术相比,血糖预测则使用机器学习和深度学习可以挖掘血糖数据内在的信息,从而更好的估计和理解当前血糖变化的趋势,以对当下和未来的情况做出预判,成为广大学者的研究热点 [1] [2] [3]。血糖预测主要依靠大量的血糖数据训练出血糖预测模型以对高血糖和低血糖事件预警,其具体包含以下步骤:首先获取血糖数据,其次通过数据预处理技术对血糖数据进行异常值检测和缺失值填补,然后建立血糖预测模型,最后通过输入生理数据到模型中实现对未来一段时间的血糖预测。血糖数据是预测的基础,而血糖预测是实现血糖管控的桥梁,因此,本文着重探讨血糖数据的采集技术、数据预处理技术和血糖预测技术,并分别分析它们的优缺点以及发展趋势。
2. 血糖数据采集技术
根据检测是否给患者带来创口,其检测方式可以分为有创,无创,微创。其中,有创是传统的指尖采血检测,它往往是通过便携式血糖仪进行单点检测,检测较为准确,但操作过程麻烦,而且不能获得连续的血糖变化,此外,频繁的指尖取血会给患者带来痛苦,导致他们常用抵触的心理。微创常用葡萄糖传感器植入皮肤体内,根据皮肤外表面的接受器获得血糖信号,优点是能够获得连续的血糖变化,但是由于组织液内的葡萄糖含量较少,血液中的葡萄糖在向组织液中扩散中需要一定的时间,因此依据此种方式获得的血糖值具有时滞性,此外,由于人体活动、环境变化以及人体内异物反应,会导致传感器发生故障,因此需要定期的更换体内的传感器。而无创多采用体液,光谱和能量守恒的方法进行血糖测量,其目前大部分处于实验阶段,只能作为血糖检测的辅助方法。根据血糖检测设备的佩戴方式,其又可以分为基于侵入式的可穿戴设备的血糖检测和接触式的可穿戴设备的血糖检测。
2.1. 基于侵入式的可穿戴设备的血糖数据采集
侵入型的可穿戴设备主要由皮下所植入的血糖测量传感器和位于皮肤表面的发射器组成,然后通过无线传输单元将血糖数据发送到移动终端。根据传感器外形结构特征可以将其分为单针一体式和多针分体式,目前,传感器多以微针的形式植入皮下, 通过组织间质液检测经代谢产生的葡萄糖。相较于直接采血的方式,微针因其较小的尺寸大大降低了患者的疼痛感。在早期的研究中,Shichir [4] 等人开发了一种带有针型血糖传感器的无线血糖监测系统,能够连续工作77小时,对植入式可穿戴设备的发展起到了推动作用,Sharma S [5] 等人将固体微针阵列修饰成葡萄糖传感器,如图1(a)所示,并将其置于皮下组织液中,可用于连续检测血糖浓度。随后,中山大学团队 [6] 研制出集血糖检测和治疗的可穿戴一体化系统,见图1(c),该系统通过微针穿刺皮肤,结合离子电渗疗技术,增强葡萄糖的提取效率和胰岛素的传输效率。蒲治华 [7] 团队研制出穿戴式柔性表皮电化学葡萄糖传感器贴片,见图1(b),与前者不同的是,该贴片使用一种热激活的方式提高间质液的葡萄糖的提取效率,使用差分结构的电化学传感器能消除汗液对血糖检测的影响。东京大学团队 [8] 研制出一种廉价、一次性和可生物降解的微针贴片传感器,见图1(d),将可降解的微针和葡萄糖置于贴片两侧,通过细胞间质液,可实现持续测量血糖。
 (a) 微针阵列葡萄糖传感器
(a) 微针阵列葡萄糖传感器
 (b) 葡萄糖传感器贴片
(b) 葡萄糖传感器贴片
 (c) 可穿戴诊疗一体化系统
(c) 可穿戴诊疗一体化系统
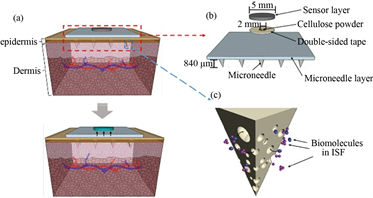 (d)微针贴片传感器
(d)微针贴片传感器
Figure 1. Microneedle-based wearable blood glucose detection device
图1. 基于微针的可穿戴血糖检测设备
近年来,各大医疗公司致力于推动可穿戴血糖检测设备从实验室走向市场。其中,ECHO Therapeutics公司针对住院患者开发了一款Symphony可穿戴设备,如图2(a)所示,其形状类似于硬币,通过抽取皮肤内组织液进行连续血糖监测,并通过wifi和蓝牙将其传输至移动终端,但其传感器探头仅有24小时的使用寿命。雅培公司研制的Free Style Libre 2血糖监测仪可通过微型针头固定在手臂外侧,见图2(b),不同的是需要手持血糖扫描器对数据进行读取,可观的是,传感器可在体内工作两周左右 [9]。类似的还有德康公司的G6血糖监测系统 [10],如图2(c),可连续进行90天血糖监测的Eversense CGM系统,如图2(d)。
然而,在实际应用中,为了反映真实的血糖水平,需要考虑组织液中的血糖值的时滞性,因为组织间液中与血液之间的葡萄糖扩散达到平衡需要一定的时间,据研究表明,相比于血液,组织液中的葡萄糖浓度滞后时间为4分钟到26分钟不等 [11]。此外还需要考虑,人体在日常活动、环境因素对传感器误差造成的影响。传感器误差可以归纳为3个部分 [12],即由血液中葡萄糖到组织间液葡萄糖之间的动力学因素引起的误差,传感器校准误差和环境噪声。其中,因校准因子的估计不足而导致的误差是误差主要来源部分。而对传感器背景电流的估计失准是产生校准误差的主要因素,其会影响对低血糖的估计,在葡萄糖发生波动时,葡萄糖在血液和组织液中的扩散会发生严重滞后,从而导致对低血糖的漏检。此外,除了来自环境和日常活动对传感器产生的误差之外,患者之间的个体差异也是不能忽略的因素。传感器工艺、微针的安装位置、皮肤厚度、组织间液内的生物化学反应等都会影响传感器的血糖检测性能和使用寿命。另外,葡萄糖氧化酶的活性对温度比较敏感,从而影响葡萄糖的分解和转化,进而使得检测结果具有差异性。
 (a) Symphony
(a) Symphony
 (b) Free Style Libre Flash
(b) Free Style Libre Flash
 (c) G6
(c) G6
 (d) Eversense CGM
(d) Eversense CGM
Figure 2. Invasive wearable blood glucose monitoring device
图2. 侵入式可穿戴血糖检测设备
2.2. 基于接触式的可穿戴设备的血糖数据采集
为了减少侵入式血糖检测传感器给人体带来的创伤,一些研究学者和医疗公司研发了接触式可穿戴设备用于血糖检测。2000年,Mendosa [13] 公司研制出一款手表式可穿戴血糖检测设备GlucoWatch,如图3(a),其通过产生微电流将皮下组织中的带电离子迁移至体表,根据带电离子量来推算葡萄糖浓度。此后,Hanna等人 [14] 设计出一种柔性可穿戴传感器,可通过调整电磁波以达到对血液中血糖的监测。美国C8 MediSensors公司 [15] 研发一款腰带式血糖仪HG1-c,见图3(b),其利用拉曼光谱技术,根据光的吸收量来推算血糖浓度。近年来,随着新兴材料技术的发展,一些研究者尝试将其用于血糖传感器材料的制备,Lee [16] 等人使用石墨烯技术开发制造的手腕贴膜片,其利用传感器探测汗液中的葡萄糖含量和pH值,再结合体温从而计算出病人血液中的葡萄糖水平。Zhu [17] 等人研制出一种腕带式可穿戴无酶葡萄糖传感器,见图3(c),其主要工作是在电极上覆盖氟碳基材料,然后通过检测皮肤表面汗液中的葡萄糖实现对血糖浓度的监测,另一个研究团队 [18] 使用开发了一款可穿戴的血糖监测设备,其主要利用石墨烯的导电性和镍的葡萄糖敏感性,通过与人体稳定连接来达到血糖监测的目的。此外,如图3(d),谷歌团队 [19] 利用机器视觉技术研制出一种用于血糖监测的智能眼镜,其主要通过生物传感器检测泪液已获得血糖浓度,但是这种通过泪液获得的葡萄糖浓度与血液中的葡萄糖浓度相比仍然具有一定的时滞性,此外还存在检测准确度较低,样本收集困难等问题。
理论上,这种与皮肤接触,通过体液来获取血糖浓度的方式不如侵入式精确,除了存在测算滞后现象外,环境因素,运动,心理变化,身体差异等都会影响血糖的检测,但是其未对皮肤造成创伤,而且设备佩戴方便,具有巨大的市场价值,但对测量的准确度和灵敏度就有了更高的要求。目前,接触式生物传感器测量与真实值有一定的误差,但可以用于医用的辅助检测。
 (a) GlucoWatch
(a) GlucoWatch
 (b) 可穿戴血糖仪HG1-c
(b) 可穿戴血糖仪HG1-c
 (c) 腕带式可穿戴无酶葡萄糖传感器
(c) 腕带式可穿戴无酶葡萄糖传感器
 (d)Google智能眼镜
(d)Google智能眼镜
Figure 3. Contact wearable blood glucose detection device
图3. 接触式可穿戴血糖检测设备
3. 血糖数据处理技术
不同于传统的便携式血糖仪由毛细血管直接检测,可穿戴设备则通过体液和组织间液间接检测,传感器检测环境存在不稳定环境因素,而且这一过程常持续数小时或者数天,此外,血糖数据在采集的过程中会发生数据丢失和数据异常等现象,其会导致后续血糖预测出现偏差,甚至会得出错误的结论,不利于对血糖水平进行决策,因此提前对血糖数据预处理是进行时间序列数据挖掘的首先执行的步骤。根据预处理方式的不同,可以分为基于误差产生原因的数据预处理和基于数据驱动的数据预处理。
3.1. 基于误差产生原因的数据预处理
Breton [20] 等人用一个单室模型来模拟葡萄糖传感器的状态,认为血糖数据异常是由传感器校准、血液到间质液的动态变化和环境噪声引起的,以至于后来处理传感器故障时都是集中在这几个方面展开研究,考虑到传感器误差具有高度依赖性,使用固定时间常数的一阶线性模型模拟BG-IG动力学引起的误差,使用自回归移动平均(AR)模型描述测量噪声;然而,时间不变的模型参数不适用于血液到间质的动态变化,因此Lunn [21] 等人将BG-IG动力学的模型的时间常数设计成个性化的,而且引入了一个基于线性回归的简单校准误差模型。基于此,Facchinetti [22] 等人在校准误差模型做了改进,使用了时间变量函数代替线性回归。Vettoretti [23] 所设计CGM误差模型结合了一阶线性动态模型来描述血浆-间质动力学,二阶多项式模型来描述校准误差,以及用一个自回归模型来描述测量噪声,将校准周期扩展到传感器整个寿命,减少了校准误差的发生,但是这些模型都是基于传感器稳态运行条件下的检测,未加入模型的随机因素,Jia [24] 使用数字滤波器来减少由采样和测量误差引起的不确定性。Andrea [25] 等人建立了一个非线性葡萄糖/胰岛素/膳食动态模型,采用无痕卡尔曼滤波器用于非线性模型的状态和参数估计,开发了主成分分析模型并用来检测动态变化。然而此类基于原因所建的误差模型,往往要考虑很多因素,稳定性较差,只能适用于特定的传感器。
3.2. 基于数据驱动的数据预处理方法
基于异常值产生原因的检测,常常要考虑BG-IG动态变化、校准误差和随机噪声,所建模型多为组合型模型,特别是考虑了人的生理变化和环境的随机性,导致模型稳定性较差且仅适用于特殊的传感器。与基于异常值产生原因的检测不同,基于数据驱动的误差检测只需要历史数据就能估计测量值与真实值之间的差距,然后判断是否超过阈值就可以完成异常检测。
早期的研究中使用小波 [26] 用于数据的异常检测,但是基于小波方法的检测效果受限于误差程度的大小。文献 [27] [28] 通过卡尔曼滤波预测的血糖值与采样值对比来进行判断,然而卡尔曼滤波的参数以及对应判断准则的设置都会影响到最终的检测结果,此外,传感器在较长时间下会出现误差累计导致后期检测效果较差。Leala等人 [29] 使用主成分分析方法用于异常值检测,当原始数据之间存在共线现象时,其由于不能有效消除重叠信息而表现不佳。此外还有使用自回归移动平均模型 [30] 估计下一时刻的血糖值,通过误差阈值来检测异常值,但是此类基于数据驱动的异常检测严重依赖大量的历史数据,其预测精度对数据集的大小和分布很敏感。
相比之下,作为一种无监督的学习方法,聚类不需要对样本进行标记就可以揭示数据内在的性质和规律。文献 [31] [32] 使用一种k-medoids聚类算法对异常值检测,且检测效果具有显著的竞争力,但是此类算法需要在集合中随机选择k个数据样本作为簇族的中心点,使的算法每次的聚类结果具有一定的差异。DBSCAN聚类算法结果比较稳定,广泛应用于各种领域 [33] [34],但是需要先验知识去设置邻域参数(ε, MinPts)。
4. 血糖预测技术
血糖预测是用来血糖控制的桥梁,对于未来的血糖管理起到重要的作用。就目前来看,可穿戴设备的监测值,相较于实际血糖值有一定的时间差,对于病人及时发现高低血糖并采取治疗措施产生不利影响。因为胰岛素注射和碳水化合物的摄入和吸收需要一定的时间,显然,由可穿戴设备检测出的血糖值不能满足要求。而准确的血糖预测可以有效避免异常血糖事件的发生,其可以在未来的血糖预判和治疗产生积极地作用。血糖预测模型主要分为生理建模和数据驱动建模两大类,近年来血糖的预测工作大多集中在基于生理模型预测和通过机器学习建模预测来实现。
4.1. 基于生理模型的血糖预测
所谓的生理模型 [3] 就是运用生理知识模拟患者体内葡萄糖代谢,胰岛素和碳水化合物等人体内的生物反应。然而生理模型的一个主要缺点是完全依赖于个人的生理机制,所建模型不具有普适性,此外还需要先验知识来调整模型生理参数 [35]。
根据生理模型的复杂度可以分为最小模型和最大模型,最小模型描述了胰岛素对血糖消耗的影响以及血糖与胰岛素释放的关系。1984年,Bergman [36] 等人提出了一个小型非线性三阶模型以预测葡萄糖静脉耐量实验的血糖浓度响应。随后同团队的Cobelli [37] 等人又对其进行了改进,并从生理角度比较了房室模型和非房室模型,突出了房室方法更合理的生理建模优势。Sorensen [38] 等人根据人体内葡萄糖代谢建立了多分室模型,包括肝脏,大脑,肠胃以及组织等,通过量化各分室模型参数来调高血糖浓度的预测能力。2004年,Hovorka [39] 等人通过外源输入胰岛素注射速率,碳水化合物的摄入量和摄入时间,根据葡萄糖-胰岛素代谢模型,计算出血液中的胰岛素和葡萄糖含量,随后,Wilinska [40] 等人在此模型的基础上,研究了胰岛素的注射速率和注射位置对葡萄糖的降解的影响。而最大模型则兼顾了生理系统中已知的病理和药理信息,并将人体的葡萄和胰岛素的代谢过程进行细分用以描述血糖调节机理,DallaMa [41] 团队采用三重示踪技术采集204位健康对象的生理数据,对人体各个部位发热葡萄糖吸收速、内源性葡萄糖转化、葡萄糖代谢和胰岛素分泌等进行估算,根据平均数据拟合得到模型中的未知参数。Roy [42] 等人考虑了葡萄糖,蛋白质和游离脂肪酸建立了混合膳食模型。
生理模型本身较为复杂,参数众多,从临床实验中收集数据来建立生理模型难度较大,因此相比于数据驱动的血糖预测方法,采用生理模型进行血糖预测的较少。
4.2. 基于数据驱动的血糖预测
与生理模型不同,数据驱动模型仅关注病人的历史数据,摒弃了基于人体的生理不确定因素,往往能达到更好的预测结果。Eren-Oruklu [43] 等人提出了一种基于ARMA模型的自适应单变量模型以预测高血糖或低血糖事件,这种使用单一的历史数据对当前状态进行预测,模型不具有稳定性,因此使用多变量来预测能够降低对单一数据的依赖。Georga [44] 等人提出了一种递归多变量核自适应滤波方法,用于个性化血糖短时预测。随后,Wang [45] 等人证实了胰岛素剂量和膳食摄入量对血糖波动具有一定的影响,基于此,一些研究将日常事件,如葡萄糖、胰岛素、膳食和运动等因素融入到模型中使其对单个变量的依赖性降低,虽然此类模型提高了预测的准确率,但是稳定性较差。
实践证明 [46] 仅仅使用一种特定的方法来预测血糖会产生片面的结果,而将各种预测方法结合起来可以发挥各自的优势,使预测结果达到最优。文献 [28] 使用了一种堆叠式LSTM的深度循环神经网络模型用于血糖预测,与单一的LSTM相比,扩张了输入数据的长度,但是LSTM只能获取数据从前向后的特征而不能获取从后向前的特征,而BiLSTM能够弥足这一缺点,因此另一篇研究 [47] 使用BiLSTM层来预测血液不同范围的葡萄糖水平,与单一的LSTM相比预测精度更高。此外,为了扩大CNN网络输入数据的深度,有学者 [48] [49] [50] 提出了一种深度DCNN网络,通过扩张卷积来处理多维度的长信号,其性能优于浅层网络。Xie [28] 等人使用TCN(DCNN网络的一种变体)网络预测BG水平,并评估了LSTM、ARX和SVR等模型的预测性能发现TCN在BG轨迹表现更加稳健。文献 [50] 开创性的提出了CNN与LSTM的结合,在预测的精度上有惊人的表现。
5. 展望
尽管基于可穿戴设备的血糖数据的采集、处理和预测技术取得飞跃的发展,但仍然存在一些问题阻碍其进一步的发展,目前面临的问题主要存在以下3个方面。
1) 对于可穿戴设备血糖数据的采集,由于侵入式设备因要将传感器植入患者体内,常常面临着环境复杂多变,个体差异等不利因素,其稳定性和准确性不能达到临床应用的标准,而接触式设备则通过血液的替代物(汗液、泪液等体液)进行检测,其准确度较低,仍处于实验阶段,因此,开发对葡萄糖具有较高敏感性的材料,设计具有较高稳定性的血糖传感器是可穿戴设备未来发展的方向。
2) 对于血糖数据的预处理,基于误差产生原因的预处理,往往要考虑很多因素(胰岛素、葡萄糖、碳水化合物吸收等),需要动态调整模型参数而导致稳定性较差,只能适用于特定的传感器。而基于数据驱动的有监督学习方法常需要有标签的数据进行训练,才能发现异常数据,因此,如何对数据进行相似性度量,利用数据本身的特点进行异常值分类值得研究和探讨。
3) 对于血糖预测,基于生理模型的预测大多数都是仅考虑单因素,其预测精度和稳定性难以保证;而基于数据驱动的预测往往仅使用一种特定的方法来预测血糖会产生片面的结果,因此,使用集成学习的方法,构建多模型和多数据驱动的方法往往是预测精度达到最优。
6. 结语
血糖数据是血糖预测的基础,其质量的好坏往往影响预测模型的精度,从而不利于血糖的管控。文中围绕基于可穿戴设备的血糖采集、处理和预测技术最新进展,对其进行总结和分类,并分析了不同技术的优缺点,此外还讨论了可穿戴设备的血糖采集、数据处理和血糖预测在未来应用中需要解决的问题,助力其在未来创新与应用。
文章引用
刘赛赛,杨观赐. 基于可穿戴设备的血糖数据采集、处理和预测研究综述
A Review of Research on Blood Glucose Data Collection, Processing and Prediction Based on Wearable Devices[J]. 软件工程与应用, 2022, 11(04): 721-730. https://doi.org/10.12677/SEA.2022.114075
参考文献
- 1. Zhang, Y., Sun, J., Liu, L., et al. (2021) A Review of Biosensor Technology and Algorithms for Glucose Monitoring. Journal of Diabetes and its Complications, 35, Article ID: 107929. https://doi.org/10.1016/j.jdiacomp.2021.107929
- 2. Hidalgo, J., Colmenar, J., Kronberger, G., et al. (2017) Data Based Prediction of Blood Glucose Concentrations Using Evolutionary Methods. Journal of Medical Systems, 41, 1-20. https://doi.org/10.1007/s10916-017-0788-2
- 3. Oviedo, S., Vehí, J., Calm, R., et al. (2017) A Review of Per-sonalized Blood Glucose Prediction Strategies for T1DM Patients. International Journal for Numerical Methods in Biomedical Engineering, 33, Article ID: e2833. https://doi.org/10.1002/cnm.2833
- 4. Motoaki, S., Nobuyuki, A., Yoshimitsu, Y., et al. (1986) Telemetry Glucose Monitoring Device with Needle-Type Glucose Sensor: A Useful Tool for Blood Glucose Monitoring in Diabetic Individuals. Diabetes Care, 9, 298-301. https://doi.org/10.2337/diacare.9.3.298
- 5. Sanjiv, S., Reddy, M. and Jugnee, N. (2018) A Pilot Study in Humans of Microneedle Sensor Arrays for Continuous Glucose Monitoring. Analytical Methods, 10, 2088-2095. https://doi.org/10.1039/C8AY00264A
- 6. Li, X., Huang, X. and Mo, J. (2021) A Fully Integrated Closed-Loop System Based on Mesoporous Microneedles-Iontophoresis for Diabetes Treatment. Advanced Science, 8, Article ID: e2100827. https://doi.org/10.1002/advs.202100827
- 7. Pu, Z., Zhang, X., Yu, H., et al. (2021) A Thermal Activated and Differential Self-Calibrated Flexible Epidermal Biomicrofluidic Device for Wearable Accurate Blood Glucose Monitoring. Science Advances, 7, Article ID: eabd0199. https://doi.org/10.1126/sciadv.abd0199
- 8. Hakjae, L., Bonfante, G., Sasaki, Y., et al. (2020) Porous Microneedles on a Paper for Screening Test of Prediabetes. Medical Devices & Sensors, 3, Article ID: e10109. https://doi.org/10.1002/mds3.10109
- 9. Bidonde, J., Fagerlund, B.C., Frønsdal, K.B., et al. (2005) FreeStyle Libre Flash Glucose Self-Monitoring System: A Single-Technology Assessment. https://www.ncbi.nlm.nih.gov/books/NBK482068/
- 10. Dexcom (n.d.) Dexcom Continuous Glucose Monitoring. https://www.dexcom.com/g6-cgm-system
- 11. Mazze, R.S., Strock, E., Borgman, S., et al. (2009) Evaluating the Accuracy, Reliability, and Clinical Applicability of Continuous Glucose Monitoring (CGM): Is CGM Ready for Real Time? Diabetes Diabetes Technology & Therapeutics, 11, 11-18. https://doi.org/10.1089/dia.2008.0041
- 12. Sparacino, G., Facchinetti, A., Cobelli, C., et al. (2010) “Smart” Con-tinuous Glucose Monitoring Sensors: On-Line Signal Processing Issues. Sensors, 10, 6751-6772. https://doi.org/10.3390/s100706751
- 13. Tierney, M., Tamada, J.A., Potts, O.R., et al. (2000) The Gluco Watch Biographer: A Frequent Automatic and Noninvasive Glucose Monitor. Annals of Medicine, 32, 632-641. https://doi.org/10.3109/07853890009002034
- 14. Hanna, J., Bteich, M., Tawk, Y., et al. (2020) Noninvasive, Wearable, and Tunable Electromagnetic Multisensing System for Continuous Glucose Monitoring, Mimicking Vascu-lature Anatomy. Science Advances, 6, Article No. a5320. https://doi.org/10.1126/sciadv.aba5320
- 15. Lipson, J., Bernhardt, J., Block, U., et al. (2009) Non-Invasive Technologies for Glucose Monitoring: Requirements for Calibration Innoninvasive Glucose Monitoring by Raman Spectroscopy. Journal of Diabetes Science and Technology, 3, 233-241. https://doi.org/10.1177/193229680900300203
- 16. Lee, H., Choi, T., Lee, Y.B., et al. (2016) A Graphene-Based Electrochemical Device with Thermoresponsive Microneedles for Diabetes Monitoring and Therapy. Nature Nano-technology, 11, 566-572. https://doi.org/10.1038/nnano.2016.38
- 17. Zhu, X., Ju, Y., Chen, J., et al. (2018) Nonenzymatic Wearable Sensor for Electrochemical Analysis of Perspiration Glucose. ACS Sensors, 3, 1135-1141. https://doi.org/10.1021/acssensors.8b00168
- 18. Zhu, J., Liu, S., Hu, Z., et al. (2021) Laser-Induced Graphene Non-Enzymatic Glucose Sensors for On-Body Measurements. Biosensors and Bioelectronics, 193, Article ID: 113606. https://doi.org/10.1016/j.bios.2021.113606
- 19. 孙甬. 揭秘谷歌测血糖隐形眼镜内置上万天线[DB/OL]. https://ihealth.dxy.cn/article/67286, 2022-8-1.
- 20. Breton, M. and Kovatchev, B. (2008) Analysis, Modeling, and Simulation of the Accuracy of Continuous Glucose Sensors. Journal of Diabetes Science and Technology, 2, 853-862. https://doi.org/10.1177/193229680800200517
- 21. Lunn, D., Wei, C., Hovorka, R., et al. (2011) Fitting Dynamic Models with Forcing Functions: Application to Continuous Glucose Monitoring in Insulin Therapy. Statistics in Medicine, 30, 2234-2250. https://doi.org/10.1002/sim.4254
- 22. Facchinetti, A., Del Favero, S., Sparacino, G., et al. (2015) Model of Glucose Sensor Error Components: Identification and Assessment for New Dexcom G4 Generation Devices. Medical & Biological Engineering & Computing, 53, 1259-1269. https://doi.org/10.1007/s11517-014-1226-y
- 23. Vettoretti, M., Battocchio, C., Sparacino, G., et al. (2019) De-velopment of an Error Model for a Factory-Calibrated Continuous Glucose Monitoring Sensor with 10-Day Lifetime. Sensors, 19, Article No. 5320. https://doi.org/10.3390/s19235320
- 24. Jia, Z., Huang, L., Liu, H., et al. (2020) Design of a Real-time Self-adjusting Calibration Algorithm to Improve the Accuracy of Continuous Blood Glucose Monitoring. Applied Bi-ochemistry and Biotechnology, 190, 1163-1176. https://doi.org/10.1007/s12010-019-03142-7
- 25. Turksoy, K., Roy, A., Cinar, A., et al. (2017) Real-Time Mod-el-Based Fault Detection of Continuous Glucose Sensor Measurements. IEEE Transactions on Biomedical Engineering, 64, 1437-1445. https://doi.org/10.1109/TBME.2016.2535412
- 26. Quan, S., Qin, J., Doniger, K., et al. (2010) Online Dropout Detection in Subcutaneously Implanted Continuous Glucose Monitoring. Proceedings of the 2010 American Control Conference, Baltimore, 30 June-2 July 2010, 4373-4378. https://doi.org/10.1109/ACC.2010.5530788
- 27. Rabby, M., Tu, Y., Hossen, M., et al. (2021) Stacked LSTM Based Deep Recurrent Neural Network with Kalman Smoothing for Blood Glucose Prediction. BMC Medical Infor-matics and Decision Making, 21, Article No. 101. https://doi.org/10.1186/s12911-021-01462-5
- 28. Xie, J. and Wang, Q. (2020) Benchmarking Machine Learning Algorithms on Blood Glucose Prediction for Type I Diabetes in Comparison with Classical Time-Series Models. IEEE Transactions on Biomedical Engineering, 67, 3101-3124. https://doi.org/10.1109/TBME.2020.2975959
- 29. Leala, Y., Ruizb, M., Lorencio, C., et al. (2013) Principal Component Analysis in Combination with Case-Based Reasoning for Detecting Therapeutically Correct and Incorrect Measurements in Continuous Glucose Monitoring Systems. Biomedical Signal Processing and Control, 8, 603-614. https://doi.org/10.1016/j.bspc.2013.05.008
- 30. Meneghetti, L., Facchinetti, A., Favero, S., et al. (2021) Model-Based Detection and Classification of Insulin Pump Faults and Missed Meal Announcements in Artificial Pancreas Systems for Type 1 Diabetes Therapy. IEEE Transactions on Biomedical Engineering, 68, 170-180. https://doi.org/10.1109/TBME.2020.3004270
- 31. Xia, Y., Sun, X., Zhao, Y., et al. (2020) Fault Detection of Continuous Glucose Measurements Based on Modified k-Medoids Clustering Algorithm. Neural Computing and Applications. https://doi.org/10.1007/s00521-020-05432-2
- 32. 周玉, 朱文豪, 房倩, 白磊. 基于聚类的离群点检测方法研究综述[J]. 计算机工程与应用, 2021, 57(12): 37-45.
- 33. Angkhawey, U. and Muangsin, V. (2018) Detecting Points of Interest in a City from Taxi GPS with Adaptive DBSCAN. 2018 7th ICT International Student Project Conference (ICT-ISPC), Nakhonpathom, 11-13 July 2018, 1-6. https://doi.org/10.1109/ICT-ISPC.2018.8523966
- 34. Lim, S., Lee, S., Kim, S., et al. (2018) Clustering of Detected Targets Using DBSCAN in Automotive Radar Systems. 2018 19th International Radar Symposium (IRS), Bonn, 20-22 June 2018, 1-7. https://doi.org/10.23919/IRS.2018.8448228
- 35. Gu, W., Zhou, Z., Zhou, Y., et al. (2017) Predicting Blood Glu-cose Dynamics with Multi-Time-Series Deep Learning. 15th Symposium on Neural Networks and Applications (NEUREL), Belgrade, 6-8 November 2017, Article No. 55. https://doi.org/10.1145/3131672.3136965
- 36. Bergman, R., Phillips, L., Cobelli, C., et al. (1981) Physiologic Evaluation of Factors Controlling Glucose Tolerance in Man: Measurement of Insulin Sensitivity and Beta-Cell Glucose Sensitivity from the Response to Intravenous Glucose. Journal of Clinical Investigation, 68, 1456-1467. https://doi.org/10.1172/JCI110398
- 37. Cobelli, C., Toffolo, G. and Ferrannini, E. (1984) A Model of Glucose Kinetics and Their Control by Insulin, Compartmental and Noncompartmental Approaches. Mathematical Biosciences, 72, 291-315. https://doi.org/10.1016/0025-5564(84)90114-7
- 38. Sorensen, Thomas, J. (1985) A Physiologic Model of Glucose Metabolism in Man and Its Use to Design and Assess Improved Insulin Therapies for Diabetes. Massachusetts Institute of Technology, Cambridge, 497-528.
- 39. Hovorka, R., Shojaee, M., Carroll, P., et al. (2002) Partitioning Glucose Distribution/Transport, Disposal, and Endogenous Production during IVGTT. American Journal of Physiology-Endocrinology and Metabolism, 282, E992-E1007. https://doi.org/10.1152/ajpendo.00304.2001
- 40. Wilinska, M., Chassin, L., Schaller, H., et al. (2005) Insulin Kinetics in Type-I Diabetes: Continuous and Bolus Delivery of Rapid Acting Insulin. IEEE Transactions on Biomedical Engineering, 52, 3-12. https://doi.org/10.1109/TBME.2004.839639
- 41. Dalla, M., Rizza, R., Cobelli, C., et al. (2007) Meal Simulation Model of the Glucose-Insulin System. IEEE Transactions on Biomedical Engineering, 54, 1740-1749. https://doi.org/10.1109/TBME.2007.893506
- 42. Roy, A. and Parker, R. (2006) Mixed Meal Modeling and Disturbance Rejection in Type I Diabetic Patients. 2006 International Conference of the IEEE Engineering in Medicine and Biology Society, New York, 30 August-3 September 2006, 323-326. https://doi.org/10.1109/IEMBS.2006.260372
- 43. Woldaregay, A., Årsand, E., Walderhaug, S., et al. (2019) Data-Driven Modeling and Prediction of Blood Glucose Dynamics: Machine Learning Applications in Type 1 Diabetes. Artificial Intelligence in Medicine, 98, 109-134. https://doi.org/10.1016/j.artmed.2019.07.007
- 44. Georga, E., Príncipe, J., Fotiadis, D., et al. (2019) Short-Term Prediction of Glucose in Type 1 Diabetes Using Kernel Adaptive Filters. Medical & Biological Engineering & Computing, 57, 27-46. https://doi.org/10.1007/s11517-018-1859-3
- 45. Saiti, K., Macaš, M., Lhotská, L., et al. (2020) Ensemble Methods in Combination with Compartment Models for Blood Glucose Level Prediction in Type 1 Diabetes Mellitus. Computer Methods and Programs in Biomedicine, 196, Article ID: 105628. https://doi.org/10.1016/j.cmpb.2020.105628
- 46. Li, K., Liu, C., Zhu, T., et al. (2020) GluNet: A Deep Learning Framework for Accurate Glucose Forecasting. IEEE Journal of Biomedical and Health Informatics, 24, 414-423. https://doi.org/10.1109/JBHI.2019.2931842
- 47. Munoz-Organero, M. (2020) Deep Physiological Model for Blood Glucose Prediction in T1DM Patients. Sensors, 20, Article No. 3896. https://doi.org/10.3390/s20143896
- 48. Mhaskar, H. and Pereverzyev, S. (2017) A Deep Learning Approach to Diabetic Blood Glucose Prediction. Frontiers in Applied Mathematics and Statistics, 3, Article No. 14. https://doi.org/10.3389/fams.2017.00014
- 49. Zhu, T., Li, K., Chen, J., et al. (2020) Dilated Recurrent Neural Networks for Glucose Forecasting in Type 1 Diabetes. Journal of Healthcare Informatics Research, 4, 308-324. https://doi.org/10.1007/s41666-020-00068-2
- 50. Li, K., Daniels, J., Liu, C., et al. (2020) Convolutional Recurrent Neural Networks for Glucose Prediction. IEEE Journal of Biomedical and Health Informatics, 24, 603-613. https://doi.org/10.1109/JBHI.2019.2908488