Advances in Clinical Medicine
Vol.
11
No.
11
(
2021
), Article ID:
46615
,
7
pages
10.12677/ACM.2021.1111772
非布司他治疗恶性肿瘤合并高尿酸血症的短期临床疗效分析
黄哲,陈瞳,张利方,郭孝兹,张杰涛*
青岛大学附属医院,山东 青岛
收稿日期:2021年10月17日;录用日期:2021年11月15日;发布日期:2021年11月22日

摘要
目的:观察非布司他治疗恶性肿瘤合并高尿酸血症患者的短期临床疗效。方法:回顾性分析2016年1月至2020年12月于青岛大学附属医院收治的新诊断或复发难治的恶性肿瘤合并高尿酸血症患者的临床资料,经排除后纳入138例有效患者,其中使用非布司他者62例(非布司他组),使用别嘌醇者76例(别嘌醇组)。采用倾向性评分匹配以均衡组间协变量,比较两组患者用药1周后血尿酸、血肌酐、eGFR水平及不良反应发生情况。结果:经倾向性评分匹配后,两组各纳入40例患者,两组患者用药1周后的sUA、sCr水平均低于本组治疗前,差异有统计学意义(P < 0.05)。其中非布司他组sUA下降幅度大于别嘌呤醇组,而别嘌呤醇组sCr下降幅度大于非布司他组,两组比较差异均无统计学意义(P > 0.05)。治疗期间,非布司他组不良反应发生率为7.5%,别嘌醇组不良反应发生率为15%,差异无统计学意义(P > 0.05)。结论:非布司他治疗恶性肿瘤合并高尿酸血症患者的疗效及安全性与别嘌醇相似。
关键词
恶性肿瘤,高尿酸血症,非布司他,别嘌醇,倾向性评分匹配法

Analysis of Short-Term Clinical Efficacy of Febuxostat in the Treatment of Malignant Tumor Complicated with Hyperuricemia
Zhe Huang, Tong Chen, Lifang Zhang, Xiaoci Guo, Jietao Zhang*
Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Oct. 17th, 2021; accepted: Nov. 15th, 2021; published: Nov. 22nd, 2021

ABSTRACT
Objective: To explore the short-term clinical efficacy of febuxostat in the treatment of malignant tumor patients with hyperuricemia. Methods: The clinical data of newly diagnosed or relapsed malignant tumor complicated with hyperuricemia admitted to the Affiliated Hospital of Qingdao University from January 2016 to December 2020 were retrospectively analyzed. After exclusion, 138 effective patients were included, including 62 patients who used febuxostat and 76 patients who used allopurinol. The tendency score matching was used to balance covariates between groups, and the levels of serum uric acid, serum creatinine, eGFR and the incidence of adverse reactions were compared between the two groups after 1 week of medication. Results: After PSM, 40 patients were included in each group. The levels of sUA and sCr in the two groups after 1 week of medication were lower than those before treatment, and the difference was statistically significant (P < 0.05). Among them, the decrease of sUA in febuxostat group was greater than that in allopurinol group, while the decrease of sCr in allopurinol group was greater than that in febuxostat group, and there was no significant difference between the two groups (P > 0.05). During treatment, the incidence of adverse reactions in febuxostat group was 7.5%, while that in allopurinol group was 15%, with no significant difference. Conclusion: The efficacy and safety of febuxostat in the treatment of malignant tumor with hyperuricemia are similar to those of allopurinol.
Keywords:Malignant Tumor, Hyperuricemia, Febuxostat, Allopurinol, Propensity Score Matching

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
高尿酸血症(hyperuricemia, HUA)是一种代谢异常性疾病,与众多疾病相关。近年来流行病学研究发现,高尿酸血症可能加速恶性肿瘤的进展、增加癌症患者死亡风险 [1] [2]。此外,恶性肿瘤患者化疗期间可能出现大量肿瘤细胞坏死而导致如肿瘤溶解综合征(Tumor lysis syndrome, TLS)、肾功能损伤等严重并发症。有文献报道,当患者尿酸水平较高时(≥8 mg/dl),其发生TLS及肾功能损伤的危险性显著增加 [3]。因此有效控制恶性肿瘤患者的尿酸水平具有重要意义。目前,临床上对于恶性肿瘤合并高尿酸血症患者主要应用别嘌醇进行治疗。然而,别嘌醇对携带HLA-B*5801基因型人群存在严重超敏反应,且其剂量需根据肾功能调整 [4] [5]。非布司他与别嘌醇结构略有不同,其降尿酸效果较别嘌醇更持久,且无需根据肾功能调整剂量,因此推测其可能更适用于恶性肿瘤患者的降尿酸治疗。本研究基于倾向性评分匹配,分析了非布司他治疗恶性肿瘤合并高尿酸血症的短期临床疗效。现将研究结果报道如下。
2. 对象与方法
2.1. 研究对象
回顾性收集2016年1月至2020年12月于青岛大学附属医院就诊的138例恶性肿瘤合并高尿酸血症患者为研究对象,其中男性76例,女性62例,年龄18~88 (52.79 ± 16.42)岁。纳入标准:所有患者均为恶性肿瘤合并HUA,HUA诊断标准采用中国高尿酸血症相关疾病诊疗多学科专家共识推荐将UA > 420 μmol/L (不分男女)定义为HUA [6];住院化疗期间使用非布司他或别嘌醇大于7天;年龄 ≥ 18岁。排除标准:临床资料不全;近期正在使用其他降尿酸药物或影响尿酸代谢或排泄的药物者;严重肾功能不全(肌酐清除率 < 30 ml/min)者;采用Cairo等标准 [7] 诊断为用药前已发生实验室TLS (LaboratoryTumor lysis syndrome, LTLS)或临床TLS (ClinicalTumor lysis syndrome, CTLS)者。根据治疗方案将患者分为非布司他组62例、别嘌醇组76例。本研究经伦理委员会审查和批准后免于受试者的知情同意。
2.2. 方法
2.2.1. 数据采集和倾向性评分匹配
通过医院信息系统(HIS)提取患者性别、年龄、体质指数(BMI)、肿瘤类型、检验指标等,使用SPSS26.0软件中的PSM模块进行倾向性评分匹配,匹配因素包括:年龄、性别、BMI、肿瘤类型、TLS风险、乳酸脱氢酶、血肌酐、血尿酸,根据倾向评分值,非布司他组和别嘌呤醇组按照1:1比例进行最邻近匹配,匹配容差设为0.02。
2.2.2. 治疗方法
患者根据病情需要进行化疗,于化疗前一天开始给予降尿酸治疗。非布司他组患者口服非布司他40 mg/d,别嘌醇组口服别嘌醇100 mg,3次/d治疗,两组患者均至少服用7天。
2.2.3. 观察指标
观察两组患者用药前后血尿酸(sUA)、血肌酐(sCr)、肾小球滤过率(eGFR)水平变化情况及TLS发生率;根据NCI-CTCAE 4.0版标准评估药物不良反应,如肝功能异常、白细胞减少、头晕、皮疹、恶心、痛风发作等。
2.2.4. TLS诊断标准
依据Cairo [7] 等修订的诊断系统,患者化疗3~7 d内符合至少2项指标即可诊断为实验室(LTLS):1) 尿酸大于或等于476 μmol/L或者增加25%;2) 钾大于或等于6.0 mmol/L或增加25%;3) 磷大于或等于2.1 mmol/L (儿童)或者大于或等于1.45 mmol/L (成人)或增加25%;4) 钙小于或等于1.75 mmol/L或者减少25%。临床TLS (CTLS)定义为LTLS合并以下1项:1) 肾损害血肌酐大于或等于1.5倍年龄矫正的正常上限;2) 心律失常/猝死;3) 癫痫。
2.3. 统计学分析
所有数据均采用SPSS 26.0统计学软件对数据进行处理。正态分布的计量资料以均数 ± 标准差( )表示,组间比较采用独立样本t检验。非正态分布的计量资料采用中位数(四分位数间距) [M(Q1, Q3))]表示,组间比较采用非参数检验Mann-Whitney U检验,同一组内治疗前后采用Wilcoxon秩和检验。计数资料以例(百分率)表示,组间比较采用c2检验或Fisher精确检验。以P < 0.05为差异有统计学意义,所有可信区间的可信度均取95%。
3. 结果
1) 倾向性评分匹配后两组患者的基本资料:按上述倾向性评分匹配规则,最终匹配成功80例,两组各40例。匹配前,两组患者在尿酸水平上差异有统计学意义(P < 0.05),经1:1匹配后,两组患者基线资料差异均无统计学意义(P > 0.05),具有可比性(见表1)。
2) 血尿酸、血肌酐、肾小球滤过率水平变化的组内比较:非布司他组治疗后sUA、sCr水平较治疗前明显降低,差异有统计学意义(P < 0.01) (图1),eGFR较治疗前升高,差异有统计学意义(P > 0.05);别嘌呤醇组治疗后sUA、sCr水平较治疗前明显降低,差异有统计学意义(P < 0.01),eGFR较治疗前升高,差异有统计学意义(P > 0.05) (表2)。
Table 1. Comparison of baseline data of patients’ propensity score before and after matching between two groups
表1. 两组患者倾向性评分匹配前后基线资料比较
注:BMI:体质指数;LDH:乳酸脱氢酶;sCr:血肌酐;sUA:血尿酸。
 血尿酸
血尿酸
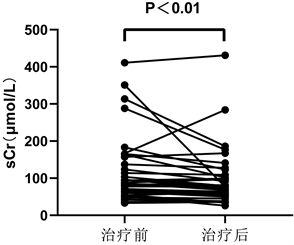 血肌酐
血肌酐
Figure 1. Changes of serum uric acid and creatinine in febuxostat group before and after treatment
图1. 非布司他组治疗前后血尿酸、血肌酐变化
Table 2. Comparison of serum uric acid, serum creatinine and eGFR between the two groups before and after treatment
表2. 两组患者治疗前后血尿酸、血肌酐、eGFR的比较
注:sUA:血尿酸;sCr:血肌酐;eGFR:肾小球滤过率。
3) 血尿酸、血肌酐降幅绝对值的组间比较:非布司他组sUA下降幅度大于别嘌呤醇组,两组比较差异无统计学意义(P > 0.05),别嘌呤醇组sCr下降幅度大于非布司他组,两组比较差异无统计学意义(P > 0.05) (表3)。
Table 3. Comparison of absolute values of serum uric acid and serum creatinine after one week of treatment between the two groups
表3. 两组患者治疗1周后血尿酸、血肌酐降幅绝对值对比
注:sUA:血尿酸;sCr:血肌酐。
4) TLS发生率别嘌醇组及非布司他组各有1例符合LTLS诊断标准。非布司他组出现LTLS的患者基线sUA水平为1287 μmol/L,治疗1周后sUA降至578 μmol/L,但其血磷升高超过正常上限,符合LTLS标准。别嘌醇组出现LTLS的患者基线sUA水平1352 μmol/L,治疗1周后sUA降至928 μmol/L,且其血钾较基线升高25%,符合LTLS诊断。两例患者均未出现CTLS。
5) 药物不良反应治疗期间,两组患者均未出现痛风发作。非布司他组患者中出现2例胃肠道不良反应及1例转氨酶升高,别嘌醇组中有2例出现皮疹,3例胃肠道不良反应及1例转氨酶升高。非布司他组及别嘌醇组不良反应发生率分别为7.5%和15%,差异无统计学意义(P > 0.05)。
4. 讨论
高尿酸血症是一种代谢异常性疾病,其可继发痛风,也可增加急性肾损伤、心血管疾病、代谢疾病的风险。目前已有各项研究示其可能增加癌症患者的病死率,高尿酸环境可能加速肿瘤的发展和转移 [8] [9],其机制可能与尿酸相关的慢性炎症反应及氧化应激 [10] [11]、黄嘌呤氧化酶(Xanthine Oxidase, XO)介导的活性氧自由基(reactive oxygen species, ROS)生成和ROS的致肿瘤作用等相关 [12]。同时,对于化疗期间出现高尿酸血症的患者有发生如肿瘤溶解综合征(TLS)等严重并发症的风险。有文献报道,血尿酸(sUA)每升高1 mg/dl,TLS和肾损伤事件的风险将分别增加1.75倍和2.21倍 [13],提示控制肿瘤患者尿酸水平对于改善恶性肿瘤预后、预防TLS起着重要作用。目前对于恶性肿瘤合并高尿酸血症的治疗临床上常用的药物为别嘌醇,但其起效缓慢,需要根据肾功能调整剂量,且可引起严重过敏反应,有研究发现,汉族人群使用别嘌醇治疗引起的严重皮肤不良反应与携带HLA-B*5801等位基因具有较强的相关性。根据国内外指南推荐,有条件的情况下患者应在服用别嘌醇前检测HLA-B*5801基因 [14] [15]。此外,对于存在中高危TLS风险的恶性肿瘤患者目前推荐使用拉布立酶,该药起效迅速、效果肯定,但由于价格昂贵限制了其使用。因此有必要寻找更好的替代药物。非布司他是一种新型非嘌呤类选择性黄嘌呤氧化酶抑制剂,于2009年被美国食品药品监督管理局批准上市,在我国于2013年被批准上市。非布司他具有更高的XO选择性,对嘌呤或嘧啶代谢的其他酶类活性没有影响,且能同时抑制还原型、氧化型黄嘌呤氧化酶,形成较稳定的药物——酶复合物,因此其降尿酸作用较别嘌醇更强而不良反应较少。Takai等 [16] [17] 的两项研究指出非布司他在化疗期间具有良好的降尿酸作用,且能有效改善肾功能。Maie等 [18] 报道了一项78例恶性肿瘤患者分别应用非布司他40 mg/d和别嘌醇300 mg/d治疗的研究,结果显示两组患者尿酸水平均较治疗前显著降低且两组降低尿酸水平效果相当。
本研究中,两组患者治疗后的sUA、sCr水平均低于本组治疗前,差异有统计学意义(P < 0.05),表明非布司他与别嘌醇均能降低恶性肿瘤合并HUA患者的血尿酸水平,改善肾功能指标。非布司他组sUA下降幅度大于别嘌呤醇组,而别嘌呤醇组sCr下降幅度大于非布司他组,两组比较差异均无统计学意义(P > 0.05),提示非布司他组与别嘌醇的降尿酸效果和肾脏保护作用效果相当。上述研究结果也与国内多项文献报道基本一致。证实了非布司他可作为治疗恶性肿瘤合并高尿酸血症、预防TLS的替代治疗药物。本研究中,非布司他组有1例患者出现了肝功能异常,2例胃肠道反应,别嘌醇组患者有1例肝功能异常,2例皮疹和3例轻度胃肠道反应,予对症治疗,症状即缓解或消失。两组患者的不良反应总发生率比较,非布司他不良反应发生率较别嘌醇偏低,但差异无统计学意义(P > 0.05),提示非布司他与别嘌醇安全性相似。中国汉族人群中携带HLA-B*5801等位基因频率6%~8% [19],应用别嘌醇发生过敏反应的风险更大,推测应用非布司他有可能更安全。
5. 结论
综上所述,非布司他在恶性肿瘤患者化疗期间能有效控制患者的尿酸水平,保护肾功能,且其安全性与别嘌醇相似,无严重不良反应。本研究采用倾向性评分匹配法均衡组间协变量,减少了混杂因素的干扰,且病例来自实际临床患者,可以反映真实世界中两种药物的治疗效果。但本研究为回顾性研究,所选病例数较少,还需要大样本量、前瞻性临床试验对本研究结论进一步证实。
文章引用
黄 哲,陈 瞳,张利方,郭孝兹,张杰涛. 非布司他治疗恶性肿瘤合并高尿酸血症的短期临床疗效分析
Analysis of Short-Term Clinical Efficacy of Febuxostat in the Treatment of Malignant Tumor Complicated with Hyperuricemia[J]. 临床医学进展, 2021, 11(11): 5230-5236. https://doi.org/10.12677/ACM.2021.1111772
参考文献
- 1. Yan, S., Zhang, P., Xu, W., et al. (2015) Serum Uric Acid Increases Risk of Cancer Incidence and Mortality: A Systematic Review and Meta-Analysis. Mediators of Inflammation, 2015, Article ID: 764250. https://doi.org/10.1155/2015/764250
- 2. Shoaib, A., et al. (2017) Plasma Urate, Cancer Incidence, and All-Cause Mortality: A Mendelian Randomization Study. Clinical Chemistry, 63, 1151-1160. https://doi.org/10.1373/clinchem.2016.268185
- 3. Abu-alfa, A.K. and Younes, A. (2010) Tumor Lysis Syndrome and Acute Kidney Injury: Evaluation, Prevention, and Management. American Journal of Kidney Diseases, 55, S1-S13. https://doi.org/10.1053/j.ajkd.2009.10.056
- 4. Nakajima, A., Oda, S. and Yokoi, T. (2016) Allopurinol Induces Innate Immune Responses Through Mitogen-Activated Protein Kinase Signaling Pathways in Hl-60 Cells. Journal of Applied Toxicology, 36, 1120-1128. https://doi.org/10.1002/jat.3272
- 5. Gaffo, A.L., Mikuls, T.R., Stamp, L.K., et al. (2016) Allopurinol Dose Reductions Based on Creatinine Alert Redesign System. The American Journal of Medicine, 129, e95. https://doi.org/10.1016/j.amjmed.2015.12.035
- 6. 李林, 朱小霞, 戴宇翔, 等. 中国高尿酸血症相关疾病诊疗多学科专家共识[J]. 中华内科杂志, 2017, 56(3): 235-248.
- 7. Cairo, M.S. and Bishop, M. (2004) Tumour Lysis Syndrome: New Therapeutic Strategies and Classification. British Journal of Haematology, 127, 3-11. https://doi.org/10.1111/j.1365-2141.2004.05094.x
- 8. Strasak, A.M., et al. (2007) The Role of Serum Uric Acid as an Antioxidant Protecting against Cancer: Prospective Study in More than 28 000 Older Austrian Women. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 18, 1893-1897. https://doi.org/10.1093/annonc/mdm338
- 9. Strasak, A.M., Rapp, K., Hilbe, W., et al. (2007) Serum Uric Acid and Risk of Cancer Mortality in a Large Prospective Male Cohort. Cancer Causes & Control, 18, 1021-1029. https://doi.org/10.1007/s10552-007-9043-3
- 10. 吴冕, 陈海冰. 高尿酸血症与癌症[J]. 中华内分泌代谢杂志, 2016, 32(5): 429-432.
- 11. Mi, S., et al. (2020) Friend or Foe? An Unrecognized Role of Uric Acid in Cancer Development and the Potential Anticancer Effects of Uric Acid-Lowering Drugs. Journal of Cancer, 11, 5236-5244. https://doi.org/10.7150/jca.46200
- 12. 朱春鹏, 任跃忠, 王彩花. 尿酸与肿瘤的研究进展[J]. 全科医学临床与教育, 2019, 17(9): 831-834.
- 13. Bertrand, C., Arnold, A., Ching-hon, P., et al. (2008) Guidelines for the Management of Pediatric and Adult Tumor Lysis Syndrome: An Evidence-Based Review. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 26, 2767-2778. https://doi.org/10.1200/JCO.2007.15.0177
- 14. 中华医学会内分泌学分会. 中国高尿酸血症与痛风诊疗指南(2019) [Z].
- 15. Khanna, D., Fitzgerald, J.D., Khanna, P.P., et al. (2012) American College of Rheumatology Guidelines for Management of Gout. Part 1: Systematic Nonpharmacologic and Pharmacologic Therapeutic Approaches to Hyperuricemia. Arthritis Care & Research (Hoboken), 64, 1431-1446. https://doi.org/10.1002/acr.21772
- 16. Takai, M., Yamauchi, T., Ookura, M., et al. (2014) Febuxostat for Management Of Tumor Lysis Syndrome Including Its Effects on Levels of Purine Metabolites in Patients with Hematological Malignancies—A Single Institution’s, Pharmacokinetic and Pilot Prospective Study. Anticancer Research: International Journal of Cancer Research and Treatment, 34, 7287-7296.
- 17. Takai, M., Yamauchi, T., Fujita, K., et al. (2014) Controlling Serum Uric Acid Using Febuxostat in Cancer Patients at Risk of Tumor Lysis Syndrome. Oncology Letters, 8, 1523-1527. https://doi.org/10.3892/ol.2014.2394
- 18. Koichiro, M., Yasuhisa, Y., Naoki, K., et al. (2014) Hypouricemic Effect and Safety of Febuxostat Used for Prevention of Tumor Lysis Syndrome. Springerplus, 3, 501. https://doi.org/10.1186/2193-1801-3-501
- 19. Wu, G.-G., Deng, Z.-H., Gao, S.-Q., et al. (2004) Study of HLA Polymorphism in the 6965 Han Bone Marrow Registry Donors. Chinese Journal of Hematology, 25, 473-477.
NOTES
*通讯作者Email: qdszjt163@163.com
