Hans Journal of Biomedicine
Vol.
14
No.
01
(
2024
), Article ID:
79848
,
7
pages
10.12677/HJBM.2024.141007
枸杞多糖通过生物节律基因Clock和Bmal1调节小鼠脂质代谢
杨萍1,田甜2,马媛2,赵涓汝3,周佳1,陈焓1,常越2*
1宁夏医科大学临床医学院,宁夏 银川
2宁夏医科大学基础医学院,宁夏 银川
3宁夏医科大学药学院,宁夏 银川
收稿日期:2023年10月24日;录用日期:2024年1月17日;发布日期:2024年1月24日

摘要
目的:探究枸杞多糖通过调节生物节律基因(Clock, Bmal1)的变化来影响小鼠脂质代谢。方法:选用C57BL/6J雄性小鼠建立肥胖小鼠模型,不同剂量枸杞多糖进行干预。检测小鼠血清学指标总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL);利用苏木素伊红(HE)染色法进行肝脏组织形态学观察。利用蛋白免疫印记杂交(Western blot)检测Clock蛋白、Bmal1蛋白的表达水平。结果:血清学指标示:实验组TG、LDL及HDL水平与模型组相比均有显著性差异。HE染色结果显示:在肝脏的组织切片中,模型组中肝细胞出现大量的脂滴。枸杞多糖低剂量组、中剂量组和高剂量组肝细胞脂肪变的情况有不同程度改善。Western blot检测结果显示:在模型组中生物节律基因Clock和Bmal1的表达有所下降,在枸杞多糖干预组中Clock和Bmal1的表达有所上调。结论:枸杞多糖能够改善肥胖小鼠脂质的异常代谢,其机制可能是通过调节小鼠生物节律基因Clock和Bmal1的表达水平来实现的。
关键词
枸杞多糖,肥胖,脂代谢,生物节律基因

Lycium Barbarum Polysaccharides Regulate Lipid Metabolism in Obese Mice through the Biological Rhythm Genes Clock and Bmal1
Ping Yang1, Tian Tian2, Yuan Ma2, Juanru Zhao3, Jia Zhou1, Han Chen1, Yue Chang2*
1School of Clinical Medicine, Ningxia Medical University, Yinchuan Ningxia
2School of Basic Medicine, Ningxia Medical University, Yinchuan Ningxia
3School of Pharmacy, Ningxia Medical University, Yinchuan Ningxia
Received: Oct. 24th, 2023; accepted: Jan. 17th, 2024; published: Jan. 24th, 2024

ABSTRACT
Objective: To investigate the effect of LBP on lipid metabolism in mice by regulating changes in biorhythmic genes (Clock, Bmal1). Methods: C57BL/6J male mice were selected to establish an obese mouse model, and different doses of LBP were used for drug intervention. Total cholesterol (TC), triglycerides (TG), high-density lipoprotein (HDL), and low-density lipoprotein (LDL) were detected as serological indicators in mice. Liver histomorphometry was performed using hematoxylin eosin (HE) staining. The expression levels of Clock protein and Bmal1 protein were detected using Western blot (WB) hybridization for protein immunoblotting. Results: Serological indices showed that TG, LDL, HDL levels in the experimental group were all significantly different compared to the model group. The results of HE staining showed that in the tissue sections of the liver, a large number of lipid droplets appeared in the hepatocytes in the model group. Hepatocyte steatosis was improved to different degrees in the LBP low-dose, medium-dose and high-dose groups. The results of Western blot assay showed that the expression of biorhythm genes Clock and Bmal1 decreased in the model group, and the expression of Clock and Bmal1 was up-regulated in the LBP intervention group. Conclusion: LBP can improve the abnormal metabolism of lipids in obese mice, and its mechanism may be realized by regulating the expression levels of mouse biorhythm genes Clock and Bmal1.
Keywords:Lyciumbarbarum Polysaccharide, Obesity, Lipid Metabolism, Biological Rhythm Genes

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肥胖已经成为威胁大众健康的全球性问题,机体的能量平衡被破坏从而引起肥胖的发生,导致体重增加和代谢紊乱 [1] ,大大增加了患2型糖尿病、脂肪肝疾病、高血压、心肌梗塞、中风、痴呆和乳腺癌等疾病发生的风险 [2] 。生命体的新陈代谢受昼夜节律钟的调节,昼夜节律钟紊乱会导致肥胖 [3] [4] 、糖尿病、抑郁症以及严重的代谢问题 [5] 。
有研究发现,长期轮班工作、睡眠不足或者摄食不规律等引起的昼夜节律紊乱与肥胖、代谢紊乱密切相关 [6] 。在动物模型中,光照提前或者延迟诱导的慢性时差引起的昼夜节律紊乱也会导致小鼠瘦素抵抗,逐步趋向肥胖和代谢综合征,尤其是脂代谢的紊乱 [7] 。昼夜节律是生物机体为了适应环境,从整体、组织到细胞各个层次都呈现出以约24 h为周期波动的现象,这种生物节律受到生物钟的调节 [8] 。在分子水平上,哺乳动物生物钟主要由一组蛋白来驱动,包括转录激活因子(Clock, Bmal1)、抑制因子(PER1/2, CRY1/2)组成的复合物调控的。昼夜节律的破坏会导致各种病理生理状态,特别是脂代谢过程的异常 [9] 。它能够调控能量的合成、消耗、储存。脂肪组织中存在生物钟系统,脂肪分解、脂肪组织中葡萄糖的摄取以及脂肪因子的分泌等代谢过程均受到昼夜节律的影响 [10] 。节律紊乱会增加肥胖和代谢综合征的风险,包括2型糖尿病、非酒精性脂肪肝病。上述研究表明生物节律基因在脂代谢调节过程中具有重要的作用 [3] [11] 。
枸杞子为中国国家公布的药食同源品种之一,具有独特的营养和药用价值 [12] 。其中枸杞多糖(Lyciumbarbarum polysaccharides, LBP)作为枸杞发挥功效的重要活性成分而成为近年来一个研究的热点 [13] 。枸杞多糖能够降低血脂 [12] 、显著降低小鼠的体重的作用已被证实 [14] ,但关于枸杞多糖调节脂质代谢是否可以通过调节(Bmal1, Clock)及在脂代谢中扮演什么样的角色未见报道。本研究用枸杞多糖对肥胖小鼠进行灌胃后,收集肝脏组织,经血清学指标检验、HE染色、Western blot染色观察肝脏组织改变和Clock、Bmal1的表达,探究枸杞多糖是否可以通过调节生物节律基因(Clock, Bmal1)的变化来影响小鼠脂质代谢。
2. 材料和仪器
2.1. 材料
枸杞多糖(LBP)购自宁夏沃福百瑞生物食品工程有限公司。
2.2. 仪器
实验用C57BL/6J雄性小鼠(8~10周龄)均由宁夏医科大学动物中心提供[实验动物生产许可证号:SCXK(宁)2020-0001],经宁夏医科大学伦理审查委员会批准(伦理编号:2014-017)。实验设备全自动生化分析仪,恒温低速离心机,液体快速混合器,蛋白Western Blot检测仪器由宁夏医科大学基础医学院实验平台提供。
3. 实验方法
3.1. 小鼠肥胖模型的建立
实验动物为C57BL/6J雄性小鼠40只,按体重随机分为对照组(常规饲料)和模型组(高脂饲料)。对照组8只,普通饲料喂养,模型组32只,按照60%普通饲料、12%猪油、5%花生,10%鸡蛋、5%奶粉、5%蔗糖、2%食盐、1%麻油配比饲料高脂喂养。根据肥胖和超重标准,将肥胖度大于10%视为超重,大于20%视为肥胖并认为肥胖模型建立成功,肥胖度计算公式:肥胖度(%) = (试验组实际体重 − 对照组平均体重)/对照组平均体重 × 100)。喂养于昼夜12 h交替、湿度45%、室温(23 ± 1)℃环境中,自由进食,直至肥胖造模成功。
3.2. 分组干预及血清学指标的测量
将各小鼠分组,分别为:普通组(8只)、高脂模型组(8只)、高脂饮食 + 枸杞多糖高剂量组(8只,300 mg/kg)、高脂饮食 + 枸杞多糖中剂量组(8只,150 mg/kg)、高脂饮食 + 枸杞多糖低剂量组(8只,75 mg/kg),每天给药1次,持续喂养4周,各组小鼠分笼饲养。连续灌胃30 d后,空腹16 h,乙醚麻醉后称取体重,小鼠眼球动脉取血处死,测定血清学指标(TG, TC, HDL, LDL),血清生化指标的检测按照说明书操作步骤在全自动生化分析仪上进行。分离小鼠肝脏组织分别置于4%多聚甲醛溶液中固定和−80℃超低温冰箱中保存。
3.3. 以苏木精–伊红(HE)染色观察相关组织病理学变化
小鼠肝脏组织常规石蜡切片与HE染色:用4%的多聚甲醛溶液固定相关组织48 h,将固定后的组织按要求切取部分组织置于包埋盒中,依次浸入梯度乙醇溶液中进行脱水、二甲苯透明、浸蜡,进行常规石蜡切片。将石蜡切片烘烤,脱蜡,依次浸入梯度乙醇溶液最终水化。将水化后的组织切片进行常规HE染色后,梯度脱水、二甲苯透明后用中性树胶封片,置于通风橱中晾干过夜,室温保存观察。
3.4. 蛋白质印迹分析(Westernblot)
根据蛋白提取试剂盒(NE-PER, Pierce, Thermoscientific,美国)的说明,用磷酸酶抑制剂(Roche,Mannheim,德国)和蛋白酶抑制剂(Merck KGaA, Frankfurter Str, Darmstadt,德国)制备肝脏组织的组织提取物。相关组织需要在加入裂解缓冲液后用匀浆器进行处理。之后在高速离心机4℃ 12,000 r的条件下离心10 min,取肝脏上清液,使用BCA蛋白定量试剂盒进行定量,过程依据说明书进行,测定结果后加入相应的去离子水,蛋白原液与lyssis buffer煮蛋白。蛋白质在4%~12%的Bis-Tris凝胶(Nu-PAGE Novex, Invitrogen,美国)中分离,并转移到聚偏二氟乙烯膜(Millipore,Watford,英国)上。转移后,用5%的脱脂奶粉封闭2 h,然后用抗Clock抗体(1:20,000)、抗Bmal1抗体(1:1000)及抗β-ACTIN抗体(1:3000) (购自美国Cell Signaling Technology公司) 4℃孵育过夜。洗涤后,用HRP结合的小鼠抗兔IgG (1:3000,ABclomal,美国)在室温下孵育2 h。采用化学发光液(ECL),使用化学发光系统对印迹中的免疫反应蛋白进行检测。
3.5. 统计学分析
采用SPSS 22.0统计软件进行数据分析。计量资料以均数 ± 标准差( )表示;通过单因素方差分析进行统计学显著性评估。P < 0.05为差异具有统计学意义。
4. 结果
4.1. 血清学指标
Table 1. The expression of serum TG, TC, HDL, and LDL in each group of mice ( ). Compared with the model group *P < 0.5, **P < 0.01
表1. 各组小鼠血清TG、TC、HDL、LDL表达情况( ),与模型组比较*P < 0.5,**P < 0.01
血清学指标示:TG水平示:正常组、枸杞多糖干预各组与模型组相比均有显著性差异;TC水平各组间没有统计意义;HDL水平示:正常组与模型组相比具有统计学意义,GM和GL组与模型组相比有显著性差异;LDL水平示:模型组与正常组、GM组相比有显著性差异,与GL组相比有统计学意义。见表1。
4.2. 小鼠肝脏组织形态学观察
HE结果显示在肝脏的HE染色病理切片中,高脂模型组中肝小叶正常结构形态紊乱,肝细胞索排列不规整,肝细胞中出现大量的脂滴,脂滴大小不等;此外肝间质内可见多量炎细胞浸润。枸杞多糖低剂量组、中剂量组和高剂量组中肝小叶结构清晰,肝细胞索排列规整,肝细胞脂肪变的情况有不同程度改善,炎细胞浸润情况也有所减少。如图1。
4.3. 生物节律基因Clock和Bmal1蛋白在小鼠肝组织中的表达
Western Blot结果显示,小鼠造模后,与正常组比较,模型组Clock、Bmal1的相对表达量均下调,LBP干预4周后,LBP干预组的Clock相对表达量较模型组有所提高,尤其高级多糖中剂量组;与模型组比较,LBP干预组中的低剂量组和中剂量组的Bmal1的相对表达量有所提高。见图2。
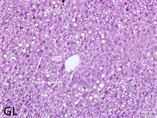
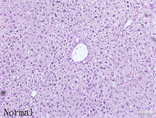
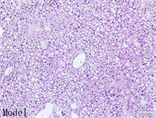


Figure 1. Liver histological examination results of mice in each experimental group (100×)
图1. 实验各组小鼠肝组织学检查结果(100×)
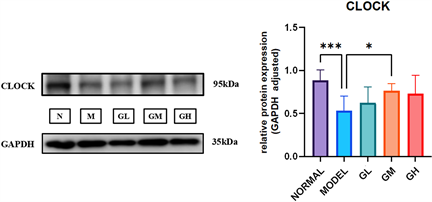

Figure 2. The effect of lyceum barbarum polysaccharides on the levels of Clock and Bmal1 proteins in the liver of different groups of mice. Compared with the model group *P < 0.5, **P < 0.01
图2. 枸杞多糖对不同组别小鼠肝脏Clock和Bmal1蛋白水平的影响,与模型组比较*P < 0.5,**P < 0.01
5. 讨论
肥胖是一种脂质累积而诱发的一种代谢性疾病,且易并发高脂血症、动脉粥样硬化、冠心病、高血压、糖尿病、痛风、脂肪肝等疾病,肥胖是全球范围公认的公共卫生问题之一 [1] 。长时间光照、睡眠模式改变以及轮班工作等因素引起的生物钟系统紊乱,增加了罹患慢性代谢性疾病的风险 [10] 。
LBP是枸杞主要组成成分,具有改善各种实验动物和人群代谢综合征的功效 [13] 。研究证明高脂饮食不仅会诱导小鼠代谢性疾病同时还能引起其生物钟系统 [15] 的紊乱,而机体的生物节律是由“转录翻译负反馈调节环”(TTFL)进行调节的,生物钟基因(Bmal1, Clock)在脂肪生成和脂质体内平衡中发挥关键作用 [16] 。
Yu Yang等 [10] 研究发现LBP除可降低血清TC、TG水平,提高HDL-C的水平,还可以显著降低小鼠的体重,这与本实验结果一致。同时我们在肝的组织切片中发现肝细胞的脂肪变性和炎细胞浸润情况也有所改善。高浓度的药物干预效果反而差于中低浓度,我们猜想高浓度LBP干预也许对肥胖小鼠有毒性,继而减弱了调节脂质代谢的能力。
在Shigeki [17] 的研究中发现,全身性敲除C57BL/6小鼠Bmal1后循环血液中甘油三酯、游离脂肪酸以及胆固醇水平增加,且在肝脏和骨骼肌中出现异位脂肪沉积。Chelsea [18] 等观察到给脂肪细胞特异性Bmal1转基因小鼠喂食高脂膳食后,体重增长受到限制,而耗氧量及葡萄糖耐量均显著增加,这说明了节律基因能够影响到小鼠肥胖的发生及脂代谢的异常。在本研究中我们发现模型组Clock、Bmal1的相对表达量均下调,LBP干预后,Clock与Bmal1的相对表达量较模型组有所提高。有研究发现,当小鼠全身性敲除Bmal1后,白色脂肪组织中UCP1和PPARγ等蛋白表达显著增加 [19] ,也有研究发现小鼠棕色脂肪组织特异性敲除Bmal1后,虽然UCP1的mRNA和蛋白水平在24小时内显著升高,但棕色脂肪组织中脂肪酸利用被破坏,产热及全身能量消耗降低 [20] 。因此,LBP对生物钟的影响有可能通过高表达UCP1和PPARγ等蛋白来促进白色脂肪棕色化、影响能量代谢,从而产生代谢性肥胖。枸杞多糖的干预,也许是通过节律基因BMAL1介导的AMPK/SIRT1–BMAL1-PGC-1α [21] 通路或BMAL1–NRF2–IL-1β/IL-6 [22] 通路促进UCP1的表达,进而促进白色脂肪棕色化,以改善机体葡萄糖代谢水平和维持能量平衡 [7] 。LBP的调节脂质代谢作用可能是通过调控生物节律基因Clock和Bmal1的能量代谢达到降脂减肥的作用,从而改善肥胖模型中的脂质代谢紊乱 [4] [23] 。这将为枸杞多糖改善昼夜节律紊乱引起的肥胖的机制研究提供新的思路。
6. 结论
本研究结果提示,枸杞多糖能有效地改善高脂饮食所致肥胖小鼠脂质代谢的紊乱,其机制可能是通过调节小鼠生物节律基因Clock和Bmal1的表达水平来实现的。
基金项目
2022年大学生创新创业训练计划项目(S202210752018);2023年大学生创新创业训练计划项目(S2023 10752021);2020年度卫生健康系统科学研究课题项目。
文章引用
杨 萍,田 甜,马 媛,赵涓汝,周 佳,陈 焓,常 越. 枸杞多糖通过生物节律基因Clock和Bmal1调节小鼠脂质代谢
Lycium Barbarum Polysaccharides Regulate Lipid Metabolism in Obese Mice through the Biological Rhythm Genes Clock and Bmal1[J]. 生物医学, 2024, 14(01): 65-71. https://doi.org/10.12677/HJBM.2024.141007
参考文献
- 1. 张彦康, 张婷, 李雨, 等. 肥胖治疗的挑战与希望[J]. 自然杂志, 2022, 44(6): 469-479.
- 2. 高璐璐, 杨建军. 枸杞多糖对高脂饮食诱导的非酒精性脂肪肝大鼠的保护作用及对肠道菌群的影响[C]//营养研究与临床实践——第十四届全国营养科学大会暨第十一届亚太临床营养大会、第二届全球华人营养科学家大会论文摘要汇编. 2019: 495-496.
- 3. 杨捷, 刘子龙, 高玉雯, 等. 似昼夜节律与糖脂代谢的研究进展[J]. 空军军医大学学报, 2022: 1-10.
- 4. 张玮芸, Chi-tang Ho, 吕慕雯. 基于脂质组学研究胡椒碱对肥胖大鼠脂代谢基因昼夜节律的影响[J]. 食品科学, 2023: 1-13.
- 5. 中国超重/肥胖医学营养治疗指南(2021) [J]. 中国医学前沿杂志(电子版), 2021, 13(11): 1-55.
- 6. 庞文琪, 钱帅伟, 李春艳, 等. 社会时差与肥胖和糖尿病关系研究进展[J]. 中国糖尿病杂志, 2022, 30(9): 695-699.
- 7. 高扬, 杨婷婷, 于亮. 时钟基因Bmal1: 白色脂肪棕色化的重要调控点[J]. 中国运动医学杂志, 2023, 42(6): 493-500.
- 8. 陈江慧, 周玫余, 黄荣凤, 等. 进食节律差异调节棕色脂肪组织的生物钟与代谢基因昼夜节律[J]. 生理学报, 2022, 74(5): 726-736.
- 9. 邢陈, 顾晔, 宋伦. 昼夜节律在代谢调控中的作用[J]. 军事医学, 2017, 41(7): 618-622.
- 10. 郁珽, 李晓南. 生物钟与肥胖[J]. 中国儿童保健杂志, 2018, 26(12): 1327-1331.
- 11. 吴礼邦. 昼夜颠倒进食对高脂肥胖小鼠脂肪组织脂代谢及节律的研究[D]: [硕士学位论文]. 武汉: 武汉轻工大学, 2022.
- 12. 张敏, 岳坤, 姜交华, 等. 枸杞子及其有效成分的药理作用研究进展[J]. 药物评价研究, 2023, 46(7): 1611-1619.
- 13. 宋育林, 曾民德, 陆伦根, 等. 枸杞多糖对高脂饮食诱导的脂肪肝大鼠模型的影响[J]. 安徽医药, 2007(3): 202-205.
- 14. 张民, 肖军霞, 施春雷, 等. 枸杞多糖-4对下丘脑损伤性肥胖小鼠减肥作用的探讨[J]. 营养学报, 2003(2): 196-199.
- 15. 陈紫蕙, 王惠琴. 肥胖高血压患者血清半胱氨酸天冬氨酸蛋白水解酶1和含NLR家族Pyrin域蛋白3与血压昼夜节律的关系[J]. 中华高血压杂志, 2023, 31(10): 985-989.
- 16. 张正敏, 曹洪战, 芦春莲, 等. 生物钟对动物糖脂代谢的影响研究进展[J]. 中国畜牧杂志, 2020, 56(1): 30-34.
- 17. Shigeki, S., Norimasa, I., Yuki, O., et al. (2005) Brain and Muscle Arnt-Like Protein-1 (BMAL1), a Component of the Molecular Clock, Regulates Adipogenesis. Proceedings of the National Academy of Sciences of the United States of America, 102, 12071-12076. https://doi.org/10.1073/pnas.0502383102
- 18. Hepler, C., Weidemann, B.-J., Waldeck, N.-J., et al. (2022) Time-Restricted Feeding Mitigates Obesity through Adipocyte Thermogenesis. Science (New York, N.Y.), 378, 276-284. https://doi.org/10.1126/science.abl8007
- 19. Feldmann, H.M., Golozoubova, V., Cannon, B. and Nedergaard, J. (2009) UCP1 Ablation Induces Obesity and Abolishes Diet-Induced Thermogenesis in Mice Exempt from Thermal Stress by Living at Thermoneutrality. Cell Metabolism, 9, 203-209. https://doi.org/10.1016/j.cmet.2008.12.014
- 20. Hasan, N., Nagata, N., Morishige, J.-I., et al. (2021) Brown Adipocyte-Specific Knockout of Bmal1 Causes Mild but Significant Thermogenesis Impairment in Mice. Molecular Metabolism, 49, Article ID: 101202. https://doi.org/10.1016/j.molmet.2021.101202
- 21. Tong, X., Zhang, D.Q., Arthurs, B., et al. (2015) Palmitate Inhibits SIRT1-Dependent BMAL1/CLOCK Interaction and Disrupts Circadian Gene Oscillations in Hepatocytes. PLOS ONE, 10, e0130047. https://doi.org/10.1371/journal.pone.0130047
- 22. Pekovic-vaughan, V., Gibbs, J., Yoshitane, H., et al. (2014) The Circadian Clock Regulates Rhythmic Activation of the NRF2/Glutathione-Mediated Antioxidant Defense Pathway to Modulate Pulmonary Fibrosis. Genes & Development, 28, 548-560. https://doi.org/10.1101/gad.237081.113
- 23. 陈少影, 李晶晶, 兰卫. 常用中药有效成分降脂作用研究进展[J]. 中国实验方剂学杂志, 2023, 29(13): 241-253.
