Botanical Research
Vol.
07
No.
05
(
2018
), Article ID:
26965
,
8
pages
10.12677/BR.2018.75064
Molecular Cloning and Expression Analysis of HbPDK of Hevea brasiliensis
Jianghua Yang, Xiangyu Long, Yunxia Qin*
Rubber Research Institute, CATAS/Ministry of Agriculture Key Laboratory for Biology and Genetic Resources of Rubber Tree/State Key Laboratory Breeding Base for Cultivation & Physiology for Tropical Crops, Danzhou Hainan
Received: Sep. 4th, 2018; accepted: Sep. 18th, 2018; published: Sep. 25th, 2018

ABSTRACT
Pyruvate dehydrogenase kinase (PDK) through phosphates pyruvate complex (PDC), negatively regulates the activity of PDC, PDK inhibits the oxidative decarboxylation of pruvate, plays an important role in regulating intermediary metabolism. The pyruvate dehydrogenase kinase gene of Hevea brasiliensis, HbPDK, its coding region is 1110 bp and encodes 369 amino acids. HbPDK is mainly expressed in leaves, latex and flowers. The expression of HbPDK didn’t change much in different leaf development. After Ethrel treatment, the expression of HbPDK in latex reduced slightly. However, HbPDK reduced significantly after tapping in virgin trees, it was down-regulated about 5 folds. HbPDK is negatively correlated with the increasing yield of latex due to tapping, it produces an effect on the latex production through regulating the generation of acetyl coenzyme A. The Trx tag of pET32a promoted the soluble expression of HbPDK in E. coli, the recombinant protein of HbPDK was purified by nickel-nitrilotriacetic acid chelate chromatography; the purification of purified recombinant protein was over 90%.
Keywords:Hevea brasiliensis, Pyruvate Dehydrogenase Kinase, HbPDK, Mitochondria
橡胶树丙酮酸脱氢酶激酶基因的克隆 与表达分析
阳江华,龙翔宇,秦云霞*
中国热带农业科学院橡胶研究所,农业部橡胶树生物学重点开放实验室,省部共建国家重点实验室培育基地–海南省热带作物栽培生理学重点实验室,海南 儋州
收稿日期:2018年9月4日;录用日期:2018年9月18日;发布日期:2018年9月25日

摘 要
丙酮酸脱氢酶激酶(PDK)通过磷酸化丙酮酸脱氢酶复合体(PDC),负调控PDC的酶活性,抑制丙酮酸的氧化脱羧反应,在中间物代谢过程中起着重要的调控作用。橡胶树丙酮酸脱氢酶激酶基因,HbPDK,编码区长1110 bp,编码369个氨基酸。HbPDK主要在橡胶树叶片、胶乳和花组织中表达,在叶片不同发育时期,其表达量变化不明显。乙烯利处理只是轻微下调HbPDK的表达量,但割胶处理却能显著下调HbPDK在新开割树胶乳中的表达,HbPDK的表达量下降了近5倍。结果说明HbPDK与割胶促进胶乳产量的增加呈明显的负相关,可以通过调控乙酰辅酶A的生成而影响橡胶树产量。pET32a原核表达载体的Trx标签,促进了HbPDK在大肠杆菌中的可溶性表达,通过镍柱亲和层析,获得了纯度在90%以上的重组蛋白。
关键词 :巴西橡胶树,丙酮酸脱氢酶激酶,HbPDK,线粒体

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
丙酮酸脱氢酶复合体(Pyruvate Dehydrogenase Complex,PDC)催化丙酮酸的氧化脱羧,生成乙酰-CoA和NADH [1] 。乙酰-CoA是三羧酸循环的起始底物,也是脂肪酸合成的底物。PDC除了定位于线粒体,在质体中也有分布,但只有线粒体丙酮酸复合体(mtPDC)通过磷酸化/去磷酸化的方式,失活/激活其酶活性。丙酮酸脱氢酶激酶(Pyruvate Dehydrogenase Kinase, PDK)通过磷酸化PDC上的E1α亚基的Ser残基,失活PDC [2] 。在拟南芥中,AtPDK还会自磷酸化自身的Ser残基,但是当His121和His168突变为Gln时,其自磷酸化能力下降80%左右 [3] 。
动物有4个PDK基因,在生长发育和疾病发生过程中起着重要的作用,更是肿瘤治疗的新靶标基因 [4] 。而在植物中普遍只有1~2个PDK基因,拟南芥和油菜只有1个PDK基因 [5] [6] ,玉米和水稻有2个PDK基因 [7] [8] 。AtPDK通过负调控PDC的活性,与拟南芥的脂肪酸含量呈负相关 [9] ,Zou等 [10] 应用反义mRNA技术抑制拟南芥PDK的表达,在PDC蛋白的表达量没有明显增加的情况下,由于PDK表达量的降低,使得PDC的酶活性得到增加,转基因拟南芥表现为植株生长加快,花期提前,种子重量及含油量增加。在油菜中PDK同样调控油菜种子的脂肪酸合成,过表达油菜PDK1基因,转基因油菜种子的含油量降低 [6] 。在水稻中有两个PDK基因,OsPDK1主要在叶片中表达,而OsPDK2在各个器官中组成型表达,各自起着不同的生物学功能。OsPDK1的RNAi转基因植株,其线粒体丙酮酸脱氢酶的活性是野生型的2倍,植株比野生型矮10%~30% [8] 。
橡胶树的异戊二烯单体来源于异戊烯基焦磷酸(isopentenylpyrophosphate, IPP),而IPP的底物是乙酰–辅酶A [11] ,因而橡胶树PDK很可能会通过调控PDC的活性而影响乙酰辅酶A的生成,进而调控橡胶树橡胶烃的合成。本研究从橡胶树中获得了一个丙酮酸脱氢酶激酶基因HbPDK,分析了HbPDK在橡胶树胶乳中的表达特征,并利用原核表达体系,获得了高纯度的重组蛋白,该项工作为揭示HbPDK的功能奠定了基础。
2. 材料和方法
2.1. 材料
2.1.1. 实验材料
实验用树为10年生、开割3年的未进行乙烯利刺激割胶的热研7-33-97品系,定植于中国热带农业科学院试验场1队。采集了八个不同组织和不同发育时期叶片;用1%乙烯利涂抹在胶线和胶线上部1~2 cm处的树皮上处理后的12小时、24小时和48小时分别割胶,采集胶乳。
2.1.2. 实验试剂和菌种
Taq DNA聚合酶和大肠杆菌感受态DH5α和Rossetta (DE3),荧光定量试剂TransStart Tip Green qPCR SuperMix,ProteinIso Ni-NTA Resin为北京全式金生物技术有限公司产品,蛋白预染marker,限制性核酸内切酶、反转录试剂盒为美国Thermo Scientific公司产品。通用植物总RNA提取试剂盒为北京百泰克生物技术有限公司产品。原核表达载体pET32a为本实验室保存。引物和测序均在华大基因完成。
2.2. 方法
2.2.1. 总RNA的提取及cDNA第一链的合成
巴西橡胶树胶乳总RNA的提取方法参照Tang等 [12] ,其它组织的总RNA的提取,使用百泰克公司的通用植物总RNA提取试剂盒。cDNA第一链的合成使用Thermo Scientific公司的RevertAid First Strand cDNA Synthesis Kit,操作步骤依照产品说明书进行。
2.2.2. HbPDK基因的克隆
使用拟南芥AtPDK和ZmPDK1的氨基酸序列tblastn搜索巴西橡胶树的转录组和基因组数据库,发现在橡胶树中只有一个PDK基因。根据mRNA序列,设计了一对基因特异性引物HbPDK-F和HbPDK-R,以树叶和胶乳的cDNA为模板,进行RT-PCR扩增。PCR产物经琼脂糖凝胶电泳和胶回收后,连接到pMD-18T载体中,转化DH5α感受态细胞,挑选5个经菌落PCR鉴定的阳性克隆,送华大基因进行测序验证。引物序列见表1。
Table 1. The sequences of all primers used in this paper
表1. 本文所用的引物及序列
2.2.3. HbPDK的进化树分析
使用Mega7.0 [13] 对橡胶树HbPDK的氨基酸序列,与木薯(XP_021607932.1),麻风树(XP_012084195.1),大豆(XP_003546545.1),可可(XP_007035981.1),棉花(XP_016731482.1),油菜(NP_001302545.1),拟南芥(AtPDK),金丝小枣(XP_015900132.1),番茄(XP_004252952.1),水稻(OsPDK1和OsPDK2),玉米(ZmPDK1和ZmPDK2),油棕(XP_010943866.1)和大麦(BAJ85210.1)的PDK基因的氨基酸序列进行进化树分析,应用Neibgbber-Joining法进行分子系统学分析,并进行1000次bootstrap统计学检验。
2.2.4. HbPDK基因的表达分析
根据HbPDK的mRNA序列,分别设计基因三对荧光定量引物,经溶解曲线和标准曲线分析,确定qPDK-F1和qPDK-R1为最终荧光定量引物,PCR产物经胶回收,构建到pMD-18T中,送公司测序验证。参照Li等 [14] 的方法,使用伯乐公司的CFX96 TOUCH实时荧光定量PCR仪,分析HbPDK基因在橡胶树不同组织、叶片不同时期,以及随着新开割树前8刀割胶后其在胶乳中的表达情况以及当受乙烯利处理4个不同时间后的表达特征参照前期研究,分析不同组织和叶片不同时期的表达情况时,选用的内参基因为RH2b,胶乳内的表达特征,选用的内参基因是YSL8 [15] 。荧光定量分析获得不同处理条件下的HbPDK和内参基因的Cq值,使用SPSS 13进行统计学分析。
2.2.5. HbPDK原核表达载体的构建与表达
以yPDK-F和yPDK-R为引物,含HbPDK基因全长cDNA序列的质粒为模板,使用TaKaRa公司的PrimeSTAR HS DNA Polymerase扩增HbPDK基因的编码区序列。PCR扩增产物使用限制性内切酶Pml I和Sal I双酶切,原核表达载体pET32a使用EcoRV和Sal I双酶切,酶切产物经琼脂糖凝胶回收、连接转化DH5α感受态。挑选阳性克隆,DNA测序确认正确的克隆,成功构建了HbPDK基因在pET32a中的原核表达载体,pET32-HbPDK,重组蛋白命名为Trx-HbPDK。构建完成的原核表达载体转化大肠杆菌表达菌种Rossetta (DE3),待含有pET32-HbPDK质粒的大肠杆菌培养至OD600为0.4~0.6左右时,加入终浓度为0.5 mM的IPTG,20℃诱导12小时。
2.2.6. HbPDK重组蛋白的纯化
IPTG诱导后的Rossetta (DE3)菌经超声破碎后,4℃,13,000 rpm,10 min高速离心,吸取上清至新的离心管,沉淀用相同体积的无菌水重悬,12%聚丙烯胺浓度的SDS-PAGE检测重组蛋白在上清和沉淀中的表达。因为pET32a带有His标签,使用全式金公司的ProteinIso Ni-NTA Resin的镍柱亲和层析介质,从上清中纯化重组蛋白Trx-HbPDK,使用方法参照产品说明书。
3. 结果与分析
3.1. HbPDK基因全长cDNA序列
HbPDK全长cDNA的测序结果显示,其全长cDNA序列为1377 bp,其中编码区长1110 bp,编码369个氨基酸序列,分子量为41.9 kD,ExPASy的ProtParam tool分析其等电点为6.68。用Mega7.0 [13] 对橡胶树、拟南芥、水稻和玉米等PDKs做进化树分析,HbPDK归于双子叶亚类,与同为大戟科的木薯、麻风树的PDK同源性最高(图1)。应用在线预测软件TargetP,Signal P和MITOPROT ,分析HbPDK的氨基酸序列,其不同于哺乳动物的PDKs,没有明显的线粒体信号肽 [16] [17] 。但是MITOPROT,ProtComp和TargetP都预测HbPDK定位于线粒体上 [16] [17] [18] 。
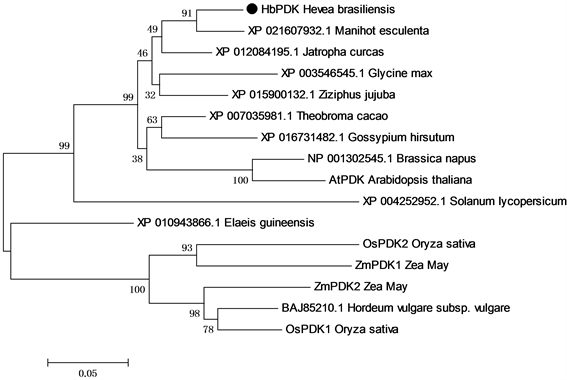
Figure 1. The phylogenetic analysis of HbPDK
图1. HbPDK的进化树分析
3.2. HbPDK基因在不同组织、叶片和胶乳中的表达分析
实时荧光定量PCR分析结果显示,HbPDK基因主要在巴西橡胶树的叶片、胶乳和花中表达(图2)。HbPDK基因在不同发育时期的橡胶树叶片中的表达变化不明显(图3),乙烯利刺激割胶使HbPDK在胶乳中呈轻微下调表达(图4),而割胶却明显下调HbPDK的表达(图5)。
3.3. HbPDK在大肠杆菌中的重组表达
原核表达载体pET32a的Trx标签为105个氨基酸,能够有效的促进外源蛋白在大肠杆菌的表达。SDS-PAGE电泳结果显示,Trx-HbPDK在上清和沉淀中都大量表达,其表达量占上清总蛋白的50%以上。相对于玉米 [7] 的PDK1,PDK2使用His标签,95%的重组表达蛋白在沉淀中表达,Trx标签明显促进了HbPDK的可溶性表达。应用镍柱亲和层析,纯化上清中的Trx-HbPDK蛋白,得到了纯度在90%的融合蛋白。
4. 讨论
橡胶树HbPDK基因在根和树皮中表达量很低,而叶片中的表达量最高(图2),并且在叶片发育的各个时期表达量比较稳定,这和水稻的OsPDK1和玉米的ZmPDK2主要在叶片中表达很相似,这可能与植物叶片光呼吸产生的大量ATP相关 [7] [8] 。橡胶树随着割胶次数的增加,产量逐渐增加,但每次割胶,乳管细胞损失了大量的细胞质、亚细胞器和营养物质,为了快速恢复橡胶的合成和其它生物物质的生成,乳管细胞必然进行快速的代谢活动。HbPDK作为PDC的负调控因子,割胶条件下,HbPDK的表达量明显下调,在第二刀就下降了50%左右(图5),从而减少了PDK对PDC的抑制作用,增强了PDC的活性,促进乙酰辅酶A的合成。乙酰辅酶A除了是柠檬酸循环的底物,还是脂肪酸和橡胶烃合成的起始底物,在橡胶树中乙酰辅酶A通过甲羟戊酸途径生成异戊烯基焦磷酸(IPP),而IPP是橡胶烃合成的前体。
其它植物的PDK基因的表达受到激素的调控,在水稻中,GA能上调OsPDK1的表达,使得PDC的活性下降50%左右,而其它激素(IAA,BA,BL等)对PDK1的表达基本无影响 [8] ,ABA还能下调OsPDK1

Figure 2. Expression of HbPDK in different Hevea tissues. 1: Latex, 2: Leaf, 3: Bark, 4: Male flower, 5: Female flower, 6: Seed, 7: Root, 8: Young bark
图2. HbPDK基因在橡胶树不同组织中的表达分析。1:胶乳,2:叶片,3:树皮,4:雄花,5:雌花,6:种子,7:根,8:嫩茎树皮

Figure 3. Expression of HbPDK in different stages of Hevea leaf development. 1: Bronze leaf, 2: Color change leaf, 3: Pale-green leaf, 4: Mature leaf; the relative expression of Color change leaf is 1.0
图3. HbPDK基因在橡胶树叶片不同发育时期的表达分析1:古铜期叶片,2:变色期叶片,3:淡绿期叶片,4:稳定期叶片
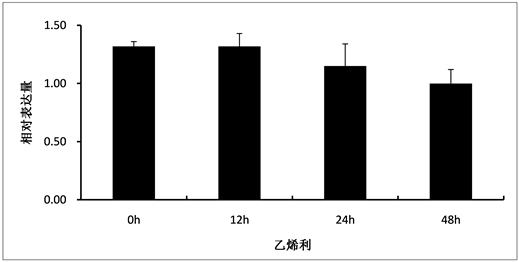
Figure4. Expression of HbPDK in Hevea latex under 1% ethrel treatment
图4. HbPDK在1%乙烯利刺激割胶条件下叶片中的表达分析
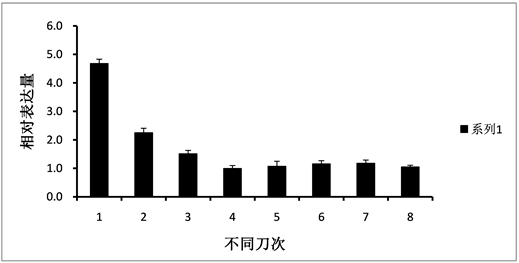
Figure 5. The expression of HbPDK during eight successive tapping on Hevea brasiliensis virgin trees
图5. HbPDK在橡胶树新开割树前8刀的表达分析

Figure 6. The SDS-PAGE electrophoresis of HbPDK recombinant protein. M: Prestained Protein Marker, 1: The supernatant of pET32-HbPDK, 2: The precipitate of pET32-HbPDK; 3: The purified recombinant protein. Where the arrows point is the recombinant protein
图6. HbPDK重组蛋白的SDS-PAGE电泳图片。M:预染蛋白marker,1:pET32-HbPDK超声破碎后上清,2:pET32-HbPDK超声破碎后沉淀,3:pET32-HbPDK镍柱纯化后的目的蛋白,箭头所指为重组蛋白Trx-HbPDK
的表达。通过在橡胶树树干的割胶部位涂抹乙烯利,乙烯利释放乙烯,刺激橡胶产量的增加,是橡胶树增产的重要方式,但乙烯利处理,HbPDK的表达量只有轻微的下调(图4)。乙烯利增产很可能不是通过下调HbPDK的表达来达到增产的目的。也可能是割胶刺激后,HbPDK的表达已经达到了一个较低的表达水平,乙烯利不能进一步下调HbPDK的表达。
割胶刺激显著增加橡胶树胶乳的产量,而随着割胶次数的增加,HbPDK的表达量明显减少,HbPDK是割胶增产的负调控因子,通过调控乙酰辅酶A的生成而增加橡胶树产量。本实验还获得了较高纯度的HbPDK的重组蛋白(图6),为下一步研究HbPDK蛋白的功能奠定了一定的基础。
基金项目
中国热带农业科学院基本科研业务费专项资金(1630022018019和1630022017001)支持。
文章引用
阳江华,龙翔宇,秦云霞. 橡胶树丙酮酸脱氢酶激酶基因的克隆与表达分析
Molecular Cloning and Expression Analysis of HbPDK of Hevea brasiliensis[J]. 植物学研究, 2018, 07(05): 528-535. https://doi.org/10.12677/BR.2018.75064
参考文献
- 1. Bowker-Kinley, M. and Popov, K.M. (1999) Evidence That Pyruvate Dehydrogenase Kinase Belongs to the ATPase/Kinase Super-family. The Biochemical Journal, 344, 47-53. https://doi.org/10.1042/bj3440047
- 2. Tovar-Mendez, A., Miernyk, J.A. and Randall, D.D. (2003) Regulation of Pyruvate Dehydrogenase Complex Activity in Plant Cells. European Journal of Biochemistry, 270, 1043-1049. https://doi.org/10.1046/j.1432-1033.2003.03469.x
- 3. Tovar-Mendez, A., Miernyk, J.A. and Randall, D.D. (2002) Histidine Mutagenesis of Arabidopsis thaliana Pyruvate Dehydrogenase Kinase. European Journal of Biochemistry, 269, 2601-2606. https://doi.org/10.1046/j.1432-1033.2002.02933.x
- 4. Lee, I.K. (2014) The Role of Pyruvate Dehydrogenase Kinase in Diabetes and Obesity. Diabetes & Metabolism Journal, 38, 181-186. https://doi.org/10.4093/dmj.2014.38.3.181
- 5. Thelen, J.J., Miernyk, J.A. and Randall, D.D. (2000) Pyruvate Dehydrogenase Kinase from Arabidopsis thaliana: A Protein Histidine Kinase That Phos-phorylates Serine Residues. The Biochemical Journal, 349, 195-201. https://doi.org/10.1042/bj3490195
- 6. Li, R.J., Hu, Z.Y., Zhang, H.S., Zhan, G.M., Wang, H.Z. and Hua, W. (2011) Cloning and Functions Analysis of a Pyruvate Dehydrogenase Kinase in Brassica napus. Plant Cell Reports, 30, 1533-1540. https://doi.org/10.1007/s00299-011-1066-2
- 7. Thelen, J.J., Muszynski, M.G., Miernyk, J.A. and Randall, D.D. (1998) Mo-lecular Analysis of Two Pyruvate Dehydrogenase Kinases from Maize. The Journal of Biological Chemistry, 273, 26618-26623. https://doi.org/10.1074/jbc.273.41.26618
- 8. Jan, A., Nakamura, H., Handa, H., Ichikawa, H., Matsumoto, H. and Komatsu, S. (2006) Gibberellin Regulates Mitochondrial Pyruvate Dehydrogenase Activity in Rice. Plant & Cell Physiology, 47, 244-253. https://doi.org/10.1093/pcp/pci241
- 9. Marillia, E.F., Micallef, B.J., Micallef, M., Weninger, A., Pedersen, K.K., Zou, J. and Taylor, D.C. (2003) Biochemical and Physiological Studies of Arabidopsis thaliana Transgenic Lines with Repressed Expression of the Mitochondrial Pyruvate Dehydrogenase Kinase. Journal of Experimental Botany, 54, 259-270. https://doi.org/10.1093/jxb/erg020
- 10. Zou, J., Qi, Q., Katavic, V., Marillia, E.F. and Taylor, D.C. (1999) Effects of Antisense Repression of an Arabidopsis thaliana Pyruvate Dehydrogenase Kinase cDNA on Plant Development. Plant Molecular Biology, 41, 837-849. https://doi.org/10.1023/A:1006393726018
- 11. 刘卫平, 王敏杰, 韩玉珍, 赵德刚. (2002) 天然橡胶的生物合成机制[J]. 植物生理学通讯, 2002, 38(4): 382-388.
- 12. Tang, C., Qi, J., Li, H., Zhang, C. and Wang, Y. (2007) A Convenient and Efficient Pro-tocol for Isolating High-Quality RNA from Latex of Hevea brasiliensis (Para Rubber Tree). Journal of Biochemical and Biophysical Methods, 70, 749-754. https://doi.org/10.1016/j.jbbm.2007.04.002
- 13. Kumar, S., Stecher, G. and Tamura, K. (2016) MEGA7: Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets. Molecular Biology and Evolution, 33, 1870-1874. https://doi.org/10.1093/molbev/msw054
- 14. Li, H., Qin, Y., Xiao, X. and Tang, C. (2011) Screening of Valid Reference Genes for Real-Time RT-PCR Data Normalization in Hevea brasiliensis and Expression Validation of a Sucrose Transporter Gene HbSUT3. Plant Science, 181, 132-139. https://doi.org/10.1016/j.plantsci.2011.04.014
- 15. Long, X., He, B., Gao, X., Qin, Y., Yang, J., Fang, Y., Qi, J. and Tang, C. (2015) Validation of Reference Genes for Quantitative Real-Time PCR during Latex Regeneration in Rubber Tree. Gene, 563, 190-195. https://doi.org/10.1016/j.gene.2015.03.026
- 16. Emanuelsson, O., Brunak, S., von Heijne, G. and Nielsen, H. (2007) Locating Proteins in the Cell Using TargetP, SignalP and Related Tools. Nature Protocols, 2, 953-971. https://doi.org/10.1038/nprot.2007.131
- 17. Claros, M.G. and Vincens, P. (1996) Computational Method to Predict Mitochondrially Imported Proteins and Their Targeting Sequences. European Journal of Biochemistry, 241, 779-786. https://doi.org/10.1111/j.1432-1033.1996.00779.x
- 18. Softberry ProtComp 9.0 Website. 10. http://www.softberry.com/berry.phtmltopic=protcomppl&group=programs&subgroup=proloc
NOTES
*通讯作者。
