Hans Journal of Chemical Engineering and Technology
Vol.
09
No.
01
(
2019
), Article ID:
28630
,
5
pages
10.12677/HJCET.2019.91008
Speciation of Inorganic Antimony in Seawater
Shuifeng Wang1, Zhaojing Chen2, Jinghua Guo1*
1Analytical and Testing Center, Beijing Normal University, Beijing
2Beihai Middle School Affiliated to Beijing Normal University, Beihai Guangxi
Received: Jan. 4th, 2019; accepted: Jan. 17th, 2019; published: Jan. 24th, 2019

ABSTRACT
Both Sb(III) and Sb(V) could form stable complexes readily with citric acid in an aqueous solution at room temperature. Sb(III)-citrate and Sb(V)-citrate were separated on a PRP-X100 anion-exchange column with 5 mmol∙L−1 EDTA-2Na and 3 mmol∙L−1 phthalic acid (pH = 4.5) being the mobile phase. Thus, a HPLC-ICP-MS analytical method for the speciation of Sb(III) and Sb(V) in seawater was developed.
Keywords:Antimony, Inorganic Speciation, HPLC-ICP-MS
海水中不同价态无机锑的分析方法研究
王水锋1,陈昭靖2,郭敬华1*
1北京师范大学分析测试中心,北京
2北京师范大学北海附属中学,广西 北海
收稿日期:2019年1月4日;录用日期:2019年1月17日;发布日期:2019年1月24日

摘 要
室温下柠檬酸在水溶液中可与Sb(III)和Sb(V)形成稳定络合物,使用高效液相色谱与电感耦合等离子体质谱仪联用,以5 mmol∙L−1乙二胺四乙酸二钠(EDTA-2Na)和3 mmol∙L−1邻苯二甲酸(调pH为4.5)为流动相,Sb(III)和Sb(V)的柠檬酸络合物在PRP-X100阴离子交换柱上达到基线分离,从而实现了海水中Sb(III)与Sb(V)的分离检测。
关键词 :锑元素,无机形态分析,高效液相色谱与电感耦合等离子体质谱仪联用

Copyright © 2019 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
锑及其化合物被美国环保局列为首要污染物,但由于锑在环境中的浓度较低,大多数锑的化合物的溶解度也不高,有关锑的形态、含量、生物可利用性及其迁移规律的研究一直没有受到足够的重视 [1] 。随着无机和有机锑化合物在工农业生产中的广泛应用,使得每年有相当数量的锑进入环境中 [2] 。锑的相关研究日益受到人们的关注,Sb(III)的毒性是Sb(V)的10倍左右,有机锑化合物的毒性一般较无机锑小 [3] 。
锑的形态分析方法有电化学分析法、分光光度法和原子光谱法等。近年来,随着色谱与元素检测器联用技术的发展,锑的形态分析工作取得很大进展。Smichowski等 [4] 总结了常见的锑形态分析方法。其中应用越来越多的是不同的高压液相色谱分离方法与各种检测技术的联用。这种检测方法可以同时检测Sb(III)、Sb(V)以及有机锑,避免了传统氢化法检测锑时通过检测总锑、Sb(III)从而计算出Sb(V)可能产生的误差,把Sb(III)、Sb(V)的检出限降低至1微克∙升−1以下。然而,Sb(III)很容易氧化为Sb(V),Zheng等人 [5] 报道了在河水样品中加入的Sb(III)可以在30分钟内被氧化为Sb(V)。柠檬酸可以与Sb(III)和Sb(V)生成稳定络合物,防止Sb(III)向Sb(V)的转化,同时该络合物可使用高效液相色谱与电感耦合等离子体质谱仪联用的方法分离检测,从而应用于无机锑的测定 [6] [7] [8] 。
本文以柠檬酸络合海水中的Sb(III)和Sb(V),建立了使用高效液相色谱与电感耦合等离子体质谱仪联用测定海水中无机锑各形态含量的分析方法。
2. 实验部分
2.1. 仪器及试剂
NexION 300X型电感耦合等离子体质谱仪;Flexar高效液相色谱仪(美国PerkinElmer仪器有限公司);色谱柱为Hamilton PRP-X100离子交换柱(5 μm, 150 * 4.6 mm)。
所用硝酸为北京化学试剂公司生产,优级纯;一水合柠檬酸,乙二胺四乙酸二钠,邻苯二甲酸和氨水为西陇化工股份有限公司产,分析纯;水为二次去离子水;三氧化二锑为阿拉丁试剂(上海)有限公司产,分析纯;焦锑酸钾为中国上海试剂四厂产,分析纯;海水取自中国南海,经ICP-MS检测含Sb总量低于0.02微克∙升−1。
2.2. 标准工作溶液的配制
用三氧化二锑和焦锑酸钾分别配制成含Sb(III)、Sb(V)1000 mg∙L−1的母液于冰箱中保存。在南海采集海水样品,样品经孔径0.22 μm混合纤维素酯孔膜过滤后,装于聚乙烯塑料瓶中,置于冰箱中低温保存。经ICP-MS检测,该海水中Sb总量低于0.02 μg∙L−1。使用时将母液用超纯水稀释至100 μg∙L−1,取1 mL该溶液,加入1 mL海水用26 mmol∙L−1柠檬酸溶液稀释至所需浓度,室温放置10分钟后待测。
3. 结果与讨论
3.1. 分析条件的确定
分别考察了pH值、EDTA和邻苯二甲酸浓度以及流动相流速对分离和检测的影响。实验表明随着pH值增大,Sb柠檬酸络合物的色谱峰峰高变高,半峰宽变小,保留时间增大,选择pH = 4.5为实验酸度。EDTA和邻苯二甲酸的加入都会缩短样品出峰时间,改善样品峰形,考察了不同的EDTA和邻苯二甲酸浓度组合,确定最佳实验条件为5 mmol∙L−1乙二胺四乙酸二钠(EDTA-2Na)和3 mmol∙L−1邻苯二甲酸(调pH为4.5)为流动相,使用Hamilton PRP-X100阴离子交换柱,在1.5 mL∙min−1流速下分离,并以ICP-MS对121Sb进行检测。ICP-MS的工作参数见表1。得到的色谱图见图1。
3.2. 方法检出限和精密度
在选定的测试条件下,按标样配制方法制备含Sb(III)和Sb(V)各10微克∙升−1的溶液,连续测定11次,计算得到本方法测定Sb(III)和Sb(V)的精密度和检出限分别为4.6%,3.4%和0.17微克∙升−1,0.30微克∙升−1。经验证,本方法在1~100微克∙升−1范围内保持良好的线性关系(图2)。
Table 1. Operating parameters for ICP-MS
表1. ICP-MS的工作参数
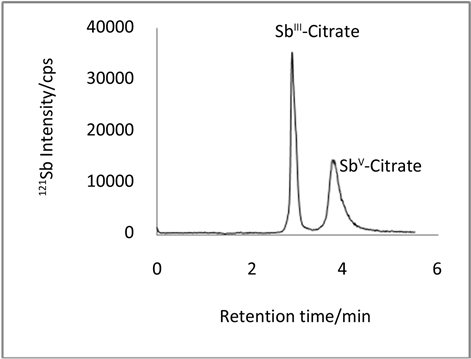
Figure 1. Chromatogram of Sb(III)-citrate and Sb(V)-citrate (each 10 ug l−1as Sb) on PRP-X100 anion-exchange column
图1. Sb(III)-citrate和Sb(V)-citrate (分别为10微克∙升−1)的色谱峰
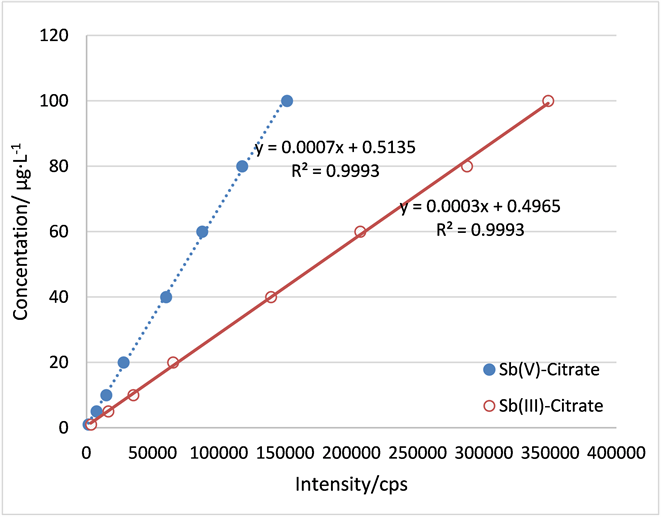
Figure 2. Linear relation of the method
图2. 方法线性相关性
3.3. 无机锑柠檬酸络合物的稳定性
按标样配制方法制备含Sb(III)-Citrate和Sb(V)-Citrate浓度分别为10微克∙升−1的混标,在确定的最佳实验条件下每隔一个小时测量一次,连续测定11次,计算所得Sb(III)-Citrate和Sb(V)-Citrate强度的标准偏差分别为2.6%和3.9%。结果表明柠檬酸的加入不仅防止了在样品存储和测定期间Sb(III)向Sb(V)的转化,还极大程度的改善了Sb(III)的峰形,提高了Sb(III)的检出限 [8] 。
4. 小结
一直以来,由于Sb(III)与离子交换柱的强烈相互作用导致其峰形较宽,难以获得与Sb(V)接近的检出限。本方法得到的Sb(III)-Citrate和Sb(V)-Citrate均为尖峰,且在柱子上都有适当的保留,很大程度上降低了Sb(III)的检出限。同时由于柠檬酸的加入,大大减少了Sb(III)在检测过程中向Sb(V)的转化。提高了检测结果的准确性。
文章引用
王水锋,陈昭靖,郭敬华. 海水中不同价态无机锑的分析方法研究
Speciation of Inorganic Antimony in Seawater[J]. 化学工程与技术, 2019, 09(01): 46-50. https://doi.org/10.12677/HJCET.2019.91008
参考文献
- 1. Liu, F., Le, X.C., Mcknight-Whitford, A., et al. (2010) Antimony Speciation and Contamination of Waters in the Xikuangshan Antimony Mining and Smelting Area, China. Environmental Geochemistry & Health, 32, 401.
- 2. He, M., Wang, X., Wu, F., et al. (2012) Antimony Pollution in China. Science of the Total Environment, 421-422, 41.
- 3. Groth, D.H., Stettler, L.E., Burg, J.R., et al. (1986) Carcinogenic Effects of Antimony Trioxide and Antimony Ore Concentrate in Rats. Journal of Toxicology & Environmental Health, 18, 607-626. https://doi.org/10.1080/15287398609530898
- 4. Smichowski, P., Madrid, Y. and Cámara, C. (1998) Analytical Methods for Antimony Speciation, in Waters at Trace and Ultratrace Levels. A Review. Journal of Analytical Chemistry, 360, 623.
- 5. Zheng, J., Iijima, A. and Furuta, N. (2001) Complexation Effect of Antimony Compounds with Citric Acid and Its Application to the Speciation of Antimony (III) and Antimony (V) Using HPLC-ICP-MS. Journal of Analytical Atomic Spectrometry, 16, 812-818. https://doi.org/10.1039/b101943k
- 6. Wei, C.Y., Ge, Z.F., Chu, W.S., et al. (2015) Speciation of Antimony and Arsenic in the Soils and Plants in an Old Antimony Mine. Environmental and Experimental Botany, 109, 31-39. https://doi.org/10.1016/j.envexpbot.2014.08.002
- 7. Miravet, R., Lopez-Sanchez, J.F., Rubio, R., et al. (2007) Speciation Analysis of Antimony in Extracts of Size-Classified Vocanic Ash by HPLC-ICP-MS. Analytical and Bio-analytical Chemistry, 387, 1949-1954. https://doi.org/10.1007/s00216-006-1077-y
- 8. Miravet, R., Hernandez-Nataren, E., Sahuquillo, A., et al. (2010) Speciation of Antimony in Environmental Matrices by Coupled Techniques. Trends in Analytical Chemistry, 29, 28-39. https://doi.org/10.1016/j.trac.2009.10.006
