Hans Journal of Agricultural Sciences
Vol.
11
No.
05
(
2021
), Article ID:
42767
,
9
pages
10.12677/HJAS.2021.115064
烟草赤星病生防菌的筛选、鉴定及应用研究
杨德政1,孙光军2,桑维钧1*
1贵州大学烟草学院,贵州 贵阳
2中国烟草总公司贵州省公司烟叶处,贵州 贵阳

收稿日期:2021年4月25日;录用日期:2021年5月21日;发布日期:2021年5月28日

摘要
为了从生物途径探索有效控制烟草赤星病对烟叶生产带来的危害,本文以烟草赤星病菌为指示菌,采用平板对峙法从烟草根际土壤中筛选出了烟草赤星病的一种拮抗菌Y2,通过形态特征、生理生化特征及16S rRNA、gyrA序列分析等手段,鉴定该菌株为贝莱斯芽孢杆菌(Bacillus velezensis)。之后,利用该拮抗菌株分别进行了烟草赤星病离体叶片与盆栽防效试验,结果发现其对烟草赤星病的防效分别为57.17%和59.81%。另外,研究表明该菌株对其他4种烟草病害病原菌也存在不同程度的抑制作用。研究结果为该拮抗菌株的进一步研究奠定了基础,并且为烟草赤星病的生物防治提供了参考。
关键词
烟草赤星病,生防菌,筛选鉴定,防治效果
Screening, Identification and Application of Biocontrol Bacteria against Tobacco Brown Spot Optimization
Dezheng Yang1, Guangjun Sun2, Weijun Sang1*
1College of Tobacco Science, Guizhou University, Guiyang Guizhou
2Tobacco Department Guizhou Branch of China Tobacco Corporation, Guiyang Guizhou
Received: Apr. 25th, 2021; accepted: May 21st, 2021; published: May 28th, 2021

ABSTRACT
In order to explore the effective control method to tobacco brown spot disease from the biological way, an antagonistic bacteria strain Y2 was isolated from tobacco rhizosphere soil by plate confrontation method, with an Alternaria alternata strain as indicator. The inhibition rate to A. alternata was 51.5%. By means of morphological, physiological and biochemical characteristics, as well as 16S rRNA and gyrA sequence analysis, the Y2 strain was finally identified as Bacillus velezensis. The control effects of Y2 strain on tobacco brown spot In vitro leaf experiment and pot experiment were 57.17% and 59.81%, respectively. At the same time, it was found that Y2 strain had different degrees of inhibition also on four tobacco disease pathogens. The results of the experiment laid a foundation for further study on the antagonistic bacteria on tobacco disease.
Keywords:Tobacco Brown Spot Disease, Biocontrol, Screening and Identification, Prevention and Control Effect

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
本烟草赤星病是由丝孢纲链格孢属普通链格孢菌(Alternaria alternata)引起的真菌性病害,发生于烟叶成熟期 [1]。发病之初会在叶片上形成黄褐色圆形小斑点,而后逐渐扩大,颜色加深成褐色,病斑质脆易破,严重时病斑相互连接处枯焦脱落,该病害对烟叶品质与产量造成了严重的影响 [2]。烟草赤星病于1892年在美国被首次发现,而后在非洲烟草生产中盛行,但随着时代的进步,物流业开始飞速发展,世界各地的交流也变得密切,烟草赤星病便蔓延到了全球各大种植区 [3] [4]。我国于1916年首次发现了该病害,1963年在河南烟区和山东山区爆发,其所造成的冲击立刻引起了国内人士极大的关注 [5] [6] [7]。
目前对于烟草赤星病害的防治,主要采取的策略是“预防为主,综合治理”,治理方法主要包括农业防治、化学防治、生物防治等,其中以抗病品种结合化学农药防治是当前最简单有效的方法 [8] [9] [10],但化学药剂的施用会对环境带来的巨大负担,而且会使病菌产生抗药性 [5],所以具有高效、环保、成本低、病原菌不易产生抗药性等特点的生物防治成为了近年人们研究的热点 [11]。目前已有部分学者对烟草赤星病生物防治方面进行了研究,也取得了一定的成果,如易龙等 [12] 通过平板对峙培养的方法,从烟草叶片上筛选出了一株对烟草赤星病有较好抑制作用的拮抗菌Ata28,其在离体叶片及盆栽上的防治高达73%和75.8%。唐圣华等 [13] 从烟草根际土壤中分离筛选出的枯草芽孢杆菌(Bacillus. subtilis) BS06-1在对烟草赤星病的田间抗病试验中获得了较好的效果。司世飞 [14] 筛选出了一株甲基营养型芽孢杆菌(Bacillus methylotrophicus) Y37,该菌株的田间防效也很不错,活菌液的防效达到了49.86%。但烟草赤星病的生物防治仍处于初级阶段,其还具有广阔的前景,需要更多学者从筛选、鉴定、应用研究等方面入手,为发掘出更多具有潜力的生物防治资源而努力。因此,本研究对烟草根际土壤中的微生物资源进行分离、筛选,目的在于获得对烟草赤星病具有一定抑制效果的拮抗菌,之后对其进行离体叶片及盆栽防治效果测定,为下一步田间赤星病生物防治奠定基础的同时,期望能为赤星病生物防治提供新的微生物资源。
2. 材料与方法
2.1. 供试材料
供试土壤:贵州省遵义市绥阳县蒲场镇赤星病严重发生烟田的健康烟株根际土壤。
供试菌株:
1) 靶标菌株:烟草赤星病菌(Alternaria alternate),2020年从贵州省安顺市天龙镇茶场村烟草种植地中患病烟株分离而得。
2) 其他菌株:烟草立枯病菌(Rhizoctonia solani)、烟草青枯病菌(Ralstonia solanacearum)、烟草黑胫病菌(Phytophthora nicotianae)、烟草炭疽病菌(Colletotrichum nicotianae)各病菌由贵州大学烟草学院实验室提供。
供试培养基:马铃薯琼脂糖培养基(PDA)、Luria-Bertani培养基(LB)、营养琼脂培养基(NA)。
供试品种:云烟87。
2.2. 方法
2.2.1. 生防菌的分离
将采集到的供试土样各取一部分充分混匀,称取10 g倒入容量为250mL的三角瓶内(三角瓶内有玻璃珠),加入90 mL无菌水,放入摇床震荡20~30 min (180 r\min)后静置10 min,取1 mL土壤悬液移至试管中,加入9 mL无菌水混匀,得到10−1稀释液。采用上述同样方法,制成10−3、10−4、10−5、10−6土壤稀释液。从稀释度为10−4、10−5、10−6的土壤悬液各取200 μL分别放入LB、NA、PDA培养基平板,用已灭菌的涂布棒将其涂匀。28℃培养24 h,将形态、大小不同的单菌落挑选出来,用平板划线法纯化后,移接在新的培养基上培养及保存。
2.2.2. 生防菌的筛选
采用平板对峙法 [15] 对分离出的菌株进行初筛,将5 mm大小的赤星病菌菌饼倒扣放置于PDA平板中央,将待试菌株分别接在距离病菌20 mm处呈十字型的4个对称点,28℃条件下培养5 d,观察各菌株是否有抑菌效果,将有抑菌效果的菌株单独保存以供复筛。仍使用平板对峙法对通过初筛的菌株进行复筛,将待测菌株接在距离病菌20 mm处的2个对称点上,每株菌三次重复,28℃培养5 d后观察菌株抑制效果,计算抑制率。
2.2.3. 生防菌的鉴定
1) 形态学与生理生化反应鉴定
将菌株单菌落培养在LB培养基上,观察菌落形态,并参照《常见细菌系统鉴定手册》 [16]、《伯杰细菌系统分类学手册》(第二版) [17] 对菌株进行部分生理生化鉴定。
2) 分子生物学鉴定
采用百泰克细菌基因组DNA提试剂盒提取,使用细菌16S rDNA通用引物 [18] 27F (5'-AGAGTTTGATCCTGGCTCAG-3')、1492R (5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应体系(25 μL):上、下游引物各1 μL,12.5 μL 2xPCR Master mix,9.5 μL ddH2O,1 μL DNA模板。按照94℃ 5 min,94℃ 30 s,54℃退火30 s,72℃ 90 s,35个循环,72℃ 7 min进行扩增。产物电泳检测后送上海生工测序,将结果输入NCBI网站进行BLAST相似序列检索比对,将待测菌株确定到属。
将前一步提取的DNA,用gyrA特异性引物 [18] gyrA-5P(5'-CAGTCAGGAAATGCGTACGTCCTT-3')、gyrA-3P (5'-CAAGGTAATGCTCCAGGCATTGCT-3')进行PCR扩增。PCR反应体系与前述步骤一致。按照94℃ 5 min,94℃ 30 s,53℃退火30 s,72℃ 90 s,35个循环,72℃ 7 min进行扩增。
将电泳检测后的PCR产物送至上海生工进行Sanger测序。结果在NCBI网站上进行BLAST比对后,从GenBank下载菌株对应属的gyrA序列10条(表1),以链球菌属(Streptococcus)作为外祖序列,使用MEGA 7.0软件进行Muscle多序列同源性分析,邻接法(Neighboring-Joinning, NJ)构建系统发育树。
Table 1. GyrA gene sequence information used in the experiment
表1. 实验中所用gyrA基因序列信息
2.2.4. 生防菌对赤星病离体烟叶防治效果测定
采取中下部健康烟叶,使用75%的酒精对烟叶表面进行消毒,用无菌水将待测菌株发酵液菌体浓度稀释至6 × 108 cfu/ml,将稀释液喷施至烟草叶片上,CK喷无菌水,24 h后利用孢子液棉球接种法 [19] 接种烟草赤星病菌,每叶放置6个棉球,处理4片叶,重复3次,叶片根部断裂处用湿棉球包裹保湿,25℃~28℃保温保湿培养5 d [12]。统计各位点发病率和病级(分级标准见表2),计算病情指数和防效。
Table 2. Grading standard of disease severity of detached leaves
表2. 离体叶片发病严重程度分级标准 [20]
2.2.5. 生防菌株对赤星病盆栽防治效果测定
按常规管理方式对盆栽进行管理,选用每株烟中下部3片健康叶进行试验,用无菌水将待测菌株发酵液菌体浓度稀释至6 × 108 cfu/ml,稀释液喷施到烟草叶片上,CK喷施无菌水,24 h后采用孢子液棉球接种法接种烟草赤星病菌,每叶放置8个棉球,重复3次,25℃~28℃保湿培养5 d [12]。统计各位点发病率和病级,计算病情指数和防效。
2.2.6. 生防菌株对4种烟草病害病菌的抑制作用测试
为测试菌株是否对其他烟草病害病菌也存在抑制作用,同样采取平板对峙法,将筛选出的菌株与另外4种烟草病害(烟草立枯病菌、烟草青枯病菌、烟草黑胫病菌、烟草炭疽病菌)进行对峙,并计算抑制率。
2.2.7. 数据处理
(1)
(2)
(3)
用DPS数据处理软件对数据进行处理。
3. 结果与分析
3.1. 生防菌的分离与筛选
通过平板对峙法对土壤中分离处的32株菌进行筛选,结果发现有3株对烟草赤星病菌具有抑制效果,其中一株效果较好(图1)抑制率为51.5% (表3),命名为Y2。

Figure 1. Inhibitory effect of strain Y2 on Alternaria alternata
图1. Y2菌株对烟草赤星病菌的抑制效果
Table 3. Inhibitory effect of Y2 strain on Alternaria alternata
表3. Y2菌株对烟草赤星病原菌的抑制效果
注:表中不同字母表示差异性显著,P ≤ 0.05。
Note: Mean with different letters in the table showed significantly at P ≤ 0.05.
3.2. 生防菌的鉴定
3.2.1. Y2菌株形态及生理生化鉴定
图2表明,Y2菌株菌落整体为乳白色圆形,菌落较小,表面粗糙,边缘为锯齿状,不透明,革兰氏染色为阳性。株菌的生理生化结果见表4。
3.2.2. Y2菌株分子生物学鉴定
提取Y2菌株基因组DNA进行PCR产物克隆扩增,Y2菌株的16S rDNA、gyrA产物长度约为1500 bp与1000 bp左右,Sanger检测结果显示,该菌株16S rDNA与gyrA的片段长度分别为1031 bp和1003 bp。
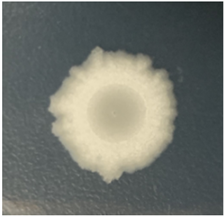
Figure 2. Colony morphology of strain Y2 (Amplification 5 times)
图2. Y2菌株菌落形态(放大5倍)
Table 4. Physiological and biochemical characteristic of Y2
表4. Y2菌株的生理生化特征
注:“+”表示阳性,“−”表示阴性。
Note: “+” means positive and “−“ means negative.
将Y2菌株的16S rDNA序列在NCBI上进行BLAST序列比对,发现该序列与芽胞杆菌属具有较高的相似性,能够初步确定T11菌株为芽胞杆菌属(Bacillus. sp.),但无法根据该片段确定它的种。将gyrA序列于GenBank中进行BLAST分析,结果显示该序列与贝莱斯芽孢杆菌(B.velezensis)具有很高的相似性。图3的系统发育结果表明Y2菌株与贝莱斯芽孢杆菌(B. velezensis)的菌株LF01 (CP058216)在同一分支上,并且该分支可信度为99%,与其他几个种,比如说16S rDNA的BLAST结果不能区分的解淀粉芽孢杆菌(B. amyloliquefaciens)都有一定距离。
3.3. 离体叶片防效测定
经处理,保温保湿培养5 d后,对照组已明显发病,其中一些接种赤星病菌的位点,病菌菌丝已穿透了烟叶在另一面生长,发病严重的叶片开始发黄出现了枯萎的趋势。喷施过Y2菌株发酵液的叶片,接种点病斑面积小,且周边组织迅速变焦枯死,病菌无明显扩散现象,少有菌丝穿透情况。从试验结果(表5)也能看出,经生防菌发酵液处理过的叶片,病情与发病率较对照组来说都有所降低,三组处理的平均防效为57.17%。
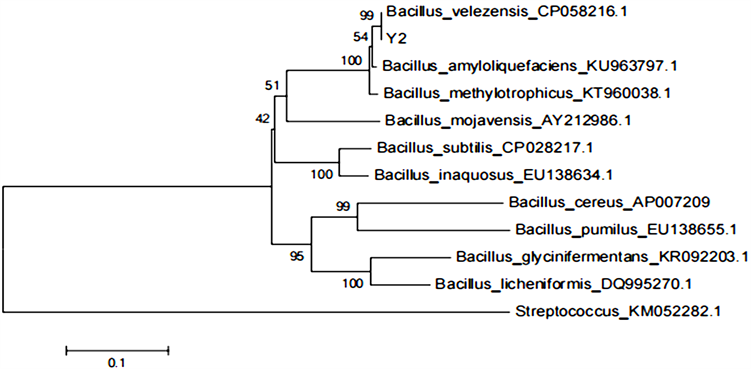
Figure 3. The phylogenetic tree based on gyrA gene sequence of Y2 strain and references from Bacillus sp
图3. 基于Y2菌株gyrA基因序列和芽胞杆菌参考序列构建的系统发育树
Table 5. Control effect of Y2 strain on detached leaves
表5. Y2菌株离体叶片的防治效果
3.4. 盆栽防效测定
结果表明(表6),经Y2菌株发酵液处理过的叶片,发病率为28.61%,病情指数为11.67,防治效果为59.81%,与对照组相比较,接种位点的发病率及病情指数均有不同程度的降低。
Table 6. Control effect of Y2 strain in pot
表6. Y2菌株盆栽防治效果
3.5. 生防菌对四种烟草病害病菌的抑制作用
试验结果表明(图4),Y2菌株对四种烟草病害的病原菌都具有一定抑制效果,其中对烟草立枯病菌的抑制效果最好抑制率达到了78.70%,其次是烟草立枯病菌,抑制率为54.58%。Y2菌株在与烟草炭疽病菌和烟草青枯病菌的对峙中,抑制作用较差,抑制率均在15%以下(表7)。
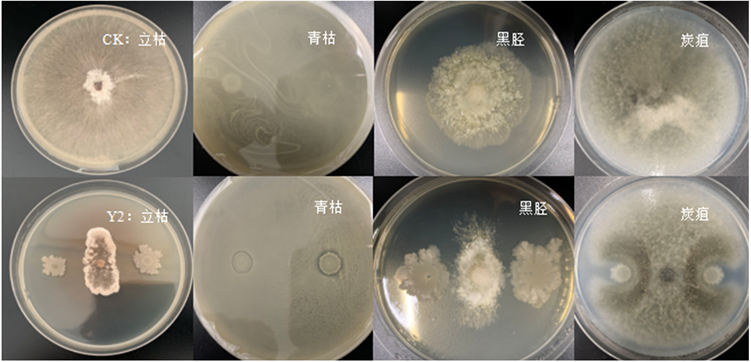
Figure 4. Inhibition effect of Y2 strain on four kinds of disease pathogens
图4. Y2菌株对四种病害病菌的抑制效果
Table 7. Inhibition of Y2 strain on four tobacco diseases
表7. Y2菌株对四种烟草病害病菌的抑制作用
4. 讨论
烟草赤星病是烟株生长期间主要的病害之一,其对烟叶的产量与质量有着巨大的影响。因此,该病害是否能被有效控制对烟叶生产来说至关重要。目前控制烟草赤星病的主要途径是依靠抗病品种和化学防治,但两种防治措施均存在着一定的弊端,因而绿色、低毒、无害、环保的生物防治法就成为了赤星病防治的热点。
本研究在赤星病的防效实验中,盆栽防治效果要好用离体叶片防治效果,推测其原因,认为可能是由于培养箱高温高湿培养环境对赤星病菌的生长及侵染有利,从而加重了叶片的病情,相对就降低了离体叶片的防效。目前该研究仍然处于初级阶段,菌株对于病菌的抑菌机制、菌株的定殖能力、菌株的发酵工艺优化等研究还未进行,应用研究还缺少大田试验,这些也将是下一步研究的主要工作。
5. 结论
本研究从健康烟株的根际土壤筛选出了一株对烟草赤星病菌具有一定抑制作用的拮抗菌Y2。通过形态学特征及生理生化特征进行初步鉴定,结合16S rRNA和gyrA同源性为基础来验证,最终将菌株Y2鉴定为贝莱斯芽孢杆菌。其在离体叶片防效试验和盆栽防效试验中表现出了较好得效果防效均在50%以上。同时在对峙试验中发现,该菌株对烟草赤星病菌、烟草立枯病菌、烟草青枯病菌、烟草黑胫病菌、烟草炭疽病菌等4种烟草病害病菌也表现出了不同程度的抑制作用。这为下一步田间小区试验奠定了基础。
基金项目
中国烟草总公司贵州省公司项目“贵州省烟草叶斑病成灾规律与绿色防控技术研究示范”(黔烟科合:201920)资助。
文章引用
杨德政,孙光军,桑维钧. 烟草赤星病生防菌的筛选、鉴定及应用研究
Screening, Identification and Application of Biocontrol Bacteria against Tobacco Brown Spot Optimization[J]. 农业科学, 2021, 11(05): 461-469. https://doi.org/10.12677/HJAS.2021.115064
参考文献
- 1. Hou, Y.J., Ma, X., Wan, W.T., et al. (2016) Comparative Genomics of Pathogens Causing Brown Spot Disease of To-bacco: Alternaria longipes and Alternaria alternata. PLoS ONE, 11, e0155258. https://doi.org/10.1371/journal.pone.0155258
- 2. 华劲松, 王强. 烟草赤星病发生程度对烟叶产量及产值损失估测[J]. 技术与市场, 2014, 21(2): 129-130.
- 3. Stavely, J.R. and Main, C.E. (1970) Influence of Temperature and Other Factors on Initiation of Tobacco Brown Spot. Phytopathology, 60, 1591-1596. https://doi.org/10.1094/Phyto-60-1591
- 4. Lucas, G.B. (1975) Disease of Tobacco. 3rd Edition, Biological Con-sulting Associates, Raleigh, 267-296.
- 5. 陈瑞泰. 烟草病虫害防治[M]. 济南: 山东科学技术出版社, 1989.
- 6. 宋利明. 我国赤星病发生流行规律调查研究[J]. 烟草科技, 1994(3): 40-42.
- 7. 谈文. 烟草赤星病的发生规律及综合治理[J]. 烟草科技, 1993(2): 45-48.
- 8. 丁国华, 赵淑华. 我国烟草病害及抗赤星病育种研究进展[J]. 黑龙江农垦师专学报, 2001, 15(1): 99-100.
- 9. 成巨龙, 孙渭. 烟草不同发育阶段对赤星病的抗性表现与综合防治技术[J]. 植物保护学报, 2001, 28(1): 44-48.
- 10. 孔凡玉, 石金开. 烟草品种资源对烟草赤星病抗病性鉴定初报[J]. 中国烟草, 1996, 17(4): 39-41.
- 11. Idris, E.E., Iglesias, D.J., Talon, M., et al. (2007) Tryptophan-Dependent Produc-tion of Indole-3-Acetic Acid (IAA) Affects Level of Plant Growth Promotion by Bacillus amyloliquefaciens FZB42. Molecular Plant-Microbe Interactions: MPMI, 20, 619-626. https://doi.org/10.1094/MPMI-20-6-0619
- 12. 易龙, 肖崇刚. 烟草赤星病拮抗细菌的筛选及其控病作用[J]. 植物保护学报, 2004(1): 63-68.
- 13. 唐圣华, 万秀清, 郭兆奎, 等. 烟草赤星病拮抗生防菌BS06-1的筛选[J]. 安徽农业科学, 2008, 36(35): 15564-15565+15595.
- 14. 司世飞. 烟草赤星病生防菌筛选及发酵条件优化[D]: [硕士学位论文]. 贵阳: 贵州大学, 2018.
- 15. 谢宗华, 高健, 王金宇, 等. 一株水稻纹枯菌拮抗细菌的分离与鉴定[J]. 微生物学通报, 2012, 39(4): 477-485.
- 16. 东秀珠, 蔡妙英, 等. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
- 17. R. E. 布坎南, N. E. 吉本斯. 伯杰细菌鉴定手册[M]. 第9版. 北京: 科学出版社, 1984.
- 18. Chun, J. and Bae, K. (2008) Phylogenetic Analysis of Bacillus subtilis and Related Taxa Based on Partial gyrA Gene Sequences. Antonie van Leeuwenhoek, 78, 123-127. https://doi.org/10.1023/A:1026555830014
- 19. 沈奕, 高智谋, 杜雷, 等. 烟草赤星病菌苗期人工接种方法的研究[J]. 安徽农业大学学报, 2009, 36(3): 356-359.
- 20. 张明厚, 张敬荣, 贾文香, 等. 烟叶成熟衰老程度与对赤星病感病性的关系[J]. 植物病理学报, 1998(1): 50-55.
NOTES
*通讯作者。
