Hans Journal of Soil Science
Vol.
07
No.
03
(
2019
), Article ID:
31343
,
7
pages
10.12677/HJSS.2019.73028
Effect of De-Icing Salt on Adsorption Law and Kinetics of Cadmium in Soil
Ling Guo, Yanjiao Wang*, Ying Zhang, Wei Ma, Li Yuan
Guizhou Academy of Testing and Analysis, Guiyang Guizhou
Received: Jun. 28th, 2019; accepted: Jul. 15th, 2019; published: Jul. 22nd, 2019

ABSTRACT
NaCl in De-icing Salt is one of chemical components in soil itself. An investigation on the effects of NaCl on adsorption of Cd2+ in the Tongren, Qiandongnan, Qiannan in Guizhou province were carried out using isothermal adsorption and kinetic experiment. 1) The adsorption behaviour of Cd2+ was different when NaCl was added into solution. Under the action of NaCl, three regional soils adsorption capacity of the metals were lower. About different metals, the adsorb ability order of three regional soils was different. 2) Under the action of NaCl, the desorption rate of Cd2+ was from 8.69% - 43.3% to 17.5% - 54.1%. 3) The more suitable mode for the two types of solution in three regions to adsorb Cd2+ is Langmuir mode. The low concentration range was suitable Henry, but the high concentration range was suitable Langmiur. 4) Elovich equation has the highest correlation coefficient, and most suitable description of kinetic adsorption process. The highest R2 is 0.9098. From the parameters, under and without NaCl, Cd2+ had no effect.
Keywords:De-Icing Salt, Cd2+, Adsorption, Desorption, Kinetics
融雪剂对Cd在土壤中吸附规律及动力学影响
郭令,王艳娇*,张莹,马蔚,袁丽
贵州省分析测试研究院,贵州 贵阳
收稿日期:2019年6月28日;录用日期:2019年7月15日;发布日期:2019年7月22日

摘 要
融雪剂中NaCl是人为加入土壤中的化学成分。通过等温吸附试验和吸附动力学试验,研究了NaCl对贵州铜仁、黔东南、黔南三个地区道路周边混合黄壤中Cd2+的吸附行为。1) Cd2+在土壤中的吸附行为由于溶液中加入NaCl而有所差异。在NaCl作用下,三地区土样对两种重金属的吸附能力降低。对于不同重金属,三地区土样的吸附能力顺序有所不同。2) 在NaCl作用下,Cd2+的解吸率由原来的8.69%~43.3%增加17.5%~54.1%。3) 两种吸附液中三地区土样对Cd2+的吸附用Langmuir模式来拟合较合适。在低浓度范围用Henry模式拟合比较合适,而在高浓度时适合用Langmuir拟合比较合适。4) 动力学试验表明:Elovich方程拟合出的相关系数最高可达0.9098,最适合描述动力吸附过程。由拟合参数计算出,在有无NaCl作用下,而对Cd2+作用效果不明显。
关键词 :融雪剂,Cd2+,吸附,解吸,动力学

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
用来降低冰雪冰点的盐称为化冰盐或融雪剂(de-icing salt)。长期以来,世界各国清除道路积雪的方法主要是铺洒融雪剂,因成本低,融雪速度快,被越来越多的国家广泛采用,如氯化钠。然而在消除道路冰雪的同时,随着气温逐渐升高,含有氯化钠的积雪大量融化后进入道路周边土壤和地下水环境,造成“盐害”次生灾害。这一生态环境问题已越来越受到各国植物、生态和环境科学研究者的关注。
近年来,国外Eberhard Werner [1] 等许多学者对融雪剂施用后造成的地表水、地下水、土壤的污染甚至对整个流域产生的不良生态影响进行了研究。只有少数文献研究了融雪剂对土壤环境中重金属迁移的影响。如Ann Catrine Norrstrom [2] 研究了关于融雪剂对土壤环境中Pb、Cd、Zn、Fe迁移率的影响。从查阅的文献来看,国内外尚未见针对高Hg、Cd背景值的土壤在NaCl作用下Cd迁移行为的研究报道。
贵州铜仁、黔东南、黔南三个地区土壤中的Cd2+一直具有较高的背景值,在研究其混合黄壤对Cd2+吸附解吸特性的基础上,结合道路铺洒融雪剂情况,分析高浓度Na+和Cl−进入土壤后对上述三地区公路沿线周围黄壤中Cd2+迁移行为的作用机制及规律,为评价区域内土壤质量、农产品产地认证;分析此次低温雨雪冰冻灾害对环境影响;为灾后恢复重建提供科学依据。
本文研究了NaCl对贵州铜仁、黔东南、黔南三地区混合土壤Cd2+的吸附解吸规律的影响。
2. 样品处理及实验
2.1. 供试土壤
供试土壤为贵州高Cd2+背景值地区(铜仁、黔东南、黔南等)的黄壤。采样点位分布在:铜仁地区:玉屏—铜仁高速沿线;黔东南地区:麻江—凯里高速沿线;黔南地区:都匀—独山高速沿线,每条高速沿线随机选取20个采样点,采样深度为0~20 cm,混合而成三个地区的土壤样品。土样基本理化性质测定值 [3] [4] 见表1。土样经风干、粉碎后,分别过20目筛备用。
2.2. 实验器材及方法
2.2.1. 仪器及相关参数
火焰原子分光光度计(Nov AA Contr 300)。
Table 1. The properties of tested soil
表1. 土壤基本理化性质
检出限:Cd ≤ 0.001。
相关系数:Cd ≥ 0.995。
元素相对标准偏差:Cd ≤ 5%。
高纯乙炔气:≥99.99%。
实验过程全部用水均为去离子水。
2.2.2. 等温吸附试验
称取供试土壤1.0000 g (±0.0005 g)置于离心管中,分为两组:① 分别加入以去离子水和NaCl水溶液(0.1 mol∙L−1)为溶剂配制的Cd2+溶液,浓度分别为0.1 mg∙L−1、l mg∙L−1、5 mg∙L−1、l0 mg∙L−1、20 mg∙L−1、50 mg∙L−1、100 mg∙L−1、200 mg∙L−1,300 mg∙L−1;② 加入以不同浓度NaCl水溶液(0.2, 0.4, 0.6, 0.8, 1.0, 1.2, 1.4, 1.6, 2.0 mol∙L−1)为溶剂配制的相同浓度的Cd2+溶液(50 mg∙L−1)。土液比为1:40,恒温(25℃ ± 0.1℃)下振荡16h,离心后取上清液。将第一组吸附过Cd2+的土样立即称重,计算出土样中残留液体积。然后加入去离子水和0.1 mol∙L−1的NaCl水溶液,恒温(25℃ ± 0.1℃)下振荡16 h,离心后取上清液。用novAA300火焰原子吸收光谱仪测定吸附及解吸平衡后溶液中Cd2+浓度C和C′,计算出土样中Cd2+的吸附量X和解吸量X′。土壤中Cd2+的等温吸附解吸过程用langmuir等温方程拟合。试验重复5次。
2.2.3. 吸附动力学试验
称取供试土壤1.000 g (±0.0005 g)置于离心管中,分别加入以去离子水和NaCl水溶液(0.1 mol∙L−1)为溶剂配制的Cd2+浓度为50mg∙L−1的溶液,土液比为1:40,恒温(25℃ ± 0.1℃)下分别振荡1 min、5 min、10 min、15 min、30 min、45 min、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、12 h、16 h、20 h后取出一只离心管,离心后取上清液,用火焰原子吸收分光光度计测定Cd2+浓度,通过上清夜的浓度计算出不同时间的吸附量(S)。分别用双常数方程、Elovich方程、一级动力学方程、抛物线方程及二级动力学方程进行拟合。试验重复5次。
3. 结果讨论
3.1. NaCl对Cd的吸附规律的影响
Sm值越大,意味着土样对Cd2+的吸附能力越强,表中的三组数据都显示在溶液中添加NaCl后土样对Cd2+的吸附能力降低,而参数k1可作为土壤对重金属吸附作用强弱的指标,越大则表示土壤对重金属离子吸附作用越强 [5] ,由表2中数据也可得知,对于三个土样,在吸附液中添加NaCl致使吸附能力下降。这与实验结果一致。
3.2. 吸附–解吸关系
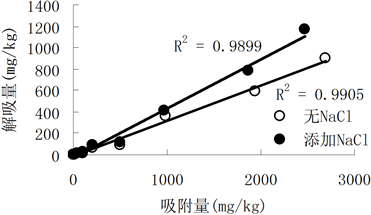
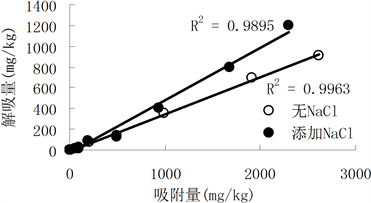
图1显示三个土样两种重金属随着吸附量的增加,解吸量也随之增加,这与吸附过程有关。随着吸
Table 2. The fitting parameters of three soil adsorption isotherm equation
表2. 三个土样吸附等温线方程拟合参数
附量的增加,土壤和Cd2+的专性吸附逐渐减少,交换吸附的Cd2+增多,而高浓度时吸附(交换吸附)在低位能点Cd2+较容易解吸,从而使土壤吸附态镉的解吸量增加。而对单个图来看,有无添加NaCl对Cd2+吸附量与解吸量关系并无明显影响,线性关系都可达到0.9以上。
背景溶液对土壤吸附Cd2+的解吸率8.69%~43.3%的范围内,而添加了NaCl的背景溶液对土壤吸附Cd2+的解吸率17.5%~54.1%的范围内。由langmuir方程计算出Cd2+的最大吸附量都因添加NaCl而降低,然而添加NaCl使镉的解吸量只有少量增加,这说明Cd2+在土壤中的移动性稍强。
对Cd2+而言,有无NaCl的作用,土壤对Cd2+的吸附选择性弱,以低位能点或物理吸附为主,解吸相对容易,因而添加NaCl后,Cd2+的吸附量与解吸量的关系变化不大。
 (a)
(a)
 (b)
(b)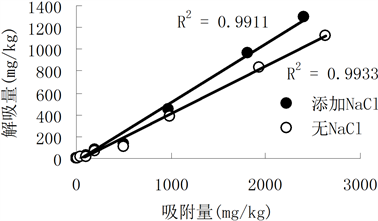 (c)
(c)
Figure 1. Relationship between Cd adsorption and desorption in three regions
图1. 三个土样对Cd的吸附与解吸关系曲线
3.3. 吸附动力学
与土壤对镉的静态吸附相同,在研究两种土壤对镉的动态吸附时,同样发现NaCl对镉的吸附具有抑制作用,由图可看出,添加NaCl可使镉的平衡吸附时间提前。
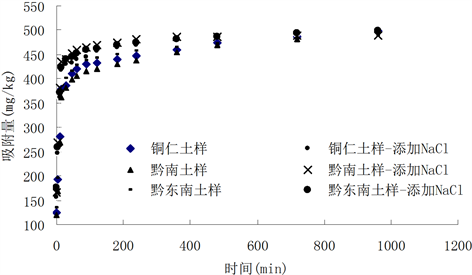
Figure 2. Cd adsorption curves in three soil samples
图2. Cd在三个土样上的吸附动力学曲线
上图2中吸附量的变化也显示了同样的趋势。两种溶液在最开始的阶段吸附速度都很快,几乎呈直线上升,然后突然放慢,进入吸附速度增长缓慢的阶段。吸附过程包括最初的快速反应和之后的慢速反应阶段,随着溶液与吸附剂作用时间的延长吸附曲线变得十分平缓,吸附速度变缓,吸附与解吸逐渐趋于平衡。土壤中慢速反应的机制至少包括以下两个过程:1) 金属离子扩散至土壤空隙及之后的吸附反应;2) 吸附络合反应可能经历后续反应以形成稳定结构。金属离子在空隙中的解吸和形成络合稳定结构要比初始吸附慢得多。
吸附速率与参与吸附反应的吸附质和吸附剂性质有关。物理吸附一般在几毫秒或几秒内就可以达到局部平衡,但其它的吸附过程如化学吸附反应需要较大的活化能,存在慢吸附反应步骤。通常情况下,重金属等污染物在土壤及土壤组分上的吸附过程分为快速阶段和慢速阶段,一般认为快速阶段可归因于化学反应和表面扩散机制(表面扩散是反应限速步骤):而慢速阶段与污染物向无机矿物和腐殖质的微孔、反应能态较低位点扩散以及表面沉淀现象有关。Lehmann [6] 的Cu2+吸附动力学试验表明,94%的Cu2+吸附在15分钟内完成,提示Cu2+先吸附在高能位点上。如果Cu2+过量,剩余的Cu2+再去填充低能位点,这种松结合态的键合反应可持续几小时到一天左右。Cu2+在针铁矿上的吸附快反应发生在毫秒级时间尺度上。
这种吸附模式可以称为两阶段过程(bi-phasic process),通常有两个概念模型解释“两阶段吸附”机理 [7] ,即两点模型(two-site model)和多层理论(multi-1ayer theory)。两点模型认为吸附的每个阶段分别由不同的吸附位(低能位和高能位)产生,而多层吸附理论认为,最初的快速吸附是开始在吸附表面形成第一个分子层的结果,而非平衡吸附即慢速吸附则是吸附质在第一分子层的基础上继续积累的结果,而非平衡(或慢速吸附)是吸附质从颗粒间向有机质内部扩散的过程。多层理论通常指BET理论。Shonnard [8] 等曾成功应用这一理论解释了某些吸附。
3.4. 动力学方程拟合
常用来描述离子吸附的动力学过程的数学模型包括两类:一类是建立在化学动力学模型基础上,如抛物线方程、一级动力学方程等;另一类属经验性方程,如Elovich方程及双常数方程等 [9] [10] 。
一级动力学方程是基于反应物浓度与反应速度之间调控关系的化学动力学方程。抛物线方程说明了吸附与解吸过程的扩散转运机制,Elovich方程是基于吸附剂表面吸附热随其表面覆盖度的增加而线性下降,并于此条件对理想吸附等温式加以改进而推导得到的方程,它描述的是包括一系列反应机制的过程,如溶质在溶液体相或界面处的扩散、表面的活化与去活化作用等,它不适合描述单一反应机制的过程,却非常适用于反应过程中活化能变化较大、包括一系列反应机制的过程 [11] [12] ,如土壤和沉积物界面上的吸附过程。双常数方程也是经验式,即修改的Freundlich方程,经实验应用表明,它同样适合于描述反应过程较复杂的动力学方程,可用于研究磷、砷等含氧酸根和重金属的吸附解吸动力学 [10] 。
表3、表4是用四种动力学方程进行拟合得出的相关参数。可见Elovich和双常数方程拟合的相关性均达到了显著水平,通过相关系数r2的比较,Elovich方程更适合描述两种土壤的动力吸附过程。Elovich方程中,a值大小反映了吸附速率的快慢,对于Cd,Elovich线性方程的相关系数较好,而添加NaCl的吸附过程a值较无NaCl作用时大,说明对于Cd的吸附过程中,NaCl的加入,起到支持电解质的作用促进Cd吸附。双常数方程中 [13] ,a被视为初始瞬时速率,a值高,意味着吸附瞬间速率高;而b则反映了一定范围内动力学过程的一个平均速率,b值高,意味着在一定浓度范围内,吸附速率较低。当b > 1时,则吸附速率随时间的延长而增大;当0
Table 3. The Cd fitting parameters of three soil adsorption kinetics equation
表3. 两种吸附液三个土样对Cd的动力学吸附方程拟合参数
Table 4. The Cd fitting parameters of three soil adsorption kinetics equation (continuation table)
表4. 两种吸附液三个土样对Cd的动力学吸附方程拟合参数(续表)
4. 结论
融雪剂中NaCl是人为加入土壤中的化学成分。通过等温吸附试验和吸附动力学试验,研究了NaCl对贵州铜仁、黔东南、黔南三个地区道路周边混合黄壤中Cd2+的吸附行为。1) Cd2+在土壤中的吸附行为由于溶液中加入NaCl而有所差异。在NaCl作用下,三地区土样对两种重金属的吸附能力降低。对于不同重金属,三地区土样的吸附能力顺序有所不同。2) 在NaCl作用下,Cd2+的解吸率由原来的8.69%~43.3%增加17.5%~54.1%。3) 两种吸附液中三地区土样对Cd2+的吸附用Langmuir模式来拟合较合适。在低浓度范围用Henry模式拟合比较合适,而在高浓度时适合用Langmuir拟合比较合适。4) 动力学试验表明:Elovich方程拟合出的相关系数最高可达0.9098,最适合描述动力吸附过程。由拟合参数计算出,在有无NaCl作用下,而对Cd2+作用效果不明显。
基金项目
国家自然科学基金(2176070134);人才培养项目(黔科合平台人[2017]5719-02)。
文章引用
郭 令,王艳娇,张 莹,马 蔚,袁 丽. 融雪剂对Cd在土壤中吸附规律及动力学影响
Effect of De-Icing Salt on Adsorption Law and Kinetics of Cadmium in Soil[J]. 土壤科学, 2019, 07(03): 226-232. https://doi.org/10.12677/HJSS.2019.73028
参考文献
- 1. Werner, E. and Di Pretoro, R.S. (2006) Rise and Fall of Road Salt Contamination of Water-Supply Springs. Environmental Geology, 51, 537-543. https://doi.org/10.1007/s00254-006-0350-x
- 2. Norrstrom, A.C. (2005) Metal Mobility by De-Icing Salt from an Infiltration Trench for Highway Runoff. Applied Geochemistry, 20, 1907-1919. https://doi.org/10.1016/j.apgeochem.2005.06.002
- 3. 郎印海, 聂新华, 曹正梅, 刘宗峰, 等. 胶州湾近岸沉积物中五氯酚钠的吸附–解析研究[J]. 海洋环境科学, 2008, 27(3): 231-235.
- 4. 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业出版社, 2000.
- 5. 丁昌璞, 潘映华. 红壤对铝锰离子的吸附特征: III. 铝锰离子对的交换吸附[J]. 土壤学报, 2004, 41(2): 259-264.
- 6. Lehmann, R.G. and Hatter, R.D. (1984) Assessment of Copper-Soil Bond Strength by Desorption Kinetics. Soil Science Society of America Journal, 48, 769-772. https://doi.org/10.2136/sssaj1984.03615995004800040014x
- 7. Morrissey, F.A. and Grismer, M.E. (1999) Kinetics of Volatile Organic Compound Sorption/Desorption on Clay Minerals. Journal of Contaminant Hydrology, 36, 291-312. https://doi.org/10.1016/S0169-7722(98)00150-8
- 8. Shonnard, D.R., Bell, R.L. and Jackman, A.P. (1993) Effects of Nonlinear Sorption on the Diffusion of Benzene and Dichloromethane from Two Air-Dry Soils. Environmental Science & Technology, 27, 457-466. https://doi.org/10.1021/es00040a002
- 9. 胡国松, 赵春生. 可变电荷土壤和矿物对Pb2+和Cu2+的吸附动力学[J]. 热带亚热带土壤科学, 1994, 3(3): 146-152.
- 10. 魏俊峰, 吴大清. 铅在高岭石表面的解吸动力学[J]. 矿物岩石, 2002, 22(2): 5-8.
- 11. 涂从. 土壤体系中的化学动力学方程及其应用[J]. 热带亚热带土壤科学, 1994, 3(3): 175-182.
- 12. Ahrland, S., Grenthe, I. and Noren, B. (1960) The Ion Exchange Properties of Silica Gel: I. The Sorption of Na+, Ca2+, Ba2+, UO22+, Gd3+, Zr(IV)+Nb, U(IV)and Pu(IV). Acta Chemica Scandinavica, 14, 1059-1076. https://doi.org/10.3891/acta.chem.scand.14-1059
- 13. Chien, S.H. and Clayton, W.R. (1980) Application of Elovich Equation to the Kinetics of Phosphate Release and Sorption in Soils. Soil Science Society of America Journal, 44, 260-264. https://doi.org/10.2136/sssaj1980.03615995004400020013x
- 14. Allen, E.R., Hossner, L.R., Ming, D.W. and Henninger, D.L. (1996) Release Rates of Phosphorus, Ammonium, and Potassium in Clinoptilolite-Phosphate Rock Systems. Soil Science Society of America Journal, 60, 1467-1472. https://doi.org/10.2136/sssaj1996.03615995006000050026x
