Open Journal of Fisheries Research
Vol.05 No.02(2018), Article ID:25662,14
pages
10.12677/OJFR.2018.52012
Reproductive Property of the American Shad, Alosa sapidissima, under Reared Conditions
Xiaoqiang Gao1, Zhifeng Liu1, Bin Huang1, Changtao Guan1, Yaohui Wang2, Guoping Xue3, Weilun Qin2, Lei Hong1*
1Chinese Academy of Fishery Sciences, Key Laboratory for Marine Fish Breeding and Biotechnology, Yellow Sea Fisheries Research Institute, Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture, Qingdao Shandong
2Jiangsu Zhongyang Group, Nantong Jiangsu
3Haian Aquatic Product Technology Promotion Department, Nantong Jiangsu

Received: Jun. 13th, 2018; accepted: Jun. 23rd, 2018; published: Jun. 28th, 2018

ABSTRACT
In order to assess the reproductive property of American shad Alosa sapidissima in the reproductive cycle, the biological indexes, oocyte development, the patterns of oogenesis, spawning season and fecundity were studied by applying histologic technology, ecology and quantitative trait method. The result showed that the development of ovary and testis was divided into six stages, respectively; in addition, the oogenesis and spermatogenesis could be divided into six phases, respectively; at least two distinct batches of vitellogenic oocytes were found in American shad ovaries at different development stage, and in mature ovaries, there were two additional modes of oocytes present, indicating that this species is a group synchronized multiple batch spawners. During the gonadal development, the mean GSI for females and males remained a high level from April to June for 2016, and a maximum was reached in May (29.24% ± 3.84% for female and 8.06% ± 1.19% for male), suggesting that the reproduction periods occurred from April to June. The HIS of females displayed a sharp increase was observed from January to March, with peak values occurring in March (2.05% ± 0.05%). The HIS of males exhibited a fast fall from January to June, and the lowest in June (0.93% ± 0.1%). The estimated values of batch fecundity varied widely from 69,033.99 to 414,184.28 eggs per fish (mean = 304,251.71 ± 61,293.27). The relative batch fecundity ranged from 71.38 to 395.38 oocytes g−1 body weight (mean = 254.44 ± 49.11). In a word, American shad belongs to the non-synchronized multiple batch spawner, and the breeding season is from April to June. Its fecundity is low and the breeding period is long.
Keywords:American Shad Alosa sapidissima, Gonad Development, Reproductive Season, Spawning Pattern, Fecundity
美洲鲥繁殖特性研究
高小强1,刘志峰1,黄滨1,关长涛1,王耀辉2,薛国平3,秦巍仑2,洪 磊1*
1农业部海洋渔业可持续发展重点实验室,青岛市海水鱼类种子工程与生物技术重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛
2江苏中洋集团股份有限公司,江苏 南通
3海安县水产技术推广站,江苏 南通

收稿日期:2018年6月12日;录用日期:2018年6月23日;发布日期:2018年6月28日

摘 要
采用组织学、形态学及数量统计学等分析方法,研究了自2015年10月至2016年9月人工养殖条件下美洲鲥亲鱼繁殖周年特性。结果表明,美洲鲥卵巢发育分为6期,精巢发育分为6期;根据卵母细胞的形态结构、卵黄物质积累和滤泡细胞的变化,将卵子发生划分为6个时相;根据精母细胞的形态结构及变化,将精子发生分为6期;不同发育阶段的卵巢中至少含有两种处于不同发育时相的卵母细胞,且卵径分布呈现明显的“双峰型”也表明美洲鲥产卵类型为部分同步类型。在性腺周期发育过程中,雌雄亲鱼性腺指数(GSI)在4~6月份保持较高的水平,且最高值均出现在5月(雌鱼:29.24% ± 3.84%,雄鱼:8.06% ± 1.19%),暗示了美洲鲥繁殖季节主要发生在4~6月份。自2016年1月到3月,雌鱼肝体比(HIS)迅速增加,且在3月到达最大值(2.05% ± 0.05%)。而雄鱼自2016年1月到6月,指数快速降低,在6月到达最低值(0.93% ± 0.1%),说明了肝脏在性腺发育过程中发挥着重要的生理作用。肥满度(CF)在繁殖盛期达到最大,表现出与GSI类似的变化趋势。美洲鲥绝对繁殖力为69,033.99粒~414,184.28粒(平均304,251.71 ± 61,293.27),相对繁殖力为71.38粒/g~395.38粒/g (平均254.44 ± 49.11粒/g)。综上所述,美洲鲥产卵类型属于非同步批次产卵类型,繁殖期主要为4~6月,其繁殖力低,繁殖期较长。
关键词 :美洲鲥,性腺发育,繁殖季节,产卵类型,繁殖力

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
繁殖特性是生物在长期进化过程中,为了更好的适应环境、选择压力、提高生殖适合度的一种生活史对策,在种群调节中起着重要的作用,也是物种进化的一个重要方面,其包含了性腺发育、繁殖方式、繁殖地点、产卵时间及亲本护幼等方面。鱼类为了保证其种群及后代能够最大限度的适应所生存的环境,其在繁殖模式上表现出了明显的多样性和复杂性 [1] [2] 。如大多数底栖冷水海洋鱼类更趋向于同步型产卵模式,其繁殖力是确定的;而多数在温带水域上层的鱼类则趋向于非同步型产卵模式,具有不确定的繁殖力,而且非同步型产卵鱼类相对于同步产卵鱼类具有更长的繁殖期 [2] [3] [4] 。因此,全面了解养殖鱼类的繁殖特性,对于深入了解其繁殖特点、生理机制及苗种繁育至关重要。
美洲西鲱(Alosa sapidissima)又名美洲鲥,隶属于鲱形目(Clupeiformes)、鲱科(Clupeidae)、西鲱属(Alosa),是鲱科中个体较大且较为普遍的溯河产卵种类,主要分布在北美洲大西洋海岸、太平洋海岸的加州圣地亚哥到阿拉斯加、俄罗斯的勘察加半岛及亚洲东南部等区域 [5] [6] [7] [8] ,与中国鲥(Tenualosa reevesii)同属不同种,具有类似的溯河产卵习性,形态特征、肉质和风味等都与中国鲥十分相似,具有较高的营养价值。在过去的几十年里,作为我国鲥替代品引入中国,其养殖规模及技术日益成熟,已经成为我国名贵的淡水鱼类之一。目前,国内外对美洲鲥研究报道较多,如美洲鲥胚胎发育 [9] [10] [11] 、繁育育种 [12] [13] 、早期器官发生 [14] 、摄食特性 [15] [16] 、生长特性 [17] [18] 、遗传多样性 [19] [20] 及消化生理 [21] 等方面进行了系统的研究。而对于亲鱼整体繁殖特性方面研究较少,本实验通过对美洲鲥的性腺周期发育、繁殖季节、产卵类型、繁殖力等繁殖生物学特性的研究,旨在了解美洲鲥繁殖策略,从而进一步丰富和完善美洲鲥繁殖生物学基础数据和资料,也为美洲鲥的亲鱼营养强化、人工诱导产卵及大规模繁殖提供理论参考。
2. 材料与方法
2.1. 亲鱼采集
根据国内美洲鲥10多年的养殖经验数据发现,养殖美洲鲥2龄时即已达到性成熟 [9] [22] 。本研究根据目测等级法及组织学切片法,随机选取性成熟美洲鲥亲鱼(3龄)作为研究对象,于温室大棚水泥池进行饲养,规格为68 × 21 × 1.5 m3,共4000尾。2015年10月到2016年9月在江苏中洋集团养殖基地进行美洲鲥样品周期收集,每月随机选取24尾亲鱼,共采集美洲鲥288尾,其中雌鱼164尾,雄鱼124尾。采样渔具为尼龙制拖底拉网(网目6 cm)。期间全部测定鱼体体长(Standard length, SL)、全长(Total length, TL)、体重(Body weight, BW)、内脏重(Visceral weight, VW)、肝重(Liver weight, LW)和性腺重(Gonad weight, GW),长度精确到1 mm,重量精确到0.1 g。饲养管理:对每个月养殖水质进行监测,每天测量3次(8:00, 12:00, 18:00),期间养殖水温变化见图1,溶解氧控制在5.5~7.5 mg/L,pH 7.5~8.0,氨氮控制在0.05 mg/L以下,自然光照。定时巡查,每月换等温淡水1/5,饲养用水为经充分过滤、曝气及消毒处理后的地下水。每日定时投喂公司自制专用饲料(7:00, 11:00, 17:00)。

Figure 1. The water temperature change during the rearing period
图1. 养殖期间水温变化
2.2. 性腺组织切片
亲鱼称重测量以后,于冰盘上剖开腹部,取出性腺,剪切成适当大小,用生理盐水冲洗净后立即浸泡于4%多聚甲醛溶液中24 h,然后转入70%的酒精中保存带回实验室备用。实验时,将性腺样本常规乙醇梯度脱水、二甲苯透明及石蜡包埋,运用LeiCa RM2265轮转式切片机进行连续切片,切片厚度6~10 um,H.E染色,中性树胶封片,NIKON YS100显微镜下观察拍照。性腺分期参照Roomiani对云鲥Tenualosa ilisha的划分标准 [23] 。
2.3. 繁殖季节
繁殖季节主要依照性腺发育情况来确定。当样本中出现一定比例的Ⅳ、V期个体,基本可以确定属于繁殖季节。另外,还可以结合种群雌雄个体不同月份的体指参数变化来确认。美洲鲥繁殖期主要采用了性腺指数GSI (gonadosomatic index)、肝体比HIS (hepatosomatic index)和脏体比K (Fulton’s condition factor)三个参数来进行描述 [24] 。其公式如下:GSI = 100 × (GW/BW),HIS = 100 × (LW/BW),K = 100 × (BW/SL3),其中GW性腺的重量,BW为鱼体的体重,LW为肝脏重量,SL为鱼体体长。
2.4. 产卵类型
美洲鲥产卵类型的判断主要以卵径的分布来判断 [24] [25] 。每月随机选取至少6条雌鱼的卵巢进行卵径的测量,共选取样本90尾雌鱼,解剖的卵巢样品取得后用10%中性福尔马林固定,带回实验室进行测量。选取卵巢同样的部位在解剖镜(Leica EZ4 HD)下对卵粒进行分离工作,应用显微镜(Olympus BX51 Tokyo, Japan)进行拍照,然后用Image-Proplus软件对卵径进行测量。每尾鱼至少测量1000粒卵。
2.5. 繁殖力
获取一定数量的Ⅳ期雌鱼,立即称取卵巢重(精确到0.1 g),作为繁殖力研究对象进行怀卵量统计,分别从卵巢的前、中、后部随机取部分卵巢混合后称取1~5 g,以10%的福尔马林固定,带回实验室计数。Panhwar等研究云鲥表明,卵母细胞 < 125 um属于卵黄积累前期阶段,125~250 um滤泡阶段,卵母细胞直径 > 250 um属于卵黄积累阶段 [26] 。因此,本实验计数时将所有直径大于250 um的卵母细胞全部进行计数,获得每克卵巢所含卵粒数,并以此计算绝对和相对怀卵量。
绝对怀卵量 = 1克卵粒数 × 卵巢重;相对怀卵量 = 绝对怀卵量/去内脏重。
2.6. 数据统计分析
统计分析采用SPSS 18.0进行处理,实验结果以平均值 ± 标准差(Mean ± SD),应用Origin 8.0软件进行相关图制作。
3. 结果
3.1. 美洲鲥卵巢发育形态变化
美洲鲥卵巢成对存在,分为左右2叶,位于体腔中腹两侧,紧贴于体肾,在鱼体稍后端形成细小的输卵管。美洲鲥卵巢富有产卵板及大的卵巢腔,当卵巢发育成熟时,卵巢的滤泡膜破裂,大量成熟的卵子进入卵巢腔,后经输卵管由泄殖孔排出体外。根据卵巢外部形状、色泽及显微表观观察为卵巢划分依据,将美洲鲥的卵巢发育分为6期。
第Ⅰ期 卵巢较小,呈透明细线状,位于腹腔壁后体腔两侧,肉眼不能分辨雌雄。卵巢内主要以卵原细胞为主,其排列杂乱无章,多为圆形或椭圆形,具有较大的细胞核 [27] 。终生只出现一次,在亲鱼卵巢周年期发育过程中并未发现。
第Ⅱ期 卵巢长度继续增加,可见完整的双叶状结构,呈现前部钝圆逐渐往后细长延伸的圆锥形,肉红色,表面由一层淡红色被膜所覆盖,表明可见明显的微细血管,肉眼可初步分辨出雌雄,内部则观察不到卵粒,此时性指数GSI为1.91% (图2(A))。
第Ⅲ期 卵巢呈现粉红色或淡黄色,表面具丰富的血管。卵巢体积明显比II期增大,外部形态为扁平长囊状,前端膨胀延长,呈现三角形。卵巢上可见分叶所形成的横纹,此时,肉眼可观察到细小的卵粒,但不容易分离,此时性指数GSI为6.33% (图2(B))。
第Ⅳ期 卵巢呈现淡黄色或浅红色,其表面富满血管。其体积进一步膨胀,呈囊状,几乎充满体整个体腔。两侧卵巢在鳔处有少量重叠,卵巢内部卵细胞颗粒多而饱满,肉眼可见,但卵粒相互粘连,不游离,此时性指数GSI为16.81% (图2(C))。
第Ⅴ期 卵巢极度发育,表面血管密布,呈淡黄色,体表可见明显的圆柱形隆起。其膨大饱满、松软,内部透明卵粒较多,主要集中在前中部,末端较少。卵巢内卵粒大都呈游离态。轻轻挤压雌鱼腹部,泄殖孔处有成熟卵粒流出,遇水后快速膨胀而呈圆形。此时性指数GSI为29.24% (图2(D))。
第Ⅵ期 即产后卵巢,卵巢开始退化,体积和重量大幅度降低,质地松软、瘪塌,卵巢腔开始萎缩,其后端空虚,呈现暗红色。卵巢中仍然可见未产出退化的乳白色成熟卵,此时性指数GSI为5.68% (图2(E))。
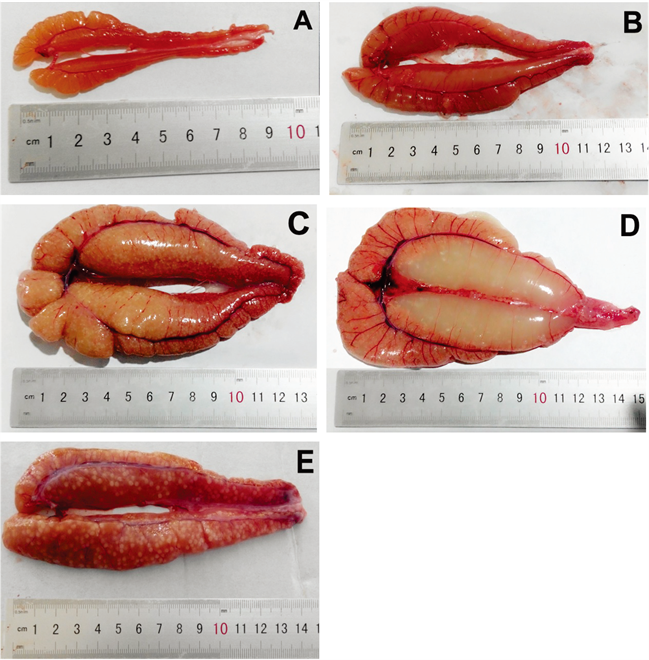 A: Ⅱ期卵巢;B: Ⅲ期卵巢;C: Ⅳ期卵巢;D: Ⅴ期卵巢;E: Ⅵ期卵巢;A: stage Ⅱ ovary; B: stage Ⅲ ovary; C: stage Ⅳ ovary; D: stage Ⅴ ovary; E: stage Ⅵ ovary
A: Ⅱ期卵巢;B: Ⅲ期卵巢;C: Ⅳ期卵巢;D: Ⅴ期卵巢;E: Ⅵ期卵巢;A: stage Ⅱ ovary; B: stage Ⅲ ovary; C: stage Ⅳ ovary; D: stage Ⅴ ovary; E: stage Ⅵ ovary
Figure 2. Morphological change of the ovary in Alosa sapidissima
图2. 美洲鲥鱼卵巢发育形态
3.2. 美洲鲥卵巢组织学分期
鱼类卵子的发生经过增殖、生长和成熟这几个时期。随着季节的变化和性周期的运转,在卵巢的组织发育过程中,可以观察到处在不同发育阶段的生殖细胞。根据显微拍照观察显示,美洲鲥卵巢发育分为6个时期:
I期卵巢 卵巢内细胞主要为卵原细胞,呈现圆形或椭圆形。
II期卵巢 处于此时期的卵巢中的卵细胞进入小生长期,即卵原细胞经过卵质的合成、积累和贮存形成初级卵母细胞。此时期的卵母细胞主要处于染色质核仁阶段和核仁外周期阶段,其呈圆形、椭圆形或多角形,细胞核卵圆形,并可清晰观察到细胞核的偏位现象,细胞核切面上有约1~10个核仁,位于核膜的边缘。由于卵质的合成与积累,细胞质增长较快,细胞质呈现强嗜碱性,苏木精染色成蓝紫色(图3(A))。
III期卵巢 初级卵母细胞进入大生长期,其形态基本呈圆球形,细胞体积明显增大,细胞质呈现弱嗜碱性。核膜呈波状形,核仁明显增多,十几个到数十个不等的细小核仁附在核膜上。此时一些卵母细胞处在染色质核仁阶段,大部分卵母细胞处于核仁外周期,更大的卵母细胞的细胞质外缘出现皮质液泡,进入皮质泡阶段(图3(B)),随后液泡数目不断增加并逐渐向内缘移位,从一层、两层到数层,细胞质中清晰可见卵黄颗粒,此时卵黄细胞进入早期卵黄积累阶段(图3(C))。
 A: II时相卵母细胞;B和C: III时相卵母细胞;D: IV时相卵母细胞;E: V时相卵母细胞;F: VI时相卵母细胞;CNS:染色质核仁阶段;EPN:核仁外周期;LPNS:核仁外周期晚期;CAS:皮质泡期;EVIT:早期卵黄积累阶段;LVIT:晚期卵黄积累阶段;Mat:成熟卵;AT:闭锁细胞;POF:产后卵泡;A: phase II oocyte; B and C: phase III oocyte; D: phase IV oocyte; E: phase V oocyte; F: phase VI oocyte; CNS: chromatin nucleolar stage; EPN: early perinucleolus stage; LPNS: late perinucleolus stage; CAS: cortical alveoli stage; EVIT: early vitellogenic stage; LVIT: late vitellogenic stage; Mat: mature; AT: atretic follicle; POF: post-ovulatory follicle
A: II时相卵母细胞;B和C: III时相卵母细胞;D: IV时相卵母细胞;E: V时相卵母细胞;F: VI时相卵母细胞;CNS:染色质核仁阶段;EPN:核仁外周期;LPNS:核仁外周期晚期;CAS:皮质泡期;EVIT:早期卵黄积累阶段;LVIT:晚期卵黄积累阶段;Mat:成熟卵;AT:闭锁细胞;POF:产后卵泡;A: phase II oocyte; B and C: phase III oocyte; D: phase IV oocyte; E: phase V oocyte; F: phase VI oocyte; CNS: chromatin nucleolar stage; EPN: early perinucleolus stage; LPNS: late perinucleolus stage; CAS: cortical alveoli stage; EVIT: early vitellogenic stage; LVIT: late vitellogenic stage; Mat: mature; AT: atretic follicle; POF: post-ovulatory follicle
Figure 3. Histological sections of the ovary in Alosa sapidissima
图3. 美洲鲥的卵巢发育组织学
IV期卵巢处于大生长期晚期的初级卵母细胞,即卵黄充满期,此时是卵黄快速积累的时期,细胞体积不断增大,卵黄颗粒迅速向细胞质外周扩散,液泡被挤压到卵母细胞边缘的细胞质中,并最终消失,卵黄颗粒充满整个细胞质,此时卵母细胞进入晚期卵黄积累阶段。IV时相卵巢中,大部分卵母细胞处于卵黄卵母细胞晚期,也存在部分卵黄卵母细胞早期,少部分处于III期(图3(D))。
V时相 该期卵巢中的卵母细胞经过充分发育后,细胞达到成熟,成为次级卵母细胞。核膜破裂并消失,细胞质被卵黄挤到细胞的边缘。卵黄球散布于整个卵母细胞的胞质内,大多数呈椭圆形,排列十分紧密,有的卵黄球已经融合成卵黄板,呈均质红染。卵质的边缘仍有液泡,即将排卵的滤泡膜松驰,大部分与卵膜分离。V时相卵巢中,V时相卵母细胞数量优势显著,少量III和IV时相的卵黄卵母细胞(图3(E))。
VI时相 卵母细胞形状不规则,蜷曲于卵巢内,开始闭锁,其特征是核消失,卵黄液化。卵巢中还有少量未产出的卵细胞和大量的排卵后残留的滤泡壁,大部分卵母细胞与II时相的类似(图3(F))。
3.3. 美洲鲥精巢发育形态变化
美洲鲥精巢为小叶型,精巢与卵巢相似成对存在,基本对称。精巢由许多精小叶构成,分布及形状不规则。精小叶由许多精小囊组成。当精细胞发育成熟形成精子后,精小囊破裂,精子进入小叶腔中,经输精管排出。非成熟期精巢外观呈现浅粉色,成熟期的为乳白色。根据精巢外部形状、色泽,将美洲鲥的精巢发育分为6个时期。
第Ⅰ期 精巢很小,呈透明线状,精巢内以精原细胞为主,终生只出现一次。
第II期 精巢呈现粗线状,为半透明粉红色,紧贴于腹腔的背侧,表面可见细微血管,此时性指数GSI为0.89% (图4(A))。
 A: Ⅱ期精巢;B: Ⅲ期精巢;C: Ⅳ期精巢;D: Ⅴ期精巢;E: Ⅵ期精巢;A: stage Ⅱ testis; B: stage Ⅲ testis; C: stage Ⅳ testis; D: stage Ⅴ testis; E: stage Ⅵ testis
A: Ⅱ期精巢;B: Ⅲ期精巢;C: Ⅳ期精巢;D: Ⅴ期精巢;E: Ⅵ期精巢;A: stage Ⅱ testis; B: stage Ⅲ testis; C: stage Ⅳ testis; D: stage Ⅴ testis; E: stage Ⅵ testis
Figure 4. Morphological change of the testis in Alosa sapidissima
图4. 美洲鲥精巢发育形态
第III期 精巢体积开始增加,外表面紧致,微血管增多,此时性指数GSI为2.88% (图4(B))。
第IV期 精巢体积进一步增大,精巢的两个分支部分延长,外观呈现灰白色,较为饱满,此时性指数GSI为6.57% (图4(C))。
第V期 精巢体积达到最大,非常饱满,占据整个腹部,精巢质地软,颜色乳白色,血管清晰可见,将精巢剪断有乳白色精液流出,此时性指数GSI为8.06% (图4(D))。
第VI期 此时精巢开始萎缩,表面出现褶皱,体积变小,精巢质地开始变硬,此时性指数GSI为5.49% (图4(E))。
3.4. 美洲鲥精巢组织学分期
美洲鲥自第一次性成熟时,雄鱼生殖细胞会经过5个发育时期,即精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子。依据雄性生殖细胞的发育阶段、分布和数量,将精巢分为6个时期:
I期精巢精巢中主要为精原细胞。
II期精巢 精巢中出现初级精母细胞,其体积较大,呈圆形或椭圆形,核大,核膜明显,HE染色核较深,细胞质染色较浅(图5(A))。
III期精巢 精巢发育到III期,其内已无精原细胞。在精小囊边缘的位置为体积较大、排列松散的初级精母细胞,嗜碱性增强,整个细胞被苏木精染成深蓝色,在其内侧分布的是排列更紧密的体积较小的次级精母细胞。在精小叶中间的精子细胞体积比次级精母细胞更小,嗜碱性强,整个细胞被苏木精染成深蓝色。此时的小叶腔被以上三种细胞充满(图5(B))。
 A: Ⅱ期精巢;B: Ⅲ期精巢;C: Ⅳ期精巢;D: Ⅴ期精巢;E: Ⅵ期精巢;PSC:初级精母细胞;SSC:次级精母细胞;ST:精子细胞;SZ:精子;A: stage Ⅱ testis; B: stage testis; C: stage Ⅳ testis; D: stage Ⅴ testis; E: stage Ⅵ testis; PSC: primary spermatocyte; SSC: secondary spermatocyte; ST: spermatid; SZ: spermatids
A: Ⅱ期精巢;B: Ⅲ期精巢;C: Ⅳ期精巢;D: Ⅴ期精巢;E: Ⅵ期精巢;PSC:初级精母细胞;SSC:次级精母细胞;ST:精子细胞;SZ:精子;A: stage Ⅱ testis; B: stage testis; C: stage Ⅳ testis; D: stage Ⅴ testis; E: stage Ⅵ testis; PSC: primary spermatocyte; SSC: secondary spermatocyte; ST: spermatid; SZ: spermatids
Figure 5. Histological sections of the testis in Alosa sapidissima
图5. 美洲鲥的精巢发育组织学
IV期精巢 精巢小叶腔内充满流动的精子(图5(C))。
V期精巢此时期精巢完全成熟,部分精子开始排出(图5(D))。
VI期精巢经过排精或自然退化到达VI期。此时期的精巢中仍然可见稀松未完全排出的精子,整个精巢开始萎缩,结缔组织增多(图5(E))。经过一段时间的生长,精巢将过渡到II时期,进行下一周的发育。
3.5. 繁殖季节
美洲鲥雌雄腺腺指数(GSI)、肝体比(HSI)及肥满度(CF)的月变化见图6。由图可见,2015年10月到12月,雌鱼和雄鱼的GSI较为稳定,自2016年1月开始,雌鱼和雄鱼的GSI快速增加,且最高值均出现在5月(雌鱼:29.24% ± 3.84%,雄鱼:8.06% ± 1.19%) (ANOVA, Tukey’s post hoc, P < 0.05)。6月份,雌鱼和雄鱼的GSI有所降低,但仍保持较高水平,之后快速降低到7月份。自8月份开始,雌雄GSI保持一定的水平(图6(A))。
自2015年10月到12月,雌鱼的HIS逐渐增加;自2016年1月到3月份,HIS迅速增加,且在3月到达最大值(2.05% ± 0.05%) (ANOVA, Tukey’s post hoc, P < 0.05),之后HIS略有降低,但仍然保持较高的水平一直到6月份。自7月开始,HIS开始降低;自2015年10月到12月,雄鱼的HIS表现出了轻微的波动;自2016年1月到6月,指数快速降低,在6月到达最低值(0.93% ± 0.1%),之后开始缓慢升高(图6(B))。
自2015年10月到12月,雌雄鱼CF缓慢增加,自2016年1月份开始,快速增加,且在2016年5月达到最大值(雌鱼:1.88% ± 0.9%;雄鱼:1.65% ± 0.02%) (ANOVA, Tukey’s post hoc, P < 0.05),自6月份开始下降,9月份开始回升(图6(C))。
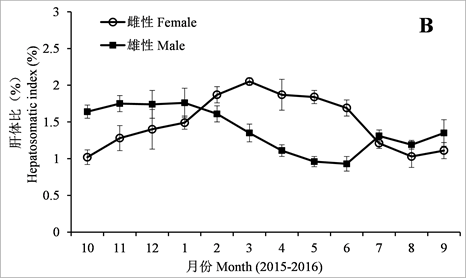


Figure 6. Monthly variations in gonadosomatic index (GSI), hepatosomatic index (HSI), and condition factor (CF) of female and male American shad
图6. 美洲鲥雌雄腺指数(GSI)、肝体比(HSI)及肥满度(CF)的月变化
3.6. 卵径
对2015年10月-2016年9月每个月中的美洲鲥卵巢卵子的卵径进行了测量(图7)。从图可知,从2015年10月到2016年2月,美洲鲥平均卵径展现了增加的趋势,此时卵径表现出单峰分布。自3月份,美洲鲥平均卵径进一步增加,此时卵黄开始积累,呈现了2个峰,平均卵径分别分布在0.15~0.6 mm和0.7~1.2 mm两个范围内。随着生长发育,较大卵径的卵母细胞进一步发育成为首批成熟卵子(1.2~1.8 mm),这时大规模的成批次的产卵行为发生在4、5、6三个月份。自7月份开始,平均卵径开始变小,卵巢中成熟卵的数量较少。从那时起,美洲鲥卵巢开始进入恢复期(图7)。


Figure 7. Monthly size frequency distributions of oocytes for American shad October 2015 to September 2016
图7. 美洲鲥卵径频率分布图(2015.10~2016.9)
3.7. 繁殖力
计数了30尾Ⅳ期雌鱼的怀卵量,其体长范围为40.5到45.0 cm,体重在1.25 ± 0.46 kg。可知,绝对繁殖力为69,033.99粒~414,184.28粒(平均304,251.71 ± 61,293.27),相对繁殖力为71.38粒/g~395.38粒/g (平均254.44 ± 49.11粒/g)。
4. 讨论
美洲鲥自上一繁殖周期结束后,性腺指数迅速下降,并保持较低的水平一直到12月份,表明此期间鲥鱼性腺处于休整阶段;自12月份后,随着温度的上升及光照周期的延长,雌鱼性腺指数显著上升,到翌年4~5月份分别达到了28.31%和29.24%,至6月份有所降低为22.34,这说明了美洲鲥产卵季节发生在为4~6月份,其中主要集中在4~5月份中。自7月份开始,性指数迅速降低,并保持在较低水平。由此可见,美洲鲥性腺发育分为两个相对明显的阶段,即:繁殖结束后的7月~12月份为卵巢休整恢复期,而翌年1月份~6月份为性腺明显发育成熟繁殖期。而肝指数在产卵结束后开始降低并保持一定的水平一直到12月份,自翌年1到3月份开始,肝指数迅速增加,说明了1~3月份可能是美洲鲥性腺启动卵子发育、卵黄能量储备的重要时期。之后在4~6月份仍然保持高的水平,产卵结束后下降。而肝指数在繁殖季节仍然保持较高的水平这可能与卵母细胞中卵黄蛋白合成有关。分析认为当卵巢发育进入卵黄快速积累阶段,肝脏中卵黄蛋白原合成和分泌较为旺盛,亲鱼大部分储备能被肝脏用于相关卵黄蛋白合成及运输。产卵结束后,卵母细胞内卵黄积累结束,肝脏相关的合成及代谢活动下降,其指数开始下降,这与大西洋庸鲽Hippoglossoides platessoides、大西洋鳕鱼Gadus morhua和半滑舌鳎Cynoglossus semilaevis Gtinthe的报道类似 [28] [29] [30] 。
雄性美洲鲥性腺指数变化规律与雌鱼类似。产卵结束后性腺指数显著降低,并保持一定水平到12月份。自翌年1月份开始,性腺指数迅速增加,在3月份~5月份达到非常高的水平,6月份稍有降低。这说明了美洲鲥雄鱼自3月份即开始性成熟,一直延续到6月份,可见,雄鱼性成熟的时间要早于雌性,这可能与美洲鲥的自身繁殖策略有关。肝指数自产卵结束后到12月份表现出了轻微的波动;自翌年1月份开始,肝指数开始逐渐降低,在4~6月份降到了较低水平,分析认为美洲鲥在繁殖过程中具有快速追逐雌鱼的习性,期间可能需要消耗大量的能量用于繁殖活动代谢。另外,柳学周等对半滑舌鳎的研究表明了雄鱼在繁殖季节肝体比的快速降低可能与精子的发生发育有关 [30] 。由此可知,美洲鲥雄鱼在繁殖周期中肝脏储备的大量能量可能很大程度上参与了机体活动代谢及精子发生发育过程。
雌雄鱼肥满度周年变化具有相似趋势。肥满度产卵后有所下降,在8月份到达了最小值,之后保持较为平稳,自翌年1月份后,肥满度显著升高,并在繁殖期间(5月份)达到了峰值。可见,产卵结束后到12月份,亲鱼的处于缓慢的恢复期,能量储备较慢;而自翌年1月份开始大幅度增加,这也从另一方面证实了此时期是美洲鲥能量储备的重要时期。因此,此阶段应加强亲鱼营养强化,保证其充足的能量储备。另外,繁殖期肥满度的显著增高可能与不同种类性腺发育及繁殖过程中的生殖耗能策略相关,这与大西洋庸鲽和赛内加尔鳎Solea senegalensis在繁殖期的肥满度变化研究结果相同 [27] [31] 。
卵巢按照其卵母细胞的发育情况可分为三种类型:完全同步型(synchronic),是指卵巢内的卵母细胞都基本处于相同的发育期,在整个生活史中的性成熟阶段,只产卵一次;部分同步型(partial synchronic),是指卵巢内存在两种或两种以上处于不同发育期的卵母细胞,它们在整个生活史中通常只产卵一次;不同步型(asynchronic),是指卵巢内含有各个不同发育期的卵母细胞,在个体的生活史中可以多次产卵,生殖季节非常长 [32] 。在本研究中发现,美洲鲥不同发育阶段的卵巢中至少含有两种处于不同发育时相的卵母细胞,而且在排卵结束后的卵巢中,仍在存在着少量处于3、4发育时相的卵母细胞,这与半滑舌鳎、欧洲鳎(Solea solea)、条斑星鲽 (Verasper moseri)及叉尾麦氏鲈(Macquaria colonorum)的产卵模式类似 [24] [30] [33] [34] 。另外,美洲鲥卵径4~6月份均处于最大值,卵径分布呈现明显的“双峰型”,这也表明美洲鲥产卵类型应属于一年产卵的部分同步产卵类型,也被称为非同步批次产卵类型,且第二批成熟卵的数量少于第一批。因此,在美洲鲥亲鱼营养强化充分、机体营养积累充足,且养殖环境理想的情况下,在短时间内具有再次排卵的可能性。
繁殖力体现了物种或种群对栖息环境变动的适应性特征。Kurita等对大西洋鲱Clupea harengus的繁殖调控研究表明,其相对繁殖力为331 ± 61~195 ± 31粒/g [35] 。Narejo等对云鲥Tenualosa ilisha研究表明,全长为20.1~40.8 cm的亲鱼,其繁殖力达到64,608~1,153,383粒 [36] 。Panhwar等也研究表明,全长为21.0~35.0 cm的云鲥繁殖力达到87,267~614,482粒 [26] 。吴国犀对长江鲥研究表明,体长为40~45 cm的亲鱼,绝对怀卵量达到108.1万粒,相对怀卵量达到37.7万粒 [37] 。在本研究中,记录了体长范围为40.5 到45.0 cm的亲鱼,其绝对繁殖力为69,033.99粒~414,184.28粒(平均304,251.71 ± 61,293.27),相对繁殖力为71.38粒/g~395.38粒/g (平均254.44 ± 49.11粒/g)。可见,美洲鲥绝对繁殖力较低,这可与种间差异性及栖息环境有关,另外,美洲鲥成熟卵的卵径为3.09 ± 0.08 mm,卵径较其它鲥鱼大,从而保证了相对较高的孵化率和早期存活率,所以表现出较低的繁殖力。
5. 结论
综上所述,美洲鲥是一种性成熟较早的温水性鱼类,根据卵巢外部形状大小及色泽等的不同,可将美洲鲥鱼卵巢发育过程分为6个时期,属于非同步分批产卵类型,繁殖温度主要为18℃~22℃,繁殖期主要为4~6月,自7月开始,产卵行为逐渐下降,其繁殖力低,繁殖期较长。
基金项目
青岛博士后应用研究项目(Q51201611);中央级公益性科研院所基本科研业务费专项,(20603022015005);江苏省国家长江珍稀鱼类工程技术研究中心培育点(BM2013012)共同资助。
文章引用
高小强,刘志峰,黄 滨,关长涛,王耀辉,薛国平,秦巍仑,洪 磊. 美洲鲥繁殖特性研究
Reproductive Property of the American Shad, Alosa sapidissima, under Reared Conditions[J]. 水产研究, 2018, 05(02): 98-111. https://doi.org/10.12677/OJFR.2018.52012
参考文献
- 1. Murua, H. and Saborido-Rey, F. (2003) Female Reproductive Strategies of Marine Fish Species of the North Atlantic. Journal of Northwest Atlantic Fishery Science, 33, 23-31. https://doi.org/10.2960/J.v33.a2
- 2. Simon, K.D., Bakar, Y., et al. (2012) Aspects of the Reproductive Biology of Two Archer Fishes toxotes chatareus, (Hamilton 1822) and Toxotes jaculatrix, (Pallas 1767). Environmental Biology of Fishes, 93, 491-503. https://doi.org/10.1007/s10641-011-9944-6
- 3. Ganias, K., Somarakis, S., Machias, A., et al. (2004) Pattern of Oocyte Development and Batch Fecundity in the Mediterranean Sardine. Fisheries Research, 67, 13-23. https://doi.org/10.1016/j.fishres.2003.08.008
- 4. Plaza, G., Sakaji, H., Honda, H., et al. (2007) Spawning Pattern and Type of Fecundity in Relation to Ovarian Allometry in the Round Herring Etrumeus teres. Marine Biology, 152, 1051-1064. https://doi.org/10.1007/s00227-007-0756-3
- 5. Evermann, B.W. and Jordan, D.S. (1986) The Fishes of North and Middle America: A Descriptive Catalogue of the Species of Fish-Like Vertebrates Found in the Waters of North America, North of the Isthmus of Panama. Volume 1, Government Printing Office, US, 427-428.
- 6. Limburg, K.E., Hattala, K.A. and Kahnle, A. (2003) American Shad in Its Native Range. In: Limburg, K.E. and Waldman, J.R., Eds., Biodiversity, Status, and Conservation of the World’s Shads, American Fisheries Society Symposium, Vol. 35, Bethesda, Maryland, 125-140.
- 7. Jones, P.W., Martin, F.D. and Hardy, J.D. (1978) Development of Fishes of the Mid-Atlantic Bight: An Atlas of Egg, Larval, and Juvenile Stages. I. Acipenseridae through Ictaluridae. Fish and Wildlife Service, U.S., 98-104.
- 8. Jordan, D.S. and Evermann, B.W. (1898) The Fishes of North and Middle America: A Descriptive Catalogue of the Species of Fish-Like Vertebrates Found in the Waters of North America, North of the Isthmus of Panama. Government Printing Office, US, 2037-2039.
- 9. 徐钢春, 张呈祥, 郑金良, 等. 美洲鲥的人工繁殖及胚胎发育的研究[J]. 海洋科学, 2012, 36(7): 89-96.
- 10. 高小强, 刘志峰, 黄滨, 等. 美洲鲥(Alosa sapidissima)胚胎发育形态学及组织切片观察[J]. 渔业科学进展, 2017, 38(5): 9-18.
- 11. Shardo, J.D. (1995) Comparative Embryology of Teleostean Fishes. I. Development and Staging of the American Shad, Alosa sapidissima (Wilson, 1811). Journal of Morphology, 225, 125-167. https://doi.org/10.1002/jmor.1052250202
- 12. 吴文化, 王斌, 师伟, 等. 美洲鲥鱼苗种规模化养殖技术研究-稚鱼培育[J]. 水产学杂志, 2004, 17(2): 61-64.
- 13. 张呈祥. 美洲鲥的早期发育生物学及苗种培育技术研究[D]: [硕士学位论文]. 南京: 南京农业大学, 2014.
- 14. Gao, X.Q., Hong, L., Liu, Z.F., et al. (2016) An Integrative Study of Larval Organogenesis of American Shad Alosa sapidissima, in Histological Aspects. Chinese Journal of Oceanology & Limnology, 33, 1-17.
- 15. Nack, C.C., Limburg, K.E. and Schmidt, R.E. (2016) Diet Composition and Feeding Behavior of Larval American Shad, Alosa sapidissima (Wilson), after the Introduction of the Invasive Zebra Mussel, Dreissena polymorpha (Pallas), in the Hudson River Estuary, NY. Northeastern Naturalist, 22, 437-450.
- 16. 高小强, 洪磊, 刘志峰, 等. 美洲西鲱仔鱼不可逆点及仔、稚鱼摄食特性研究[J]. 水产学报, 2015, 39(3): 392-400.
- 17. 张呈祥, 徐钢春, 徐跑, 等. 美洲鲥仔、稚、幼鱼的形态发育与生长特征[J]. 中国水产科学, 2010, 17(6): 1227-1234.
- 18. 高小强, 洪磊, 刘志峰, 等. 美洲鲥仔稚鱼异速生长模式研究[J]. 水生生物学报, 2015, 39(3): 638-644.
- 19. Hasselman, D.J., Ricard, D. and Bentzen, P. (2013) Genetic Diversity and Differentiation in a Wide Ranging Anadromous Fish, American Shad (Alosa sapidissima), Is Correlated with Latitude. Molecular Ecology, 22, 1558-1573. https://doi.org/10.1111/mec.12197
- 20. Wang, J., Yu, Z., Wang, X., et al. (2017) The Next-Generation Sequencing Reveals the Complete Mitochondrial Genome of Alosa sapidissima (Perciformes: Clupeidae) with Phylogenetic Consideration. Mitochondrial DNA Part B, 2, 304-306. https://doi.org/10.1080/23802359.2017.1331322
- 21. Gao, X.Q., Liu, Z.F., Guan, C.T., et al. (2017) Developmental Changes in Digestive Enzyme Activity in American Shad, Alosa sapidissima, during Early Ontogeny. Fish Physiology & Biochemistry, 43, 397-409. https://doi.org/10.1007/s10695-016-0295-2
- 22. 施永海, 徐嘉波, 陆根海, 等. 养殖美洲鲥的生长特性[J]. 动物学杂志, 2017, 54(2): 638-645.
- 23. Roomiani, L., Sotudeh, A.M. and Mofrad, R.H. (2014) Reproductive Biology of Hilsa Shad (Tenualosa ilisha) in Coastal Waters of the Northwest of Persian Gulf. Iranian Journal of Fisheries Sciences, 13, 201-215.
- 24. Walsh, C.T., Gray, C.A., West, R.J., et al. (2011) Reproductive Biology and Spawning Strategy of the Catadromous Percichthyid, Macquaria colonorum, (Günther, 1863). Environmental Biology of Fishes, 91, 471-485. https://doi.org/10.1007/s10641-011-9807-1
- 25. Plaza, G. and Espejo, V. (2011) Female Reproductive Biology of the Silverside Odontesthes regia. Fisheries Research, 111, 31-39. https://doi.org/10.1016/j.fishres.2011.06.009
- 26. Panhwar, S.K., Siddiqui, G., Ayub, Z., et al. (2011) Reproductive Pattern and Some Biological Features of Anadromous Fish tenualosa ilisha (Family: Clupeidae) from Pakistan. Indian Journal of Geo-Marine Sciences, 40, 687-696.
- 27. 洪磊, 李兆新, 陈超, 等. 美洲鲥鱼卵巢发育规律和性类固醇激素变化研究[J]. 中国工程科学, 2014, 16(9): 86-92.
- 28. Dahle, R., Taranger, G.L., Karlsen, Ø., et al. (2003) Gonadal Development and Associated Changes in Liver Size and Sexual Steroids during the Reproductive Cycle of Captive Male and Female Atlantic Cod (Gadus morhua L.). Comparative Biochemistry & Physiology Part A, 136, 641-653. https://doi.org/10.1016/S1095-6433(03)00215-0
- 29. Tomkiewicz, J., Tybjerg, L. and Jespersen, Å. (2003) Micro- and Macroscopic Characters Staging Gonadal Maturation of Female Baltic Cod (Gadus morhua L.). Journal of Fish Biology, 62, 253-275. https://doi.org/10.1046/j.1095-8649.2003.00001.x
- 30. 柳学周, 徐永江, 倪娜, 等. 半滑舌鳎卵巢发育的组织学和形态数量特征研究[J]. 渔业科学进展, 2009, 30(6): 25-35.
- 31. Garca, L., Couto, E., Canario, A.V.M., et al. (2006) Ovarian Development and Plasma Sexsteroid Levels in Cultured Female Senegalese Sole, Solea senegalensis. Comparative Biochemistry and Physiology—Part A, 146, 342-354.
- 32. 林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社, 2007: 155-213.
- 33. Witthames, P.R. and Greer, W.M. (1995) Determinacy of Fecundity and Atresia in Sole (Solea solea) from the Channel, the North Sea and the Irish Sea. Aquatic Living Resources, 8, 91-109. https://doi.org/10.1051/alr:1995007
- 34. 倪娜, 柳学周, 徐永江, 等. 条斑星鲽卵巢发育规律和性类固醇激素周年变化研究[J]. 渔业科学进展, 2011, 32(3): 16-25.
- 35. Kurita, Y., Meier, S. and Kjesbu, O.S. (2003) Oocyte Growth and Fecundity Regulation by Atresia of Atlantic Herring (Clupea harengus) in Relation to Body Condition throughout the Maturation Cycle. Journal of Sea Research, 49, 203-219. https://doi.org/10.1016/S1385-1101(03)00004-2
- 36. Narejo, N.T., Ali, S.S., Jafri, S.I.H., et al. (1999) A Study on the Age and Growth of Palla, Tenualosa ilisha from the River Indus. Pakistan Journal of Zoology, 31, 25-29.
- 37. 吴国犀. 长江鲥鱼卵巢的发育特点及怀卵量[J]. 淡水渔业, 1978(2): 28-33.
NOTES
*通讯作者。