Material Sciences
Vol.05 No.03(2015), Article ID:15301,7
pages
10.12677/MS.2015.53016
Selectively Tumor Targeted Fe3O4 Magnetic Nanoparticles Modified with Peptide
Fei You, Guangfu Yin*, Ximing Pu
College of Materials Science and Engineering, Sichuan University, Chengdu Sichuan
*通讯作者。
Email: *nic0700@scu.edu.cn
Received: May 4th, 2015; accepted: May 20th, 2015; published: May 27th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Fe3O4 magnetic nanoparticles (MNPs) have been widely used in tumor imaging and therapy. However, low therapeutic concentration at tumor sites is one of the most important factors that limit their applications. MNPs conjugated with specific targeting ligands might selectively bind to specific tumor cells to increase the concentration of MNPs at tumor sites while the total dose decreased. Objective: Fe3O4 MNPs specific binding peptide (TVNFKLY) and ovarian tumor cells A2780 specific binding peptide (QQTNWSL) were conjugated together to form a bi-functional peptide, which was used to modify Fe3O4 MNPs, and the cytotoxicity and targeting ability of MNPs were investigated. Methods: Fourier transform infrared spectrometry, thermal analysis and fluorescence microscopy have been used to demonstrate the presence of peptide on the surface of Fe3O4 MNPs. MTT assays were employed to detect the cell viability. The targeting ability of Fe3O4 MNPs was verified by Prussian blue staining. Results: Synthesized peptide (QQTNWSLTVNFKLY) could bind to Fe3O4 MNPs, and Fe3O4 MNPs binding with peptide had no significant cytotoxicity to L929 cells and exhibited good targeting ability to tumor cells. Conclusion: The synthesized bi-functional peptide could bind to Fe3O4 MNPs, and the MNPs had better capability to target tumor cells.
Keywords:Fe3O4 Magnetic Nanoparticles, Specific Peptide, Active Targeting, Tumor Cells

多肽修饰Fe3O4磁性纳米颗粒及其肿瘤细胞靶向性
尤 飞,尹光福*,蒲曦鸣
四川大学材料科学与工程学院,四川 成都
Email: *nic0700@scu.edu.cn
收稿日期:2015年5月4日;录用日期:2015年5月20日;发布日期:2015年5月27日

摘 要
Fe3O4磁性纳米颗粒已被广泛的应用于肿瘤的成像与治疗,但限制其应用的一个主要因素是磁性纳米颗粒在肿瘤部位达不到足够的功能剂量。在磁性纳米颗粒表面偶联特异性靶向配体可使其结合于特定肿瘤细胞。目的:将特异性结合Fe3O4磁性纳米颗粒的短肽(TVNFKLY)与特异性结合卵巢肿瘤细胞A2780的短肽(QQTNWSL)合成的双功能多肽用于修饰Fe3O4磁性纳米颗粒,并研究其对正常细胞的毒性及对A2780细胞的靶向效果。方法:采用傅立叶转换红外光谱、热重分析、荧光显微镜等方法分析多肽与Fe3O4磁性纳米颗粒的结合,采用MTT法检测多肽结合后的Fe3O4磁性纳米颗粒的细胞毒性,并通过普鲁士蓝染色法验证靶向性。结果:合成的多肽(QQTNWSLTVNFKLY)能与Fe3O4磁性纳米颗粒结合,结合多肽后的纳米颗粒对L929等正常细胞无明显细胞毒性,对肿瘤细胞有较好的靶向性。结论:合成的双功能多肽能与Fe3O4磁性纳米颗粒结合并具有主动靶向A2780细胞的能力,具有潜在的应用价值。
关键词 :Fe3O4磁性纳米颗粒,特异性多肽,主动靶向,肿瘤细胞

1. 前言
Fe3O4磁性纳米颗粒已被广泛用于生物医学领域,例如作为磁共振成像造影剂、药物靶向载体及磁热疗介质等[1] -[3] 。但体外细胞试验研究证明Fe3O4磁性纳米颗粒具有较强的细胞毒性[4] -[6] ,并且Fe3O4磁性纳米颗粒在应用于临床肿瘤成像与治疗方面也因其不具有对特定肿瘤细胞的靶向性而受到限制。利用生物分子进行表面修饰通常可改善Fe3O4磁性纳米颗粒的生物相容性并可以通过偶联靶向配体使其具有靶向肿瘤细胞的能力。恰当的表面修饰可以使Fe3O4磁性纳米颗粒避免被肝、脾、肺等网状内皮系统吞噬,延长血液循环半衰期,此外通过在Fe3O4磁性纳米颗粒表面偶联特定的靶向配体如叶酸、多肽等可使其功能化,靶向于特定肿瘤细胞[7] -[11] 。主动靶向Fe3O4磁性纳米颗粒可提高粒子在肿瘤细胞的浓度,使其达到较好的成像或治疗效果,并能降低对正常组织的毒性,已成为国内外研究的热点。
多肽因其免疫原性低,生物相容性好,分子小易修饰等特点已被广泛用于纳米材料的表面改性。噬菌体展示肽库技术已成为筛选纳米材料及肿瘤细胞特异性结合肽的有效手段[12] -[15] 。通过该技术得到的材料特异性结合肽通常用于材料的表面修饰,而细胞特异性结合肽通常用于细胞靶向研究。
本研究拟利用我们前期通过噬菌体展示技术筛选得到的Fe3O4磁性纳米颗粒特异性结合肽(TVNFKLY,记为TVN)与卵巢肿瘤细胞A2780靶向肽(QQTNWSL)按照不同的顺序偶联形成QQTNWSLTVNFKLY及LSWNTQQTVNFKLY两条14肽,考察其结合Fe3O4磁性纳米颗粒的能力及对A2780细胞的靶向能力。
2. 材料与方法
2.1. 材料
Fe3O4磁性纳米颗粒,购自南京艾普瑞纳米材料有限公司;QQTNWSLTVNFKLY肽(记为QT肽)及LSWNTQQTVNFKLY肽(记为LT肽)及荧光标记的两种多肽均委托上海波肽生物有限公司合成。人卵巢肿瘤细胞A2780及鼠成纤维细胞系L929均购自四川大学华西第二医院。RPMI1640培养基购自Gibco公司,碳酸氢钠、磷酸二氢钾、亚铁氰化钾等化学试剂均购自成都科龙化工试剂公司。
主要使用仪器有X射线衍射仪(Philip)、透射电子显微镜(Carl Zeiss)、傅立叶红外光谱仪(Thermo)、热重分析仪(Mettler Toledo)、倒置荧光显微镜(Olympus)、恒温细胞培养箱(Thermo)、酶联免疫检测仪(Molecular Devices)。
2.2. 方法
2.2.1. Fe3O4纳米颗粒表征
X射线衍射(XRD)对Fe3O4磁性纳米颗粒进行物相分析,并采用透射电子显微镜(TEM)进行形貌观察。
2.2.2. 合成多肽与Fe3O4纳米颗粒结合及表征
将浓度为500 μg/mL的QT肽与LT肽分别与20 mg的Fe3O4混合后孵育1 h,离心洗去未结合多肽,将结合产物37℃真空干燥。荧光标记多肽与Fe3O4的结合分析则采用透析法去除未结合多肽。以纯Fe3O4作为对照。将制备的样品分别进行红外光谱检测分析、热分析、荧光显微镜观察。
2.2.3. Fe3O4结合多肽后的细胞毒性试验
分别将QT肽及LT肽以500 μg/mL浓度与5 mg的Fe3O4结合1 h后洗去未结合多肽,再用RPMI1640培养基将Fe3O4纳米颗粒分别稀释至6.25 μg/mL、12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL,以未加Fe3O4磁性纳米颗粒(0 μg/mL)组为对照。将L929细胞及A2780细胞分别接种至96孔细胞培养板。待细胞贴壁后,将不同浓度的纳米颗粒悬液分别加至培养板中,与细胞共同培养1 d、2 d、3 d后,分别取出培养板,加入20 μL的噻唑蓝(MTT)溶液后继续培养4 h。将液体吸出后,每孔分别加入200 μL的二甲亚砜(DMSO)将沉淀溶解,用酶联免疫检测仪在37℃,490 nm波长下检测吸光度值(OD)。
2.2.4. 普鲁士蓝染色法
QT肽与TVN肽分别以500 μg/mL浓度与5 mg的Fe3O4磁性纳米颗粒结合1 h,洗脱未结合的多肽,然后用无血清培养基将材料稀释至100 μg/mL。将培养的L929细胞及A2780细胞分别接种到24孔板上。待细胞贴壁后,将稀释好的材料加入细胞中共培养4 h。培养结束后吸出培养液,用PBS洗涤细胞两遍。每孔加入4%多聚甲醛400 μL固定细胞10 min后吸出固定液风干10 min。再加入400 μL PBS浸泡5 min后吸出。将2%的亚铁氰化钾溶液与2%的HCl溶液以1:1混合后加入细胞培养板,每孔400 μL,室温染色30 min。染色结束后吸出染色液,用PBS洗涤细胞3遍后用显微镜观察染色结果并记录。
2.2.5. 数据分析
实验数据均以平均数 ± 标准差表示。数据分析是采用SPSS 18.0数据分析软件中单因素方差分析(ANOVA),p < 0.05表示具有显著性差异。
3. 结果
3.1. Fe3O4纳米颗粒表征
Fe3O4纳米颗粒的XRD图谱如图1(A)所示。由图可看到在2θ值为30.3˚、35.7˚、43.5˚、53.9˚、57.5˚、63.2˚分别出现6个较明显的衍射峰。这些衍射峰的位置与强度与尖晶石型Fe3O4标准卡片(PDF No.75-0449)对比能较好的匹配,分别对应于立方晶相的(220)、(311)、(400)、(442)、(511)和(440)晶面,说明纳米颗粒是尖晶石型Fe3O4。图1(B)为Fe3O4磁性纳米颗粒的TEM图片,由图可见,纳米颗粒为不规则形状,且粒径约为10~30 nm。

 (A) (B)
(A) (B)
Figure 1. (A) XRD patterns of Fe3O4 NPs; (B) TEM image of Fe3O4 NPs
图1. (A) Fe3O4的XRD图谱;(B) Fe3O4的TEM图
3.2. 合成多肽与Fe3O4纳米颗粒结合表征
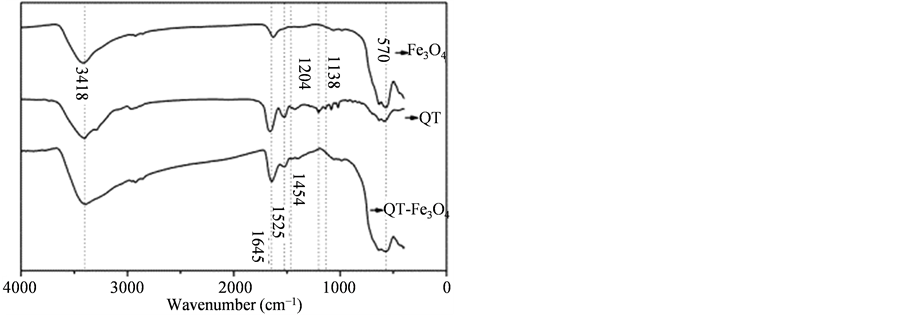
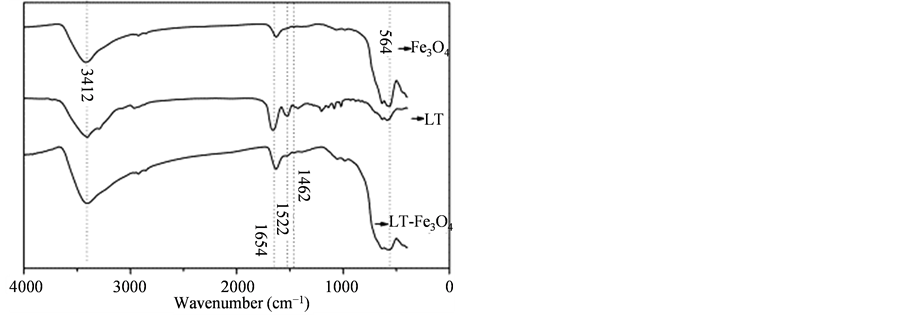
图2是QT肽及LT肽与Fe3O4磁性纳米颗粒结合的红外谱图。图2(A)中,QT肽由氨基酸组QT肽及其与Fe3O4结合后(QT-Fe3O4)的谱图均存在波数为1645 cm−1、1525 cm−1和1454 cm−1处的吸收峰,分别对应酰胺I键、酰胺II键及酰胺III键,QT-Fe3O4谱图所示波数为570 cm−1处的峰为Fe3O4中的Fe-O键的吸收峰,说明QT肽存在。并且QT肽与Fe3O4结合后,波数为1204 cm−1及1138 cm−1的吸收峰(对应于C-O键的伸缩振动)消失,进一步说明QT肽与Fe3O4并非单纯物理混合而是发生了键联。而在图2(B)中,LT肽与Fe3O4发生结合后的红外谱图中LT肽的特征峰非常微弱,说明LT肽与Fe3O4结合能力很弱。
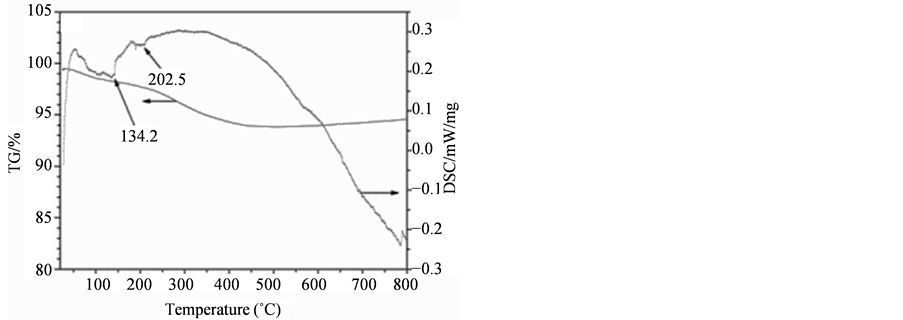
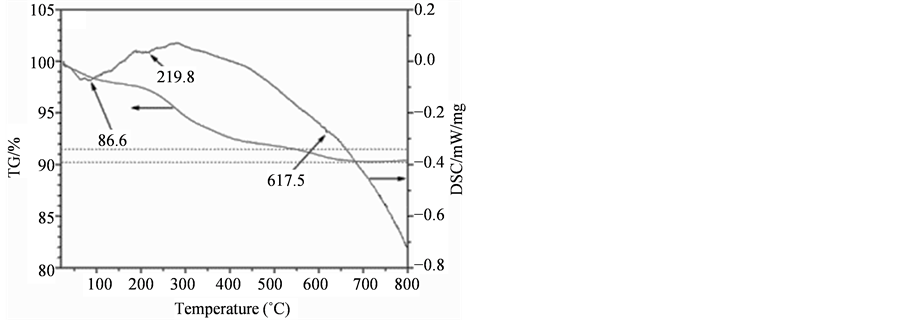
图3为QT肽及LT肽与Fe3O4磁性纳米颗粒结合的热分析图。QT肽结合Fe3O4 (图3(B))的TG/DSC曲线中在630℃左右有失重台阶,对比纯Fe3O4 (图3(A))可知,这是结合在Fe3O4表面的肽分解所造成。说明QT肽与Fe3O4发生了结合,结合量约为总质量的1%。而LT肽结合Fe3O4后的TG/DSC曲线(图3(C))与纯Fe3O4基本相同,说明LT肽未与Fe3O4纳米颗粒结合或结合量很少。
图4为荧光显微镜观察荧光标记的QT肽及LT肽与Fe3O4磁性纳米颗粒结合结果。图4(a)为荧光标记LT肽与Fe3O4磁性纳米颗粒结合结果,由图可见,荧光非常微弱甚至无荧光,说明LT肽几乎与Fe3O4磁性纳米颗粒不发生结合。图4(b)显现的荧光说明荧光标记的QT肽已与Fe3O4磁性纳米颗粒发生结合。此结果与红外分析结果及热分析结果均说明LT肽不能与Fe3O4磁性纳米颗粒结合或结合非常微弱,因此仅采用能较强结合的QT肽进行后续试验。
3.3. 细胞毒性及细胞靶向试验
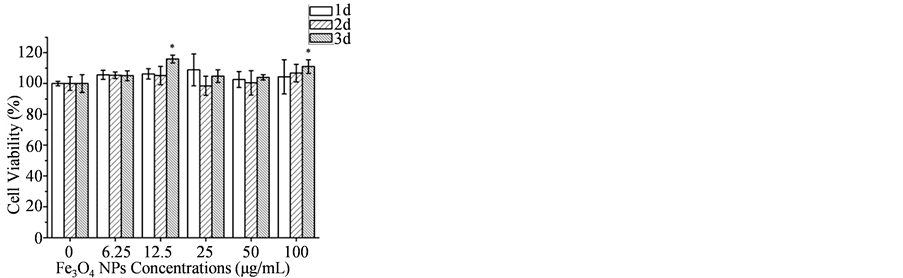
图5为QT肽结合Fe3O4磁性纳米颗粒后对L929及A2780细胞的毒性试验结果。图5(A)表明纯Fe3O4磁性纳米颗粒对L929细胞无明显毒性,图5(B)表明QT肽结合的Fe3O4磁性纳米颗粒对L929细胞具有一定促进增殖的作用,图5(C)表明纯Fe3O4磁性纳米颗粒在第1天与A2780细胞作用时稍微抑制细胞增殖,而在第2天与第3天促进细胞增殖,可能是由于在第1天A2780细胞对Fe3O4磁性纳米颗粒应激效应明显,而第2、第3天纳米颗粒被细胞吞噬形成表面包覆层而减少对细胞伤害。图5(D)表明QT肽结合的Fe3O4磁性纳米颗粒对A2780细胞增殖具有一定抑制作用。
图6为QT肽结合Fe3O4磁性纳米颗粒后与A2780细胞结合的普鲁士蓝染色结果。图6(A)所示为QT肽结合的Fe3O4磁性纳米颗粒,由图中可见,较多的纳米颗粒结合于A2780细胞表面,图6(B)及图6(C)
 (A) (B)
(A) (B)
Figure 2. FT-IR absorption spectra of Fe3O4 MNPs: (A) QT-Fe3O4; (B) LT-Fe3O4
图2. Fe3O4磁性纳米颗粒与短肽结合的FT-IR图谱:(A) QT-Fe3O4;(B) LT-Fe3O4
 (A) (B)
(A) (B)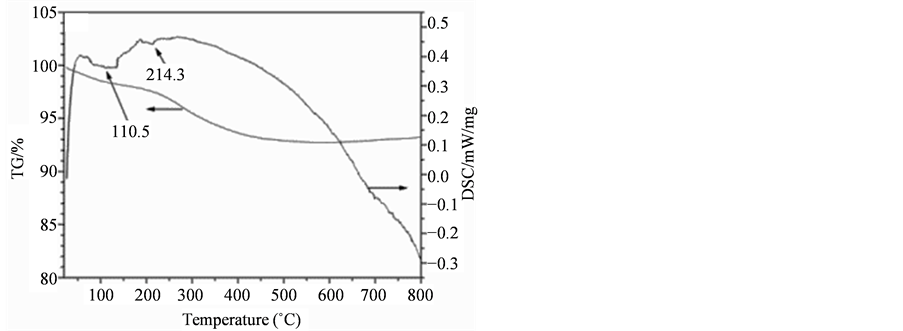 (C)
(C)
Figure 3. TG/DSC curves of Fe3O4 MNPs: (A) pure Fe3O4; (B) QT-Fe3O4; (C) LT-Fe3O4
图3. Fe3O4磁性纳米颗粒与14肽结合的TG/DSC曲线:(A) 纯Fe3O4;(B) QT-Fe3O4;(C) LT-Fe3O4
分别为TVN肽结合的Fe3O4磁性纳米颗粒及纯Fe3O4磁性纳米颗粒对A2780细胞的结合,两图中均只见少量纳米颗粒结合于细胞而被染色,比较可知QT肽结合的Fe3O4磁性纳米颗粒对A2780细胞具有一定程度的特异亲和性,推断QT肽具有靶向A2780细胞的作用。
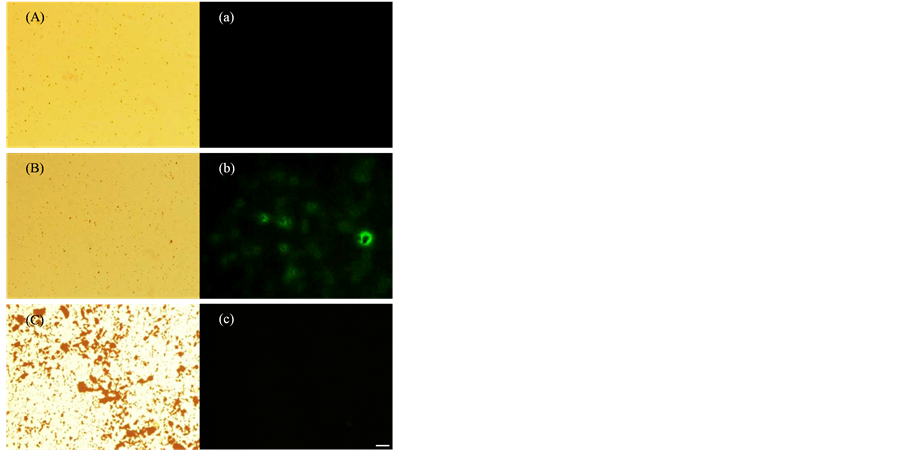
Figure 4. Fluorescent study of synthesized peptides to Fe3O4 MNPs: (A, a) LT-Fe3O4; (B, b) QT-Fe3O4; (C) pure Fe3O4 (Scale: 100 μm)
图4. 荧光显微镜观察多肽与Fe3O4磁性纳米颗粒的结合:(A, a) LT-Fe3O4;(B, b) QT-Fe3O4;(C) 纯Fe3O4 (标尺:100 μm)
 (A) (B)
(A) (B)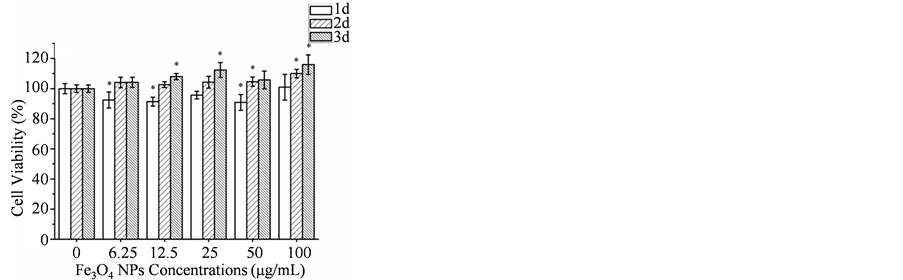
 (C) (D)
(C) (D)
Figure 5. Cell viability of L929 cells (A, B) and A2780 cells (C, D) incubated with NPs concentrations of 0, 6.25, 12.5, 25, 50, 100 μg/mL at different time: (A) pure Fe3O4 to L929; (B) QT-Fe3O4 to L929; (C) pure Fe3O4 to A2780, (C) QT-Fe3O4 to A2780. Error bars indicate standard deviation (n = 5). Sign * represents significant difference.
图5. 不同浓度的Fe3O4纳米颗粒细胞毒性:(A) 纯Fe3O4对L929毒性;(B) QT-Fe3O4对L929毒性;(C) 纯Fe3O4对A2780毒性;(D) QT-Fe3O4对A2780毒性。星号代表显著性差异。
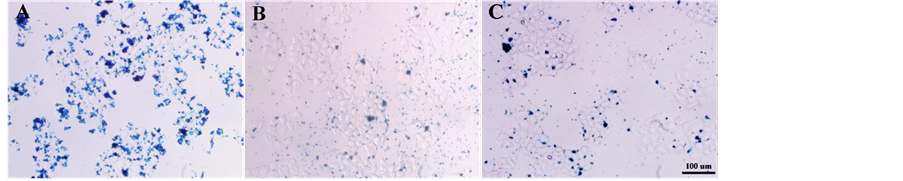
Figure 6. A2780 cells binding with QT-Fe3O4 NPs detected by Prussian blue staining method: (A) QT-Fe3O4; (B) TVN-Fe3O4; (C) pure Fe3O4 (Scale: 100 μm)
图6. 普鲁士蓝染色观察QT-Fe3O4与A2780细胞的结合:(A) QT-Fe3O4;(B) TVN-Fe3O4;(C) 纯Fe3O4 (标尺:100 μm)
4. 讨论
本研究中首先将特异性结合Fe3O4磁性纳米颗粒的TVNFKLY肽与特异性结合肿瘤细胞A2780的QQTNWSL肽按照不同顺序合成了两条14肽,分别是QQTNWSLTVNFKLY肽及LSWNTQQTVNFKLY肽,并研究合成多肽是否具有结合Fe3O4磁性纳米颗粒及靶向肿瘤细胞的能力。通过不同材料分析方法说明合成的14肽QT仍具有结合Fe3O4磁性纳米颗粒的能力,而另一条14肽LT则丧失了结合能力。通过细胞毒性试验说明QT肽结合Fe3O4磁性纳米颗粒后对L929细胞具有较好的细胞相容性,而对肿瘤细胞A2780则有一定抑制作用。普鲁士蓝染色法证实QT肽结合Fe3O4磁性纳米颗粒后对A2780细胞具有较好的结合能力。说明合成的14肽QQTNWSLTVNFKLY具有同时结合Fe3O4磁性纳米颗粒与A2780细胞的能力。此外,多肽在磁性纳米颗粒表面的修饰还可能具有降低其免疫原性,改善磁性纳米颗粒分散性等作用。因此,所合成双功能多肽用于Fe3O4磁性纳米颗粒的主动靶向是可行的。
目前,Fe3O4磁性纳米颗粒应用于肿瘤主动靶向的研究是一个热门课题,其发展迅速,随着纳米生物技术的发展,主动靶向磁性纳米颗粒必将显示出巨大的应用价值。
致谢
感谢国家自然科学基金(No. 51372157)对本研究的资助。
文章引用
尤 飞,尹光福,蒲曦鸣, (2015) 多肽修饰Fe3O4磁性纳米颗粒及其肿瘤细胞靶向性
Selectively Tumor Targeted Fe3O4 Magnetic Nanoparticles Modified with Peptide. 材料科学,03,111-118. doi: 10.12677/MS.2015.53016
参考文献 (References)
- 1. Jordan, A., Scholz, R., Maier-Hauff, K., Johannsen, M., Wust, P., Nadobny, J., Schirra, H., Schmidt, H., Deger, S., Loening, S., et al. (2001) Presentation of a new magnetic field therapy system for the treatment of human solid tumors with magnetic fluid hyperthermia. Journal of Magnetism and Magnetic Materials, 225, 118-126.
- 2. Sun, C., Lee, J.S.H. and Zhang, M. (2008) Magnetic nanoparticles in MR imaging and drug delivery. Advanced Drug Delivery Re-views, 60, 1252-1265.
- 3. Veiseh, O., Gunn, J.W. and Zhang, M. (2010) Design and fabrication of magnetic nano-particles for targeted drug delivery and imaging. Advanced Drug Delivery Reviews, 62, 284-304.
- 4. Karlsson, H.L., Gustafsson, J., Cronholm, P. and Moller, L. (2009) Size-dependent toxicity of metal oxide particles—A comparison between nano- and micrometer size. Toxicology Letters, 188, 112-118.
- 5. Chang, Y.-K., Liu, Y.-P., Ho, J.H., Hsu, S.-C. and Lee, O.K. (2012) Amine-surface-modified superparamagnetic iron oxide nanoparticles interfere with diffe-rentiation of human mesenchymal stem cells. Journal of Orthopaedic Research, 30, 1499-1506.
- 6. Hussain, S.M., Hess, K.L., Gearhart, J.M., Geiss, K.T. and Schlager, J.J. (2005) In vitro toxicity of nanoparticles in BRL 3A rat liver cells. Toxicology in Vitro, 19, 975-983.
- 7. Xie, J., Chen, K., Lee, H.-Y., Xu, C., Hsu, A.R., Peng, S., Chen, X. and Sun, S. (2008) Ultrasmall c(RGDyK)-coated Fe3O4 nanoparticles and their specific targeting to integrin alphavbeta3-rich tumor cells. Journal of the American Chemical Society, 130, 7542-7543.
- 8. Valetti, S., Maione, F., Mura, S., Stella, B., Desmaele, D., Noiray, M., Vergnaud, J., Vauthier, C., Cattel, L., Giraudo, E., et al. (2014) Peptide-functionalized nanoparticles for selective targeting of pancreatic tumor. Journal of Controlled Release, 192, 29-39.
- 9. Gan, Z.-F., Jiang, J.-S., Yang, Y., Du, B., Qian, M. and Zhang, P. (2008) Immobilization of homing peptide on magnetite nanoparticles and its specificity in vitro. Journal of Biomedical Materials Research Part A, 84A, 10-18.
- 10. Yang, X., Chen, Y., Yuan, R., Chen, G., Blanco, E., Gao, J. and Shuai, X. (2008) Folate-encoded and Fe3O4-loaded polymeric micelles for dual targeting of cancer cells. Polymer, 49, 3477-3485.
- 11. Zheng, S.W., Huang, M., Hong, R.Y., Deng, S.M., Cheng, L.F., Gao, B. and Badami, D. (2014) RGD-conjugated iron oxide magnetic nanoparticles for magnetic resonance imaging contrast enhancement and hyperthermia. Journal of Biomaterials Applications, 28, 1051-1059.
- 12. Golec, P., Karczewska-Golec, J., Los, M. and Wegrzyn, G. (2012) Novel ZnO-binding peptides obtained by the screening of a phage display peptide library. Journal of Nanoparticle Research, 14, 1218.
- 13. Ploss, M., Facey, S.J., Bruhn, C., Zemel, L., Hofmann, K., Stark, R.W., Albert, B. and Hauer, B. (2014) Selection of peptides binding to metallic borides by screening M13 phage display libraries. BMC Biotechnology, 14, 12.
- 14. Guo, Y., Ma, C., Li, C., Wu, J., Zhang, D., Han, J., Wang, Q., Xu, J., Lu, S. and Hou, Y. (2014) Screening and identification of a specific peptide binding to hepatocellular carcinoma cells from a phage display peptide library. Journal of Peptide Science, 20, 196-202.
- 15. Ma, C., Yin, G., Yan, D., He, X., Zhang, L., Wei, Y. and Huang, Z. (2013) A novel peptide specifically targeting ovarian cancer identified by in vivo phage display. Journal of Peptide Science, 19, 730-736.