Advances in Clinical Medicine
Vol.
09
No.
03
(
2019
), Article ID:
29150
,
10
pages
10.12677/ACM.2019.93034
Atrial Fibrillation Detection in Dual-Chamber Pacemaker Recipients by Using Remote Monitoring System
Qian Zhang1*, Zhilei Wang2, Xin Jin2, Yanfei Zhang3, Jiabin Tong2, Haifeng Shi2, Hao Chen2, Junpeng Liu2, Jiefu Yang2, Tong Zou2#
1Department of Cardiology, Shenzhen University General Hospital, Shenzhen Guangdong
2Department of Cardiology, Beijing Hospital, Beijing
3The National Institute on Aging, Beijing Hospital, Beijing

Received: Feb. 14th, 2019; accepted: Feb. 28th, 2019; published: Mar. 6th, 2019

ABSTRACT
Objective: To determine whether the remote monitoring system can diagnose and treat asymptomatic atrial fibrillation earlier. Methods: This was a single-center controlled trial, including 316 recipients with Germany Biotronic dual-chamber permanent pacemakers in Beijing Hospital, from April 2009 to April 2015. These 316 cases were divided into remote monitoring follow-up group (experimental group, RG) and routine clinical department follow-up group (control group, CG) according to the kinds of pacemakers; the mean follow-up time was 24.4 ± 1.8 months; detection time, duration, AF burden and antithrombotic therapy were compared between the two groups. Results: 69 patients experienced at least one episode of atrial fibrillation during the entire follow-up, yielding the occurrence rate of atrial fibrillation was 23.4%. 89.9% patients have no symptoms, and it is easier to diagnose for experimental group. It was significantly shorter in the RG to detect the first atrial fibrillation episode (P = 0.039). 48 patients experienced two or more episodes, and the median time of first atrial fibrillation recurrence in RG was also shorter (P = 0.001). The average duration of paroxysmal atrial fibrillation was shorter in RG (P = 0.006). The average number of daily AF burden > 25% was shorter in RG too (P = 0.036). Only 42% patients undertook antithrombotic therapy (RG = 52% vs CG = 29%, P = 0.048). Conclusion: Because of its real-time monitoring function, the remote monitoring system can detect earlier and treat timely in patients with permanent cardiac dual-chamber pacemakers, and thus by reducing the duration and burden of atrial fibrillation, may have a result of long-term clinical benefits.
Keywords:Dual-Chamber Permanent Pacemakers, Remote Monitoring, Atrial Fibrillation, Signs and Symptoms, Clinical Application
远程监测系统对心脏起搏器患者中房颤的监测效果
张倩1*,王志蕾2,金鑫2,张雁飞3,佟佳宾2,施海峰2,陈浩2,刘俊鹏2,杨杰孚2, 邹彤2#
1深圳大学总医院心内科,广东 深圳
2北京医院心内科,北京
3国家老年医学中心北京医院,北京

收稿日期:2019年2月14日;录用日期:2019年2月28日;发布日期:2019年3月6日

摘 要
目的:观察远程监测系统能否对房颤患者进行早期诊断予及时治疗。方法:这是一项单中心对照研究,连续选取北京医院2009~04至2015~04期间植入Biotronic双腔起搏器的老年患者316例,按照起搏器是否具有远程功能分成远程监测组(实验组)和常规诊室随访组(对照组),平均随访24.4 ± 1.8个月,比较两组房颤发作的诊断时间、持续时间、房颤负荷及抗凝比例。结果:随访中69例患者出现房颤发作(实验组38例,对照组31例),总发病率23.4%,89.9%的患者(实验组36例,对照组26例,P = 0.230)房颤发作是隐匿的,其中实验组无症状房颤检出率更高(实验组26.5%,对照组16.6%)。实验组首次房颤发作的中位诊断时间较对照组明显缩短(P = 0.039)。48例患者出现2次及以上房颤发作,实验组在房颤首次复发的中位诊断时间上也较对照组明显缩短(P = 0.001)。阵发房颤患者中实验组较对照组房颤平均持续时间缩短(P = 0.006),同时房颤负荷 > 25%天数也明显缩短(P = 0.036)。69例患者中78.3%的患者CHA2DS2-VASc评分 ≥ 2分,但仅42%的患者接受抗凝治疗(实验组52.6%,对照组29%,P = 0.048)。结论:远程监测系统能够对房颤患者进行早期诊断与及时治疗,减少房颤持续时间、降低房颤负荷,可能给患者带来临床长远益处。
关键词 :心脏双腔起搏器,远程监测,房颤,体征和症状,临床应用

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
心房颤动是临床工作中最常见的心律失常类型,在普通人群中发病率约为1.5%~2% [1] [2] [3] 。在起搏器随访过程中发现,术后患者合并房颤的比例很高,即使患者在植入术前可能没有房颤相关病史,并且大多数患者的房颤是隐匿发作 [4] 。然而无论患者有没有症状,房颤负荷高、发作持续时间长都是脑卒中和死亡的独立危险因素 [5] ,因此对于这类无症状性房颤发作的患者同样需要提高警惕和及时有效干预。目前的心脏起搏器均具有诊断和记录心律失常发作的功能,但这些数据(如腔内心电图)只有在患者常规诊室随访或者自觉不适时主动就诊才能得到。而在临床实际工作中发现,患者术后随访的依从性较差 [6] [7] [8] 。鉴于传统的起搏器术后随访方式在预防疾病进展和监控患者病情变化等诸多方面存在问题,远程监测系统应运而生。本研究旨在观察远程监测系统能否早期发现和及时治疗无症状性房颤,为患者带来长远益处,进而评价该系统的临床应用价值。
2. 研究对象和方法
2.1. 研究对象
连续选取北京医院心血管内科2009~04至2015~04期间需植入Biotronic心脏双腔起搏器的老年患者316例,根据起搏器是否具有远程监测功能,分为远程监测随访组(实验组)和常规诊室随访组(对照组)。其中实验组152例,对照组164例。入组标准:年龄60岁及以上;病态窦房结综合征和/或房室传导阻滞需行永久性双腔起搏器植入术的患者,或者原有起搏器电池耗竭需行起搏器更换术的患者;既往无房颤病史;超声心动图提示左室射血分数 ≥ 50%;纽约心功能分级I级或II级。排除标准:目前正在口服I类或III类抗心律失常药物患者;目前正在口服抗凝药物或有明确抗凝禁忌症患者;既往有风湿性心脏病患者;既往有甲状腺功能亢进患者;既往有脑卒中病史患者;合并其他疾病如恶性肿瘤晚期、严重肝肾功能不全等不宜入组的患者;不愿参与者。
2.2. 研究方法
对所有患者术前详细询问病史、充分了解用药情况、进行全面的体格检查、完善体表12导心电图和超声心动图等辅助检查。所有患者行心脏永久性起搏器植入术或起搏器更换术,出院前均进行起搏器程控。远程监测随访组出院前打开家庭监测功能,予配备家庭监测移动终端,并指导患者及家属使用方法和注意事项。植入术后1个月、3个月、6个月、1年对所有患者进行诊室随访,此后1年至少1次 [1] 。随访时应用Biotronic公司程控仪行起搏器程控,诊室随访主要观察患者是否出现心房高频事件发作,询问患者有无自觉症状,并记录事件发作的时间、频率、持续时间及发作时有无心电图检查结果。远程监测随访组在上述随访基础上应用家庭监测系统每日自动传输起搏器信息,特殊报警事件随时传送。此外所有患者因病情变化进行不定期随访。所有患者随访2年,并由专人完成资料采集。主要研究终点为房颤首发(或者房颤复发)以及房颤确诊时间、诊疗方案。次要研究终点为出现房颤并发症(如脑卒中等)。
2.3. 起搏器参数设置
所有患者起搏器起搏方式设置为DDDR模式,最低心率为60次/分。打开起搏器自动模式转换功能,将检测频率设定为160次/分。
2.4. 房颤和无症状房颤的诊断标准及诊断时间
房颤诊断标准定义为:发生模式转换时起搏器记录的腔内心电图确认房颤发作(正常腔内心电图见图1(a),房颤腔内心电图见图1(b)),或起搏器未记录心电图的病例,发生模式转换时心房频率大于190次/分,持续时间大于6分钟 [9] 。房颤的症状定义为心悸、胸闷、胸痛、气短、头晕、乏力 [10] 。起搏器记录到的房颤时间段内患者完全无上述症状考虑为无症状性房颤发作。实验组房颤诊断时间定义为家庭监测系统报警时间与上次诊室随访的时间间隔。对照组房颤诊断时间定义为诊室随访时发现房颤的时间与上次诊室随访的时间间隔。
 (a)
(a) (b)
(b)
Figure 1. (a) Normal intracadiac electrogram in home monitoring system; (b) Atrial fibrillation intracadiac electrogram in home monitoring system
图1. (a) 家庭监测系统记录的正常腔内心电图;(b) 家庭监测系统记录的房颤腔内心电图
2.5. 统计学处理
采用SPSS 18.0 Windows版软件进行统计学处理,计量资料采用均数±标准差表示,计数资料采用百分数表示,连续变量的比较采用独立t检验,分类变量的比较采用χ2检验。P < 0.05为差异有统计学意义。
3. 结果
3.1. 患者临床基本资料
本研究连续选取北京医院心血管内科2009年4月至2015年4月需植入双腔起搏器的患者316例,远程监测随访组和常规诊室随访组两组间性别、年龄、适应症、合并症等方面均无明显差异(P > 0.05)。见表1。
Table 1. Patient clinical manifestations
表1. 患者临床基本特征
3.2. 患者诊室随访情况

Figure 2. The comparison of follow-up visits between two groups
图2. 两组患者2年内随访情况比较
316例患者自起搏器术后当日算起,2年内诊室随访0次15例(实验组7例,对照组8例),只有41.8%的患者随访次数达到了要求的5次及5次以上(实验组65例,对照组67例)。两组间比较无明显差异(P = 0.858)。具体随访次数见图2。此外远程监测组6例患者一直或者间断出现数据传输错误,遂共计失访21例(诊室随访0次15例),失访率6.6%。剩余295例患者平均随访24.4 ± 1.8个月(实验组:24.5 ± 1.7个月,对照组:24.3 ± 1.9个月,P = 0.346)。
3.3. 房颤诊断时间
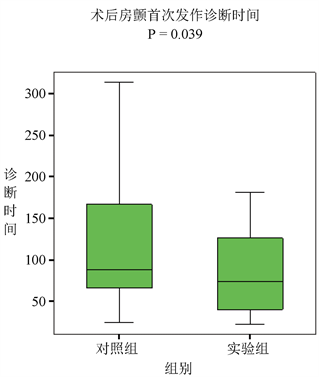
经过平均24.4个月随访观察,295例患者中共计69例患者(实验组38例,对照组31例)出现至少一次房颤发作,术后房颤的总发病率23.4% (实验组25%,对照组18.9%,P = 0.253)。观察发现房颤发作次数136次(实验组72次,对照组64次),其中66次(48.5%)房颤发作出现在术后6个月内(实验组37次,对照组29次,P = 0.479)。随访中发现实验组首次房颤发作的中位诊断时间较对照组明显缩短(实验组74天,对照组88天,P = 0.039)见图3(a)。此外48例患者(实验组28例,对照组20例)在整个随访过程中出现2次及以上房颤发作,实验组在房颤首次复发的中位诊断时间上也较对照组明显缩短(实验组57.5天,对照组151天,P = 0.001),见图3(b)。
3.4. 房颤持续时间
除去随访中9例持续性房颤患者,房颤发作平均持续时间为23.4小时(实验组17.6 ± 22.9小时,对照组27.9 ± 31.6小时,P = 0.006),且观察中发现症状性房颤发作持续时间均大于24小时。同时实验组较对照组平均房颤负荷 > 25%天数缩短(实验组1.6天,对照组2.2天,P = 0.036)。
 (a)
(a)  (b)
(b)
Figure 3. (a) The median time of first atrial fibrillation episode in two groups; (b) The median time of first atrial fibrillation recurrence in two groups
图3. (a) 患者术后房颤首次发作诊断时间;(b) 患者术后房颤首次复发诊断时间
3.5. 隐匿性房颤
89.9%的患者(实验组36例,对照组26例,P = 0.230)房颤发作是隐匿的,实验组无症状房颤检出率更高(实验组26.5%,对照组16.6%)。7例患者存在不同程度的心悸、头晕和乏力(实验组2例,对照组5例),其中对照组2例患者房颤复发时仍有症状,但程度较前明显减轻。
3.6. 房颤的抗凝治疗
54例(78.3%)房颤患者CHA2DS2-VASc评分 ≥ 2分,其中仅42% (29例)的患者接受抗凝治疗(实验组52.6%,对照组29%,P = 0.048)。18例患者服用华法林,余下患者服用新型口服抗凝药物(如达比加群等),如图4所示。抗凝持续时间2~24个月不等,随访结束时仅11例患者仍继续抗凝治疗中。另外发现7例患者因出血风险高或者患者意愿等原因选择服用阿司匹林(实验组3例,对照组4),未见抗凝、抗聚联合治疗病例。随访期间先后共有24例患者(P = 0.365)选择行房颤射频消融术,且均于术后进行了至少3个月的抗凝治疗。所有患者在随访期间未发现确诊脑卒中病例,也没有心力衰竭和死亡的病例。
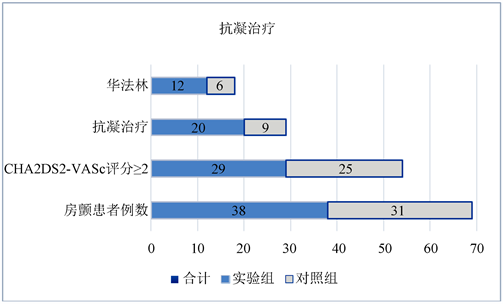
Figure 4. The comparison of antithrombotic therapy between two groups
图4. 两组抗凝治疗情况比较
4. 讨论
传统的随访模式要求起搏器术后1个月、3个月、6个月、1年随访1次,此后每年至少随访1次 [11] 。因早期起搏器阈值不稳定,需要及时程控调试,优化参数设置,同时也能及时发现术后并发症。然而国内现状不容乐观,调查显示我国起搏器术后1年门诊随访率为55%~85% [6] [7] [8] 。本实验中术后至少1次门诊随访的随访率95%,但只有41.8%的患者随访次数达到了要求的随访频次,两组间无明显差异。患者随访依从性差,部分患者可能认为植入设备后即可“高枕无忧”,忽视此后的随访工作。同时多数患者为老年人,如缺少家属陪同,自行门诊就诊存在诸多不便,通常延误按期的门诊随访。如果患者居住外地,则多数可能选择就近就医,也给随访工作带来不便。
目前的心脏双腔起搏器均具有诊断和记录心律失常发作的功能,很早就有人提出通过监测心房高频事件(Atrial High Rate Episodes, AHRE)来帮助诊断房性心律失常发作 [12] [13] 。但并不是所有心房高频事件都是房颤发作。Kaufman等人 [9] 将发生模式转换心房频率大于190次/分且持续时间大于6分钟设为房颤发作的截点,结果假阳性率17.3%。多数人认为假阳性可能与心房电极R波过感知有关 [14] [15] ,且更容易发生在心室起搏比例高的病例中。此外还有反复非夺获心室–心房同步现象(repetitive non-re-entrant ventriculo-atrial synchrony),是指当逆行P波出现在心室后心房不应期内,同时后面跟随一个心房起搏,且不能被夺获,从而导致了循环重复。当然,通过提高心房频率的检测截点,可以有效的降低假阳性率 [14] 。同时回顾记录下来的腔内心电图是十分必要的。本研究因样本量低,房颤发作次数较少,并未发现假阳性房颤发作事件。同时发现实验组患者更容易留下房颤发作的体表12导心电图,这可能与家庭监测系统报警后患者及时进行诊室随访,从而将阵发房颤发作记录下来。
文献报道起搏器术后患者房颤发生率20%~60%,如术前合并房性心律失常病史,这一比率可能会更高 [5] [16] [17] 。本实验术后2年房颤发病率23.4%,这较整体人群房颤发病率高,分析其原因可能为新进展的房内传导阻滞(interatrial block, IAB),患者因传导系统病变行起搏器植入术,虽然经起搏治疗,但并不能阻止累及传导系统的病变继续进展,出现房内传导阻滞。后者可引起心房点传导的不均一性和心脏血流动力学改变,进而导致部分患者阵发房颤发作 [18] 。同时阵发房颤反复发作,即使经过药物或者射频消融治疗后仍有再发风险,房内传导阻滞可能是原因之一 [19] [20] 。此外,不除外部分患者在入组前即已存在无症状性房颤发作,目前尚缺乏有效的检查方法筛出此类患者。
分析发现应用远程监测与规律的诊室随访相比,无论是术后首次房颤发作诊断时间,还是复发房颤的诊断时间,均有明显差异。远程监测系统因其实时监测功能,能够早期发现房颤事件,尤其是当房颤隐匿发作时。对照组在诊断复发房颤上较首发房颤需要更长的时间,这可能与前期诊室随访较为频繁有关,因多数房颤首次发作发生在术后6个月内,此时如患者按时诊室随访,可能已就诊3次,而此后6~12个月1次的诊室随访可能不够,这时远程监测的实时监测优势更加凸显,其作为诊室随访的补充,可降低后期低门诊随访的隐患。房颤负荷定义为房颤持续时间占总时间的百分比。实验组房颤持续时间及房颤负荷大于25%天数明显缩短,这可能与早期发现和及时有效的干预相关。房颤反复发作及持续时间长均可增加血栓栓塞事件的风险。
随访中发现89.9%的房颤患者完全为隐匿性发作,即使是那些有症状的房颤患者也同时存在无症状性发作。早期发现无症状性房颤发作具有重要意义。首先,无症状性发作有50%最终可能进展成有症状的房颤 [16] ,如不能早期发现与及时治疗,由阵发房颤变成持续或永久性房颤的进程可能也会加快。其次,长期无症状性房颤发作可能会导致心房重构,诱发充血性心力衰竭和栓塞事件,增加死亡率 [21] 。最后,对于ICD/CRT-D的患者来说,房颤发作时如合并快速心室率可能会被误诊为室速,从而导致不适当放电等不良后果。
根据危险因素的多少,房颤患者卒中风险增加2~7倍,死亡风险增加2倍,目前对栓塞风险评估主要依靠CHA2DS2-VASc评分系统 [1] 。因脑卒中具有高致残率及致死率,所以对其有效预防尤为重要。研究表明房颤患者应用华法林或新型口服抗凝药物,可减少约2/3的卒中风险 [22] 。目前对于无症状房颤患者抗凝治疗尚存在争议,争论的焦点在于何时开始或者终止抗凝治疗 [23] [24] [25] 。多数人认为房颤持续48小时后左房才能形成血栓,增加卒中风险,因此无症状性房颤持续几分钟或者几小时可能并不能形成血栓,所以近期出现卒中事件的患者如无症状性房颤诊断明确,建议开始抗凝治疗;如近期没有卒中病史的患者出现无症状性房颤,建议继续密切心电监测而不是立即抗凝治疗,尤其是对于那些有出血风险的患者 [25] 。而部分患者即使房颤转律治疗很成功,仍会复发房颤,且无症状性房颤发作十分常见,更应重视对于这类患者的诊治。本研究发现只有42%的CHA2DS2-VASc评分 ≥ 2分的患者接受了抗凝治疗,随访结束时仅11例患者继续抗凝治疗中,实验组的抗凝比例接近于对照组的2倍。患者对于卒中风险、抗凝获益认识不足,对于出血风险的过分焦虑,一定程度上影响着患者抗凝的依从性。同时华法林抗凝剂量较难控制,个体差异大,且受日常饮食和配伍药物的影响,需要频繁监测INR值,部分患者难以坚持。新型口服抗凝药虽然具有抗凝疗效确切、不需要监测INR值等优点,但因价格较高等因素,目前尚未广泛应用。本研究由于样本量小、随访时间短、未常规完善头部影像学检查等因素未观察到血栓栓塞事件的发生。目前仍需更多的实验研究证实短暂房颤发作与卒中风险及抗凝获益,从而指导临床诊疗。
5. 结论
起搏器术后患者房颤发病率高达23.4%,且绝大多数为隐匿发作。常规通过临床症状和体征、体表12导心电图、24小时动态心电图等方法检测房颤发作并不全面可靠,可能低估房颤的真实发病率。植入式永久性心脏起搏器可回顾发现房颤的发作,而远程监测系统因其具有实时监测功能,可以对这些无症状房颤患者进行早期诊断,从而及时干预,有望改变传统随访模式,为预防术后低门诊随访率所导致的不安全隐患提供了新的思路。
基金项目
本课题受《首都临床特色应用研究与成果推广》项目基金资助,课题编号:Z171100001017203。
文章引用
张 倩,王志蕾,金 鑫,张雁飞,佟佳宾,施海峰,陈 浩,刘俊鹏,杨杰孚,邹 彤. 远程监测系统对心脏起搏器患者中房颤的监测效果
Atrial Fibrillation Detection in Du-al-Chamber Pacemaker Recipients by Using Remote Monitoring System[J]. 临床医学进展, 2019, 09(03): 215-224. https://doi.org/10.12677/ACM.2019.93034
参考文献
- 1. Kirchhof P., Benussi, S., Kotecha, D., et al. (2016) 2016 ESC Guidelines for the Management of Atrial Fibrillation Developed in Collaboration with EACTS. European Journal of Cardio-Thoracic Surgery, 74, 1359-1469.
- 2. 周自强, 胡大一, 陈捷, 等. 中国心房颤动现状的流行病学研究[J].中华内科杂志, 2004, 43(7): 491-494.
- 3. Go, S., Hylek, E.M., Phillips, K.A., Chang, Y., Henault, L.E., Selby, J.V., et al. (2001) Prevalence of Diagnosed Atrial Fibril-lation in Adults: National Implications for Rhythm Management and Stroke Prevention: The Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA, 285, 2370-2375. https://doi.org/10.1001/jama.285.18.2370
- 4. Orlov, M.V., Ghali, J.K., Araghi-Niknam, M., Sherfesee, L., Sahr, D. and Hettrick, D.A. (2007) Asymptomatic Atrial Fibrillation in Pacemaker Recipients: Incidence, Progression, and Determinants Based on the Atrial High Rate Trial. Pacing and Clinical Electrophysiology, 30, 404-411. https://doi.org/10.1111/j.1540-8159.2007.00682.x
- 5. Glotzer, T.V., Daoud, E.G., Wyse, D.G., Singer, D.E., Ezekowitz, M.D., Hilker, C., Miller, C., Qi, D. and Ziegler, P.D. (2009) The Relationship between Daily Atrial Tach-yarrhythmia Burden from Implantable Device Diagnostics and Stroke Risk: The TRENDS Study. Circulation: Ar-rhythmia and Electrophysiology, 2, 474-480. https://doi.org/10.1161/CIRCEP.109.849638
- 6. 曹亚红, 周明. 单中心心脏永久起搏器植入术后患者主动随访的调查[J]. 中国误诊学杂志, 2009, 9(22): 5540-5541.
- 7. 林爱玲, 廖梅芳, 肖慧梅, 等. 老年患者安装心脏起搏器术后90例随访依从性分析[J]. 基层医学论坛, 2011, 15(3): 4-5.
- 8. 赵月香, 单兆亮, 郭红阳, 等. 心脏永久性起搏器植入患者门诊随访依从性分析[J]. 中国循环杂志, 2014, 29(10): 784-786
- 9. Kaufman, E.S., Israel, C.W., Nair, G.M., et al. (2012) Positive Predictive Value of Device-Detected Atrial High-Rate Episodes at Different Rates and Durations: An Analysis from ASSERT. Heart Rhythm, 9, 1241-1246. https://doi.org/10.1016/j.hrthm.2012.03.017
- 10. Kerr, C., Boone, J., Connolly, S., et al. (1996) Follow-Up of Atrial Fibrillation: The Initial Experience of the Canadian Registry of Atrial Fibril Lation. European Heart Journal, 17, 48-51. https://doi.org/10.1093/eurheartj/17.suppl_C.48
- 11. Marinskis, G., van Erven, L., Bongiorni, M.G., Lip, G.Y., Pison, L., Blomstrom-Lundqvist, C., et al. (2012) Practices of Cardiac Implantable Electronic Device Follow-Up: Results of the European Heart Rhythm Association Survey. Europace, 14, 423-425. https://doi.org/10.1093/europace/eus020
- 12. Seidl, K., Meisel, E., Van Agt, E., et al. (1998) Is the Atrial High Rate Episode Diagnostic Feature Reliable in Detecting Paroxysmal Episodes of Atrial Tachyarrhythmias? Pacing and Clinical Electrophysiology, 21, 694-700. https://doi.org/10.1111/j.1540-8159.1998.tb00125.x
- 13. Healey, J.S., Connolly, S.J., Gold, M.R., et al. (2012) ASSERT Investigators. Subclinical Atrial Fibrillation and the Risk of Stroke. New England Journal of Medicine, 366, 120-129. https://doi.org/10.1056/NEJMoa1105575
- 14. Plummer, C.J., McComb, J.M. trial S.A. (2003) Detection of Atrial Fibrillation by Permanent Pacemakers: Observations from the STOP AF Trial. Cardiac Electrophysiology Review, 7, 333-340. https://doi.org/10.1023/B:CEPR.0000023133.43829.9a
- 15. Bordacher, P., Cazeau, S., Graindorg, L. and Ritter, P. (2003) Impact and Prevention of Far-Field Sensing in Fallback Mode Switches. Pacing and Clinical Electrophysiology, 26, 206-209. https://doi.org/10.1046/j.1460-9592.2003.00017.x
- 16. Glotzer, T.V., Hellkamp, A.S., Zimmerman, J., Sweeney, M.O., Yee, R., Marinchak, R., et al. (2003) Atrial High Rate Episodes Detected by Pacemaker Diagnostics Predict Death and Stroke: Report of the Atrial Diagnostics Ancillary Study of the Mode Selection Trial (MOST). Circulation, 107, 1614. https://doi.org/10.1161/01.CIR.0000057981.70380.45
- 17. Gillis, A.M. and Morck, M. (2002) Atrial Fibrillation after DDDR Pacemaker Implantation. Journal of Cardiovascular Electrophysiology, 13, 542-547. https://doi.org/10.1046/j.1540-8167.2002.00542.x
- 18. Alicja, D.-K., Ewa, L., Anna, F., et al. (2011) Right Atrial Appendage Pacing in Cardiac Resynchronization Therapy—Haemodynamic Consequences of Interatrial Conduction Delay. Archives of Medical Science, 7, 728-731. https://doi.org/10.5114/aoms.2011.24146
- 19. Andres, E., Diego, C., Wilma, H., et al. (2014) Advanced Interatrial Block Is Associated with Recurrence of Atrial Fibrillation Post Pharmacological Cardioversion. Cardiovascular Therapeutics, 32, 52-56. https://doi.org/10.1111/1755-5922.12063
- 20. Gul, E.E., Pal, R., Caldwell, J., et al. (2017) Interatrial Block and Interatrial Septal Thickness in Patients with Paroxysmal Atrial Fibrillation Undergoing Catheter Ablation: Long-Term Follow-Up Study. Annals of Noninvasive Electrocardiology, 22. https://doi.org/10.1111/anec.12428
- 21. Levin, L.A., Husberg, M., Sobocinski, P.D., et al. (2014) Atrial Fibrillation in Patients with Cryptogenic Stroke. The New England Journal of Medicine, 370, 2467-2477. https://doi.org/10.1056/NEJMoa1311376
- 22. Boriani, G., Botto, G.L., Padeletti, L., Santini, M., Capucci, A., Gulizia, M., et al. (2011) Improving Stroke Risk Stratification Using the CHADS2 and CHA2DS2-VASc Risk Scores in Patients with Paroxysmal Atrial Fibrillation by Continuous Arrhythmia Burden Monitoring. Stroke, 42, 1768-1770. https://doi.org/10.1161/STROKEAHA.110.609297
- 23. Jedrzejczyk-Patej, E., Lenarczyk, R., Mazurek, M., Liberska, A., Przybylska-Siedlecka, K., Podolecki, T., et al. (2015) Can We Rely on Machines? Device-Detected Atrial High Rates Correspond Well with Atrial Arrhythmias in Cardiac Resynchronization Recipients. Europace, 18, 436-444.
- 24. Merinopoulos, I., Raphael, C.E., Yardley, A., Goonewardene, M. and Vassiliou, V.S. (2016) Device Identified Atrial Fibrillation at Pacing Clinics. Should It Guide Anticoagulation? International Journal of Cardiology, 207, 378-381. https://doi.org/10.1016/j.ijcard.2016.01.040
- 25. Dobreanu, D., Svendsen, J.H., Lewalter, T., et al. (2013) Current Practice for Diagnosis and Management of Silent Atrial Fibrillation: Results of the European Heart Rhythm Association Survey. Europace, 15, 1223-1225. https://doi.org/10.1093/europace/eut227
NOTES
*第一作者。
#通讯作者。
