Advances in Clinical Medicine
Vol.
09
No.
10
(
2019
), Article ID:
32582
,
11
pages
10.12677/ACM.2019.910180
Effect of MARCH2 on Autophagy and Growth of Ovarian Cancer HO-8910 Cells
Dan Xia
Pathology Department of Shandong Medical College, Linyi Shandong

Received: Sep. 19th, 2019; accepted: Oct. 14th, 2019; published: Oct. 21st, 2019

ABSTRACT
MARCH2 is a member of MARCH family, which is mainly responsible for vesicle transport. In this study, we constructed an over-expressed MARCH2 and silenced MARCH2 HO-8910 cell line to study the effect of MARCH2 on the autophagy level of ovarian cancer cells. It was found that knockout of MARCH2 could promote the formation of autophagosome and autophagic flow. On the contrary, overexpression of MARCH2 could inhibit the formation of autophagosome and autophagic flow. Further studies showed that the absence of MARCH2 mediated autophagy upstream of ULK1 and PIK3C3 complexes. In addition, MARCH2 deficiency can inhibit cell proliferation in vitro and the growth of xenografts in nude mice. These effects are related to the activation of autophagic signals.
Keywords:MARCH2, Autophagy, HO-8910 Cells, Ovarian Cancer
MARCH2对卵巢癌HO-8910细胞自噬及生长的影响
夏丹
山东医学高等专科学校病理教研室,山东 临沂

收稿日期:2019年9月19日;录用日期:2019年10月14日;发布日期:2019年10月21日

摘 要
Membrane-associated RING-CH protein 2 (MARCH2)是MARCH家族成员之一,主要负责囊泡运输,本研究构建了过表达MARCH2和沉默MARCH2的HO-8910细胞系,目的是为了研究MARCH2对卵巢癌细胞自噬及生长的影响。研究发现,沉默MARCH2可以促进自噬体的形成和自噬流,相反,过表达MARCH2会抑制自噬体的形成和自噬流,进一步研究发现,MARCH2缺失介导的自噬作用在ULK1和PIK3C3-BECN1复合物的上游。此外,沉默MARCH2可以抑制体外细胞增殖,亦会抑制体外裸鼠移植瘤的生长。这些效应与自噬信号的活化有关系。
关键词 :MARCH2,自噬,HO-8910细胞,卵巢癌

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
细胞自噬(Autophagy)是细胞依赖溶酶体对大批量蛋白和细胞器(如线粒体等)进行降解的一条重要途径 [1] [2] [3] 。细胞自噬在进化过程中高度保守,从酵母、线虫、果蝇到脊椎动物和人都可以找到参与细胞自噬的同源蛋白。这些细胞自噬蛋白的定位、修饰及相互作用网络决定着自噬体的形成、成熟、降解以及再生等动态过程。细胞自噬不仅对细胞在应激情况下(如饥饿、缺氧)的存活、程序性细胞死亡、抗原呈递以及细胞内病原体的清除有重要作用,而且对个体发育也至关重要。研究表明,细胞自噬异常可引发多种人类重大疾病,如肿瘤、自身免疫性疾病、心血管病、神经系统疾病、代谢综合症等,细胞自噬异常严重影响细胞和生物个体的发育、生长和衰老过程 [3] 。
自噬受到多个信号通路的调节,其中MTOR信号通路发挥重要的作用 [3] 。自噬的起始是由ULK1和PIK3C3两个激酶相互协调共同作用的结果,ULK1是ULK1复合物的一部分,当营养缺乏时,ULK1被激活,其下游的PIK3C3亦被激活,ULK1和PIK3C3的激活会招募更多的ATG蛋白到phagophore膜,从而促进自噬体的形成 [4] [5] 。
膜相关环指蛋白2 (Membrane-associated RING-CH protein 2, MARCH2)包含RING结构域,具有E3连接酶活性 [6] 。MARCH2首次是作为与病毒免疫逃逸蛋白相关的泛素连接酶家族成员之一被发现的 [7] 。MARCH2通过与STX6相互作用参与囊泡运输 [8] 。作为E3泛素连接酶,MARCH2能泛素化几种底物,DLG1 [9] 、β2AR [10] 和CFTR [11] 。我们的前期研究显示,MARCH2可以负向调控细胞自噬 [12] ,这个机制包括PIK3CA-AKT-MTOR和CFTR信号通路的抑制。然而,MARCH2在肿瘤中的作用尚不可知。
本研究中,我们展示了应用CRISPR/Cas9基因编辑生物技术敲除MARCH2会抑制卵巢癌的体内、外生长,这种抑制是通过自噬通路的效应实现的。
2. 材料和方法
2.1. 抗体和试剂
本研究所用试剂和抗体列表,如表1所示。
Table 1. List of reagents and antibodies used in this study
表1. 本研究所用试剂和抗体列表
2.2. 细胞培养、转染和处理
HO-8910细胞均培养于含10% FBS的DMEM培养基(12800-017; Invitrogen, Carlsbad, CA, USA)中,37℃,5% CO2无菌培养箱,常规传代。细胞转染使用MegaTran 1.0转染试剂(TT200004; ORIGEN, Rockville, MD, USA),按说明书操作步骤转染pcDB-MARCH2或空载质粒,选择G418构建过表达MARCH2细胞系,空载转染细胞系做对照。
2.3. 应用CRISPR/Cas9基因编辑技术构建敲除MARCH2基因的细胞系
应用CRISPR/Cas9基因编辑技术构建敲除MARCH2基因的HO-8910细胞系。由上海南方模式生物科技发展有限公司设计CRISPR干扰靶序列,人MARCH2的靶序列为TCCAAGGTCGTGGAGGCTACGGG (第二外显子),对克隆进行筛选。
2.4. 细胞活力检测
使用CellTiter96 AQueous One Solution细胞增殖检测试剂盒(G3582; Promega, Madison, WI, USA),按照操作手册进行。细胞活力计算方法:细胞活力 = 实验组吸光度/对照组吸光度 × 100%。每个实验设置3个复孔,独立重复3次。
2.5. Westernblot
细胞总蛋白的提取:将细胞置于冰上,用冰预冷的1 × PBS洗两遍,刮下细胞,收集到1.5 ml离心管中,于4℃,2000 g离心5分钟。去除上清,在沉淀中加入细胞裂解液(20 mM Tris-HCl,pH7.4,150 mM NaCl,1 mM EDTA,1 mM EGTA,1% Triton X-100,蛋白酶抑制剂Cocktail),吹吸混匀,冰上放置30分钟,4℃,15000 g离心20分钟,上清转入新管。细胞提取的蛋白按照BCA蛋白定量试剂盒说明书提供的方法进行蛋白定量。每组细胞蛋白取30 mg,加入蛋白上样缓冲液,于95℃水浴煮5分钟。15%丙烯酰胺胶SDS-PAGE电泳;100 V电转2小时;5%牛奶(TBST液配制)室温封闭1小时;加入相应的一抗,4℃过夜;用TBST充分洗膜3次,每次10分钟;然后加入相应的DyLight 680/800标记的二抗(1:10000),室温避光反应1小时;TBST洗膜后使用Odyssey Infrared Imager检测荧光信号并分析灰度值。
2.6. 裸鼠移植瘤模型构建
选用6~8周雌性BALB/c裸鼠(北京大学医学部实验动物中心)构建裸鼠移植瘤模型。所有动物在无病原环境下饲养,所有实验程序和协议由北京大学实验动物护理管理局批准。将对照(野生型) HO-8910细胞或Cas9-MARCH2HO-8910细胞注射在BALB/c裸鼠(n = 6)右侧腋窝皮下,注射总体积为100 μl (4 × 106细胞) [13] 。在注射后第20天,处死小鼠,剥离肿瘤并拍照。取部分肿瘤组织匀浆并提取蛋白,应用Western blot法检测SQSTM1、LC3B和ACTB的表达水平。
2.7. 免疫组织化学染色
采用免疫组化SP法,抗原修复为高压热修复,修复液使用1 mmol/L EDTA (pH9.0),一抗4℃孵育过夜,操作步骤按照试剂说明书进行,DAB显色。由两位病理医师独立阅片综合判断。每张切片随机观察5个有代表意义的高倍视野,每个高倍视野计数150~200个细胞,蛋白表达采用免疫反应评分(immunoreactivity score, IRS),将着色细胞数比例与着色强度相结合。按着色细胞占计数细胞百分率计分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。按着色强度计分:无着色为0分,淡黄为1分,黄色为2分,棕色为3分。将两项得分结果相乘:0~1分为阴性(−);2~4分为弱阳性(+);5~8分为中等阳性(++);9~12分为强阳性(+++)。如果两名病理医师评分差异 > 3分,则该标本需重新评分。
2.8. 统计学分析
Student’s t检验分析各组之间是否存在显著性差异,p < 0.05认为差异具有统计学意义。ns代表无显著性差异;*,p < 0.05;**,p < 0.01;***,p < 0.001。
3. 结果
3.1. 过表达/沉默MARCH2对卵巢癌细胞自噬水平的影响
3.1.1. MARCH2在自噬体形成早期阶段的作用
我们构建了过表达MARCH2质粒以及MARCH2 shRNA,将MARCH2-MYC、Vector、shMARCH2或shControl转染卵巢癌HO-8910细胞,经过嘌呤霉素以适合的浓度筛选得到过表达/沉默MARCH2的稳定细胞系,并对其有效性进行mRNA及Western blot水平的鉴定(图1),结果显示MARCH2-MYC能有效增加细胞中MARCH2的mRNA及蛋白水平,并且MARCH2 shRNA能有效敲减细胞中MARCH2的mRNA及蛋白水平,证实我们合成的MARCH2-MYC和shMARCH2有效。
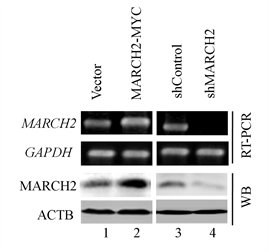
Figure 1. Identification of MARCH2-MYC and shMARCH2
图1. MARCH2-MYC、shMARCH2的鉴定
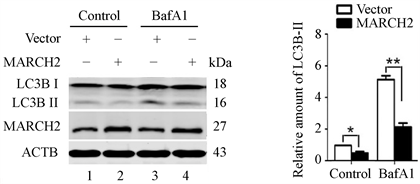
然后分析对自噬的效应。结果如图2所示,与对照组相比,MARCH2过表达能够减低本底LC3B-II的蛋白水平(图2,lane 2 vs lane 1)。减低的LC3B-II可能源于自噬体生成的减少或降解的增多,为了区分这两种可能性,我们使用了自噬体晚期抑制剂巴弗洛霉素A1 (BafA1,抑制囊泡H+-ATPase,溶酶体酸化受抑,从而阻碍自噬体与溶酶体的融合)。结果显示,经BafA1处理(孵育6小时)后,MARCH2过表达细胞和对照细胞中LC3B-II蛋白水平明显高于未处理的细胞,但过表达MARCH2细胞依然低于对照组(图2,lane 4 vs lane 3)。上述结果表明,MARCH2过表达引起的LC3B-II水平减低源于自噬体生成减少,而不是自噬体降解增多。
 (a) (b)
(a) (b)
Figure 2. The levels of LC3B-II were detected by western blot
图2. Western blot检测LC3B-II水平变化(*, p < 0.05; **, p < 0.01)
3.1.2. MARCH2在自噬流(Autophagic Flux)中的作用
上述结果表明,MARCH2过表达减少自噬体形成,那么它对自噬流是否有影响?
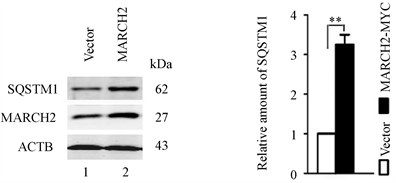
与对照细胞相比,过表达MARCH2细胞会导致内源性自噬底物SQSTM1水平有所升高(图3(a)和图3(b)),预示着自噬水平的减低,表明过表达MARCH2抑制自噬流。
 (a) (b)
(a) (b)
Figure 3. MARCH2 overexpression impairs autophagic flux
图3. MARCH2过表达抑制自噬流(**, p < 0.01)
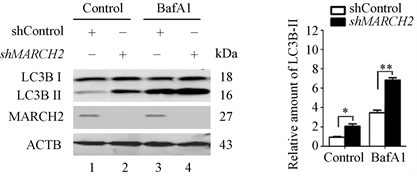
重复实验的数据显示,与对照组相比,敲减MARCH2能升高内源性LC3B-II的水平(图4,lane 2 vs lane 1)。升高的LC3B-II可能由于自噬体生成增多,也可能是自噬体降解减少,用BafA1处理阻断溶酶体降解后,与对照组相比,MARCH2沉默细胞中内源性LC3B-II的水平进一步升高(图4,lane 4 vs lane 3),表明MARCH2沉默促进了自噬体的生成,而不是阻断其降解。
 (a) (b)
(a) (b)
Figure 4. The levels of LC3B-II were detected by Western blot
图4. Western blot检测LC3B-II水平变化(*, p < 0.05; **, p < 0.01)
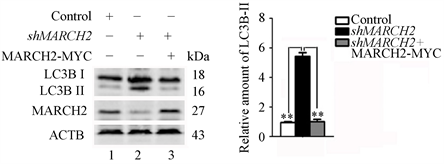
为了进一步确定MARCH2对自噬作用的特异性,我们还进行了补救实验。用对照HO-8910细胞(野生型)、shMARCH2HO-8910细胞或转染MARCH2-MYC过表达质粒24小时的shMARCH2HO-8910细胞进行Western blot检测,如图5(a)和图5(b)所示,转入MARCH2-MYC过表达质粒可以逆转沉默MARCH2引起的LC3B-II增多。
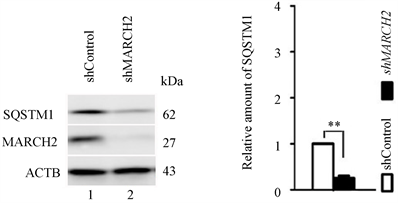
与对照组相比,沉默MARCH2细胞中内源性自噬底物SQSTM1 (图6(a)和图6(b))明显减少,表明沉默MARCH2促进自噬流。
3.1.3. 确定MARCH2调控卵巢癌细胞自噬的关键作用点
为了进一步明确MARCH2在自噬过程中作用的节点,我们利用Western blot检测敲减自噬起始阶段将PIK3C3-BECN1复合体重新定位到内质网的关键分子ULK1对于沉默MARCH2诱导自噬的影响,研究发现,敲减ULK1能阻断MARCH2失活导致的LC3B脂化(图7(a)和图7(b),lane 4 vs lane 2)。上述结果表明ULK1参与了MARCH2调控的细胞自噬。
 (a) (b)
(a) (b)
Figure 5. Exogenous MARCH2 expression can remedy the up-regulation of MARCH2 deficiency-induced autophagosome formation
图5. 外源性MARCH2的表达能够补救MARCH2沉默上调的自噬体形成(**, p < 0.01)
 (a) (b)
(a) (b)
Figure 6. MARCH2 silencing increases autophagic flux
图6. 沉默MARCH2促进自噬流(**, p < 0.01)
 (a) (b)
(a) (b)
Figure 7. ULK1 knockdown inhibits MARCH2 silencing-mediated autophagy
图7. ULK1敲减能够抑制沉默MARCH2诱导的自噬(**, p < 0.01; ***, p < 0.001)
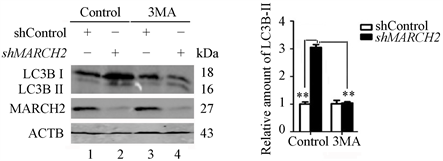
此外,我们还检测了BECN1-PIK3C3复合物对于敲减MARCH2诱导自噬的影响。3-MA (3-methylpurine)是PIK3C3的抑制剂,能够抑制PI3P的形成,被广泛用来作为自噬的抑制剂。我们利用Western blot检测3-MA对于沉默MARCH2诱导自噬的影响,结果显示沉默MARCH2能够明显上调LC3B-II的水平(图8(a)和图8(b),lane 2 vs lane 1),而3-MA处理减弱沉默MARCH2诱导的LC3B转换(图8(a)和图8(b),lane 4 vs lane 2)。上述的研究结果证明PIK3C3的活性与沉默MARCH2诱导的自噬相关联。上述结果表明MARCH2缺失介导的自噬作用在ULK1和PIK3C3-BECN1复合物的上游。
 (a) (b)
(a) (b)
Figure 8. MARCH2 silencing-mediated autophagy is associated with PIK3C3 activity
图8. 沉默MARCH2诱导的自噬与PIK3C3的活性相关(**, p < 0.01)
3.2. MARCH2调控的卵巢癌细胞自噬与信号通路
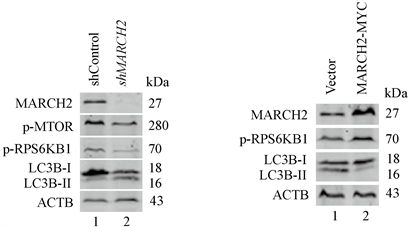
调节自噬的信号通路有多个,其中最重要的是MTOR信号通路。为了证实MARCH2缺陷是否通过抑制MTOR通路来启动自噬,我们对MTOR通路进行了检测。数据显示MARCH2缺陷的HO-8910细胞中MTOR (Ser2448)以及其下游的效应分子RPS6KB1激酶(Thr389)的磷酸化水平减低(图9(a)),表明MARCH2失活减弱了MTOR信号。相反地,在MARCH2过表达细胞中RPS6KB1激酶的磷酸化水平升高(图9(b)),表明MARCH2过表达促进MTOR信号通路。
 (a) (b)
(a) (b)
Figure 9. MTOR signaling pathway is involved in autophagy regulated by MARCH2
图9. MTOR信号通路参与MARCH2调控的自噬
3.3. MARCH2调控的自噬对卵巢癌细胞生长的影响
3.3.1. 体外实验:Cas9-MARCH2细胞的增殖情况
我们针对MARCH2基因第二外显子设计的CRISPR/Cas9干扰靶序列为 TCCAAGGTCGTGGAGGCTACGGG,通过载体构建、质粒纯化、转染、流式分选、单克隆培养、测序、分析、鉴定得到了敲除MARCH2基因的HO-8910细胞系。然后,我们检测了Cas9-MARCH2HO-8910细胞系的活力,进行了MTS细胞增殖实验,将对照组细胞(野生型细胞)和Cas9-MARCH2HO-8910细胞铺在96孔板(每孔3000个细胞,做5个复孔),血清饥饿18 h,然后加入10% FCS 24 h,48 h,96 h,144 h。检测结果显示,与对照组相比,Cas9-MARCH2HO-8910细胞的活力减低(图10)。
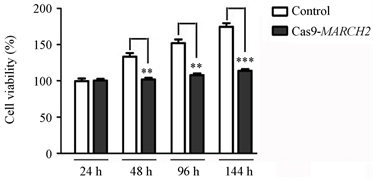
Figure 10. Viability of Cas9-MARCH2 HO-8910 cells were detected by MTS cell proliferation assay
图10. MTS细胞增殖实验检测Cas9-MARCH2 HO-8910细胞的活力(**, p < 0.01;***, p < 0.001)
3.3.2. 体内实验:动物移植瘤的生长情况
为了证实MARCH2在体内的效应,我们进行了BALB/c裸鼠体内卵巢癌移植瘤的实验。将野生型HO-8910细胞或Cas9-MARCH2 HO-8910细胞注射入BALB/c裸鼠右侧腋窝皮下。接种第20天后,处死小鼠,剥离出肿瘤、拍照。如图11(a),Cas9-MARCH2组比对照组的肿瘤体积小,表明沉默MARCH2降低HO-8910细胞的肿瘤形成能力(图11(a))。Western blot结果显示,与对照组相比,Cas9-MARCH2组的肿瘤内源性SQSTM1的水平减低,LC3B-II的水平升高(图11(b)),表明发生了自噬。提示在体内HO-8910细胞中沉默MARCH2诱导的自噬有抗肿瘤的作用。
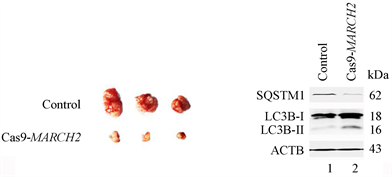 (a) (b)
(a) (b)
Figure 11. Loss of MARCH2 inhibits the tumorigenicity of ovary cancer cells in vivo
图11. 敲除MARCH2抑制卵巢癌移植瘤生长
3.4. 临床卵巢癌标本中MARCH2蛋白表达的检测
接下来,我们检测了原发性卵巢癌组织和相邻的非肿瘤组织中MARCH2的表达情况。在非肿瘤组织中,MARCH2呈现阴性表达(图12(a))。相反的,在大多数卵巢癌组织中,MARCH2呈现中度的表达(图12(b))。这些结果进一步提示MARCH2的高表达可能促进卵巢癌的发生发展。
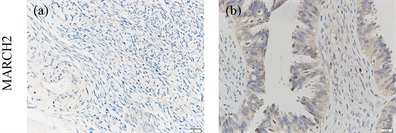
Figure 12. Upregulation of MARCH2 expression in human ovarian cancer
图12. MARCH2在人卵巢癌组织中表达上调(SP, ×200)
4. 讨论
本研究中,我们对MARCH2在卵巢癌发展中的功能和作用机制进行了体内、外的检测。沉默MARCH2抑制卵巢癌HO-8910细胞的活力,并且抑制移植瘤生长。进一步研究表明,这些效应与沉默MARCH2细胞中的自噬活化密切相关。而且,MARCH2在人卵巢癌组织呈中、高表达,而在非肿瘤组织中呈阴性表达,提示MARCH2可能促进卵巢癌的发生发展。此外,过表达MARCH2还伴有减低的自噬(LC3B表达的降低、升高的SQSTM1表达),减低的MTOR信号。这首次证明了在卵巢癌中MARCH2、MTOR和自噬之间的相关性,表明MARCH的灭活可能成为卵巢癌治疗的新靶点。
众所周知,自噬在肿瘤生物学中有促进和拮抗双重效应。自噬最初被认为可以抑制肿瘤的起始,这种肿瘤抑制作用的间接证据是自噬失活引起癌基因和肿瘤抑制基因的改变如AKT的扩增、PI3K突变和PTEN的缺失 [14] 。这意味着激活的自噬可以阻断细胞的癌基因转化。自噬作为肿瘤抑制因子的更多直接证据是来自核心自噬分子如ATG5、ATG7和BECN1的遗传学研究,研究显示自噬的缺陷能够增加肿瘤的发生 [15] [16] 。从机制的角度看,自噬的抑制引起ROS的积累、DNA损伤增多、线粒体缺陷,这些都参与了肿瘤发生 [17] 。自噬失活引起SQSTM1增多参与肿瘤发生 [16] 。相反,自噬可以通过SQSTM1减少抑制肿瘤发生 [17] 。SQSTM1的过表达参与了肾癌的发生 [18] 。SQSTM1缺陷抑制肿瘤发生 [19] ,可能因为升高了氧应激,也可能由于SQSTM1是多种癌基因通路的信号接合器,包括MTOR、NRF2和NF-κB [20] 。我们对敲除MARCH2的生物学活性研究也提供了新的证据,细胞中减少SQSTM1的水平,能够诱导细胞自噬从而抑制肿瘤的生长。
基金项目
本研究由国家自然科学基金项目(81702776);山东省医药卫生科技发展计划项目(2016WS0569)资助。
文章引用
夏 丹. MARCH2对卵巢癌HO-8910细胞自噬及生长的影响
Effect of MARCH2 on Autophagy and Growth of Ovarian Cancer HO-8910 Cells[J]. 临床医学进展, 2019, 09(10): 1163-1173. https://doi.org/10.12677/ACM.2019.910180
参考文献
- 1. He, C. and Klionsky, D.J. (2009) Regulation Mechanisms and Signaling Pathways of Autophagy. Annual Review of Genetics, 43, 67-93. https://doi.org/10.1146/annurev-genet-102808-114910
- 2. Levine, B., Mizushima, N. and Virgin, H.W. (2011) Autophagy in Immunity and Inflammation. Nature, 469, 323-335. https://doi.org/10.1038/nature09782
- 3. Mizushima, N., Levine, B., Cuervo, A.M. and Klionsky, D.J. (2008) Autophagy Fights Disease through Cellular Self-Digestion. Nature, 451, 1069-1075. https://doi.org/10.1038/nature06639
- 4. Dunlop, E.A. and Tee, A.R. (2014) mTOR and Autophagy: A Dynamic Relationship Governed by Nutrients and Energy. Seminars in Cell & Developmental Biology, 36, 121-129. https://doi.org/10.1016/j.semcdb.2014.08.006
- 5. Heras-Sandoval, D., Perez-Rojas, J.M., Hernandez-Damian, J. and Pedraza-Chaverri, J. (2014) The Role of PI3K/AKT/mTOR Pathway in the Modulation of Autophagy and the Clearance of Protein Aggregates in Neurodegeneration. Cellular Signalling, 26, 2694-2701. https://doi.org/10.1016/j.cellsig.2014.08.019
- 6. Bartee, E., Mansouri, M., Hovey, N.B., Gouveia, K. and Fruh, K. (2004) Downregulation of Major Histocompatibility Complex Class I Byhuman Ubiquitin Ligases Related Toviral Immune Evasion Proteins. Journal of Virology, 78, 1109-1120. https://doi.org/10.1016/j.cellsig.2014.08.019
- 7. Boutell, C., Sadis, S. and Everett, R.D. (2002) Herpes Simplex Virus Type 1 Immediate-Early Protein ICP0 and Is Isolated RING Finger Domain Act as Ubiquitin E3 Ligases in Vitro. Journal of Virology, 76, 841-850. https://doi.org/10.1128/JVI.76.2.841-850.2002
- 8. Nakamura, N., Fukuda, H., Kato, A. and Hirose, S. (2005) MARCH-Iiisasyntaxin-6-Binding Protein Involved in Endosomal Trafficking. Molecular Biology of the Cell, 16, 1696-1710. https://doi.org/10.1091/mbc.e04-03-0216
- 9. Cao, Z., Huett, A., Kuballa, P., Giallourakis, C. and Xavier, R.J. (2008) DLG1 Is an Anchor for the E3 Ligase MARCH2 at Sites of Cell-Cell Contact. Cellular Signalling, 20, 73-82. https://doi.org/10.1016/j.cellsig.2007.08.019
- 10. Han, S.O., Xiao, K., Kim, J., Wu, J.H., Wisler, J.W., Nakamura, N., et al. (2012) MARCH2 Promotes Endocytosis and Lysosomal Sorting of Carvedilol-Bound Beta(2)-Adrenergic Receptors. The Journal of Cell Biology, 199, 817-830. https://doi.org/10.1083/jcb.201208192
- 11. Cheng, J. and Guggino, W. (2013) Ubiquitination and Degradation of CFTR by the E3 Ubiquitin Ligase MARCH2 through Its Association with Adaptor Proteins CAL and STX6. PLoS ONE, 8, e68001. https://doi.org/10.1371/journal.pone.0068001
- 12. Xia, D., Qu, L., Li, G., Hongdu, B., Xu, C., Lin, X., et al. (2016) MARCH2 Regulates Autophagy by Promoting CFTR Ubiquitination and Degradation and PIK3CA-AKT-MTOR Signaling. Autophagy, 12, 1614-1630. https://doi.org/10.1080/15548627.2016.1192752
- 13. Kugimiya, N., Nishimoto, A., Hosoyama, T., Ueno, K., Enoki, T., Li, T.S., et al. (2015) The c-MYC-ABCB5axis Plays a Pivotal Role in 5-Fluorouracil Resistance in Human Colon Cancer Cells. Journal of Cellular and Molecular Medicine, 19, 1569-1581. https://doi.org/10.1111/jcmm.12531
- 14. Kimmelman, A.C. (2011) The Dynamic Nature of Autophagy in Cancer. Genes & Development, 25, 1999-2010. https://doi.org/10.1101/gad.17558811
- 15. Takamura, A., Komatsu, M., Hara, T., et al. (2011) Autopha-gy-Deficient Mice Develop Multiple Liver Tumors. Genes & Development, 25, 795-800. https://doi.org/10.1101/gad.2016211
- 16. Inami, Y., Waguri, S., Sakamoto, A., et al. (2011) Persistent Activation of Nrf2 through p62 in Hepatocellular Carcinoma Cells. The Journal of Cell Biology, 193, 275-284. https://doi.org/10.1083/jcb.201102031
- 17. White, E. (2015) The Role for Autophagy in Cancer. Journal of Clinical Investigation, 125, 42-46. https://doi.org/10.1172/JCI73941
- 18. Mathew, R., Karp, C.M., Beaudoin, B., et al. (2009) Autophagy Sup-presses Tumorigenesis through Elimination of p62. Cell, 137, 1062-1075.
- 19. Li, L., Shen, C., Nakamura, E., et al. (2013) SQSTM1 Is a Pathogenic Target of 5q Copy Number Gains in Kidney Cancer. Cancer Cell, 24, 738-750. https://doi.org/10.1016/j.ccr.2013.10.025
- 20. Duran, A., Linares, J.F., Galvez, A.S., et al. (2008) The Signaling Adaptor p62 Is an Important NF-kappaB Mediator in Tumorigenesis. Cancer Cell, 13, 343-354. https://doi.org/10.1016/j.ccr.2008.02.001
