Traditional Chinese Medicine
Vol.07 No.02(2018), Article ID:24153,9
pages
10.12677/TCM.2018.72026
Effect and Mechanism of Berberine on Human Hepatocellular Carcinoma Cell Line Hep-G2
Min Wang1, Zhimin Zhang2, Bicheng Zhang2, Bo Yang2, Lan Liu2, Hongxing Fu2, Zhiguo Rao2
12015 Graduate Class, Hubei University of Traditional Chinese Medicine, Wuhan Hubei
2Department of Oncology, Wuhan General Hospital, Guangzhou Command of PLA, Wuhan Hubei
Received: Mar. 6th, 2018; accepted: Mar. 18th, 2018; published: Mar. 26th, 2018

ABSTRACT
Objective: To investigate the effect and mechanism of Berberine on inhibiting cell proliferation and inducing apoptosis in Hepatocellular carcinoma Hep-G2 cell line. Methods: The inhibitory effect of Berberine on the proliferation of Hep-G2 cells was detected by CCK-8 method; effect of Berberine on cell apoptosis by flow cytometry (FCM); western blotting and real time fluorescent quantitative PCR (RT-PCR) analysis were used to detect the mRNA and protein expression of anti proliferation gene BTG2 and CyclinB1, cyclin D1. Results: The proliferation of Hep-G2 cell lines was inhibited by Berberine in a dose and time dependent manner, and compared with the control group, the difference was statistically significant (p < 0.01). Berberine promotes cell apoptosis, and the rate of apoptosis is proportional to the effect time of Berberine (P < 0.01). The expression of BTG2 mRNA increased with the time of Berberine treatment (p < 0.01), and compared with the control group, there’s significant difference (p < 0.01); while the expression of CyclinB1, CyclinD1 mRNA was gradually decreased with the time of Berberine intervention (p < 0.01 or p < 0.05), and the difference was significantly compared with the control group (p < 0.01). Compared with the control group, the differential expression of BTG2 and CyclinB1, CyclinD1 protein was significant (p < 0.05). Conclusions: Berberine can inhibit the proliferation of Hep-G2 cells and induce cells apoptosis, which mechanism may be related to the up-regulation of BTG2 and down-regulation of CyclinB1, Cyclin D1 by berberine.
Keywords:Berberine, Hepatocellular Carcinoma, Cell Proliferation, Cell Apoptosis, BTG2, CyclinB1, Cyclin D1
黄连素对肝癌Hep-G2细胞株的作用研究
王敏1,张志敏2,章必成2,杨波2,刘兰2,付红星2,饶智国2
1湖北中医药大学2015级研究生班,湖北 武汉
2解放军武汉总医院肿瘤科,湖北 武汉
收稿日期:2018年3月6日;录用日期:2018年3月18日;发布日期:2018年3月26日

摘 要
目的:探讨黄连素(berberine, BBR)作用于肝癌Hep-G2细胞增殖和凋亡的机制。方法:CCK-8法检测BBR对Hep-G2细胞增殖的抑制作用;流式细胞术检测BBR对细胞凋亡的影响;蛋白印迹法(Western blotting)及实时荧光定量PCR (RT-PCR)检测抗增殖基因BTG2及细胞周期蛋白CyclinB1、CyclinD1的蛋白及mRNA表达的情况。结果:与对照组相比,BBR可以抑制肝癌Hep-G2细胞的增殖,且抑制率与BBR浓度成正比,差异具有统计学意义(p < 0.01);与对照组相比,BBR可诱导细胞凋亡(p < 0.01),且凋亡率随着黄连素的作用时间的延长而增加(p < 0.01);BTG2 mRNA的表达随着BBR作用时间的延长逐渐增强(p < 0.01),且与对照组相比,差异具有显著性(p < 0.01),而CyclinB1、CyclinD1mRNA的表达则随着BBR作用时间的延长逐渐减弱(p < 0.01或p < 0.05),与对照组相比,差异具有显著性(P < 0.01);与对照组相比,BTG2和CyclinB1、CyclinD1蛋白表达的差异具有显著性(p < 0.05)。结论:BBR可抑制肝癌细胞Hep-G2的增殖,诱导细胞凋亡,其机制可能与其上调抗增殖基因BTG2和下调细胞周期蛋白CyclinB1、CyclinD1的表达有关。
关键词 :黄连素,肝癌,细胞增殖,细胞凋亡,BTG2,细胞周期蛋白B1,细胞周期蛋白D1

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
原发性肝癌是我国常见的恶性肿瘤之一,肝细胞癌(hepatocellular carcinoma, HCC)占90%以上,最新资料显示HCC高居中国肿瘤发病的第3、4位和肿瘤死因的第2、3位 [1] [2] 。对于原发性肝癌的治疗,最根本的方法是手术切除,但由于起病隐袭、侵袭性高、进展迅速和早期诊断困难,我国HCC患者确诊时多己为局部晚期或者发生远处转移,往往不适合或不能够单独采取外科手术、肝动脉栓塞化疗(transcatheter arterial chemoembolization, TACE)或理化消融等局部治疗 [3] 。这类患者预后很差。
黄连素又称小檗碱,1959年Hano [4] 报道了其具有抗肿瘤活性。近年研究发现黄连素及其衍生物可选择性诱导人肝癌细胞死亡,但对人的正常肝细胞无细胞毒性,表明黄连素及其衍生物具有肝癌靶向细胞毒性,有可能成为有前途的多功能抗肝癌药物 [5] 。本文以体外细胞实验研究黄连素调节抑癌基因BTG2和细胞周期蛋白CyclinB1、CyclinD1的表达来探讨其抗肝癌细胞株Hep-G2作用机制及可能影响的信号通路的研究,且该方面的研究及报道较少见,为其临床应用于肝癌的治疗提供理论基础,也为后期更为精确的用药提供理论支持。
2. 材料与方法
2.1. 药品和试剂
黄连素(盐酸小檗碱)购自成都艾特姆生物科技有限公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;PI染色试剂盒及AnnexinV-FITC/PI 凋亡检测试剂盒均购自Bio-Swamp公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,鼠抗BTG2和兔抗CyclinB1、CyclinD1抗体均购自Abcam公司;引物由上海Invitrogen生物制品公司合成;Trizol购自北京康为世纪生物科技有限公司,SYBR Green PCR试剂盒购自KAPA Biosystems公司,逆转录试剂盒购自TAKARA公司。
2.2. 细胞系与细胞培养
人肝癌细胞株Hep-G2由中国典型培养物保藏中心(武汉大学保藏中心)提供,用MEM Hyclone培养基、10%胎牛血清、青霉素-链霉素溶液配制成的完全培养基,于37℃、5% CO2饱和湿度的细胞培养箱中培养,待细胞生长至对数生长期时备用。
2.3. CCK-8检测BBR对Hep-G2细胞增殖的抑制作用
取对数生长期的Hep-G2细胞,接种于三个96孔板中,100 ul/孔,于37℃、5% CO2饱和湿度的细胞培养箱中培养24 h,待细胞贴壁后,给予不同浓度的BBR (12.5,25,50,100,200 µmol/L)干预细胞,另设阴性对照组(只有细胞和培养基)和空白组(没有细胞只有培养基),每个浓度设五个复孔,每个96孔板边缘孔均加入PBS 100 ul,分别培养24 h、48 h、72 h后,吸出原液,用遇冷的PBS洗涤一遍,每孔加入用MEM培养基稀释的CCK-8 100 ul,置于细胞培养箱中孵育三小时。用酶联免疫检测仪测定每孔在450 nm处的吸光度值,然后根据公式计算细胞增殖抑制率。实验重复三次。细胞增殖抑制率(%) = [1 − (实验组OD值 − 空白组OD值)/(阴性对照组OD值 − 空白组OD值)] × 100%。经加权直线回归方程计算出黄连素抑制细胞增殖率为25%时的对应浓度值。
2.4. 流式细胞术检测细胞周期变化及细胞凋亡率
取对数生长期的细胞,制成3 × 105/ml的单细胞悬液,接种于三个6孔板中,于37℃、5% CO2饱和湿度的细胞培养箱中培养24 h,待细胞贴壁后,给予抑制率为25%的BBR用药浓度对细胞进行处理,另设空白对照组,继续孵育24、48、72小时。孵育时间到后用遇冷的PBS洗涤两遍,胰酶消化,离心收集细胞,并重悬于200 ul的Binging Buffer中,再根据PI染色试剂盒和AnnexinV-FITC/PI凋亡检测试剂盒的说明书进行细胞染色,最后用流式细胞仪检测细胞周期及凋亡细胞分布情况。实验重复三次。
2.5. Western Blot检测BTG2和CyclinB1、CyclinD1的蛋白表达情况
取对数生长期的细胞,制成3 × 105/ml的单细胞悬液,接种于三个6孔板中,于37℃、5% CO2饱和湿度的细胞培养箱中培养24 h,待细胞贴壁后,给予抑制率为25%的BBR用药浓度对细胞进行处理,另设空白对照组,继续孵育24、48、72小时。收集细胞后提取蛋白并根据BCA蛋白浓度测定试剂盒说明书测定各组蛋白的含量,每组样品各取40 µg蛋白进行上样。根据10% SDS-PAGE凝胶试剂盒制成分离胶和5%的浓缩胶,进一步电泳、转膜,将凝胶上的蛋白转移至NC膜上。用5%的BSA室温下于摇床上封闭1小时,加入一抗(鼠抗BTG2和兔抗CyclinB1、CyclinD1,工作液的浓度分别为1:500、1:1000和1:1000),于4℃冰箱里孵育过夜,1 × TBST洗涤液洗膜后再加入相应的二抗((1:5000 HRP 标记的羊抗兔IgG和羊抗鼠IgG),室温下于摇床上孵育30 min,以β-actin作为内参。仍然用1 × TBST洗涤液洗膜后,用ECL化学发光法进行观察。实验重复三次。
2.6. RT-PCR检测BTG2和CyclinB1、CyclinD1 mRNA的表达
取对数生长期的细胞,制成3 × 105/ml的单细胞悬液,接种于三个6孔板中,于37℃、5% CO2饱和湿度的细胞培养箱中培养24 h,待细胞贴壁后,给予抑制率为25%的BBR用药浓度对细胞进行处理,另设空白对照组,继续孵育24、48、72小时。孵育时间到后收集各组细胞,提取蛋白后用Trizol提取总RNA,并测定RNA的质量,根据逆转录试剂盒说明书将总RNA逆转录成cDNA,根据该试剂盒的说明书,反转录的条件是:20 uL反应体系,其反应程序是42℃,60 min;70℃,10 min;−20℃,hold。根据PCR试剂盒说明书及荧光定量PCR仪对cDNA进行扩增,反应体系20 uL:PreMix 10 μL、上游引物0.5 μL、下游引物0.5 μL、cDNA 模板1 μL及ddH2O 8 μL,PCR扩增反应程序设置:94℃预变性1 min;94℃变性15 s,58℃退火20 s,72℃延伸20 s,循环40次;72终末延伸5 min;4℃保温。最后运用c-omparative2−△△CT 法分析各基因的相对表达。实验重复三次。所用引物序列见表1。
2.7. 统计学处理
应用SPSS 20.0软件进行实验数据的统计学分析,实验数据均以 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验,若方差不齐则采用Tamhane检验,以p < 0.05为差异有统计学意义。
表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验,若方差不齐则采用Tamhane检验,以p < 0.05为差异有统计学意义。
3. 结果
3.1. BBR对肝癌Hep-G2细胞增殖的影响:见表2
各组BBR作用于HepG-2细胞12 h、24 h、48 h、72 h后,细胞生长出现明显抑制,且细胞生长抑制率随药物浓度的增加而升高。经加权直线回归方程计算出BBR作用于HepG-2细胞24 h的抑制率为25%的BBR用药浓度为30 µmol/L。
将浓度为30 µmol/L的BBR干预Hep-G2细胞24 h、48 h、72 h小时后,与对照组相比,实验组细胞凋亡率增加,具有明显的时间依耐性,差异具有显著性(P < 0.01)。
3.3. BBR对Hep-G2细胞BTG2 mRNA和CyclinB1、CyclinD1mRNA表达的影响:见图2
将浓度为30 µmol/L的BBR分别干预细胞24 h、48 h、72 h后,与对照组相比,BTG2 mRNA的相对表达量逐渐增加(P < 0.01),随着作用时间的延长增加更显著(P < 0.01)。而CyclinB1、CyclinD1mRNA的表达,与对照组相比,逐渐减低(P < 0.01)。
3.4. BBR对Hep-G2细胞BTG2和CyclinB1、CyclinD1蛋白表达的影响:见图3
与对照组相比,将浓度为30 µmol/L的BBR分别干预细胞24 h、48 h、72 h后,BTG2蛋白的表达逐渐增高(P < 0.01)。同时CyclinB1、CyclinD1蛋白的表达逐渐减弱(P < 0.01或P < 0.05)。
4. 讨论
黄连素,可从传统中药黄连、黄柏、三颗针等植物中提取,黄连素及其衍生物在治疗心血管疾病、抗肿瘤、免疫调节、精神疾病、骨质疏松等多方面具有一定的药理作用。近年研究显示黄连素可通过诱导ROS生成 [6] 、调节HIF-1α、抑癌因子p21WAFl/CIPl、细胞周期蛋白CyclinB1的表达 [7] [8] 、触发Caspase-3、Caspase-8和Caspase-7的活性 [9] 、抑制NF-κB的活性及其通路影响VEGF mRNA和蛋白的表达 [10] 、提高GRP78/HSPA5的表达 [11] 等多种途径影响肿瘤细胞的增殖、调控细胞周期、抑制侵袭及转移、调节自噬、增敏增效等方面发挥其抗肿瘤作用。
BTG2 (B-cell translocation gene-2)作为一种抗增殖基因,是早期瞬时反应基因之一,属于BTG/Tob抑癌基因家族成员之一。已有大量研究证实,BTG2在许多肿瘤中的表达下调,在多种肿瘤细胞的分化、
Table 1. Real-time fluorescence quantitative PCR primers were used in this study
表1. 本研究使用的实时荧光定量PCR引物序列
Table 2. Comparison of the growth inhibition rate of hepg2 cells with different concentrations of berberine at different time levels (%,)
表2. 不同浓度的BBR培养HepG2不同时间后细胞生长抑制率的比较(%,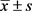 )
)
注:BBR为黄连素;Hep-G2为人肝癌细胞株;每组每个时间点的样本量为3;a代表与空白对照组的比较P < 0.01;b代表与12.5 μmol/L的比较P < 0.01;c代表与25 μmol/L的比较P < 0.01;d与50 μmol/L的比较P < 0.01;e与100 μmol/L的比较P < 0.01。
 注:左上象限为坏死细胞;左下象限为正常细胞;右上象限为凋亡中晚期细胞;右下象限为凋亡早期细胞。
注:左上象限为坏死细胞;左下象限为正常细胞;右上象限为凋亡中晚期细胞;右下象限为凋亡早期细胞。
Figure 1. The effects of BBR on apoptosis of Hep-G2 cells measured by flow cytometry
图1. 流氏细胞仪测BBR对Hep-G2细胞凋亡的影响
Table 3. The comparison of the apoptosis rate of Hep-G2 cells with a certain concentrations of berberine at different time levels (%,)
表3. 一定浓度的BBR培养Hep-G2不同时间后细胞凋亡率的比较(%, )
)
注:BBR为黄连素;Hep-G2为人肝癌细胞株;a代表与对照组相比P < 0.01;b代表实验组之间与24 h的比较P < 0.01;c代表实验组之间与48 h的比较P < 0.01。
 注:*代表相对于对照组P < 0.01。
注:*代表相对于对照组P < 0.01。
Figure 2. The effects of BBR on the expression of Hep-G2 cells in BTG2 and CyclinB1 and CyclinD1 mRNA
图2. BBR对Hep-G2细胞BTG2和CyclinB1、CyclinD1mRNA表达的影响
 注:A. Western Blotting检测BTG2和CyclinB1、CyclinD1蛋白表达情况;B、C、D半定量分析BTG2和CyclinB1、CyclinD1蛋白表达情况(*代表相对于对照组P < 0.01,#代表相对于对照组P < 0.05)。
注:A. Western Blotting检测BTG2和CyclinB1、CyclinD1蛋白表达情况;B、C、D半定量分析BTG2和CyclinB1、CyclinD1蛋白表达情况(*代表相对于对照组P < 0.01,#代表相对于对照组P < 0.05)。
Figure 3. The effects of BBR on the expression of Hep-G2 cells in BTG2 and CyclinB1 and CyclinD1 protein
图3. BBR对Hep-G2细胞BTG2和CyclinB1、CyclinD1蛋白表达的影响
增殖、DNA损伤修复以及凋亡中起重要作用 [12] [13] [14] [15] [16] ,且与肿瘤的大小、分级、转移、复发及预后不良都有一定关系 [17] 。多个实验研究表明上调BTG2的表达,可抑制乳腺癌、前列腺癌、胶质母细胞瘤等肿瘤细胞的增殖、诱导细胞凋亡 [18] [19] [20] [21] 。目前,也有学者证实BTG2在肝癌组织中不表达或者表达非常低,而相应的癌旁组织或正常肝细胞中表达则较高,提示BTG2的高表达对肝癌的发生、进展均具有抑制作用 [22] [23] 。本实验结果发现一定剂量的黄连素干预Hep-G2细胞后,BTG2蛋白及mRNA的表达都随着时间延长逐渐增强,差异具有统计学意义。
细胞周期蛋白Cyclin B1作为Cyclins家族的一员,活化并与CDKs即CDC2 (cell division cycle)形成复合物,促使细胞进行G2/M期转变。有多项研究表明,Cyclin B1的表达,在肿瘤细胞的增殖中起重要作用 [24] [25] 。有研究 [26] 发现人肝癌组织中CyclinB1 mRNA表达水平与临床分期、门静脉癌栓、术后复发、肿瘤直径和肿瘤低分化等成正相关。在本实验中当一定剂量的黄连素干预HepG-2细胞后,CyclinB1 mRNA和蛋白的表达均随着时间延长逐渐增强,具有明显时间依赖性,差异具有统计学意义。
Cyclin D1作为一种潜在的原癌基因蛋白,且是调控G1期的关键蛋白,并且在多种肿瘤中过表达。有研究表明下调Cyclin D1的表达,可使细胞周期阻滞在G1期,从而抑制肿瘤细胞增殖、诱导细胞凋亡 [27] [28] 。目前,另有学者研究cyclin D1在丙型肝炎相关性肝细胞肝癌组织中的表达较癌旁组织,以及基本正常肝脏组织明显增高,且与肝癌组织的病理学分级及患者的不良预后呈正相关,提示cyclin D1高表达的致癌作用 [29] 。在本实验中当一定浓度的黄连素干预HepG-2细胞后,CyclinD1 mRNA和蛋白的表达均随着时间延长逐渐增强,具有明显的时间依耐性,差异具有统计学意义。
肿瘤发生的本质原因是癌基因的激活和(或)抑癌基因的失活。BTG2作为抗增殖蛋白基因,是细胞周期动力学的重要调节因子,与细胞周期的控制和细胞对DNA损伤反应有关。研究 [8] [28] 发现提高BTG2的表达可抑制CyclinD1蛋白的转录活性,降低CyclinD1蛋白表达,然后通过经视网膜母细胞瘤基因(Rb)途径使细胞阻滞在G1期,促使细胞凋亡。BTG2也可通非Rb途径阻止CyclinB1和Cdc2的结合,抑制Cdc2激酶活性,导致G2期的停滞,而诱导G2/M期的细胞周期阻滞及细胞凋亡。在该实验中我们发现随着一定剂量的黄连素作用时间的延长,细胞的凋亡率逐渐增多,且BTG2蛋白表达逐渐上升,同时CyclinB1、Cyclin D1 mRNA及蛋白表达逐渐下调,引起细胞周期阻滞,诱导细胞凋亡。
由此我们推断,黄连素具有抑制肝癌细胞增殖,诱导细胞凋亡的作用。这与前期,我们实验组研究的48 h的半数抑制浓度IC50 = 41.18 μmol/L的黄连素调节肝癌HepG2细胞增殖和凋亡的结果相一致。其机制之一可能是通过上调抑癌基因BTG2的表达,同时引起CyclinB1、Cyclin D1的表达下调。但是在该实验中黄连素对抗增殖基因BTG2的作用机制并不清楚,有待进一步研究,且BTG2抗肿瘤的作用与Cyclin B1、Cyclin D1的表达抑制是否有直接相关性,也需要进一步实验来证实。若将黄连素用于肝癌的临床治疗,是否具有临床疗效,还需要临床试验及进一步深入探讨。
基金项目
国家自然科学基金青年项目(81301631)。
湖北省卫计委青年人才项目(WJ2017H0036)。
文章引用
王敏,张志敏,章必成,杨 波,刘 兰,付红星,饶智国. 黄连素对肝癌Hep-G2细胞株的作用研究
Effect and Mechanism of Berberine on Human Hepatocellular Carcinoma Cell Line Hep-G2[J]. 中医学, 2018, 07(02): 158-166. https://doi.org/10.12677/TCM.2018.72026
参考文献
- 1. Torre, L.A., Bray, F., Siegel, R.L., et al. (2015) Global Cancer Statistics, 2012. Ca A Cancer Journal for Clinicians, 65, 87-108. https://doi.org/10.3322/caac.21262
- 2. Chen, W., Zheng, R., Baade, P.D., et al. (2016) Cancer Statistics in China, 2015. Ca A Cancer Journal for Clinicians, 66, 115. https://doi.org/10.3322/caac.21338
- 3. Gong, X.L. and Qin, S.K. (2016) Review and Present Status of Systematic Treatment of Advanced Hepatocellular Carcinomain in 30 Years. Practical Journal of Oncology, 31, 357-397.
- 4. Hano, K. (1959) The Carcinostatic Effects of Some Plant Components and Their Related Compounds. Acta-Unio Internationalis Contra Cancrum, 15, 122.
- 5. Liu, B., Wang, G., Yang, J., et al. (2011) Berberine Inhibits Human Hepatoma Cell Invasion without Cytotoxicity in Healthy Hepatocytes. PLoS ONE, 6, e21416. https://doi.org/10.1371/journal.pone.0021416
- 6. Ren, K., Zhang, W., Wu, G., et al. (2016) Synergistic Anti-Cancer Effects of Galangin and Berberine through Apoptosis Induction and Proliferation Inhibition in Oesophageal Carcinoma Cells. Biomedicine & Pharmacotherapy, 84, 1748-1759. https://doi.org/10.1016/j.biopha.2016.10.111
- 7. Zhang, Q., Wang, J.F. and Ma, J.X. (2013) Radiosensitizing Effect of Berberine on Nude Mice Transplanted with LNCaP Cells of Prostate Cancer. Chinese Journal of Clinicians, 7, 11549-11552.
- 8. Eo, S.H., Kim, J.H. and Kim, S.J. (2015) Induction of G2/M Arrest by Berberine via Activation of PI3K/Akt and p38 in Human Chondrosarcoma Cell Line. Oncology Research, 22, 147-157. https://doi.org/10.3727/096504015X14298122915583
- 9. Seo, Y.S., Yim, M.J., Kim, B.H., et al. (2015) Berberine-Induced Anticancer Activities in FaDu Head and Neck Squamous Cell Carcinoma Cells. Oncology Reports, 34, 3025-3034. https://doi.org/10.3892/or.2015.4312
- 10. Lei, B.T. and Ma, C.Y. (2014) Research Progress on Anti-Hepatocarcinoma of Berberine. Chinese Archives of Traditional Chinese Medicine, 32, 254-256.
- 11. La, X., Zhang, L., Li, Z., et al. (2017) Berberine-Induced Autophagic Cell Death by Elevating GRP78 Levels in Cancer Cells. Oncotarget, 8, 20909-20924. https://doi.org/10.18632/oncotarget.14959
- 12. Mao, B., Zhang, Z. and Wang, G. (2015) BTG2: A Rising Star of Tumor Suppressors (Review). International Journal of Oncology, 46, 459-464. https://doi.org/10.3892/ijo.2014.2765
- 13. Gao, S.S., Yang, X.H. and Wang, M. (2016) Inhibitory Effects of B-Cell Translocation Gene 2 on Skin Cancer Cells via the Wnt/β-Catenin Signaling Pathway. Molecular Medicine Reports, 14, 3464-3468. https://doi.org/10.3892/mmr.2016.5596
- 14. Rouault, J.P., Falette, N., Guéhenneux, F., et al. (1996) Identification of BTG2, an Antiproliferative p53-Dependent Component of the DNA Damage Cellular Response Pathway. Nature Genetics, 14, 482-486. https://doi.org/10.1038/ng1296-482
- 15. Lee, J.C., Chung, L.C., Chen, Y.J., et al. (2015)Upregulation of B-Cell Translocation Gene 2 by Epigallocatechin-3-Gallate via p38 and ERK Signaling Blocks Cell Proliferation in Human Oral Sduamous Cell Carcinoma Cells. Cancer Letter, 360, 310-318. https://doi.org/10.1016/j.canlet.2015.02.034
- 16. Micheli, L., Ceccarelli, M., Fariolivecchioli, S., et al. (2015) Control of the Normal and Pathological Development of Neural Stem and Progenitor Cells by the PC3/Tis21/Btg2 and Btg1 Genes. Journal of Cellular Physiology, 230, 2881-2890. https://doi.org/10.1002/jcp.25038
- 17. Takahashi, F., Chiba, N., Tajima, K., et al. (2011) Breast Tumor Progression Induced by Loss of BTG2 Expression Is Inhibited by Targeted Therapy with the RrbB/HER Inhibitor Lapatinib. Oncogene, 30, 3084-3095. https://doi.org/10.1038/onc.2011.24
- 18. Karve, T.M. and Rosen, E.M. (2012) B-Cell Translocation Gene 2 (BTG2) Stimulates Cellular Antioxidant Defenses through the Antioxidant Transcription Factor NFE2L2 in Human Mammary Epithelial Cells. The Journal of Biological Chemistry, 287, 31503-31514. https://doi.org/10.1074/jbc.M112.367433
- 19. Takahashi, M., Hayashida, T., Okazak, H., et al. (2014) Loss of B-Cell Translocation Gene 2 Expression in Estrogen Receptor-Positive Breast Cancer Predicts Tamoxifen Resistance. Cancer Science, 105, 675-682. https://doi.org/10.1111/cas.12410
- 20. Tsui, K.H., Chung, L.C., Feng, T.H., et al. (2012) Up-Regulation of Prostate-Derived Ets Factor by Luteolin Causes Inhibition of Cell Proliferation and Cell Invasion in Prostate Carcinoma Cells. International Journal of Cancer, 130, 2812-2823. https://doi.org/10.1002/ijc.26284
- 21. Li, W.Q., Yu, H.Y. and Zhong, N.Z. (2015) miR-27a Suppresses the Clonogenic Growth and Migration of Human Glioblastoma Multiforme Cells by Targeting BTG2. International Journal of Oncology, 46, 1601-1608. https://doi.org/10.3892/ijo.2015.2843
- 22. Ye, Y., Xiao, H., Luo, J., et al. (2017) Expression and Clinical Significance of B Cell Translocation Gene 2 in Primary Hepatocellular Carcinoma. Journal of Third Military Medical University, 39, 685-690.
- 23. Han, P., Wang, Q.L. and Zhang, X. (2016) Expression of TRAP1 in Gastric Cancer Tissue and Its Correlation with Malignant Biology. Asian Pacific Journal of Tropical Medicine, 9, 64-68. https://doi.org/10.1016/j.apjtm.2015.12.014
- 24. Xia, H., Xiang, S.L., Zeng, Y., et al. (2016) Overexpression of Chk 1/2 Gene G2/M Arrest in MGC803 Cells Induced by Affects Diallyl Disulfide. Chinese Pharmacological Bulletin, No. 2, 199-204.
- 25. Li, Q.Y., Hao, Y.R., Qin, J., et al. (2016) Effect of BIX-01294 on Cell Proliferation of Liver Cancer. Chinese Journal of Cancer Prevention and Treatment, 23, 487-492.
- 26. Xu, T., Zhong, L., Gan, L.-G., et al. (2016) Effects of LG268 on Cell Proliferation and Apoptosis of NB4 Cells. International Journal of Medical Sciences, 13, 517-523. https://doi.org/10.7150/ijms.15507
- 27. Liu, T., Li, W.-M., Wang, W.-P., et al. (2016) Inhibiting CREPT Reduces the Proliferation and Migration of Non-Small Cell Lung Cancer Cells by Down-Regulating Cell Cycle Related Protein. American Journal of Translational Research, 8, 2097-2113.
- 28. Zhou, J., Li, L.U., Fang, L.I., et al. (2016) Quercetin Reduces Cyclin D1 Activity and Induces G1 Phase Arrest in HepG2 Cells. Oncology Letters, 12, 516-522. https://doi.org/10.3892/ol.2016.4639
- 29. Zhang, Z., Chen, C., Wang, G., et al. (2011) Aberrant Expression of the p53-Inducible Antiproliferative Gene BTG2 in Hepatocellular Carcinoma Is Associated with Overexpression of the Cell Cycle-Related Proteins. Cell Biochemistry and Biophysics, 61, 83-91. https://doi.org/10.1007/s12013-011-9164-x
