Advances in Clinical Medicine
Vol.
13
No.
08
(
2023
), Article ID:
70719
,
16
pages
10.12677/ACM.2023.1381809
痹宁汤基于网络药理学–转录组学分析 通过PPAR信号通路抑制痛风肾的 作用机制
佟颖1*,高一然2
1黑龙江中医药大学第一附属医院风湿科,黑龙江 哈尔滨
2黑龙江中医药大学第一临床医学院,黑龙江 哈尔滨
收稿日期:2023年7月18日;录用日期:2023年8月9日;发布日期:2023年8月16日

摘要
目的:痛风肾是一种因血尿酸产生过多或排泄减少而导致大量血尿酸沉积于肾小管而引起的常见肾小球疾病。痹宁汤是治疗痛风肾的有效方剂。然而,其作用机制尚不明确。本研究运用网络药理学、分子对接技术以及转录组学分析,探讨痹宁汤治疗痛风肾的潜在分子机制、方法。方法:首先,使用网络药理学方法找到痹宁汤对痛风肾的潜在靶点:从公共数据库TCMSP获取痹宁汤相关9味中药有效化合物靶点,从OMIM、GenBank、GeneCards、Disgenet数据库中获取痛风肾相关基因靶点,进一步筛选和聚类。然后,将网络药理学预测的痹宁汤靶点与筛选的痛风肾相关基因重叠,利用Venny2.1.0获取相交靶标,找到交集靶点,然后利用Cytoscape软件构建活性成分——靶标网络。通过String数据库和Cytoscape软件绘制蛋白–蛋白相互作用(PPI)网络。然后,通过DAVID数据库进行《京都基因与基因组百科全书》(KEGG)的基因本体(GO)和途径富集分析。最后,使用Discovery Studio 2019 Client进行分子对接。另外,以动物实验的方法进行痛风肾建模,以痹宁汤对痛风肾小鼠进行治疗,并采集样本进行分析。将其结果以转录组学方法进行测序实验分析,并作出表达量差异分析。结果:根据筛选标准,共筛选出痹宁汤的413个活性化合物和1085个潜在靶点。发现了118个基因。在活性成分–靶点网络中,β-谷甾醇beta-sitosterol、谷甾醇sitosterol、甘露醇Mandenol、豆甾醇Stigmasterol是重要的活性成分。在PPI网络中,MAPK8、JAK2、PTPN11、ESR1、HSP90AA1、MAPK14是核心靶点。将其进行分子对接,发现MAPK8与化合物豆甾醇Stigmasterol有比较好的结合亲和力,且豆甾醇Stigmasterol化和物广泛存在于痹宁汤中黄柏、山慈菇、薏苡仁中药成分中。因此在分子对接方面,痹宁汤活性成分与核心靶点具有良好的亲和力。将转录组学数据与118个靶基因相交,推测PPAR信号通路可能是痹宁汤的有效机制。体内实验中痹宁汤治疗后的痛风肾小鼠肾功、尿蛋白有显著改善。这些结果证实痹宁汤主要通过PPAR信号通路在痛风肾疾病中发挥有效作用。结论:本研究初步预测了痹宁汤治疗痛风肾的主要有效成分、潜在靶点、信号通路,为进一步研究痹宁汤对痛风肾的保护机制及临床应用提供新的思路。
关键词
痹宁汤,网络药理学,转录组学,痛风肾

Bining Decoction Based on Network Pharmacology-Transcriptome Analysis of the Mechanism of Inhibition of Gout Kidney through PPAR Signal Pathway
Ying Tong1*, Yiran Gao2
1Department of Rheumatology, The First Affiliated Hospital of Heilongjiang University of Traditional Chinese Medicine, Harbin Heilongjiang
2The First Clinical Medical College of Heilongjiang University of Traditional Chinese Medicine, Harbin Heilongjiang
Received: Jul. 18th, 2023; accepted: Aug. 9th, 2023; published: Aug. 16th, 2023

ABSTRACT
Objective: Gouty nephropathy is a common glomerular disease caused by excessive uric acid production or decreased uric acid excretion, which leads to a large amount of uric acid deposition in renal tubules. Bining Decoction is an effective prescription for treating Gouty nephropathy. However, its mechanism of action is still unclear. In this study, network pharmacological molecular docking technology and transcriptomics analysis were used to explore the potential molecular mechanism of Bining Decoction in treating Gouty nephropathy. Method: Firstly, the potential targets of Bining Decoction on Gouty nephropathy were found by using network pharmacology methods: the effective compound targets of 9 traditional Chinese medicines related to Bining Decoction were obtained from public database TCMSP, and the Gouty nephropathy-related gene targets were obtained from OMIM, GenBank, GeneCards, Disgenet database for further screening and clustering. Then the network pharmacological prediction of Bining Decoction target and the Gouty nephropathy-related genes was overlapped using Venny2.1.0 to obtain the intersection target and then use Cytoscape software to construct the active ingredient-target network. Protein-protein interaction (PPI) network is plotted by String database and Cytoscape software. Then the gene ontology (GO) and pathway enrichment of Kyoto Encyclopedia of Genomics and Genomics (KEGG) were analyzed by DAVID database. Finally, Discovery Studio 2019 Client is used for molecular docking. In addition, the model of Gouty nephropathy was established by animal experiment, and the mice with Gouty nephropathy were treated with Bining Decoction and samples were collected for analysis. The results were sequenced and analyzed by transcriptomics method, and the difference of expression quantity was analyzed. Results: According to the screening criteria, 413 active compounds and 1085 potential targets of Bining Decoction were screened out. 118 genes were discovered. Beta-sitosterol sitosterolmannitol Mandenolstigmasterol is an important active component in the active component-target network. MAPK8, JAK2, PTPN11, ESR1, HSP90AA1, MAPK14 are the core target in PPI network. It was found that MAPK8 had good binding affinity with stigmasterol and stigmasterol widely existed in Chinese herbal medicine components of Phellodendron amurensis, mushroom and coix seed in Bining Decoction. Therefore, the active ingredients of Bining Decoction have good affinity with the core target in molecular docking. Combining the transcriptomics data with 118 target genes, it is speculated that PPAR signaling pathway may be an effective mechanism of Bining Decoction. In vivo experiment, urinary protein of kidney function in Gouty nephropathy mice treated with Bining Decoction was significantly improved. These results confirmed that BND plays an effective role in Gouty nephropathy disease mainly through PPAR signaling pathway. Conclusion: This study predicted the potential target signal pathway of the main effective components of BND in treating Gouty nephropathy, and provided a new idea for further study on the protective mechanism of BND on Gouty nephropathy and its clinical application.
Keywords:Bining Decoction, Network Pharmacology, Transcriptomics, Gouty Nephropathy

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 介绍
痛风肾为体内嘌呤代谢异常,血尿酸生成过多,或肾脏排泄量降低,导致尿酸结晶沉积于远端小管或集合管管腔而引起的肾脏病变 [1] [2] [3] 。近些年来逐渐年轻化。其绵延不愈、发病反复的特征使痛风肾患者痛苦不已,甚至引发一系列并发症,导致痛风肾患者生活质量严重下降 [4] 。因此,控制尿酸在肾脏的堆积、缓解痛风肾患者的肾损伤已成为如今一个重要的研究方向。
痛风的发病原因分为尿酸生成增加与尿酸排泄减少。两者都有遗传因素和获得性因素,其中获得性因素占比较大。尿酸是人类嘌呤的最终代谢产物。作为来自食物的外源性嘌呤和来自受损和死亡细胞的内源性嘌呤的最终产物,尿酸主要在肝、肠和血管内皮中合成。肾脏在尿酸排泄中起主导作用,每天产生的尿酸约有70%由肾脏排泄;剩余的30%从肠排出。经肾小球滤过后,尿酸被近端小管吸收、分泌和重吸收,未吸收部分以尿液形式排出。在近端小管中,重吸收的尿酸盐被分泌到管腔中,约10%的经过滤的尿酸盐以尿形式排泄,其余90%被重吸收 [5] 。长此以来尿酸盐沉积于肾髓质中,损害肾小管,最终累及肾小球。肾脏的损害程度与血尿酸增加的程度呈明显正比例关系 [6] [7] [8] [9] 。随着病情进展,将出现急性或慢性的肾功能衰竭。
这些年,痛风肾在中医药临床治疗方面取得了良好的治疗效果。由《丹溪心法》经典方剂四妙散衍生而来的痹宁汤,具有祛浊保肾的疗效,并完成了质谱分析,药物稳定性良好 [10] 。研究表明,痹宁汤可有效缓解痛风肾肾小管上皮细胞炎症损伤,改善痛风肾患者的肝肾功能,但其背后的分子机制仍然未知。
因此,课题组应用了网络药理学和转录组学进行分析研究。网络药理学是将疾病和药物整合到生物分子网络中,预测其活性成分和作用机制。网络药理学作为中医研究的一种新的思路和方法,已被广泛应用于中医与疾病复杂网络关系的研究中 [11] 。
转录组学测序技术即为RNA-Seq,是一种鉴定和定量样本中所有mRNA物种以及许多非编码RNA物种的方法。与逆转录酶–聚合酶链式反应一样,RNA-Seq的第一步是对所有mrna进行逆转录,得到相应的cDNAs。然而,与仅扩增一个cDNA靶的逆转录酶–聚合酶链式反应不同,RNA-Seq通过使用连接到每个cDNA末端的接头来扩增样品中的所有cDNA。RNA-Seq的读出使用下一代DNA测序仪来鉴定特定序列,这些序列对应于特定物种基因组编码的每个mRNA转录物(“转录组”)。该过程允许计算每个转录物的“阅读”次数,以此作为原始样本中每个转录物总量的量度。因此,RNA-Seq可以被简单地视为定量逆转录酶–聚合酶链式反应,但更广泛和公正。一假定给定转录物的丰度与标准化为每个单个基因的注释外显子长度的独立序列“读取”数以及样本获得的总读取数成比例。这一计算得出每百万人(TPM)的转录本数 [12] 。RNA-seq由于其高通量和可量化的优势,可以检测出大量的差异表达基因(DEGs),广泛用于基因表达和调控途径的鉴定 [13] 。RNA-seq可以全面快速地获取某一物种特定器官或组织在某一状态下的几乎所有转录本。反映出它们的表达水平,并能够全面快速地获得某一物种特定组织或器官在某一状态下的几乎所有转录本序列信息,因此广泛应用于基础研究、临床诊断和药物研发等领域。
本研究试图通过网络药理学分析和转录组学分析证实痹宁汤改善了由于尿酸刺激引起的肾小管上皮细胞炎症损伤和病变,并进一步阐明痹宁汤防治痛风肾的关键信号通路和主要靶点。为此,课题组建立了痛风肾小鼠模型,并采用了痹宁汤进行干预。用血清、尿液评价肾小管上皮细胞损伤程度,并将其样本进行RNA-Seq处理。
2. 材料和方法
2.1. 痹宁汤的组成及预期功效
痹宁汤包括粉萆薢、车前子、苍术、薏苡仁、山慈菇、黄柏、忍冬藤、川芎、川牛膝9味中药。方中以苍术等为君药,共奏利湿去浊,使湿热从小便解之效,且证明了现代药理发现的降低尿酸,促进尿酸排泄作用;以黄柏等为臣药,助君药清热祛湿,又可解毒化痰,证明了其保护肾脏、抗炎、调节细胞免疫的效果。以川芎为佐药,活血利湿,以川牛膝为使药,帮助药物到达下焦发挥药效,且现代药理发现川芎、川牛膝有抗炎消肿作用。课题组认为,痛风肾本是湿热瘀阻所致,痹宁汤利湿去浊、清热祛瘀,可缓解痛风肾浊毒对肾的损伤,上述药物合用,祛邪兼顾正气,标本兼治。
2.2. 痹宁汤活性化合物的筛选
首先,找到痹宁汤9味中药的有效化合物靶点:检索TCMSP (https://tcmsp-e.com/)中医药系统药理学数据库和分析平台,以收集中药痹宁汤9味中药(粉萆薢、车前子、苍术、薏苡仁、山慈菇、黄柏、忍冬藤、川芎、川牛膝)的化学成分。根据三个阈值口服生物利用度(Oral bioavailability, OB) ≥ 30%、血脑屏障(Blood-brain barrier, BBB) ≥ 0.3,和类药性(Drug likeness, DL) ≥ 0.18筛选出9味中药的有效化合物。
2.3. 预测药物靶点
将9味中药的有效化合物通过PubChem数据库下载3Dsdf文件,如没有3Dsdf文件,下载chem3D软件将下载下来的2D转化为3D。TCMSP数据库中没有靶点信息的化合物,通过在PubChem数据库中查到的化合物的Canonical SMILES序列,进而在SwissTargetPrediction数据库进行蛋白靶标预测补充。将PubChem数据库下载下来的3D/2Dsdf文件上传pharm mapper,并等待邮箱返回的结果,结果出来后整理数据,并通过Uniprot数据库(https://www.uniprot.org/uploadlists/)查询整合成对应的人类靶点基因。将对应人类靶点基因后的9味中药有效化合物进行整合并删除重复项。
2.4. 痛风肾疾病靶点的筛选
找到痛风肾疾病基因集:以“Gouty nephropathy、gouty kidney、uric acid nephropathy”作为关键词,在OMIM数据库(https://omim.org/)、GenBank (http://www.ncbi.nlm.nih.gov)、GeneCards数据库(https://www.genecards.org/)、Disgenet数据库(https://www.disgenet.org/home/)进行疾病靶点整合,去掉重复项。
2.5. 构建药物–疾病交集靶标PPI网络图
利用Venny2.1.0网站(https://bioinfogp.cnb.csic.es/tools/venny/)整合获取药物和疾病交集靶标,制作VENN图。将痹宁汤9味中药对痛风肾的交集靶标上传至STRING在线数据库(https://cn.string-db.org/),基因种属限定为“Homosapiens”,相互作用阈值设定为“highest confidence (0.900)”,选择隐藏网络中断开的节点“hide disconnected nodes in the network”,得到蛋白与蛋白之间相互作用信息,导入Cytoscape3.7.2软件绘制PPI网络图。
2.6. GO和KEGG途径富集分析
痹宁汤相关中药对痛风肾的交集靶标的GO功能(GOMF、GPBP、GOCC)与KEGG通路分析将得到的交集靶标导入metascape数据库(https://metascape.org/gp/index.html#/main/step1),基因种属限定为“Homosapiens”,分别进行基因本体(Gene Ontology, GO)功能和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析。计算富集结果的每个错误检出率(false discovery rate, FDR)值,根据从小到大的顺序对错误检出率值进行排序。采用在线绘图平台微生信 (http://www.bioinformatics.com.cn/)将其结果可视化。然后构建网络图。
2.7. 分子对接
通过Cytoscape3.7.2软件插件CytoNCA对PPI网络进行拓扑分析,选取核心蛋白进行分子对接,获得痹宁汤对痛风肾的潜在治疗分子机制和关键治疗靶点。
3. 转录组学材料准备
3.1. 动物实验材料
3.1.1. 药物制备
痹宁胶囊:由本院药厂生产(批准文号:黑药制字Z20100112;执行标准:黑Z-ZJ-0052-2009)。规格为0.5 g/粒,每粒含生药0.3 g。
别嘌呤醇:由浙江海正药业股份有限公司生产,批号H33020771。规格为0.1 g/片,36片/盒。
3.1.2. 模型建立
ICR小鼠痛风慢性尿酸盐肾病模型的建立、实验分组及给药ICR小鼠的筛选方法同第一部分。依据尿酸水平平均分为8组:空白组,模型组,痹宁胶囊高、中、低剂量组,别嘌呤醇高、中、低剂量对照组,每组10只。以上各组均自由饮用蒸馏水,除空白组予等量0.5%羟甲基纤维素钠溶液灌胃,进食普通饲料,其余各组均饲养造模:用腺嘌呤、乙胺丁醇溶于0.5%羧甲基纤维素钠溶液,10%高酵母饲料喂养,控制酵母每日摄入量为10 g/kg,同时给予100 mg/kg的腺嘌呤灌胃,灌胃体积为1 ml/kg。采取造模给药和治疗给药同时进行的模式。给药:空白组与模型组均给予同体积的蒸馏水,痹宁胶囊和别嘌呤醇用蒸馏水溶解。痹宁胶囊高、中、低剂量组取生药用蒸馏水溶解灌胃,分别给予2.4 g/kg、1.2 g/kg、0.6 g/kg。别嘌呤醇高、中、低剂量组用蒸馏水溶解灌胃,分别给予60 mg/kg、40 mg/kg、20 mg/kg。
3.1.3. 样本采集
分别取6只小鼠的眼眶后静脉丛血,待血液凝固后,放置于离心机,在4℃,5000 r条件下离心10 min后,吸取血清分装,−20℃保存,用于生化法检测血清尿酸,肌酐,尿素氮,评估小鼠的肾脏功能情况。取新鲜肾脏,称重,并于−80℃保存,以作为后续分析样本。
3.2. 转录组测序的数据整理
样品提取总RNA后,对于真核生物,用带有Oligo (dT)的磁珠富集mRNA,对于原核生物,用试剂盒去除rRNA,向得到的mRNA中加入Fragmentation Buffer使其片断成为短片段,再以片断后的mRNA为模板,用六碱基随机引物(random hexamers)合成cDNA第一链,并加入缓冲液、dNTPs、RNase H和DNA polymerase I合成cDNA第二链,经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱经末端修复、加碱基A,加测序接头,再经琼脂糖凝胶电泳回收目的大小片段,并进行PCR扩增,从而完成整个文库制备工作,构建好的文库用Illumina HiSeq2000进行测序。
3.3. 筛选差异表达基因
读数不仅与基因表达水平成正比,还与基因本身的长度和测序的数据量有关。为了获得不同基因和不同样本的基因表达水平的可比数据,将读数转换为FPKM (每百万映射读数的每千碱基外显子模型片段数),通过三个步骤标准化基因表达,即Stringtie计数、TMM (修剪M值的平均值)标准化和Perl脚本计算。使用edge R进行样本间差异基因分析,得到p值,进行多假设检验。通过控制FDR (错误发现率)来确定p值的阈值。校正后的p值为q值。同时,根据FPKM值计算差异表达倍数,即倍数变化(FC)。筛选条件为q ≤ 0.05、FC ≥ 2或FC ≤ 0.5。
4. 结果
4.1. 痹宁汤中药的有效化合物
利用TCMSP数据库根据三个阈值口服生物利用度(Oral bioavailability, OB) ≥ 30%、血脑屏障(Blood-brain barrier, BBB) ≥ 0.3,和类药性(Drug likeness, DL) ≥ 0.18条件,筛选出痹宁汤的有效化合物49个。
4.2. 预测药物靶点
筛选出痹宁汤方剂活性成分351个,车前子334个,川牛膝407个,川芎408个,粉萆薢408个,黄柏412个,山慈菇408个,薏苡仁361个,去掉重复项共413个活性成分。
4.3. 痛风肾疾病靶点预测
利用OMIM数据库(https://omim.org/)、GenBank (http://www.ncbi.nlm.nih.gov)、GeneCards数据库(https://www.genecards.org/)、Disgenet数据库(https://www.disgenet.org/home/)筛选出疾病靶点1085个。
4.4. 构建药物–疾病交集靶标PPI网络图
利用Venny2.1.0获取药物和疾病相交靶标,计算出痹宁汤9味中药与痛风肾疾病的交集靶标118个(见图1),将交集靶标上传至STRING在线数据库(https://cn.string-db.org/),基因种属限定为“Homosapiens”,相互作用阈值设定为“highest confidence (0.900)”,选择隐藏网络中断开的节点“hide disconnected nodes in the network”,得到蛋白与蛋白之间相互作用信息(见图2),导入Cytoscape3.7.2软件绘制PPI网络图。结果包括116个节点,2054条边(见图3)。并绘制出痹宁汤–成分–靶点关系网络图(见图4)。
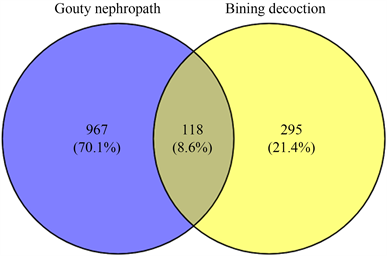
Figure 1. Venn diagram of the intersection target of Bining decoction and Gouty nephropathy
图1. 痹宁汤与痛风肾交集靶点Venn图

Figure 2. PPI network diagram of the intersection target of Bining decoction and Gouty nephropathy made by STRING online database
图2. 用STRING在线数据库制作的痹宁汤与痛风肾交叉靶点的PPI网络图

Figure 3. PPI network diagram of the cross target of Bining decoction and Gouty nephropathy made by Cytoscape3.7.2
图3. 用Cytoscape3.7.2制作的痹宁汤与痛风肾交叉靶点的PPI网络图
Figure 4. Network diagram of the relationship between Bining decoction and its components and targets
图4. 痹宁汤–成分–靶点关系网络图
4.5. GO和KEGG途径富集分析
应用Metascape对交集靶点进行富集分析,选择最小重叠值为3,p值截止到0.01,最小浓缩到1.5。分别进行KEGG、G0分析。KEGG通路分析显示,许多靶基因参与了多种代谢途径(见图5)。通过靶向破坏代谢途径的基因可以预防疾病机制(见图6)。

Figure 5. Analysis diagram of KEGG pathway at the intersection target of Bining decoction and Gouty nephropathy
图5. 痹宁汤与痛风肾交集靶点KEGG通路分析图
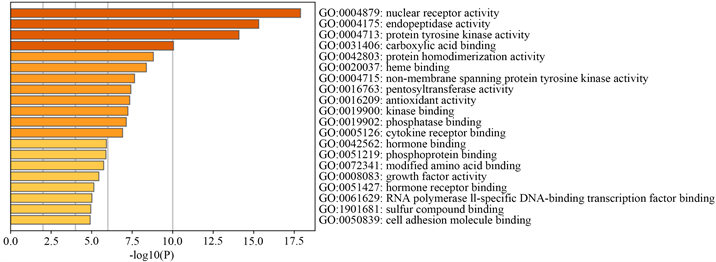
Figure 6. GO analysis diagram of the intersection target of Bining decoction and Gouty nephropathy for disease prediction
图6. 痹宁汤与痛风肾交集靶点对疾病预测的GO分析图
4.6. 分子对接
分子对接有助于识别配体与其相关蛋白的相互作用。为了验证本研究的结果,为进一步探索痹宁汤治疗痛风肾的潜在机制,为临床治疗提供更多证据,课题组使用了分子对接方法。
通过对痹宁汤中有效化合物degree值的分析,找出degree值最大的四个化合物:β-谷甾醇beta-sitosterol、谷甾醇sitosterol、甘露醇Mandenol、豆甾醇Stigmasterol。通过Cytoscape3.7.2软件插件CytoHUBBA对PPI网络进行拓扑分析:将痹宁汤9味中药对痛风肾的交集靶标上传至STRING在线数据库(https://cn.string-db.org/),基因种属限定为“Homosapiens”,相互作用阈值设定为“highest confidence (0.900) [14] ”,选择隐藏网络中断开的节点“hide disconnected nodes in thenetwork”,导出tsv文件。应用Cytoscape3.7.2软件打开tsv文件,分别对MCC和degree值进行分析,前十的蛋白为SRC、MAPK8、JAK2、STAT1、RHOA、PTPN11、ESR1、HSP90AA1、MAPK14、MAPK1 (见图7)。选出前6个关系最密切的蛋白MAPK8、JAK2、PTPN11、ESR1、HSP90AA1、MAPK14,即为核心蛋白(见图8)。
在活性成分–靶点网络中,β-谷甾醇beta-sitosterol、谷甾醇sitosterol、甘露醇Mandenol、豆甾醇Stigmasterol的degree值远高于其他成分,提示它们是治疗痛风肾的关键活性成分。其中,β-谷甾醇和谷甾醇属于植物甾醇。研究发现,β-谷甾醇具有抗炎和免疫调节作用,可治疗蛋白尿和水肿 [13] 。β-谷甾醇和豆甾醇还具有抗炎和抗高尿酸血症的活性 [15] 。谷甾醇可以介导炎性细胞因子的分泌,通过调节NF-κB信号通路,或NLRP3炎性小体 [16] 。综上所述,β-谷甾醇beta-sitosterol、谷甾醇sitosterol、甘露醇Mandenol、豆甾醇Stigmasterol可能是痹宁汤抗痛风肾的主要药效学基础。而在PPI网络中,MAPK8、JAK2、PTPN11、ESR1、HSP90AA1、MAPK14的程度较高,提示痹宁汤可能通过上述靶点实现对肾脏的保护性效应。研究表明,MAPK8表达的上调与蛋白尿的发生密切相关,其信号传导贯穿足细胞和肾小球血管内皮细胞过程。MAPK8是促分裂原活化蛋白激酶,可介导进程、增殖和凋亡。MAPK14作为p38蛋白之一,参与典型和非典型(TLR信号、TNF信号等)信号通路 [17] 。因此选取核心蛋白与痹宁汤有效化合物进行分子对接,可以获得痹宁汤对痛风肾的潜在治疗分子机制和关键治疗靶点。
分子对接结果可见,前6个核心蛋白中MAPK8与化合物豆甾醇Stigmasterol有比较好的结合亲和力,而豆甾醇Stigmasterol化和物广泛存在于黄柏、山慈菇、薏苡仁中药成分中,说明中药方剂痹宁汤和疾病痛风肾在这几个位点有比较好的结合亲和力,这可作为治疗疾病的有效靶点。图中图9(a)~(f)显示了化合物–靶标的结合位点1~6。分别是图9(a)点位124.806分,图9(b)点位124.747,图9(c)点位124.674分,图9(d)点位124.348分,图9(e)点位122.957分,图9(f)点位122.828分(见图9)。
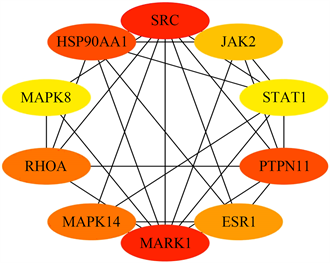
Figure 7. Top ten core proteins
图7. 前十核心蛋白
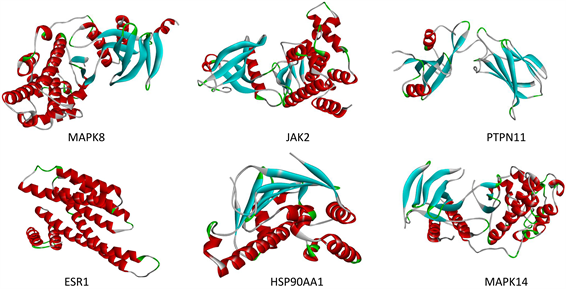
Figure 8. Core protein 3D image
图8. 核心蛋白3D图像
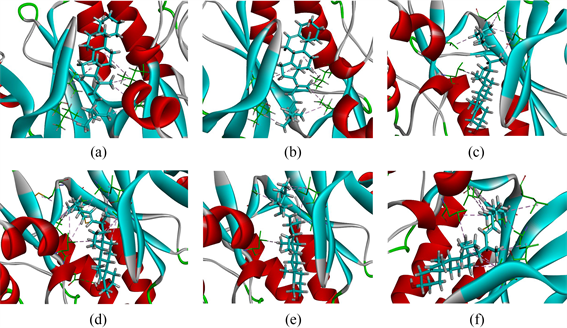
Figure 9. Six sites with the highest molecular docking score
图9. 分子对接分数最高的6个位点
4.7. 动物实验血样结果分析
动物实验造模23天后,中药组取随机10只小鼠测得血尿酸平均为180.557μmol/L,肌酐平均为71.643 μmoI/L,尿素氮平均为14.912 mmol/L,肾脏体重指数平均为1.6533 g。模型组取随机10只小鼠测得小鼠血尿酸218.034 μmol/L,肌酐平均为118.238 μmoI/L,尿素氮平均为30.497 mmol/L,肾脏体重指数平均为2.762 g。对照组取随机10只小鼠测得小鼠血尿酸120.607 μmol/L,肌酐平均为47.555 μmoI/L,尿素氮平均为9.17 mmol/L,肾脏体重指数平均为1.120 g。中药组、空白组、模型组小鼠实验室指标统计学图(见图10);中药组、空白组、模型组小鼠肝肾标本差异关系热图(见图11);中药组、空白组、模型组小鼠肝肾标本差异关系VENN图(见图12)。
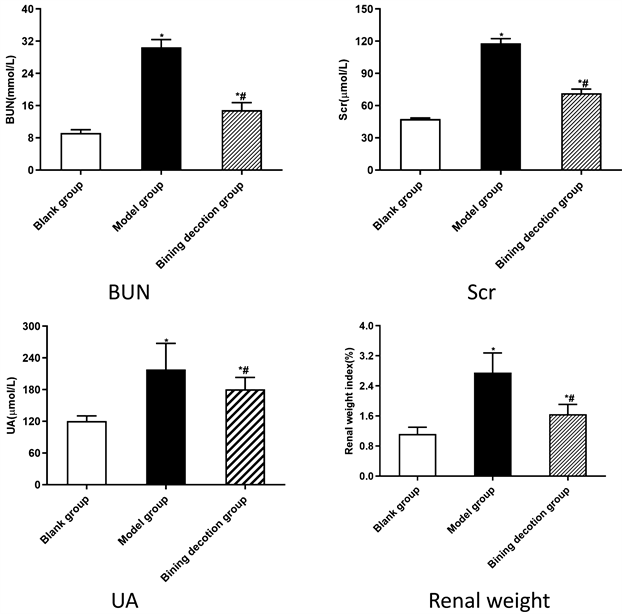
Figure 10. Statistical chart of laboratory indexes of mice in traditional Chinese medicine group, blank group and model group
图10. 中药组、空白组、模型组小鼠的实验室指标统计学图
与正常组相比,腺嘌呤诱导的模型组的尿酸、肌酐、尿素氮显著增加,服用23天痹宁汤后,中药组小鼠的尿酸、肌酐、尿素氮均处于下降趋势,证明了痹宁汤有降血尿酸作用,并对肾脏有保护作用。而同时期对照组小鼠的尿酸、肌酐、尿素氮均优于中药组,这表明了痹宁汤在治疗痛风肾过程中见效慢的弊端,但课题组认为,痹宁汤与别嘌醇相比更安全。别嘌醇的毒副作用包括腹泻、头痛、肝功能异常、心血管不良事件、肌肉骨骼不良事件和胃肠道不良事件 [18] 。研究表明,痹宁汤与别嘌醇片在治疗痛风肾过程中,别嘌醇片肾安全性低于痹宁汤的治疗 [19] 。
在对肾组织样本形态学的研究中,课题组发现痛风肾模型中大量的尿酸结晶出现在肾小管和肾间质,堵塞肾小管,引起肾小管上皮细胞脱落坏死,形成细胞管型,肾小管基底膜断裂破坏。在肾间质淋巴和单核细胞浸润,亦发现多核巨细胞,形成肾间质纤维化。另外,肾小动脉管壁增厚,管腔狭窄,肾小球毛细血管袢闭塞、硬化,系膜基质增多 [20] 。尿酸结晶的大量堆积与系膜基质增多导致了模型组肾脏体重指数的增长。从中医角度来看,痛风肾是由于患者摄入过多膏粱厚味,导致脾胃运化失调、变痰生湿、瘀阻脉络,湿热之邪瘀阻脉络,湿热下注,使肾精亏虚,骨髓失养,肾气不足,肾虚水泛。水液停滞于肾,导致肾脏体重指数增长。
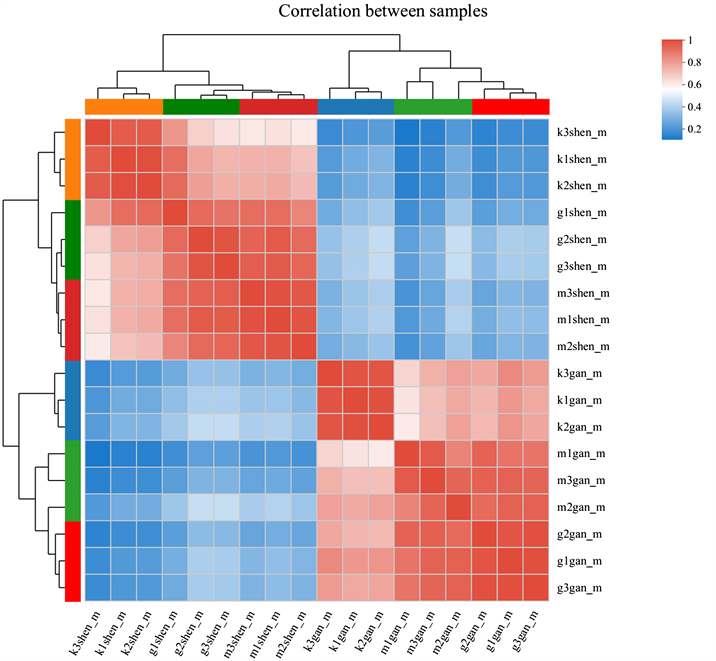 注:图中每列表示一个样本,每行表示一个基因,图中的颜色表示基因在该样本中的表达量大小,默认红色代表该基因在该样本中表达量较高,蓝色代表表达量较低。两个样本分支离的越近,说明这两个样本所有基因的表达模式越接近,即基因表达量变化趋势越接近。
注:图中每列表示一个样本,每行表示一个基因,图中的颜色表示基因在该样本中的表达量大小,默认红色代表该基因在该样本中表达量较高,蓝色代表表达量较低。两个样本分支离的越近,说明这两个样本所有基因的表达模式越接近,即基因表达量变化趋势越接近。
Figure 11. Thermogram of the difference between liver and kidney samples of mice in traditional Chinese medicine group, blank group and model group
图11. 中药组、空白组、模型组小鼠肝肾标本差异关系热图
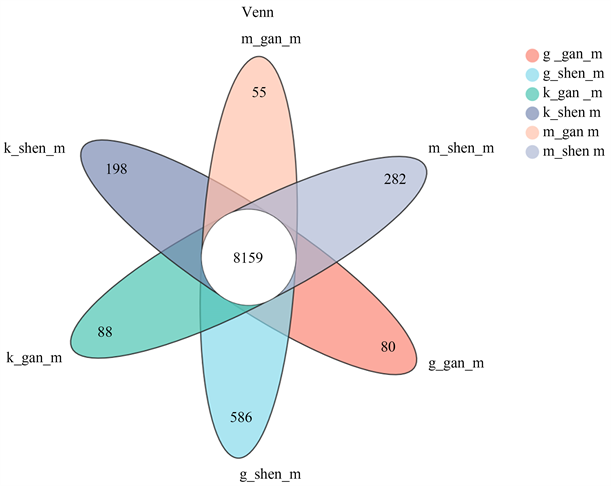
Figure 12. VENN diagram of the difference between liver and kidney samples of mice in traditional Chinese medicine group, blank group and model group
图12. 中药组、空白组、模型组小鼠肝肾标本差异关系VENN图
4.8. 转录组学数据分析
本研究共完成18个样品的转录组测序,共获得136.85 Gb Clean Data,各样品Clean Data均达到6.6 Gb以上,Q30碱基百分比在91.93%以上。其中存在部分不合格数据,是由于Illumina Novaseq 6000测序平台测序过程中试剂消耗导致,前六个碱基与RNA模板不完全结合导致。接头序列、20个碱基以下的3'末端质量Q、长度小于25个读数以及来自该物种的核糖体RNA数据均被删除。通过使用筛选和删除的读数进行进一步分析。基于RNA-Seq转录组学筛选痹宁汤组和模型组差异表达的基因。通过筛选阈值为:|log2FC| >= 1 & padjust < 0.05,本次分析共检测到表达基因共31,163个,其中已知基因30,340个,新基因823个;表达转录本共110,561个,其中已知转录本96,106个,新转录本14,455个。与模型组小鼠相比,痹宁汤给药小鼠的10,146个基因获得了1278个差异表达基因,其中413个基因显着上调,865个基因显着下调。与中药方剂痹宁汤与痛风肾疾病118个基因靶点做交集,筛选出基因ACE与PLAU。因为数百万患者接受ACEi治疗,以对抗心血管和肾脏疾病(痛风的常见合并症)。我们发现ACEi会增加啮齿动物模型中痛风的风险,这与这一观察结果一致。因此,需要仔细考虑痛风患者的ACEi治疗,因为除了B1R有助于ACEi的一些心脏保护作用外,50它也可能增加患者痛风的风险。为阐明痹宁汤对痛风肾的肾小管损伤的改善机制,进一步开展了差异基因筛选。
利用转录组学差异表达基因筛选KEGG信号通路,采用软件对基因集中的基因/转录本进行富集分析,使用方法为Fisher精确检验。为控制计算假阳性,提供多种多重检验方法矫正P值,如:Bonferroni、Holm、BH和BY等。通常情况下,默认采用BH方法对P值进行校正,当经过校正的P值(即Padjust) < 0.05时,认为此功能存在显著富集情况,因此课题组根据Padjust由小到大选择一个有意义的通路PPAR信号通路。PPAR信号通路同样也是网络药理学筛选出的KEGG信号通路。另外,PPAR信号通路在调节炎症方面起着重要作用。
4.9. PPAR信号通路在痹宁汤治疗痛风肾过程中的作用机制
PPAR信号通路是痹宁汤治疗痛风肾的重要通路之一。过氧化物酶体增殖物激活受体(PPARS)是与维甲酸、类固醇和甲状腺激素受体相关的配体激活转录因子超家族核激素受体成员。它们作为脂肪传感器调节脂肪代谢酶的转录。PPARs有PPARα、PPARβ、PPARγ三种亚型组成。研究发现,人外周血单核细胞在佛波酯(Phorbol muristyl acetate,PMA)刺激下,其上清液中某些细胞因子如TNF-α、IL-1和IL-6水平明显增加。在人类体内,PPAR-γ mRNA存在着4种异构体,即PPAR-γ1、PPAR-γ2、PPAR-γ3、PPAR-γ4 mRNA生成相同的基因产物PPAR-γ。PPARγ受体是一种核受体,被描述为对抗炎症的潜在靶点。PPAR-γ及其他核受体超家族都必须与相应配体结合后才能活化。一旦与配体结合火化后,PPAR-γ与维甲酸类X受体(retinoid X receptor,RXR)结合形成一个异二聚体,然后招募一系列协同因子,后者则在PPAR反应元件(PPRE)特定基因的启动子区域与异二聚体结合,起到调节转导的作用 [21] 。
坏死细胞会诱导损伤相关的分子模式,如高迁移率族蛋白B1 (HMGB1),由toll样受体4决定(TLR),并激活先天性免疫系统,释放过多的炎性介质,包括细胞因子,包括核因子κB (NF-κB),肿瘤坏死因子-α (TNF-α),以及白细胞介素1β (IL-1β),最终导致严重的脏器损伤。过氧化物酶体增殖物激活受体-γ (PPAR-γ)属于核激素受体家族,已被证明可增强抗氧化和抗炎基因转录,调制TLR4激活,并调节NF-κB诱导的炎症。PPAR-γ参与多种细胞事件、葡萄糖稳态和脂肪形成。作为氧化应激引起的炎症的抑制剂,它显著有助于调节炎症。这种作用可能是由于参与炎症的前炎症基因如NF-κB的转录的直接抑制活性 [22] 。
PPARγ受体是一种核受体,被描述为对抗炎症的潜在靶点。几项研究表明,当一个配体激活该受体,促炎蛋白(如IL-6或IL-8)的表达降低 [23] 。而痛风形成的MSU晶体以NLRP3依赖性方式诱导IL-1β产生,MSUC更是与IgG结合,被白细胞吞噬,促使这些细胞立即释放组胺、凝血因子、补体及花生四烯酸(AA)等物质,AA通过环氧化酶和脂氧化酶两条途径分别生成PGE及白三烯,后者刺激1L-1/1L-6产生,所有这些物质短期中引起局部血管扩张、通透性增加、渗出、水肿、白细胞聚集、发热等炎症反应,并达到高峰。因此推断,PPAR与痹宁汤结合,可以被激活并抑制促炎蛋白1L-β、IL-6、IL-8的表达降低,并缓解其炎症反应。
5. 讨论
痹宁汤由《丹溪心法》经典方剂四妙散衍生而来,现已广泛应用于痛风肾疾病的临床治疗。研究表明,四妙散的主要特征化学成分对目标IL-6、PTGS1、PPARG和BCL2具有良好的结合能力 [24] 。而四妙散加减方剂痹宁汤通过PPAR通路对痛风、高尿酸血症引起的肾小管上皮细胞组织学变化有良好的保护作用。它可以减少小鼠肾小管尿酸盐沉积并抵抗肾毒性,对肾小管上皮细胞有着保护作用。
为探讨痹宁汤防治痛风肾的可能机制,我们对痹宁汤进行了网络药理学与转录组学分析。
网络药理学作为一种系统分析药理靶点的研究方法,有助于中药复方“多成分–多靶点”研究假定基因靶点、活性单体及相关药理机制的相互关系。转录组学分析能够揭示机体在特定状态下组织或细胞中基因的表达总量,提供相关基因在组织或细胞中被调控的信息。目前转录组学与网络药理学已广泛联用,以阐明两者的药理机制与分子机制 [25] 。
本研究采用两者联用的方法将痹宁汤中9味中药的351个药物靶点与痛风肾的1085个疾病靶点取交集,得到痹宁汤“利湿去浊、清热祛瘀”作用于痛风肾的118个交集靶点。接着,将118个交集靶点通过整理分析获得4个degree值最大的化合物β-谷甾醇beta-sitosterol、谷甾醇sitosterol、甘露醇Mandenol、豆甾醇Stigmasterol和6个核心蛋白MAPK8、JAK2、PTPN11、ESR1、HSP90AA1、MAPK14,这说明这些靶点与痛风肾炎性反应的逆转紧密联系。分别进行分子对接,得到6个最高分对接点位,为MAPK8与化合物豆甾醇Stigmasterol的1~6位点。这说明MAPK8与化合物豆甾醇Stigmasterol有更好的结合亲和力,而豆甾醇Stigmasterol化和物广泛存在于黄柏、山慈菇、薏苡仁中药成分中,这说明痹宁汤对痛风肾有着靶向的治疗作用。将118个交集靶点进行GO和KEGG分析,结果表明痹宁汤可通过炎症相关通路发挥防治痛风肾的药理作用,炎症相关通路包括PPAR信号通路。并通过转录组学分析得出痹宁汤防治痛风肾的机制与PPAR介导的脂肪酸代谢信号通路相关性最强,在治疗过程中起到了重要影响。体内实验结果证实,痹宁汤可显着减轻中药组小鼠肾损伤,且其安全程度要高于对照组。
6. 结论
综上所述,基于网络药理学、分子对接以及转录组学分析预测了痹宁汤治疗痛风肾的潜在机制,提示痹宁汤治疗痛风肾的潜在机制可能与PPAR信号通路有关。然而,本研究存在一些局限性,因为需要更多的植物化学和药理学研究来证实我们的观察结果。
基金项目
黑龙江省自然科学基金(LH2019H115)。
文章引用
佟 颖,高一然. 痹宁汤基于网络药理学–转录组学分析通过PPAR信号通路抑制痛风肾的作用机制
Bining Decoction Based on Network Pharmacology-Transcriptome Analysis of the Mechanism of Inhibition of Gout Kidney through PPAR Signal Pathway[J]. 临床医学进展, 2023, 13(08): 12908-12923. https://doi.org/10.12677/ACM.2023.1381809
参考文献
- 1. 李娜, 王坤, 李琦. 加味忍冬藤汤对尿酸性肾病湿热内蕴证患者血尿酸、血β2微球蛋白的影响[J]. 四川中医, 2020, 38(9): 125-128.
- 2. 朱爽, 齐继鹏, 张志娇, 等. 基于玄府理论探讨原发性痛风及痛风性肾病的治疗策略[J]. 风湿病与关节炎, 2022, 11(4): 55-58.
- 3. 杨婷, 林志健, 王雨, 等. 痛风相关模型研究进展及痛风病建模思考[J]. 世界中医药, 2021, 16(1): 46-51.
- 4. 方茹璐, 徐巧璐, 葛晓, 等. 462例痛风患者合并症或并发症及其相关因素研究[J]. 新中医, 2022, 54(12): 258-262.
- 5. Mei, Y., Dong, B., Geng, Z. and Xu, L. (2022) Excess Uric Acid Induces Gouty Nephropathy through Crystal Formation: A Review of Recent Insights. Frontiers in Endocrinology (Lausanne), 13, Article 911968. https://doi.org/10.3389/fendo.2022.911968
- 6. Fu, W.H., Li, Q.W., Yao, J.W., et al. (2014) Protein Expression of Urate Transporters in Renal Tissue of Patients with Uric Acid Nephrolithiasis. Cell Biochemistry and Biophysics, 70, 449-454. https://doi.org/10.1007/s12013-014-9939-y
- 7. 曾小峰, 陈耀龙. 2016中国痛风诊疗指南[J]. 浙江医学, 2017, 39(21): 1823-1832.
- 8. 张亮, 裴冬梅. 2013~2020年沈阳市体检人群高尿酸血症检出率及危险因素分析[J]. 公共卫生与预防医学, 2022, 33(3): 90-93.
- 9. 祝开思, 张彩香. 慢性尿酸性肾病发病机制研究现状[J]. 中国糖尿病杂志, 2017, 25(10): 950-952.
- 10. 佟颖, 胡荣雪, 檀佳惠, 等. 痹宁汤联合针刀治疗湿热蕴结型痛风肾关节炎的效果[J]. 中国医药导报, 2021, 18(9): 172-175.
- 11. Han, L., Tao, H., Kang, L., Wang, S., Diao, Q., Han, D. and Cui, K. (2022) Transcriptome and iTRAQ-Based Proteome Reveal the Molecular Mechanism of Intestinal Injury Induced by Weaning Ewe’s Milk in Lambs. Frontiers in Veterinary Science, 9, Article 809188. https://doi.org/10.3389/fvets.2022.809188
- 12. Clark, J.Z., Chen, L., Chou, C.L., Jung, H.J., Lee, J.W. and Knep-per, M.A. (2019) Representation and Relative Abundance of Cell-Type Selective Markers in Whole-Kidney RNA-Seq Data. Kidney International, 95, 787-796. https://doi.org/10.1016/j.kint.2018.11.028
- 13. He, D., Li, Q., Du, G., Sun, J., Meng, G. and Chen, S. (2021) Re-search on the Mechanism of Guizhi to Treat Nephrotic Syndrome Based on Network Pharmacology and Molecular Docking Technology. BioMed Research International, 2021, Article ID: 8141075. https://doi.org/10.1155/2021/8141075
- 14. Yao, Z., Zhang, B., Niu, G., Yan, Z., Tong, X., Zou, Y. and Yang, M. (2022) Subunits of C1Q Are Associated with the Progression of Intermittent Claudication to Chronic Limb-Threatening Ischemia. Frontiers in Cardiovascular Medicine, 9, Article 864461. https://doi.org/10.3389/fcvm.2022.864461
- 15. Li, W.H., Han, J.R., Ren, P.P., Xie, Y. and Jiang, D.Y. (2021) Ex-ploration of the Mechanism of Zisheng Shenqi Decoction against Gout Arthritis Using Network Pharmacology. Compu-tational Biology and Chemistry, 90, Article 107358. https://doi.org/10.1016/j.compbiolchem.2020.107358
- 16. Jie, F., Yang, X., Yang, B., Liu, Y., Wu, L. and Lu, B. (2022) Stigmasterol Attenuates Inflammatory Response of Microglia via NF-κB and NLRP3 Signaling by AMPK Acti-vation. Biomedicine & Pharmacotherapy, 153, Article 113317. https://doi.org/10.1016/j.biopha.2022.113317
- 17. Guo, C., Gao, Y.Y., Ju, Q.Q., Wang, M., Zhang, C.X., Gong, M. and Li, Z.L. (2021) MAPK14 Over-Expression Is a Transcriptomic Feature of Polycythemia Vera and Correlates with Adverse Clinical Outcomes. Journal of Translational Medicine, 19, Article No. 233. https://doi.org/10.1186/s12967-021-02913-3
- 18. 冯益宇. 非布司他对比别嘌醇治疗高尿酸血症的疗效和安全性评价[D]: [硕士学位论文]. 南昌: 南昌大学, 2015.
- 19. 刘亚芮. 中药复方痹宁汤治疗痛风性肾病的临床研究[D]: [硕士学位论文]. 哈尔滨: 黑龙江中医药大学, 2017.
- 20. 李娜, 贾晓静, 冯杏, 韩艳, 赵丽君, 崔建军. 骨髓间充质干细胞对大鼠痛风肾的修复作用[J]. 中华临床医师杂志(电子版), 2017, 11(11): 1894-1901.
- 21. 陈永熙, 王伟铭, 周同, 陈楠. PPAR-γ作用及其相关信号转导途径[J]. 细胞生物学杂志, 2006, 28(3): 382-386.
- 22. Mohamed Kamel, G.A., Harahsheh, E. and Hussein, S. (2022) Diacerein Ameliorates Acetaminophen Hepatotoxicity in Rats via Inhibiting HMGB1/TLR4/NF-κB and Upregulating PPAR-γ Signal. Molecular Biology Re-ports, 49, 5863-5874. https://doi.org/10.1007/s11033-022-07366-5
- 23. Antoine, A., De Sousa Do Outeiro, C., Charnay, C., Belville, C., Henrioux, F., Gallot, D., Blanchon, L., Minet-Quinard, R. and Sapin, V. (2022) Dysregulation of the Amniotic PPARγ Pathway by Phthalates: Modulation of the Anti-Inflammatory Activity of PPARγ in Human Fetal Membranes. Life (Ba-sel), 12, Article544. https://doi.org/10.3390/life12040544
- 24. Xu, H., Wu, J., Wang, S., Xu, L., Liu, P., Shi, Y., Wu, S., Deng, L. and Chen, X. (2022) Network Pharmacology and in Vivo Experiments Reveal the Pharmacological Effects and Molecular Mechanisms of Simiao Powder in Prevention and Treatment for Gout. BMC Complementary Medicine and Therapies, 22, Article No. 152. https://doi.org/10.1186/s12906-022-03622-0
- 25. 幸鹭, 胡旭东, 陶艳艳, 彭渊, 刘成海. 通过网络药理学与转录组学探讨扶正化瘀方影响巨噬细胞的抗肝纤维化机制及效应成分[J]. 中国中药杂志, 2022, 47(11): 3029-3037.
NOTES
*通讯作者。