Advances in Clinical Medicine
Vol.
14
No.
01
(
2024
), Article ID:
79340
,
11
pages
10.12677/ACM.2024.141099
多囊卵巢综合征患者卵巢颗粒细胞SF-1对 芳香化酶P450的影响及其甲基化的调节机制
于潇涵1,刘玲1,于彬彬1,徐 琳2*
1青岛大学附属威海市立第二医院产一科,山东 威海
2青岛大学附属医院产科,山东 青岛
收稿日期:2023年12月17日;录用日期:2024年1月10日;发布日期:2024年1月17日

摘要
目的:探讨多囊卵巢综合征患者卵巢颗粒细胞与正常对照组的SF-1mRNA表达及其甲基化差异性,并评价其临床意义。方法:随机选取2020年1月至2022年12月本院41例行IVF-ET的PCOS患者和72例因男方因素或输卵管因素行IVF-ET的对照组为研究对象,提取研究对象颗粒细胞,提取RNA,逆转录为cDNA进行荧光定量RT-PCR检测;行BSP法检测颗粒细胞DNA的甲基化水平。结果:与对照组卵巢颗粒细胞相比,PCOS患者CYP19和CYP19 PII的表达量显著降低(P < 0.05),虽然LRH1和SF1在组间无显著差异,但是其与CYP19及CYP19 PII的变化呈显著正相关(P < 0.001);SF-1基因在13个CpG位点在PCOS和对照组之间存在显著差异(P <0.05);结论:该实验初步探讨了PCOS患者颗粒细胞芳香化酶P450活性下降机制,也在一定程度上解释了多囊患者雄激素升高的机制。
关键词
PCOS,颗粒细胞,SF-1,甲基化

Effect of Granulosa Cell SF-1 on Aromatase P450 and Its Regulation of Methylation in Patients with PCOS
Xiaohan Yu1, Ling Liu1, Binbin Yu1, Lin Xu2*
1Department of Obstetrics, The Second Affiliated Weihai Municipal Hospital of Qingdao University, Weihai Shandong
2Department of Obstetrics, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Dec. 17th, 2023; accepted: Jan. 10th, 2024; published: Jan. 17th, 2024

ABSTRACT
Objective: To investigate the differences of SF-1 mRNA expression and methylation in granulosa cells of patients with polycystic ovary syndrome (PCOS) and normal control group, and to explore its clinical significance. Methods: A total of 41 PCOS patients who underwent IVF-ET were randomly selected from our hospital’s cases between January 2020 and December 2022, while the control group consisted of 72 cases undergoing IVF-ET due to male factor or tubal factor. Granulosa cells were extracted from the study subjects for RNA extraction and reverse transcription into cDNA for fluorescence quantitative RT-PCR; methylation levels were assessed using the line BSP method. Results: Compared to Granulocytes in normal patients, PCOS patients exhibited significantly lower expression of CYP19 and CYP19 PII (P < 0.05), although LRH1 and SF1 did not show significant differences between groups; however, they demonstrated a significant positive correlation with changes in CYP19 and CYP19 PII (P < 0.001). The SF-1 gene was significantly different at 13 CpG sites between PCOS and healthy individuals (P < 0.05). Conclusions: This study initially investigated the mechanism of the decrease of aromatase P450 activity in granular cells of PCOS patients, and also explained the mechanism of the increase of androgen in PCOS patients to a certain extent.
Keywords:PCOS, Granulosa Cells, SF-1, Methylation

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是一种以高雄激素血症、排卵障碍和卵巢多囊样改变为主要特征的生殖内分泌代谢性疾病,是集生殖、代谢及心理障碍为一体的疾病,我国育龄期妇女患病率为5.6% [1] [2] 。多囊卵巢综合征女性不孕原因主要是卵泡生长异常及排卵障碍,但其发病机制至今仍不明确,临床治疗主要以调整月经周期防止子宫内膜病变及对有生育要求的患者促排卵治疗为主,对其治疗没有确切的针对性。雄激素升高是PCOS发病的中心环节,既往研究表明DHEA诱导的PCOS大鼠模型中出现了基因甲基化水平的改变 [3] 。“儿起源假说”亦表明孕期宫内高雄激素环境可能造成子代出生后发生PCOS [4] 。芳香化酶P450是雄激素向雌激素转化的限速酶,芳香化酶P450活性降低则可引起雄激素向雌激素转化降低,造成雌激素下降而雄激素上升。而CYP19,类固醇生长因子-1 (steroidogenic-1, SF-1)以及肝受体类似物(liverreceptorhomolog-1, LRH-1)是芳香化酶P450的编码基因,体外实验证实类固醇因子-1 (SF-1)显著上调卵巢颗粒细胞P450芳香化酶启动子活性以及SF-1参与了颗粒细胞雌激素生成的细胞外调节机制,对于正常卵泡发育和卵巢生殖功能的维持是必需的。通过探讨卵巢颗粒细胞SF-1基因非启动子区域CpG甲基化状态,探讨DNA甲基转移酶抑制剂对多囊卵巢综合征不孕行基因治疗的可行性,并为芳香化酶抑制剂药物应用提供了新的理论依据。
2. 资料与方法
2.1. 标本来源
选取2020年1月~2022年12月在威海市妇幼保健院就诊行体外授精–胚胎移植(In vitro fertilization-embryo transfer, IVF-ET)的患者,PCOS患者41例(观察组),因男方因素或输卵管因素行IVF-ET的患者72例(对照组)。观察组纳入标准:(1) 诊断标准为2003年鹿特丹标准,具有以下三个特征中的任何两个特征的患者:月经稀发或闭经;临床或生化表现为高雄激素血症;阴道超声检查至少一侧卵巢内可见2~8 mm的卵泡12个以上。具备以上标准中的两条且除外其他疾病,如肾上腺皮质增生、柯兴氏综合征、雄激素分泌性肿瘤等;(2) 年龄20~40岁女性;(3) 近3个月内未服用过影响激素变化的药物。排除标准:(1) 其他原因导致的高雄激素表现或月经异常;(2) 妊娠期患者;(3) 近3个月内使用过影响激素类药物;(4) 临床确诊为高泌乳素血症、卵巢早衰、甲状腺功能障碍等疾病;(5) 严重脏器功能不全、恶性肿瘤、自身免疫病等疾病;(6) 伴有子宫疾病、反复流产、染色体异常等。同期纳入同一医院中身体健康、由于输卵管因素或男方因素来院检查的72例健康非PCOS女性作为对照组。
本研究经本院伦理委员会审核并批准。所有研究对象及家属均签署知情同意书。
2.2. 材料
主要试剂和仪器
台式高速冷冻型微量离心机及超微量分光光度计购自美国赛默飞世尔科技公司,超净工作台购自上海力新仪器有限公司,荧光定量PCR仪购自方格林生物科技有限公司,实时荧光定量PCR试剂盒购自日本Takara公司,实时荧光定量PCR购自上海丰林生物科技有限公司,RNA分离试剂盒购自广州迈宝生物科技有限公司,逆转录试剂盒购自加拿大Applied Biological Materials (abm)公司,个人生物动物组织/细胞基因组DNA试剂盒、个人生物琼脂糖凝胶纯化试剂盒及PMDTM 18-T载体克隆试剂盒均购自上海派森诺生物科技有限公司。
2.3. 研究方法
1) 临床资料收集:收集PCOS组(n = 72)及正常对照组(n = 41)患者的临床特征资料。收集的内容包括:年龄、不孕年限、体重指数(BMI)、ART方式、Gn天数、Gn用量、扳机日内膜mm、ET日内膜、抗苗勒管激素(AMH)、卵泡刺激素(FSH)、雌二醇(E2)、LFC、RFC、以及窦卵泡数、获卵数、胚胎形成率。
2) 卵丘颗粒细胞的收集:注射HCG扳机后36 h,超声引导下经阴道穿刺抽吸直径 ≥ 16 mm的卵泡,用1ml注射器快速进行分离卵冠丘复合物,收集适量的颗粒细胞。剩余颗粒细胞放入冻存管,置于液氮(−198度)中保存。
3) RNA提取和实时定量PCR (Real-time quantitative PCR) qRT-PCR:按照RNA分离试剂盒说明书(广州迈宝生物科技有限公司Total RNA Extarction Mini Kit)提取颗粒细胞RNA,按照逆转录试剂盒说明书(abm 5X All-In-One RT MasterMix)转录mRNA为cDNA。按照Blastaq Green 2x qPCR MasterMIX说明书操作,应用FUNGL YN BIOTECH INC PCR仪进行扩增反应,以GAPDH作为mRNA的内参。采用2-△△CT法分析各基因的相对表达量。
4) 甲基化:提取颗粒细胞DNA (Personalbio Animals Tissue/Cell Genomic DNA Kit),进行亚硫酸氢盐修饰处理(EpiTect Fast DNA Bisulfite Kit),基因组上未甲基化的CpG岛,C碱基转变成 U。亚硫酸氢盐的处理步骤:(1) 基因组DNA的碱变性;(2) 硫化和脱氢;(3) 纯化和脱硫;(4) 沉淀和回收。经亚硫酸氢盐处理的基因DNA作为模板进行巢式PCR扩增。序列中未甲基化的C碱基变成T碱基,而甲基化的C 碱基不变。引物序列:MM-SF-P5:5’ GAGGATTTGGAYGAGTTGT 3’,MM-SF-P3:5’ CCTACCCCCTCAAACTATAAAA 3’,产物为352 bp。PCR反应条件:95℃ 10 min;94℃ 30 s,55℃ 30 s,72℃ 40 s,40个循环;72℃ 5 min。PCR产物采用凝胶纯化试剂盒进行纯化(Personal bio Agarose Gel Purification Kit),纯化产物克隆到PMD18-T载体上(Takara公司),挑取20个阳性单克隆菌群增菌,并且提取质粒送测序。
2.4. 统计学处理
采用SPSS26.0软件进行统计学分析,计数资料采用χ2检验,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 受试者临床基础指标
基线信息
本研究共纳入72例非PCOS样本以及41例PCOS患者,详细的样本信息请参见表1。结果如表所示,ART方式、年龄、不孕年数、Gn天数、Gn用量、扳机日内膜mm、ET日内膜、冷冻D3胚胎数、冷冻囊胚数、冷冻管数在阳性和阴性样本组之间没有显示出显著的统计学差异。在PCOS相关临床指标中,全部PCOS患者均未出现卵巢功能减退(P = 0.029),PCOS患者基础FSH (P = 0.001)和Gn启动剂量(P = 0.029)显著低于健康样本,而LFC、RFC、BMI、HCG日大卵泡、穿刺大卵泡数以及AMH则在PCOS患者中显著高于健康人。PCOS患者中取卵数显著高于健康人(P = 0.001**)。
Table 1. Baseline information among study sample groups
表1. 研究样本组间基线信息
注:*,P < 0.05;**,P < 0.01;***,P < 0.001。
3.2. qRT-PCR结果
使用统计软件包SPSS 26.0 (IBM Corp,Armonk,NY,美国)对相关数据进行分析,首先为比较实验组和对照组四个基因的差异表达情况,采用独立样本T检验来评估组间差异情况,同时绘制箱式图来可视化不同组相应基因的表达情况,结果如图所示。结果显示CYP19和CYP19 PII在PCOS组中表达量显著低于对照组,CYP19的统计量为2.322,P值为0.026 (图1(A));CYP19 PII的统计量为2.153,P值为0.038 (图1(B))。经过分析发现LRH1和SF-1在PCOS组和对照组之间表达无显著差异,P值分别为0.185和0.536 (图1(C)、图1(D))。
进一步采用相关性分析来探索LRH1和SF1和CYP19 PII之间表达量的变化来推断二者是否具有协同变化。结果如图所示,CYP19和LRH1之间呈显著正相关,相关性系数为0.840 (P < 0.001) (图2(B)),同时CYP19和SF1之间也呈显著正相关,相关性系数为0.700 (P < 0.001) (图2(A))。CYP19 PII和LRH1之间呈显著正相关,相关性系数为0.651 (P < 0.001) (图2(D)),同时CYP19 PII和SF1之间也呈显著正相关,相关性系数为0.665 (P < 0.001) (图2(C))。综上所述,PCOS患者CYP19和CYP19 PII的表达量显著降低,虽然LRH1和SF1在组间无显著差异,但是其与CYP19、CYP19 PII的变化呈显著正相关。
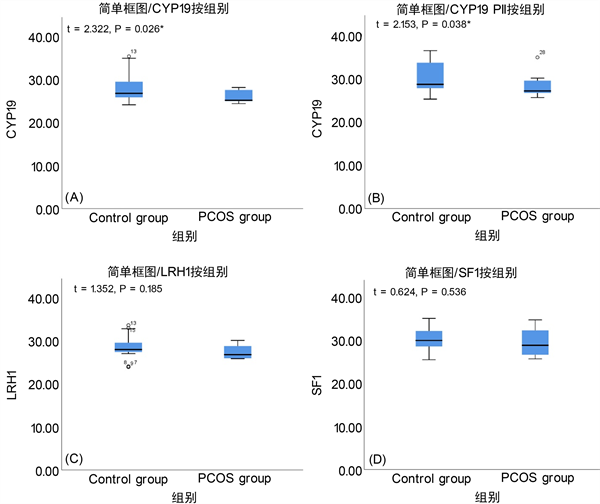
Figure 1. Differential expression of four genes between the experimental group and the control group
图1. 实验组和对照组四个基因的差异表达情况
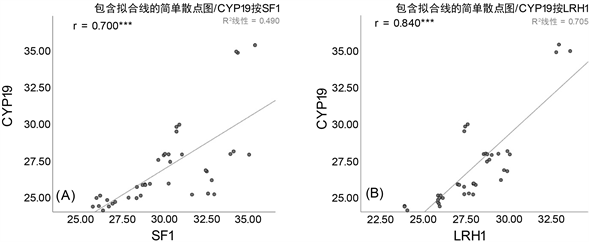

Figure 2. Correlation analysis between LRH-1, SF-1 and CYP19, CYP19 PII
图2. LRH-1、SF-1与CYP19、CYP19 PII的相关性分析
3.3. 甲基化
本研究提取6例PCOS样本以及6例健康人样本进行SF-1甲基化检测。见表2,根据结果可知SF-1基因在13个CpG位点在PCOS和健康人之间存在显著差异,这一结果表明,PCOS患者的SF-1基因可能存在表观遗传学上的改变(图3)。
Table 2. Results of SF-1 methylation
表2. SF-1甲基化结果

Figure 3. Information of differential methylation sites between groups
图3. 差异甲基化位点组间信息
4. 讨论
多囊卵巢综合征是一种由遗传和环境因素引起的多因素疾病,会导致不孕、糖代谢脂代谢异常心血管疾病发生甚至心理障碍等各种症状 [5] 。多囊卵巢形态(PCOM)、月经不规律和高雄激素血症(HA)是女性多囊卵巢综合征的诊断特征 [6] 。高雄激素血症是其最为典型的特征之一,而雄激素过多可导致卵泡闭锁及患者无排卵。卵泡穿刺可以获得卵母细胞,并且可以从活体卵巢获得颗粒细胞,这恰恰为研究卵泡颗粒细胞的功能提供了宝贵的标本。本研究通过临床数据的整理统计,PCOS患者在卵泡数、AMH以及BMI等指标与非PCOS患者存在显著差异性,这也符合我们临床上PCOS患者双侧卵巢窦卵泡大于12枚,大多存在肥胖的临床特征。
细胞色素P450芳香化酶(P450 arom)是颗粒细胞中催化雄激素生成雌激素的关键酶,若其活力受抑制可导致雄激素转化障碍 [7] [8] ,是造成高雄激素血症的直接因子 [9] [10] 。核受体为后生动物中含量最为丰富的转录调节因子之一,在整个机体的新陈代谢、细胞分化、生殖发育及稳态维持等方面扮演着重要的角色 [11] [12] 。而核受体超家族为配体激活的转录因子家族,目前已知成员共有48个,其中SF-1和LRH-1为孤儿核受体,主要负责促进性腺发育及合成类固醇激素。SF-1分布较为广泛,可分布于卵巢颗粒细胞、卵泡膜细胞、黄体中,其在内分泌组织如肾上腺、性腺和垂体的发育及类固醇激素的生成过程中都发挥着关键作用,SF-1广泛参与了各种基因如类固醇合成酶类、黄体生成素β亚基等基因的表达调控。陆湘等 [13] 报道,子宫内膜异位症患者卵巢颗粒细胞SF-1基因启动子区5’-CPG位点甲基化水平升高导致卵巢颗粒细胞SF-1mRNA表达降低与疾病发生、发展密切相关。LRH-1表达于肝、肠、胰腺和卵巢,尤其在卵巢高表达,参与机体代谢、发育和生殖功能的调控,并且在类固醇激素生成等过程中具有重要作用 [14] 。有文献报道,LRH-1与女性生殖疾病密切相关,其具有调控SF-1基因的作用 [15] 。
P450芳香化酶由Cyp19基因编码,可催化雌激素的合成,对哺乳动物生殖细胞的分化至关重要。CYP19基因包含有多个顺式作用因子,其中CYP19A1包含有类固醇生成因子1 (SF-1)结合位点。体外实验证实:SF-1显著上调颗粒细胞P450芳香化酶启动子活性以及SF-1参与了颗粒细胞雌激素生成的细胞外调节机制 [16] ,对于正常卵泡发育和卵巢生殖功能的维持是必需的。有研究发现PCOS患者卵巢颗粒细胞CYP19的mRNA表达水平降低,引起芳香化酶活性不足,从而导致雄激素向雌激素的转化受阻,雄激素在卵巢中的积聚增加 [17] 。本研究结果也证实:PCOS组和对照组的卵泡颗粒细胞都有CYP19的表达,两组比较可发现PCOS组CYP19表达显著低于对照组,虽然LRH1和SF1在组间无显著差异,但是其与CYP19、CYP19 PII的变化呈显著正相关。
DNA甲基化是表观遗传学中最为常见的机制,通过DNA和组蛋白的修饰等来调控基因表达而不涉及基因序列改变,并且这种改变在细胞增殖过程中能稳定传递。最近证实:pcos患者颗粒细胞P450 arom及其CYP19的表达比正常人低,且其甲基化程度明显增高 [18] 。为了进一步研究PCOS患者雄激素代谢异常的原因,我们研究了颗粒细胞SF-1启动子的甲基化水平,通过BSP法对比PCOS组及对照组的甲基化程度,结果提示SF-1基因在13个CpG位点在PCOS和健康人之间存在显著差异,这一结果表明,PCOS患者的SF-1基因可能存在表观遗传学上的改变这可能与PCOS的病理生理过程相关。SF-1基因甲基化差异可能导致SF-1蛋白的表达水平发生变化,从而影响了激素合成和生殖系统的正常功能。甲基化可能是导致PCOS颗粒细胞中CYP19、LRH-1、SF-1异常表达的重要原因。但本研究结果并不提示PCOS患者颗粒细胞SF-1启动子的甲基化水平存在单纯的正相关或负相关,这也提示了表观遗传学调控基因表达的组织特异性及其复杂性,这也鼓励我们进一步研究,探讨DNA甲基化转移酶抑制剂是否可为PCOS不孕症行基因治疗提供新的治疗思路。
5. 总结
多囊卵巢综合征是一种影响多个系统的多因素内分泌疾病,会导致部分女性出现排卵障碍,甚至是不孕。研究表明,类固醇生成途径,尤其是激素合成和控制的变化,与多囊卵巢综合征的患病率有关,女性的月经周期是由激素的自然功能调节的,因此,多囊卵巢综合征妇女可能会因为中断这些生育周期过程而出现不孕。SF-1启动子高度甲基化如何调节PCOS的发生、发展,将是未来需要深入研究的方向,此类研究也使人们更好地了解CYP19基因及SF-1在多囊卵巢综合征病因中的作用,同时也为治疗多囊卵巢综合征的不孕症患者的治疗提供新的思路。
基金项目
山东省医药卫生科技发展计划项目(2018WS110)。
文章引用
于潇涵,刘 玲,于彬彬,徐 琳. 多囊卵巢综合征患者卵巢颗粒细胞SF-1对芳香化酶P450的影响及其甲基化的调节机制
Effect of Granulosa Cell SF-1 on Aromatase P450 and Its Regulation of Methylation in Patients with PCOS[J]. 临床医学进展, 2024, 14(01): 711-721. https://doi.org/10.12677/ACM.2024.141099
参考文献
- 1. ESHRE, ASRM. International Evidence-Based Guideline for the Assessment and Management of Polycystic Ovary Syndrome 2018. https://www.doc88.com/p-90499863252553.html
- 2. Li, R., Zhang, Q., Yang, D., et al. (2013) Prevalence of Polycystic Ovary Syndrome in Women in China: A Large Community-Based Study. Human Re-production, 28, 2562-2569. https://doi.org/10.1093/humrep/det262
- 3. Xu, N., Chua, A.K., Jiang, H., et al. (2014) Early Embryonic Androgen Exposure Induces Transgenerational Epigenetic and Metabolic Changes. Molecular Endocrinology, 28, 1329-1336. https://doi.org/10.1210/me.2014-1042
- 4. Moran, C., Arriaga, M., Arechavale-ta-Velasco, F., et al. (2015) Adrenal Androgen Excess and Body Mass Index Inpolycystic Ovary Syndrome. The Jour-nal of Clinical Endocrinology & Metabolism, 100, 942-950. https://doi.org/10.1210/jc.2014-2569
- 5. Visser, J.A. (2021) The Importance of Metabolic Dysfunction in Poly-cystic Ovary Syndrome. Nature Reviews Endocrinology, 17, 77-78. https://doi.org/10.1038/s41574-020-00456-z
- 6. Hong, X., Qin, P., Yin, J., Shi, Y., Xuan, Y., Chen, Z., Zhou, X., Yu, H., Peng, D. and Wang, B. (2021) Clinical Manifestations of Polycystic Ovary Syndrome and Associations with the Vaginal Microbiome: A Cross-Sectional Based Exploratory Study. Frontiers in Endocrinology, 12, 662-725. https://doi.org/10.3389/fendo.2021.662725
- 7. Tee, M.K. and Miller, W.L. (2013) Phosphorylation of Human Cytochrome P450c17 by p38α Selectively Increases 17,20 Lyase Activity and Androgen Biosynthesis. Journal of Bio-logical Chemistry, 288, 23903-23913. https://doi.org/10.1074/jbc.M113.460048
- 8. Garcia Barrado, M.J., Blanco, E.J., Carretero Hernandez, M., et al. (2014) Local Transformations of Androgens into Estradiol by Aromatase P450 Is Involved in the Regulation of Prolactin and the Proliferation of Pituitary Prolactin-Positive Cells. PLOS ONE, 9, el01403. https://doi.org/10.1371/journal.pone.0101403
- 9. 沈晔, 金翠云, 李宏斌. 芳香化酶抑制剂治疗子宫腺肌病的临床效果及对患者性激素水平和P450表达的影响[J]. 中国妇幼保健, 2022, 37(18): 3351-3354.
- 10. 张慧敏, 朱文倩, 马静, 等. 多囊卵巢综合征患者颗粒细胞中miR-1270及其靶基因CYP19A1的表达及临床意义[J]. 生殖医学杂志, 2021, 30(5): 649-657.
- 11. 马艳鸽, 申爱荣, 李灿宇, 等. 子宫内膜异位症和子宫腺肌病在位、异位内膜间质细胞原代培养与形态学观察[J]. 中国妇幼保健, 2015, 12(2): 287-290.
- 12. 王莱娜, 张萍. 子宫内膜异位症与关键核受体相关机制的研究进展[J]. 现代医学, 2022, 50(1): 130-135.
- 13. 陆湘, 吴正沐, 王旻, 等. 子宫内膜异位症患者卵巢颗粒细胞SF-1基因启动子甲基化状态的研究[J]. 生殖与避孕, 2016, 12(7): 536-541.
- 14. 苏晓华, 宋殿荣, 张英, 等. 子宫内膜异位症中子宫内膜间质细胞血管生成能力的研究[J]. 国际妇产科学杂志, 2015, 32(1): 49-53.
- 15. 赵红, 丁晓萍. LRH-1在女性生殖和乳腺癌中的研究进展[J]. 北京师范大学学报, 2008, 44(3): 323-327.
- 16. Yin, M., Lv, M., Yao, G., Tian, H., et al. (2012) Transactivation of microRNA-383 by Steroidogenic Factor-1 Promotes Estradiol Release Form Mouse Ovarian Granulosa Cells by Targeting RBMS1. Molecular Endocri-nology, 26, 1129-1143. https://doi.org/10.1210/me.2011-1341
- 17. 张璐, 李安迪, 杨楠, 等. 卵巢颗粒细胞中胰岛素和雄激素对芳香化酶和5α-还原酶1影响的研究[J]. 生殖医学杂志, 2017, 26(7): 711-717.
- 18. Yu, Y.-Y., Sun, C.-X., et al. (2013) Promoter Methylation of CYP19A1 Gene in Chinese Polycystic Ovary Syndrome Patients. Gynecologic and Obstetric Investigation, 76, 209-213. https://doi.org/10.1159/000355314
NOTES
*通讯作者。
