Advances in Clinical Medicine
Vol.07 No.01(2017), Article ID:20011,7
pages
10.12677/ACM.2017.71005
Association between Tef rs738499 Gene Polymorphism with Different Subtypes of Depression in Parkinson’s Disease
Fan Huang, Xudong Pan, Na Li, Aijun Ma*
The Neurology Department at Affiliated Hospital of Qingdao University, Qingdao Shandong

Received: Mar. 9th, 2017; accepted: Mar. 25th, 2017; published: Mar. 29th, 2017

ABSTRACT
Objective: To investigate the association between Tef rs738499 gene polymorphism and depression in different subtypes of Parkinson’s disease in China’s northern Han nationality. Methods: A case-control study design was adopt in the 230 patients with Parkinson’s disease (PD group) and 250 healthy control subjects (control group). According to exercise symptoms and UPDRS score, PD group was divided into three types: Tremor type, postural disorder type and uncertainty type. PD patients were divided into depression group (PDD group, n = 116) and non-depression group (non-PDD, n = 114) according to HAMD score. Polymerase chain reaction combined with restriction endonuclease polymorphism (PCR-RFLP) were used to detect and sequence the distribution of Tef rs738499 allele and genotype. Results: (1) Compared with the control group, the allele of the T allele had no significant difference in the PD group (OR: 0.983 95% CI: 0.720 - 1.342 P = 0.913). There was no significant difference in wild type genotype that is TT genotype in the PD group (OR: 0.931 95% CI: 0.646 - 1.340 P = 0.699); (2) after PD patients were divided into PDD and n-PDD group, T allele between the two groups had statistically significant difference. T allele risk of occurrence PDD was 3.0 times more likely than the n-PDD group’s occurrence in G allele (OR: 2.975 95%CI: 1.838 - 4.815 P < 0.01). And the wild type genotype was statistically significant different between the two groups. The occurrence of PDD risk in TT genotype was 4.6 times higher than that of TG + GG (OR: 4.646 95% CI: 2.637 - 8.186 P <0.01); (3) there was significant difference between PDD group and n-PDD group in the three subtypes of TT genotype; (4) course of disease, UPDRS-III score, Tef rs738499 TT genotype were an independent risk factor for PDD. Conclusion: Tef rs738499 TT genotype and T allele are associated with different subtypes of Parkinson’s disease in Han nationality in northern China.
Keywords:Parkinson Disease, Subtype Depression, Tef rs738499 Gene Polymorphism
Tef rs738499基因多态性与帕金森病不同亚型合并抑郁的相关性
黄樊,潘旭东,厉娜,马爱军*
青岛大学附属医院神经内科,山东 青岛

收稿日期:2017年3月9日;录用日期:2017年3月25日;发布日期:2017年3月29日

摘 要
目的:探讨中国北方汉族人群Tefrs738499基因多态性与帕金森病不同亚型合并抑郁的相关性。方法:采用病例对照研究方法,选取230例帕金森病患者(PD组)和250例同期健康查体者(对照组),按运动症状及UPDRS评分将PD组分为震颤型、姿势障碍型、不确定型3种亚型,并根据HAMD评分将PD患者分为抑郁组(PDD组,n = 116)和非抑郁组(non-PDD, n = 114)。应用聚合酶链反应-限制性内切酶多态性(PCR-RFLP)方法检测Tef rs738499等位基因和基因型分布,并进行测序验证。结果:(1) 与对照组相比,该位点T等位基因在PD组中差别无统计学意义(OR: 0.983 95%CI: 0.720~1.342 P = 0.913),野生型基因型即TT基因型在PD组中差别无统计学意义(OR: 0.931 95%CI: 0.646~1.340 P = 0.699);(2) 将PD患者分为PDD与n-PDD组后,T等位基因在两组之间比较差别有统计学意义,T等位基因发生PDD的风险较n-PDD组是G等位基因的3.0倍(OR: 2.975 95%CI: 1.838~4.815 P < 0.01),野生型基因型在两组之间比较差别有统计学意义,TT基因型发生PDD的风险是TG + GG型的4.6倍(OR: 4.646 95%CI: 2.637~8.186 P < 0.01);(3) 该位点TT基因型在三种亚型分析中PDD组与n-PDD组均存在显著差异;(4) 病程、UPDRS-III评分、Tef rs738499的TT基因型是PDD的独立危险因素。结论:中国北方汉族人中,Tefrs738499 TT基因型及T等位基因与帕金森病不同亚型合并抑郁相关。
关键词 :帕金森病,亚型,抑郁,Tef rs738499基因多态性

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 前言
帕金森病(Parkinson disease, PD),是一种中老年人常见的神经系统变性疾病,临床表现除具有静止性震颤、肌强直、运动迟缓和姿势步态异常等运动症状外,还常伴发许多非运动症状,如抑郁、焦虑、睡眠障碍、便秘等。抑郁是PD最常见的非运动症状,约有35%的PD患者会出现抑郁症状 [1] ,严重地影响了患者的生活质量 [2] 。PD患者伴发抑郁障碍的识别率及治疗率较低,愿意干预治疗的比率不足11% [3] 。明确帕金森病合并抑郁(Parkinson Disease Depression, PDD)的相关因素并对抑郁症进行早期干预治疗,对提高患者的生活质量及防止病情进展具有非常重要的意义,但PDD的发病机制尚不明确。
近年来,有研究报道,Tef rs738499位点多态性与PD合并睡眠障碍等非运动症状相关 [4] 。Tef表达产物是胚胎促甲状腺因子(Thyrotroph embryonic factor, TEF),它是富含脯氨酸和酸性氨基酸的亮氨酸拉链(PAR bZip)转录因子家族成员之一,并影响储如睡眠、觉醒、体温、激素分泌、神经活动等生物节律,被称为生物钟相关基因 [5] 。本研究旨在探讨中国北方汉族人群该位点基因多态性与帕金森病不同亚型合并抑郁的相关性。
2. 对象与方法
2.1. 研究对象及分组
病例组均是2010年8月~2012年12月青岛大学附属医院崂山院区神经内科就诊帕金森病患者。全部230例患者均符合英国帕金森病脑库临床诊断标准 [6] 。经头颅CT或MRI检查,排除帕金森综合征、帕金森叠加综合征、恶性肿瘤、罹患严重躯体疾病和精神疾病及家族史者。根据24项版本的汉密顿抑郁量表(HAMD) [7] 的评分,将PD分成非抑郁组(HAMD ≤ 8分)和抑郁组(HAMD > 8分),其中PD合并抑郁共116例,年龄44-82岁,其中男性58人(50.0%),PD非抑郁共114例,年龄45~81岁,其中男性58人(50.9%)。根据PD患者运动症状及UPDRS评分 [8] ,将PD组进一步分为震颤型(n = 102)、姿势障碍型(n = 105)、不确定型(n = 23)三种类型,三种类型再进一步分为抑郁组与非抑郁组。对照组选取与PD患者年龄、性别等相匹配的健康查体者,排除抑郁患者共250例,年龄34~89岁,其中男性134人(53.6%)。
本研究通过青岛大学附属医院伦理委员会批准,所有受试者均签署知情同意书。
注:研究对象原为病例组238例,对照组260例,而后成功获取基因型的为病例组230例,对照组250例。
2.2.1. DNA提取
所有受试者均于清晨空腹抽取前臂静脉血(病例组于入院后次日凌晨采血) 5ml置于EDTA抗凝管,室温固定2h,常温下2700 r/min离心10 min,收集上清液和白细胞层分别置于2个Eppendof管中,−80℃冻存待测。应用血液基因组DNA提取试剂盒(非离心柱型)提取白细胞内DNA (Tiangen Biotech Co., Ltd., Beijing, China)。操作步骤均严格按照说明书进行。对提取的DNA进行鉴定:1%琼脂糖凝胶电泳检测DNA条带的完整性。
2.2.2. PCR扩增
引物均由上海生物技术工程有限公司设计并合成,使用德国Eppendorf公司生产PCR仪扩增目的基因片段。PCR总反应体系50 µL:DNA模板10 µL,Premix Ex TaqDNA聚合酶25 µL (含buffer,dNTP,MgCl2+),上、下游引物各4 µL (10 µmol/L),加双蒸水至50 µL。PCR反应条件:95℃预变性5 min,95℃变性10 s,62℃退火30 s,72℃延伸50 s,进行32个循环,最后在72℃终末延伸5 min。扩增的PCR产物在2%琼脂糖凝胶电泳检测,观察扩增效果。PCR扩增产物酶切(New England Biolabs, Beijing, BclI)后经2%琼脂糖凝胶电泳及凝胶成像分析系统,观察结果确定基因型。为检测PCR-RFLP的准确度,随机选择该位点的三种基因型各3个标本进行测序。引物序列和内切酶相关参数见表1。
3. 数据分析
以Hardy-Weinberg平衡检验观察样本是否具有群体代表性。采用SPSS 17.0 (SPSS 18.0, Chicago, USA)统计软件进行基础分析:符合正态分布的计量资料以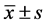 表示,组间计量资料比较采用以t检验或完全随机设计的单因素方差分析;计数资料比较采用χ2检验或者Fisher’s精确检验对组间计量资料、基因型和等位基因频率分布进行分析。多因素logistic回归分析平衡年龄、病程、UPDRS-Ⅲ评分影响因素。基
表示,组间计量资料比较采用以t检验或完全随机设计的单因素方差分析;计数资料比较采用χ2检验或者Fisher’s精确检验对组间计量资料、基因型和等位基因频率分布进行分析。多因素logistic回归分析平衡年龄、病程、UPDRS-Ⅲ评分影响因素。基
因型和等位基因风险率采用相对危险度(odds ratio, OR)表示。P < 0.05定义为差异有统计学意义。
4. 结果
4.1. 一般临床资料
PDD组和n-PDD组在年龄、病程、UPDRS-Ⅲ评分上均存在显著差异(均P < 0.05),而在性别无显著差异(均P > 0.05)。见表2。
4.2. Tef rs738499基因 PCR-RFLP结果
扩增产物经BclI内切酶酶切后琼脂糖凝胶电泳,后经测序验证呈现3种基因型:TT型片段大小124 bp;TG型片段大小124 bp、108 bp、16 bp;GG型片段大小108 bp、16 bp。如图1。
4.3. Tef rs738499等位基因和基因型频率比较
对照组基因型分布经检验均符合Hardy-Weinberg平衡(P > 0.05)。说明样本具有人群代表性。(1)与对照组相比,该位点T等位基因在PD组中差别无统计学意义(OR: 0.983 95%CI: 0.720~1.342 P = 0.913),野生型基因型即TT基因型在PD组中差别无统计学意义(OR: 0.931 95%CI: 0.646~1.340 P = 0.699);(2)将PD患者分为PDD与n-PDD组后,T等位基因在两组之间比较差别有统计学意义,T等位基因发生PDD的风险较n-PDD组是G等位基因的3.0倍(OR:2.975 95%CI:1.838~4.815 P<0.01),野生型基因型在两组之间比较差别有统计学意义,TT基因型发生PDD的风险是TG+GG型的4.6倍(OR: 4.646 95%CI: 2.637~8.186 P < 0.01)。见表3。
4.4. 多因素Logistic回归分析
将年龄、病程、UPDRS-Ⅲ评分、Tef rs738499同时纳入回归方程,病程、UPDRS-Ⅲ评分、Tef rs738499的TT基因型是PDD的独立危险因素。见表4。
4.5. 该位点在PD组3种亚型中比较分析
进一步将PD组分为震颤型、姿势障碍型、不确定型三种亚型后,各亚型中PDD组与n-PDD组患者
Table 1. PCR relative parameters
表1. PCR反应相关参数
Table 2. General clinical data
表2. 一般临床资料
注:与n-PDD组比,*p < 0.05。
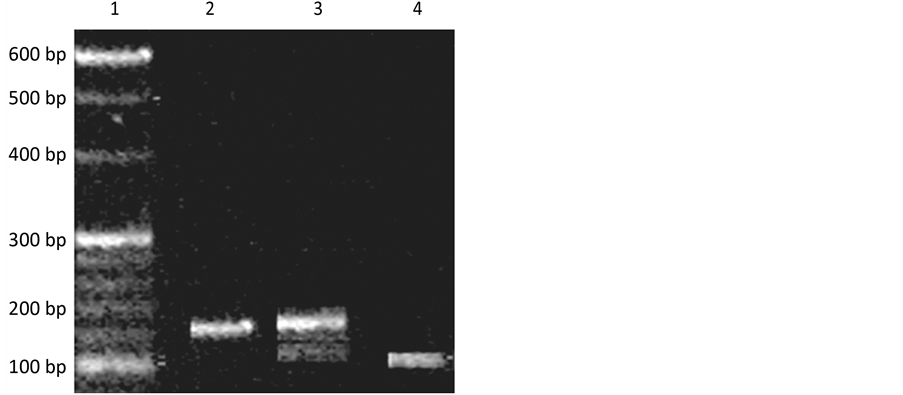
Figure 1. 1: Way DL600 Markers, 2: TT type, 3: TG type, 4: GG type (16bp not displayed)
图1. 1:道为DL600 Markers,2:TT型,3:TG型,4:GG型(16bp未显示)
Table 3. Genotype and allele frequency
表3. 基因型和等位基因频率比较
注:与n-PDD组比,*p < 0.05。
Table 4. PDD’s risk factors
表4. PDD的危险因素
进行比较,结果显示:该位点TT基因型在三种亚型分析中PDD组与n-PDD组均存在显著差异。在震颤组中,TT基因型发生PDD的风险是TG + GG型的4.2倍(OR: 4.242 95%CI: 1.807~9.958 P = 0.001);在姿势障碍组中,TT基因型发生PDD的风险是TG + GG型的4.1倍(OR: 4.082 95%CI: 1.788~9.318 P = 0.001);在不确定型组中,TT基因型发生PDD的风险是TG + GG型的13.3倍(OR: 13.333 95%CI: 1.775~100.142 P = 0.012)。见表5。
5. 讨论
帕金森病是中老年人常见疾病之一,并呈现逐年递增的趋势。抑郁作为帕金森病最常见的非运动症
Table 5. The allele at tremor type, postural disorder type and uncertainty type’s comparison
表5. 该位点在震颤、姿势障碍及不确定型三种分型比较
状,其发病机制尚不明确。多数人认为可能是遗传因素与环境因素的共同作用的结果。
Tef作为一种生物钟基因,它的表达产物是胚胎促甲状腺因子,TEF是亮氨酸拉链(PAR bZip)转录因子家族成员之一。Tef的表达产物TEF与神经递质内稳态、氨基酸代谢、凋亡调节蛋白有关,miR-125b可调节其表达 [9] 。PAR bZip缺失的小鼠会出现神经递质代谢紊乱,如脑内5-羟色胺和多巴胺水平降低 [10] 。多数人认为脑内单胺类神经递质如5-羟色胺、去甲肾上腺素和多巴胺含量下降或功能不足是重度抑郁发病机制之一 [11] ,但与PD的关系尚不明确。PD最显著的生化改变是纹状体内多巴胺含量降低,同时脑内5-羟色胺和去甲肾上腺素的含量有不同程度的下降,尤其是在PDD患者 [12] [13] [14] 。由此推断Tef基因突变可能通过引起神经递质代谢紊乱而参与到PDD的发病机制中。
本研究显示,在中国北方汉族人群中,Tef rs738499位点与PD合并抑郁的发生相关,TT基因型是发生PDD的独立危险因素。Kripke等 [15] 研究发现,Tef rs738499基因多态性与抑郁有着密切联系。Hua等 [4] [16] 研究发现,Tef rs738499位点与PD合并睡眠障碍、抑郁等非运动症状相关,这与我们的研究结果基本一致。但本研究根据UPDRS评分将PD患者分为震颤型、姿势障碍型、不确定型三种亚型,且在三种亚型中TT基因型在PDD组与n-PDD组之间均存在显著差异,携带TT基因型的PD患者更容易合并抑郁,进一步证实了该位点的TT基因型与PDD相关。除此之外,我们还发现PD病程越长和UPDRS-III评分越高,罹患PDD的可能性就越大。
总之,我们发现中国北方汉族人群中Tef rs738499基因多态性与帕金森病合并抑郁的发病相关,并首次证实该位点与PD不同亚型合并抑郁也相关。Tef rs738499基因多态性的发现对于帕金森病合并抑郁的早期诊断和治疗具有重要的意义。但由于PD是多种基因与环境共同作用的结果,单基因研究常很难阐明基因间的相互作用,以及多基因对表型的共同影响效应 。因此,有必要在后续研究中进行深入的多基因突变位点联合分析。
文章引用
黄 樊,潘旭东,厉 娜,马爱军. Tef rs738499基因多态性与帕金森病不同亚型合并抑郁的相关性
Association between Tef rs738499 Gene Polymorphism with Different Subtypes of Depression in Parkinson’s Disease[J]. 临床医学进展, 2017, 07(01): 23-29. http://dx.doi.org/10.12677/ACM.2017.71005
参考文献 (References)
- 1. Reijnders, J.S., et al. (2008) A Systematic Review of Prevalence Studies of Depression in Parkinson’s Disease. Move-ment Disorders, 23, 183-189. https://doi.org/10.1002/mds.21803
- 2. Schrag, A. (2006) Quality of Life and De-pression in Parkinson’s Disease. Journal of the Neurological Sciences, 248, 151-157. https://doi.org/10.1016/j.jns.2006.05.030
- 3. 董青, 王智樱, 李焰生. 帕金森病合并抑郁障碍的临床研究[J]. 神经病学与神经康复学杂志, 2009(3): 169-172 + 183.
- 4. Hua, P., Zhao, Y., Ding, H., Wang, L. and Xiao, H. (2012) Tef Polymorphism Is Associated with Sleep Disturbances in Patients with Parkinson’s Disease. Sleep Medicine, 13, 297-300. https://doi.org/10.1016/j.sleep.2011.06.023
- 5. Yoshida, Y., et al. (2009) The Influences of Propofol and Dexmedetomidine on Circadian Gene Expression in Rat Brain. Brain Research Bulletin, 79, 441-444.
- 6. Williams, D.R. and Lees, A.J. (2005) Visual Hallucinations in the Diagnosis of Idiopathic Parkinson’s Disease: A Retrospective Autopsy Study. The Lancet Neurology, 4, 605-610.
- 7. 汤毓华, 张明园. 汉密顿抑郁量表(HAMD)[J]. 上海精神医学, 1984(2): 61-64.
- 8. Jankovic, J., et al. (1990) Variable Expression of Parkinson’s Disease: A Base-Line Analysis of the DATATOP Cohort. The Parkinson Study Group. Neurology, 40, 1529-1534. https://doi.org/10.1212/WNL.40.10.1529
- 9. Gutierrez, O., Berciano, M.T., Lafarga, M. and Fernandez-Luna, J.L. (2011) A Novel Pathway of TEF Regulation Mediated by microRNA-125b Contributes to the Control of Actin Distribution and Cell Shape in Fibroblasts. PLoS ONE, 6, e17169. https://doi.org/10.1371/journal.pone.0017169
- 10. Gachon, F., et al. (2004) The Loss of Circadian PAR bZip Transcription Factors Results in Epilepsy. Genes & Development, 18, 1397-1412. https://doi.org/10.1101/gad.301404
- 11. 马允香. 抑郁症神经生物学机制研究进展[J]. 河北医科大学学报, 2006(6): 594-596.
- 12. Borek, L.L., Chou, K.L. and Friedman, J.H. (2007) Management of the Behavioral Aspects of Parkinson’s Disease. Expert Review of Neurotherapeutics, 7, 711-725. https://doi.org/10.1586/14737175.7.6.711
- 13. Remy, P., Doder, M., Lees, A., Turjanski, N. and Brooks, D. (2005) Depression in Parkinson’s Disease: Loss of Dopamine and Noradrenaline Innervation in the Limbic System. Brain, 128, 1314-1322. https://doi.org/10.1093/brain/awh445
- 14. Mayberg, H.S., et al. (1990) Selective Hypometabolism in the Inferior Frontal Lobe in Depressed Patients with Parkinson’s Disease. Annals of Neurology, 28, 57-64. https://doi.org/10.1002/ana.410280111
- 15. Kripke, D.F., et al. (2009) Circadian Polymorphisms Associated with Affective Disorders. Journal of Circadian Rhythms, 7, 2.
- 16. Hua, P., et al. (2012) Association of Tef Polymorphism with Depression in Parkinson Disease. Movement Disorders, 27, 1694-1697. https://doi.org/10.1002/mds.25195
