Journal of Advances in Physical Chemistry
Vol.04 No.02(2015), Article ID:15359,13
pages
10.12677/JAPC.2015.42008
Preparation and Properties of Copper Vanadate Materials
Zongliang Fan1, Xiaolin Yang1, Guixian Li1, Yu Zhao1,2*, Jianyi Shen2,3
1School of Petrochemical Engineering, Lanzhou University of Technology, Lanzhou Gansu
2School of Life Science and Chemical Engineering, Huaiyin Institute of Technology, Huai’an Jiangsu
3School of Chemistry and Chemical Engineering, Nanjing University, Nanjing Jiangsu
Email: *yzhao@lut.cn
Received: May 6th, 2015; accepted: May 23rd, 2015; published: May 28th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Copper vanadate materials can possess higher gravimetric capacity and energy density than that of traditional silver vanadium oxide electrode due to their multistep reduction properties. Thus, Copper vanadates receive much attention as a kind of potential industrial electrode used in the lithium ion batteries. Meanwhile, copper vanadate catalysts with good catalytic performance in many industrial important redox reactions also attract much interest. In this paper, we reviewed the complex crystal structures, preparation methods and applications of copper vanadates and proposed the development future of copper vanadates in some new fields.
Keywords:Copper Vanadate, Electrode Materials, Catalysis, Synthesis, Properties

钒酸铜材料的制备及性能
范宗良1,杨晓琳1,李贵贤1,赵鹬1,2*,沈俭一2,3
1兰州理工大学石油化工学院,甘肃 兰州
2淮阴工学院生命科学与化学工程学院,江苏 淮安
3南京大学化学化工学院,江苏 南京
Email: *yzhao@lut.cn
收稿日期:2015年5月6日;录用日期:2015年5月23日;发布日期:2015年5月28日

摘 要
由于铜的多步还原等特性,钒酸铜相比传统的钒酸银电极材料能够提供更高的能量密度和电极比容量,因此,钒酸铜作为具有潜在工业应用价值的锂离子电池的电极材料备受关注。同时,钒酸铜作为一类新型高活性催化剂,也引起人们较高的研究兴趣。本文综述了钒酸铜材料的晶体结构、制备方法及其在各领域应用的研究进展,展望了该材料在新领域的发展方向。
关键词 :钒酸铜,电极材料,催化,制备,性能

1. 引言
钒氧化合物和钒酸盐是比较重要的功能材料,可用于发光材料和电化学嵌锂材料的制备。钒的不同价态的溶液还可以广泛应用于全钒液流储能电池系统。由于成本低廉、环境相对友好、比容量高等特点,钒氧化合物或其它钒氧酸盐材料,已经吸引了广大研究者的关注[1] 。钒酸盐化合物通式为MxVyOz,M通常为碱性金属和过渡金属离子[2] 。由于钒的价态较多,能形成复杂的配位结构,一方面能使钒化合物具有丰富的氧化还原性,但同时也会造成钒氧化合物或钒酸盐的晶体结构非常复杂,种类繁多。而其中结构相对稳定的一般为层状化合物,[VyOz]构成层状结构,M占据层与层之间的空隙位置。按照M离子的不同,目前备受关注的钒酸盐有钒酸银(Ag2V4O11)、钒酸铋(BiVO4)、钒酸锰(MnV2O6)、钒酸钇(Eu:YVO4)、钒酸铜(CuV2O6)等。
上述过渡金属钒酸盐长久以来作为一次及二次锂电池的正极材料被广泛研究,而其中钒酸铜材料,由于其层状结构和在嵌入/脱嵌锂离子过程中可以多步还原(Cu2+/Cu+及Cu+/Cu0)的特性[3] 被认为是具有潜在应用前景的锂电池电极材料。与传统的钒酸银材料相比,由于铜的多步还原特性,钒酸铜能够提供更高的能量密度和电极比容量;铜的摩尔质量比银小的多,有利于减轻电池材料的重量[4] ;同时,铜比银更便宜,使得钒酸铜比钒酸银的成本更低。近年来,钒酸铜材料逐渐引起学术界和工业界的广泛关注,对其相关的研究也日益升温。除了主要在电池材料方面的应用,由于铜和钒均是性能优异的氧化还原催化剂,因此,其在催化领域的应用也是其性能的重要部分。已有文献报道,钒酸铜在光解水[5] 、甲苯氧化[6] [7] 、SO3分解[8] [9] 等反应中具有优异的催化性能。
本文主要从钒酸铜材料的晶体结构、制备方法、在各领域的应用等几个方面综述了国内外近期的研究成果,为钒酸铜的深入研究提供一定的便利。
2. 钒酸铜材料的晶体结构
由于钒和铜的价态均较多,因此它们形成配体的种类也数目繁多,由此带来了钒酸铜晶体结构的多样性。本文将文献中已经报道的各种晶体结构进行汇总,有利于后续研究更方便地进行。
2.1. Cu-V-O化合物
最基本的钒酸铜化合物是由钒、铜和氧三种元素组成,它们先形成CuOx单元和VyOz单元,然后通过配位构成各种复杂的钒酸铜结构。
CuV2O6、Cu5V2O10及Cu2V2O7是较常见的三种钒酸铜化合物,他们由于钒处于正方棱锥或四面体配位而表现出不同的晶体结构。CuV2O6的晶体结构是由VO5金字塔链共用边连接Cu离子组成。而Cu5V2O10和Cu2V2O7表现的是钒四面体配位结构[10] 。Cu2V2O7有α-、β-两种结晶态,它们都含有V2O7组合的错列层状结构,二者可以通过矢量晶胞参数的变化而相互转变[11] 。V4+阳离子在四面体结构中是不稳定的,因此,V5+/V4+还原过程会伴随着配位结构的变化,Cu5V2O10和Cu2V2O7在电化学应用的放电过程中会逐渐转变成无定形态[10] 。具体的晶体结构模型如图1所示。
图2给出了Ma等对于α-CuV2O6化合物确定的其晶体结构。α-CuV2O6包含了VO6八面体组成沿b轴方向形成的单层,而铜离子沿c轴方向夹杂在各层中间,同时铜与六个氧原子配位形成CuO6八面体结构(铜和钒共用部分氧原子) [12] 。
各种钒酸铜物相实质上是由氧化铜和氧化钒组成的复合氧化物,因此有学者按照不同数目的CuO与V2O5进行配位,来汇总和分析各种钒酸铜的晶体结构,如图3所示。CuV2O6实质上是由一个CuO单元与一个V2O5单元组成;Cu2V2O7实质上是由两个CuO单元与一个V2O5单元组成;Cu3V2O8实质上是由三个CuO单元与一个V2O5单元组成;Cu5V2O10实质上是由五个CuO单元与一个V2O5单元组成。这样的分析对于我们理解钒酸铜复杂而繁多的晶体结构是有利的。从图上可以看出,CuV2O6是由扭曲八面体配位VO6单元组成,而其他三种都是由四面体VO4单元组成[8] 。对于焦钒酸铜Cu2V2O7,每个V5+与四个氧原子形成四面体配位,两个四面体为一组(共用一个氧原子),构成一个V2O7单元,而Cu2+再与V2O7单元链接,组成Cu2V2O7晶体结构[8] [11] 。原钒酸铜Cu3V2O8中,V5+与氧原子形成四面体配位,多个VO4单元准立方排布形成一层,Cu离子夹在各层之间,同时铜与VO4单元形成八面体配位结构[8] 。更加复杂的Cu5V2O10物相是由八面体CuO6单元、三角双棱锥CuO5单元及扭曲四面体VO4单元经过复杂的配位构成[8] 。
除了上面几种比较常见的钒酸铜化合物以外,还有文献报道了一些特殊结构的铜-钒-氧化合物。
Harb等[13] 报道了CuVO3的是层状晶体结构,每一层都由ab轴向上的八面体的VO6单元组成,然后沿c轴堆积,铜原子夹在各层之间。VO6单元在层与层之间无作用力,而铜也以四面体结构分布。见图4所示。
另外,ε-Cu0.95V2O5化合物也有报道,但文献中未给出其晶体结构。
2.2. 其他元素掺杂X-CuVO化合物
除了仅含有CuVO三种元素的钒酸铜化合物,为了使钒酸铜材料的结构更加多样性或通过巧妙设计以满足某些特殊用途,很多文献报道了其他元素掺杂的钒酸铜化合物。比如,LiCu2VO4(OH)2 [14] 、AgCuVO4 [15] 、BaCu3(VO4)2(OH)2 [16] 、Cu3V2O7(OH)2∙2H2O [3] [16] [17] 、Cu(C6H16N3)2(VO3)4 [18] 、Ce0.8Cu0.2VO3 [19] 、(nBu4N)4[Cu6V30O82(NO3)2(CH3CN)6] [20] 、Cu2(VO4) (OH) [21] 、Cu4V2(OH)2O8 [22] 等。虽然这些化合物的物相比较复杂,但它们都是由上述介绍的VO4单元、VO6单元、V2O7单元、CuO6单元、CuO5单元等通过配位组合而成,因此可以参照Cu-V-O钒酸铜化合物的晶体结构进行理解。下面仅以较常见的Cu3V2O7(OH)2∙2H2O进行介绍。
Cu3V2O7(OH)2∙2H2O是钙钒铜矿的主要成分,同时也是低温下(<200℃)水热合成钒酸铜时常见的产物。它的晶体结构如图5所示,上文介绍的两个钒氧四面体为一组,共用一个氧原子而构成一个V2O7单元,多个V2O7单元组成各层;Cu夹在各层之间,与氧原子配位成CuO6八面体形式存在;而水分子与V2O7单元为一层,通过氢键与CuO6八面体产生作用。
3. 钒酸铜的制备方法
目前钒酸铜的制备方法大多以水热合成法制备,通过温度等合成条件的调控及添加各种模板剂等制

Figure 1. Crystal structures of three copper vanadates (CuV2O6, Cu5V2O10 and Cu2V2O7) [10]
图1. CuV2O6、Cu5V2O10及Cu2V2O7三种钒酸铜化合物的晶体结构[10]

Figure 2. Crystal structure of α-CuV2O6 nanowires [12]
图2. α-CuV2O6的晶体结构图[12]
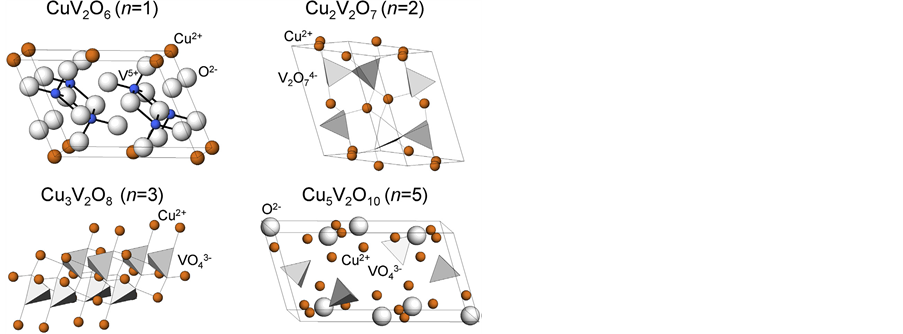
Figure 3. Crystal structure of nCuO-V2O5 (n = 1, 2, 3 and 5) [8]
图3. 各种nCuO-V2O5 (n = 1, 2, 3 and 5)的晶体结构[8]
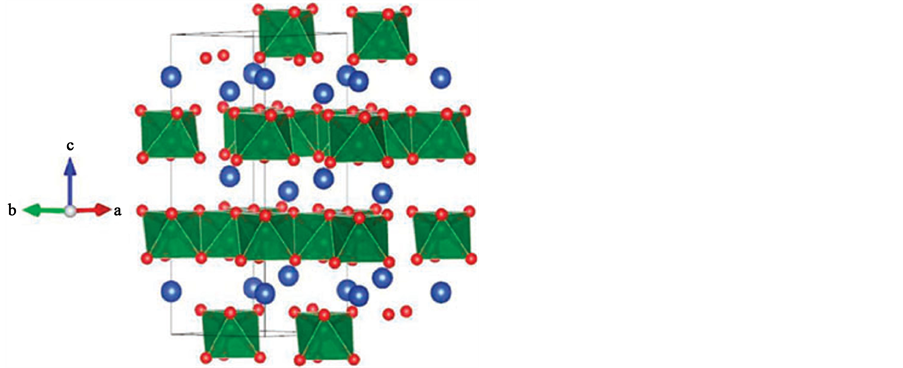
Figure 4. Polyhedral model structures of CuVO3; Cu (blue spheres), V (green spheres), and O (red spheres) [13]
图4. CuVO3的晶体结构模型[13]

Figure 5. Crystal structure of volborthite Cu3V2O7(OH)2∙2H2O [16]
图5. Cu3V2O7(OH)2∙2H2O的晶体结构模型[16]
备出晶体结构和形貌各异的钒酸铜材料。除了水热合成法以外,已报道的还有固相反应法[23] 、溶胶凝胶法[24] 、化学共沉淀法[25] 、软化学方法[26] 、电化学辅助的液相激光消融法[27] 等。
3.1. 水热合成法
水热合成法是制备纳米或微米级材料的一种常用方法。在密闭的反应器中营造高温高压的反应环境,使得通常难溶或不溶的物质溶解且重结晶而得到具有较高结晶度和特殊形貌的无机材料。
Sun等[3] 以碱式碳酸铜和偏钒酸铵为原料,以CTAB为模板剂,在80℃水热条件下,合成出花状Cu3V2O7(OH)2∙2H2O材料。实验发现,在前期(0.5 h)碱式碳酸铜并没有和偏钒酸铵反应,同时该体系沉淀的固体物为纳米片状;反应2 h之后,开始有Cu3V2O7(OH)2∙2H2O晶相生成,沉淀物形貌为球形颗粒和纳米片的混合物;8 h以后Cu3V2O7(OH)2∙2H2O晶相较纯,初步具备花状形貌;16 h以后尺寸均匀微米级花球成功合成(如图6所示)。CTAB作为模板剂在花球形貌的合成过程中起到重要作用,如果用十二烷基硫酸钠(SDS)代替CTAB,得到的是纳米纤维形貌,如果用P123(EO20PO70EO20) 仅得到不规则的片状形貌。铜源也起到重要作用,如果用CuSO4∙5H2O、CuCl2∙2H2O或Cu(NO3)2∙5H2O代替碱式碳酸铜,仅得到不规则颗粒。温度也有影响,如果温度提高到180℃,得到的是纳米带形貌。
Zhang等[17] 同样以水热合成法制备Cu3V2O7(OH)2∙2H2O材料。CuSO4∙5H2O和NH4VO3分别溶于适量的水配成溶液,然后将NH4VO3的水溶液在80℃缓慢滴加到硫酸铜溶液中,即可得到黄色沉淀,此时pH值≈5。将沉淀洗涤干燥后即得到Cu3V2O7(OH)2∙2H2O纳米颗粒(如图7(a)、图7(b)所示)。如果用氨水将上述溶液的pH值调至7~8,得到的是片状Cu3V2O7(OH)2∙2H2O材料(如图7(c)、图7(d)所示)。此时仅为沉淀法制备。如果将上述未调节pH值的溶液倒入水热釜中,在180℃保持20 h,经过该水热合成过程后,得到的是均匀的Cu3V2O7(OH)2∙2H2O纳米线(如图7(e)、图7(f)所示)。
文中还考察了铜源对合成材料形貌的影响。当以强酸根铜盐作为铜源(如Cu(NO3)2∙3H2O或CuCl2∙2H2O)时,合成材料的形貌与CuSO4∙5H2O为铜源制备的相似,均是纳米线;而弱酸根铜盐作为铜源(Cu(CH3COO)2∙H2O)时,只能得到不规则颗粒。
Ma等[12] 以CuCl2∙2H2O和NH4VO3为原料,在较高的温度下(210℃)以水热合成手段制备出α-CuV2O6纳米线。该材料直径约100 nm左右,长数微米(见图8所示)。比表面积达62 m2/g。文中提出了α-CuV2O6纳米线的形成机理。整个过程分为三步:第一步,CuCl2∙2H2O和NH4VO3为反应生成Cu3V2O7(OH)2∙2H2O晶核,并通过Ostwald熟化作用逐渐聚集成薄片微结构;第二步,Cu3V2O7(OH)2∙2H2O在水热条件下逐渐分解,生成CuV2O6、CuO和水。该过程通过H2O分子的脱嵌作用而使Cu3V2O7(OH)2∙2H2O薄片微结构以Ostwald分裂方式逐渐形成CuV2O6纳米片,最终形成CuV2O6纳米线;第三步,CuO和HCl生成CuCl2,再与NH4VO3继续反应,直到反应原料耗尽而达到反应终止。前三步的反应式见(1)~(3),最终的总反应式见式(4) [12] 。
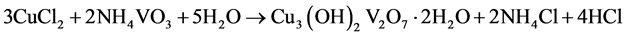 (1)
(1)
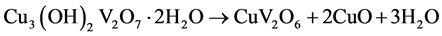 (2)
(2)
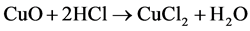 (3)
(3)
 (4)
(4)
另外,Hu等[28] 报道了以Cu(NO3)2∙3H2O和V2O5为原料,而以苯乙酮为还原剂,在水溶液中通过水热合成法于200℃保持15 h得到纯晶相ε-Cu0.95V2O5纳米带。文中着重指出,加入还原剂对于合成ε-Cu0.95V2O5至关重要,如果没有还原剂,最终的产物将为CuV2O6物相。Hu等 [29] 接着以V(IV)O(acac)2和Cu(NO3)2∙3H2O为原料,以聚乙烯吡咯烷酮(PVP)为模板剂,依然在200℃水热合成15 h,得到ε-Cu0.95V2O5空心微米球。
从上面的介绍可以看出,以铜盐和NH4VO3为原料水热条件下合成钒酸铜时,在低温下(<200℃)一般得到Cu3V2O7(OH)2∙2H2O物相,它相当于一个中间体,提升水热反应温度(≥210℃),Cu3V2O7(OH)2∙2H2O发生分解,得到α-CuV2O6物相。通过调节pH值和加入模板剂等手段,可以分别得到不同形貌的钒酸铜材料。或者通过加入还原剂还可以合成ε-Cu0.95V2O5物相,它同样也可以作为一个中间体,在高温(500℃)焙烧后也得到α-CuV2O6物相。需要指出的是,Cu3V2O7(OH)2∙2H2O或ε-Cu0.95V2O5物相不仅仅是制备α-CuV2O6的中间体,它们本身也是较好的电极材料,具有较高的电极比容量。
3.2. 固相反应法
固相合成法是制备钒酸盐粉体较为常用的一种方法,其主要过程是将反应的原材料成分混合,在一定温度下进行烧结来制备所需的材料。
Hillel等[23] 以固相合成法制备了一系列钒酸铜化合物,包括CuV2O6、Cu3V2O8、Cu2V2O7、Cu5V2O10等。将CuO与V2O5以不同摩尔比混合后,反复研磨,然后在管式炉中高温焙烧,即可得到各物相的钒酸铜化合物。在620℃保持48 h,得到的是CuV2O6;在680℃保持72 h,得到Cu2V2O7;在700℃保持

Figure 6. XRD pattern (a) and FE-SEM images with different magnifications (b) - (d) of the Cu3V2O7(OH)2∙2H2O microflowers [3]
图6. Cu3V2O7(OH)2∙2H2O花状材料的XRD图(a)及不同放大倍数下的FE-SEM照片(b)~(d) [3]

Figure 7. FE-SEM images of the as-prepared Cu3V2O7(OH)2∙2H2O (a), (b) nanoparticles, (c), (d) nanoflakes, and (e), (f) nanowires at different magnifications [17]
图7. Cu3V2O7(OH)2∙2H2O的纳米颗粒(a) (b)、纳米片(c) (d)及纳米线(e) (f)的不同放大倍数的FE-SEM照片[17]
72 h,得到Cu3V2O8;在800℃保持72 h,得到Cu5V2O10。除了反应温度的不同,CuO与V2O5的投料摩尔比也是制备各种钒酸铜物相的重要影响因素。
Hillel等也总结了前人的CuO-V2O5的相图以分析各种钒酸铜材料的热稳定性(见图9)。从图中可以看出,钒酸铜化合物的热稳定性都比较好。而CuV2O6由于在210℃至620℃较宽的温度范围内都可以成功制备,使得各种制备方法都有较大的可能性,能够满足其不同性能的需要,而其他几种钒酸铜化合物由于所需制备温度较好,制备出高比表面积材料的可能性不大,因此,在诸钒酸铜材料中,大量的文献更集中于CuV2O6的制备及性能研究。
3.3. 溶胶–凝胶法
溶胶–凝胶法是一种比较常见的制备纳米复合氧化物的方法。无机盐或金属醇盐前驱体与水或有机

Figure 8. SEM (a), (b), TEM (c), and HRTEM (d) images of the as-synthesized α-CuV2O6 nanowires [12]
图8. 制备的α-CuV2O6 纳米线的SEM(a) (b)、TEM(c)及HRTEM (d)照片[12]
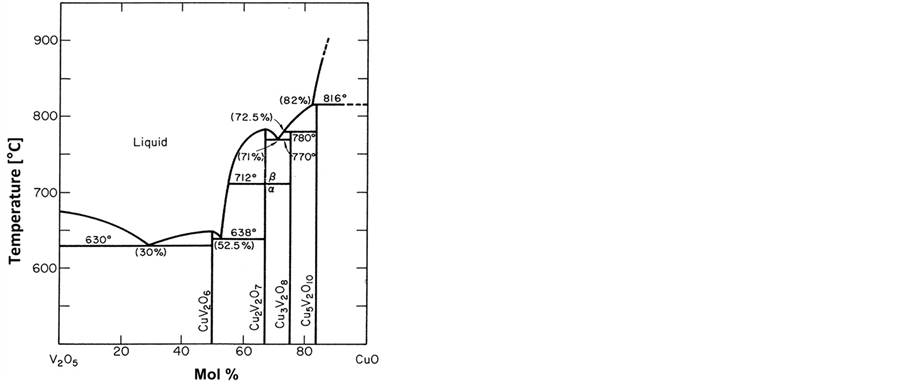
Figure 9. CuO-V2O5 phase diagram [23]
图9. CuO-V2O5形成各种化合物的相图[23]
溶剂发生水解(或醇解)反应,反应生成物聚集成纳米级粒子并形成溶胶;随之蒸发干燥形成具有一定空间结构的凝胶,再经过干燥、焙烧处理以去除有机成分,最终得到无机材料。
Cao等[24] 以NH4VO3为钒源、碱式碳酸铜(CuCO3∙Cu(OH)2∙xH2O)为铜源,在柠檬酸溶剂中80℃搅拌,逐渐形成溶胶,然后将胶体干燥得到水凝胶,凝胶在500℃~600℃焙烧即可得到CuV2O6。文中对反应过程进行分析,认为NH4VO3和碱式碳酸铜在酸性介质中分别水解出VO3−和Cu2+离子,它们和柠檬酸形成配合物溶胶;随着水分的蒸发,柠檬酸聚合成3D网络结构,金属离子镶嵌于其中而形成凝胶,继续干燥得到钒酸铜水合物前体。之后,将水合物高温焙烧,分解得到CuV2O6材料。反应式可参见式(5)、(6) [24] 。该方法得到的CuV2O6材料为不规则形貌,且颗粒较大,约2 μm左右。
 (5)
(5)
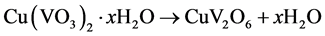 (6)
(6)
3.4. 化学沉淀法
沉淀法是通过加入沉淀剂使两种及以上的金属盐混和溶液生成沉淀物前驱体,再经过洗涤、干燥、焙烧后得到纳米或微米级材料。该方法操作简单,工艺可操作性强,但需严格控制好沉淀条件以保证产物具有较合适的粒径。
Wei等[25] 先用氨水将V2O5溶解,再将硝酸铜溶液与之混合,继续滴加氨水使pH值达到8.5左右,得到钒酸铜沉淀。该沉淀洗涤干燥后,在400℃、600℃焙烧,得到最终的CuV2O6材料。该方法得到的材料也为不规则颗粒,粒径在0.1~0.3 μm。
上述3.1节中,Zhang等[17] 也以CuSO4∙5H2O和NH4VO3为原料,在pH值≈5时得到Cu3V2O7(OH)2∙2H2O纳米颗粒;用氨水将上述溶液的pH值调至7~8,得到的是片状Cu3V2O7(OH)2∙2H2O材料。
一般来说,共沉淀法和溶胶–凝胶法得到的仅是前体或中间体,都要经过高温焙烧处理之后,才得到可用于电极材料等应用的最终钒酸铜材料(CuV2O6)。
3.5. 软化学方法
在相对温和的反应条件下,采用化学合成手段制备纳米材料的方法都统称软化学方法。上述的溶胶–凝胶法、水热法、低温时的固相法都属于软化学的范畴。但软化学方法又不仅仅是这些种类。Cao等[26] 报道了一种由V2O5水凝胶和Cu2O粉末为原料来制备钒酸铜的软化学方法(chimie douce method)。以偏钒酸钠水溶液通过强酸型阳离子交换树脂,而使钒酸缩聚,室温下老化24~48 h,得到钒的水凝胶。Cu2O粉末直接加入V2O5水凝胶中,绿棕色凝絮状沉淀生成。100℃干燥后,在250℃~550℃焙烧得到最终的CuV2O6钒酸铜材料。由上述介绍可以看出,该方法是介乎固相法和溶胶–凝胶法之间的一种方法,制备的CuV2O6钒酸铜材料也为不规则形貌颗粒。
3.6. 电化学辅助的液相激光消融法
电化学辅助的液相激光消融法(Electrochemically assisted laser ablation in liquid, ECLAL)是一种制备纳米材料的新方法。它与传统的水热合成等相比,具有以下优点:(1) 起始物质简单、不需催化剂和目标产物纯度高,因此为简单清洁合成方法;(2) 常温常压即可合成,不需高温高压;(3) 可以通过改变固体靶、电极和母液等来控制和设计纳米材料的结构[30] 。
Liang等[27] 以固体钒靶为起始物,以去离子水为母液,以铜电极为铜源,脉冲激光对准钒靶,通过不同的电压进行实验。在激光消融过程中,一直保持在常温操作。结果发现,以40 V的电压进行实验,得到纳米片组装成的花状钒酸铜材料(见图10(a)、图10(b));以80 V的电压进行实验,纳米盘的厚度显著增厚,表观堆积更紧密(见图10(c)、图10(d));而以120V的电压进行实验,为微米级块状物。XRD图谱显示,它们的晶相主要为Cu3(OH)2V2O7∙2H2O。
从上面的介绍可以看出,水热合成法是目前比较常见的制备钒酸铜的方法,它能够形成具有较高结晶度和一些特殊形貌的钒酸铜材料,但水溶剂较单一,对于合成材料的性质调控比较有限;固相合成法由于需要较高的温度,制备的钒酸铜材料一般不会达到较高的比表面积;溶胶–凝胶法、化学沉淀法及软化学方法操作简单,制备条件温和,但制备的材料颗粒度较大且大多为不规则形貌;电化学辅助的液相激光消融法一般不适宜于大规模工业生产。综上所述,每种方法均具有其优劣处,持续开发新型制备方法对于钒酸铜材料的应用具有较大的意义。
4. 钒酸铜材料的应用
4.1. 锂离子电池方面的应用
钒酸铜最早和最重要的应用就是作为锂离子电池的电极材料。Cu2V2O7具有比V2O5更高的电荷密度,在2~3.5 V之间可以充放电100次以上[31] 。CuV2O6具有远比其他过渡金属钒酸盐(镁、钙、锰、钴、镍、镉)优越的电化学性能[32] 。由于铜的多步还原特性,钒酸铜相比传统的钒酸银电极材料能够提供更高的能量密度和电极比容量[10] 。因此,钒酸铜作为具有潜在工业应用价值的锂离子电池的电极材料备受关注。
由表1可以看出,文献报道中的钒酸铜材料的电极比容量远高于传统的钒酸银电极材料。具有一定特殊形貌的钒酸铜材料一般比简单的钒酸铜颗粒的电化学性能更好,可能由于其比表面积或形貌效应的影响;而不同晶相的钒酸铜材料如CuV2O6、Cu3V2O7(OH)2∙2H2O、ε-Cu0.95V2O5等电化学性能基本相当。
4.2. 作为催化剂方面的应用
铜和钒一直以来都是工业上应用较广的氧化还原反应催化剂,因此钒酸铜材料在催化领域依然具有重要的应用。但目前的文献报道上来看,钒酸铜作为催化剂的开发远没有作为电池材料那样受关注,仅在光解水、甲苯氧化、SO3分解等少数反应中有所报道。
Palacio等[7] 以NH4[Cu2.5V2O7(OH)2] ∙H2O为前体在不同条件下焙烧而得到的钒酸铜为催化剂,考察了其在甲苯氧化反应中的活性。甲苯氧化反应主要是为了通过催化氧化的方法将空气中的少量甲苯(有毒性挥发性有机物)转化成CO2和H2O以达到净化空气的目的。该前体分别在320℃、400℃、500℃和600℃焙烧处理,分别得到了不同的晶相。将焙烧后的该组催化剂用于甲苯氧化反应,发现320℃焙烧的钒酸铜催化剂的催化活性最高,在280℃左右即可达到100%的甲苯转化率,而CO2的选择性也达到100%,无CO生成(反应条件:甲苯浓度800 ppm,催化剂装填量300 mg,气体流速15 L/h)。该催化剂的物相为结晶态Cu2V2O7 (ziesite)和无定形Cu3V2O8的混合物,催化剂的比表面积为12 m2/g。Palacio等也将钒酸铜催化剂负载在ZSM-5或无定形SO2上得到负载型催化剂,并考察其在甲苯氧化反应中的活性[6] 。钒酸铜的负载量在9~11 wt.%,物相依然为结晶态Cu2V2O7 (ziesite)和无定形Cu3V2O8的混合物。实验结果表明,以水热合成法制备的钒酸铜/ZSM-5的催化活性最好,在反应温度300℃左右时,ZSM-5负载催化剂的单位质量钒酸铜的催化活性是上述非负载催化剂的十倍以上。
Kawada等研究了几种晶相的钒酸铜催化剂(CuV2O6、Cu2V2O7、Cu3V2O8和Cu5V2O10)在SO3热分解反应中的催化活性[8] [9] 。SO3热分解反应主要用于工业制氢,其过程包括:硫酸先在350℃以上分解为水和SO3,然后SO3再在约900℃分解为SO2和氧气;另一方面,碘化氢在400℃分解为碘和氢气;最后,SO2和水及碘在低温100℃左右生成硫酸和碘化氢以完成一个反应循环。具体反应式见式(1)~(3)。总反应式为水分解为氧和氢以达到水解制氢的目的。由于第二、三个反应仅需较温和的反应温度,因此该过程的挑战就在于如何降低第一步中的SO3热分解反应的极高的反应温度。

Figure 10. SEM images of the synthesized cooper vanadate nanostructures under different electrical fields. The nanoflake-assembled flower-like samples synthesized at 40 V (a and b), the nanoplate-stacked samples synthesized at 80 V (c and d) [27]
图10. 在不同电场中形成的钒酸铜材料的SEM照片:在40 V电场中制备的纳米片组装花状样品(a)和(b),以及在80 V电场中制备的纳米片支撑状样品(c)和(d) [27]
Table 1. Summary of electrochemical properties of the previously reported copper vanadates and Ag2V4O11
表1. 文献报道的各种钒酸铜材料和传统钒酸银电极的电化学性质汇总
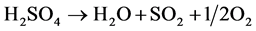 (7)
(7)
 (8)
(8)
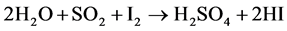 (9)
(9)
Kawada等以负载在介孔SiO2上的CuV2O6为催化剂考察了SO3热分解反应的催化性能,发现在650℃左右即可使SO3的转化率达25%以上,大大降低了反应温度[9] 。Kawada等同时研究了不同晶相的钒酸铜催化剂(CuV2O6、Cu2V2O7、Cu3V2O8和Cu5V2O10)在SO3热分解反应中的催化活性,结果表明晶相为CuV2O6的催化剂活性最高[6] 。
4.3. 作为磁性材料方面的应用
钒酸铜除了作为电极材料和催化剂方面的应用以外,还有作为磁性材料等方面的用途。Zhang等[21] 以水热合成法制备了一种新型多形体钒酸铜材料Cu2(VO4)(OH),并将其用于磁性测试。结果发现,其在低温下表现斜交反铁磁性。如果处于高磁场中,可以观察到1/3磁化稳定平台。由于在不规则Cu3(μ3-OH)三角形内的反铁磁性和铁磁性的相互竞争,弱的自旋阻挫可能形成于该钒酸铜结构系统。
4.4. 光学性能
钒酸铜材料还具有一定的光学性能。张绍岩等[2] 以水热合成法制备了α-CuV2O6纳米线,并采用紫外-可见漫反射测定了该材料的光吸收性能。结果发现,α-CuV2O6纳米线分别在紫外光区和可见光区各有一个较强的吸收峰,表明其对紫外光和可见光均具有较强的吸收性。
5. 结论及展望
钒酸铜材料性能优于传统的钒酸银电极而使其目前最有前景的应用在电池材料及电化学领域,但由于钒和铜本身的氧化还原性,其在催化领域的应用也应引起较高的关注。
由于钒的价态多变,钒酸铜的晶体结构较复杂,但其基本都是由VO4单元、VO6单元、CuO6单元、CuO5单元等通过配位组成,一般钒氧单元组成层状结构而铜嵌在各层之间。CuV2O6是钒酸铜的各种晶体结构中较稳定较常见的一种晶相,在210℃至620℃较宽的温度范围内都可以稳定存在。
钒酸铜材料目前主要以水热合成法制备,较低的合成温度一般得到Cu3V2O7(OH)2∙2H2O晶相,在较高的合成温度(≥210℃)可以得到CuV2O6晶相。通过调变合成条件,可以得到不同形貌的钒酸铜(纳米线、纳米带、片层等)。由于水溶剂较单一,可以继续开发其他溶剂中制备钒酸铜。比如,离子液体作溶剂具有品种繁多、无饱和蒸汽压、既是溶剂又是模板剂等优点,可以使合成更绿色环保、更安全方便及更有开阔的选择余地。
综上所述,钒酸铜材料是一类具有较高工业应用潜力的电极材料,其在催化领域的应用也应引起关注;钒酸铜的晶体结构复杂繁多,深入理解晶体结构及其应用性能之间的关系对于持续开发新的晶体结构具有很好的帮助;钒酸铜的制备方法比较单一,开发新型溶剂或新型可以广泛应用的制备方法对于钒酸铜的应用发展具有重要的意义。
基金项目
国家自然科学基金项目(No. 21203081)资助。
文章引用
范宗良,杨晓琳,李贵贤,赵鹬,沈俭, (2015) 钒酸铜材料的制备及性能
Preparation and Properties of Copper Vanadate Materials. 物理化学进展,02,52-65. doi: 10.12677/JAPC.2015.42008
参考文献 (References)
- 1. 郭光辉, 陈珊, 刘芳芳, 张利玉 (2014) Cu2V2O7的合成及电化学性能. 有色金属, 2, 57-60.
- 2. 张绍岩, 燕红, 高岩磊, 常永芳, 牟微 (2011) 钒酸铜纳米线的制备及光吸收性能. 人工晶体学报, 40, 1517-1520.
- 3. Sun, X.J., Wang, J.W., Xing, Y., Zhao, Y., Liu, X.C., Liu, B. and Hou, S.Y. (2011) Surfactant-assisted hydrothermal synthesis and electrochemical properties of nanoplate-assembled 3D flower-like Cu3V2O7(OH)2•2H2O microstructures. Crys-tEngComm, 13, 367-370.
- 4. Andrukaitis, E., Cooper, J.P. and Smit, J.H. (1995) Lithium intercalation in the divalent metal vanadates MeV2O6 (Me=Cu, Co, Ni, Mn or Zn). Journal of Power Sources, 54, 465-469.
- 5. Yin, C., Zhu, S.M., Chen, Z.X., Zhang, W., Gua, J. and Zhang, D. (2013) One step fabrication of C-doped BiVO4 with hierarchical structures for a high-performance photocatalyst under visible light irradiation. Journal of Materials Chemistry A, 1, 8367-8378.
- 6. Palacio, L.A., Silva, E.R., Catalao, R., Silva, J.M., Hoyos, D.A., Ribeiro, F.R. and Ribeiro, M.F. (2008) Performance of supported catalysts based on a new copper vanadate-type precursor for catalytic oxidation of toluene. Journal of Hazardous Materials, 153, 628-634.
- 7. Palacio, L.A., Silva, J.M., Ribeiro, F.R. and Ribeiro, M.F. (2008) Catalytic oxidation of volatile organic compounds with a new precursor type copper vanadate. Catalysis Today, 133-135, 502-508.
- 8. Kawada, T., Hinokuma, S. and Machida, M (2015) Structure and SO3 decomposition activity of nCuO-V2O5/SiO2 (n = 0, 1, 2, 3 and 5) catalysts for solar thermochemical water splitting cycles. Catalysis Today, 242, 268-273.
- 9. Kawada, T., Yamashita, H., Zheng, Q.X. and Machida, M. (2014) Hydrothermal synthesis of CuV2O6 supported on mesoporous SiO2 as SO3 decomposition catalysts for solar thermochemical hydrogen production. International Journal of Hydrogen Energy, 39, 20646-20651.
- 10. Cheng, F.Y. and Chen, J. (2011) Transition metal vanadium oxides and vanadate materials for lithium batteries. Journal of Materials Chemistry, 21, 9841-9848.
- 11. Touaiher, M., Rissouli, K., Benkhouja, K., Taibi, M., Aride, J., Boukhari, A. and Heulin, B. (2004) Crystal structures and magnetic properties of M2V2O7 (M = Co, Ni and Cu) compounds. Materials Chemistry and Physics, 85, 41-46.
- 12. Ma, H., Zhang, S.Y., Ji, W.Q., Tao, Z.L. and Chen, J. (2008) α-CuV2O6 nanowires: Hydro-thermal synthesis and primary lithium battery application. Journal of the American Chemical Society, 130, 5361-5367.
- 13. Harb, M., Masih, D. and Takanabe, K. (2014) Screened coulomb hybrid DFT investigation of band gap and optical absorption predictions of CuVO3, CuNbO3 and Cu5Ta11O30 materials. Physical Chemistry Chemical Physics, 16, 18198-18204.
- 14. Hoyos, D., Paillaud, J.L. and Guth, J.L. (2004) Synthesis and structure determination of a novel lithium copper vanadate LiCu2VO4(OH)2. Solid State Sciences, 6, 1359-1364.
- 15. Möller, A. and Jainski, J. (2008) Synthesis and crystal structure of AgCuVO4. Zeitschrift für Anorganische und Allgemeine Chemie, 634, 1669-1672.
- 16. Frost, R.L., Palmer, S.J., Cejka, J., Sejkora, J., Plasil, J., Bahfennea, S. and Keeffe, E.C. (2011) A raman spectroscopic study of the different vanadate groups in solid-state compounds-model case: Mineral phases ve-signieite [BaCu3(VO4)2 (OH)2] and volborthite [Cu3V2O7(OH)2•2H2O]. Journal of Raman Spectroscopy, 42, 1701-1710.
- 17. Zhang, S.Y., Ci, L.J. and Liu, H.R. (2009) Synthesis, characterization, and electrochemical properties of Cu3V2O7 (OH)2•2H2O nanostructures. Journal of Physical Chemistry C, 113, 8624-8629.
- 18. Larrea, E.S., Mesa, J.L., Pizarro, J.L., Iglesias, M., Rojo, T. and Arriortua, M.I. (2011) M(C6H16N3)2(VO3)4 as heterogeneous catalysts: Study of three new hybrid vanadates of cobalt(II), nickel(II) and copper(II) with 1-(2-aminoethyl)- piperazonium. Dalton Transactions, 40, 12690-12698.
- 19. Adijanto, L., Padmanabhan, V.B., Kungas, R., Gorte, R.J. and Vohs, J.M. (2012) Transition metal-doped rare earth vanadates: A regenerable catalytic material for SOFC anodes. Journal of Materials Chemistry, 22, 11396-11402.
- 20. Forster, J., Rosner, B., Fink, R.H., Nye, L.C., Ivanovic-Burmazovic, I., Kastner, K., Tucher, J. and Streb, C. (2013) Oxidation-driven self-assembly gives access to high-nuclearity molecular copper vanadium oxide clusters. Chemical Science, 4, 418-424.
- 21. Zhang, S.Y., He, Z.Z., Yang, M., Guo, W.B. and Tang, Y.Y. (2014) Synthesis and magnetic properties of a new polymorph of Cu2(VO4)(OH) with a quasi-2D layer structure. Dalton Transactions, 43, 3521-3527.
- 22. Wu, C.D., Lu, C.Z., Zhuang, H.H. and Huang, J.S. (2003) Synthesis, crystal structure and characterization of a novel three-dimensional polymer: [Cu4V2(OH)2O8]. European Journal of Inorganic Chemistry, 2867-2871.
- 23. Hillel, T. and Ein-Eli, Y. (2013) Copper vanadate as promising high voltage cathodes for Li thermal batteries. Journal of Power Sources, 229, 112-116.
- 24. Cao, J.Q., Wang, X.Y., Tang, A.P., Wang, X., Wang, Y. and Wu, W. (2009) Sol-gel synthesis and electrochemical properties of CuV2O6 cathode material. Journal of Alloys and Compounds, 479, 875-878.
- 25. Wei, Y.J., Nam, K.W., Chen, G., Ryu, C.W. and Kim, K.B. (2005) Synthesis and structural properties of stoichiometric and oxygen deficient CuV2O6 prepared via co-precipitation method. Solid State Ionics, 176, 2243-2249.
- 26. Cao, X.Y., Xie, J.G., Zhan, H. and Zhou, Y.H. (2006) Synthesis of CuV2O6 as a cathode material for rechargeable lithium batteries from V2O5 gel. Materials Chemistry and Physics, 98, 71-75.
- 27. Liang, Y., Liu, P., Li, H.B., Xiao, J. and Yang, G.W. (2012) Synthesis and characterization of copper vanadate nanostructures via electrochemistry assisted laser ablation in liquid and the optical multi-absorptions performance. CrystEngComm, 14, 3291-3296.
- 28. Hu, W, Zhang, X.B., Cheng, Y.L., Wu, Y.M. and Wang, L.M. (2011) Low-cost and facile one-pot synthesis of pure single-crystalline ε-Cu0.95V2O5 nanoribbons: High capacity cathode material for rechargeable Li-ion batteries. Chemical Communications, 47, 5250-5252.
- 29. Hu, W., Du, X.C., Wu, Y.M. and Wang, L.M. (2013) Novel ε-Cu0.95V2O5 hollow microspheres and α-CuV2O6 nanograins: Facile synthesis and application in lithium-ion batteries. Journal of Power Sources, 237, 112-118.
- 30. Liu, P., Liang, Y., Lin, X.Z., Wang, C.X. and Yang, G.W. (2011) A general strategy to fabricate simple polyoxometalate nanostructures: Electrochemistry-assisted laser ablation in liquid. ACS Nano, 5, 4748-4755.
- 31. Sakurai, Y., Ohtsuka, H. and Yamaki, J.I. (1988) Rechargeable copper vanadate cathodes for lithium cell. Journal of the Electrochemical Society, 135, 32-36.
- 32. Takeda, Y., Itoh, K., Kanno, R., Icikaw, T., Imanishi, N. and Yamamoto, O. (1991) Characteristics of brannerite-type CuV2-xMoxO6 (0≤ x≤ 1) cathodes for lithium cells. Journal of the Electrochemical Society, 138, 2566-2571.
- 33. Gur, I., Fromer, N.A., Geier, M.L. and Alivisatos, A.P. (2005) Air-stable all-inorganic nanocrystal solar cells processed from solution. Science, 310, 462-465.
- 34. Nordlinder, S., Augustsson, A., Schmitt, T., Guo, J.H., Duda, L.C., Nordgren, J., Gustafsson, T. and Edström, K. (2003) Redox behavior of vanadium oxide nanotubes as studied by X-ray photoelectron spectroscopy and soft X-ray absorption spectroscopy. Chemistry of Materials, 15, 3227-3232.
