World Journal of Cancer Research
Vol.3 No.1(2013), Article ID:9822,6 pages DOI:10.12677/WJCR.2013.31001
miR-21 and Pancreatic Cancer
Department of Gastroenterology, Affiliated Hospital of Nantong University, Nantong
Email: zhangh111@sina.com
Received: Mar. 11th, 2013; revised: Mar. 20th, 2013; accepted: Apr. 12th, 2013
Copyright © 2013 Lina Zhang, Hong Zhang. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
MicroRNAs (miRNAs) are a class of single-stranded, evolutionary conserved, noncoding RNA molecules, which play important roles in various physiological or pathological processes, such as cell proliferation, differentiation, apoptosis, and especially tumorigenesis. All of them, miR-21 is one of the first studied and most special miRNAs as it is over expressed in nearly all of soil tumors. miR-21 has been shown to regulate the progression of pancreatic caner by targeting tumor suppressor or oncogenes, playing a key role in cell proliferation, differentiation, migration, invasion and drug resistance of pancreatic cancer. Therefore, miR-21 will possibly be a potential biomarker for diagnosis, therapy and prognosis of pancreatic cancer, showing potentially clinical value.
Keywords: miR-21; Target Genes; Pancreatic Cancer
miR-21与胰腺癌
张莉娜,张 弘
南通大学附属医院消化内科,南通
Email: zhangh111@sina.com
摘 要:
微小RNA(microRNA, miRNA)是一类内源性小分子单链RNA,在细胞增殖、分化、凋亡尤其是肿瘤发生发展等生理病理过程中发挥重要作用。miR-21是研究最早也是较特殊的miRNA之一,其在几乎所有的实体肿瘤包括胰腺癌中高表达。miR-21通过作用于靶基因调控胰腺癌发生发发展,在胰腺癌细胞增殖、分化、迁移、侵袭以及肿瘤耐药性等起发面关键作用,有望成为胰腺癌诊断、治疗以及判断预后的潜在的生物标志物,有着潜在的临床应用价值。
收稿日期:2013年3月11日;修回日期:2013年3月20日;录用日期:2013年4月12日
关键词:miR-21;靶基因;胰腺癌
1. 引言
微小RNA(microRNA, miRNA)是一类具有高度保守性的内源性非编码蛋白质的小分子单链RNA,长度约为18~25平均约22个核苷酸分子,其在转录后水平通过抑制翻译或降解mRNA来负调控靶基因的表达。自1993年miRNA首次发现以来[1],目前已发现1800多种人类miRNA,调控约三分之一的人类基因。随着研究的深入,miRNA在调控细胞增殖、分化、凋亡、生长、代谢和免疫上方面的作用越来越受到关注。2002年首次发现两种miRNA,miR-15a和miR-16-1在人慢性淋巴细胞白血病中表达下调[2]。随后,众多临床研究发现,在某些疾病状态、肿瘤、心血管疾病、神经变性疾病和病毒感染疾病中都存在miRNA表达异常[3]。尤其是在人类多种肿瘤中存在某些miRNA表达上调或下调,且一些miRNA的表达水平与肿瘤的发生、发展以及预后有关,因此,这些miRNA可能作为潜在的肿瘤诊断和判断预后的生物标志物。而在这些差异表达的miRNA中,又以miR-21 (miRNA-21)较为特殊。因为miR-21在几乎所有实体肿瘤包括胰腺癌中存在高表达,而且高表达的miR-21可能发挥类似原癌基因的作用[4]。在540例包括6种实体肿瘤病人样本的大范围的miRNA表达谱研究中,miR-21是唯一一个在所有6种肿瘤中高表达的miRNA,包括乳腺癌、结肠癌、肺癌、胰腺癌、前列腺癌和胃癌[5]。另有研究显示,miR-21在其他肿瘤,如肝癌[6]、卵巢癌[7]、食管癌[8]表达都有升高。其不仅在肿瘤疾病中,在自身免疫性疾病如类风湿关节炎[9]、心血管疾病如心肌梗死[10]以及其他如慢性肾炎[11]等疾病中表达均有变化。miR-21在肿瘤以及各种疾病发生发展过程中的作用机制,以及显现出来的潜在的临床应用价值越来越受到人们的关注。
近几年miR-21在胰腺癌方面的研究也是层出不穷,并取得了一定的进展。胰腺的肿瘤大多是外分泌型肿瘤,80%是胰腺导管腺瘤,只有2%的胰腺外分泌肿瘤为良性[12]。胰腺癌以高侵袭性和早期转移为特点,临床症状出现晚,发现时已为晚期,很难施行治愈性的手术治疗,预后较差。近几年在我国发病率逐年上升,并且有年轻化的趋势。虽然放疗和化疗对延长患者生存期起到了一定的作用,但是患者中位生存期仍小于2年[13]。miRNA的出现为寻求胰腺癌新的诊断方法和治疗策略提供了新的线索,其中,miR-21在胰腺癌诊断、治疗和判断预后等方面有着潜在的临床应用价值,有望成为新的肿瘤生物标志物。在此,重点关注近几年miR-21在胰腺癌中的研究进展作此综述。
2. miR-21基因及其转录
miR-21基因是最早在人类基因组中检测到的miRNA基因之一[14],又可称为bsa-mir-21、MIR-21、miR-21、MIRN21等。miR-21基因位于第17号染色体的TMEM49(转膜蛋白-49、空泡膜蛋白-1)基因第10号内含子上[15]。有研究证实miR-21初级转录体(pri-miR-21)是由位于与蛋白编码基因TMEM49重叠的内含子上的保守的启动子独立转录而来[16]。Pri-miR-21长3433个核苷酸分子,具有帽和多聚酰胺酸尾以及茎环结构。由RNA聚合酶Pol II转录而来的pri-miR-21在细胞核内经RNAseIII(Drosha和DGCR8)加工生成长72nt的茎环结构的前体(pre-miR-21)。其后pre-miR-21由Exportin5转运入细胞浆,在细胞浆中进一步被另一种RNAseIII(Dicer)剪切生成长22nt的miRNA-miRNA双链体。其中一条链大多被降解,而另一条链为成熟miR-21。成熟miR-21进而与RNA诱导沉默复合体(RISC)结合形成RISC-miRNP (miRNA核糖核蛋白)复合体,其与靶mRNA 3’端非翻译区(3’UTR)碱基完全或不完全互补配对,进而使mRNA降解或抑制翻译调控靶基因的表达,参与多种生物过程[17]。
3. miR-21与胰腺癌相关的靶基因
目前研究发现和证实的miR-21的靶基因有几十种,其中很多与肿瘤的发生发展有着密切的关系,如TPM1参与细胞骨架结构形成,PDCD4抑制细胞生长,PTEN抑制细胞迁移和增殖,RECK抑制肿瘤的侵袭和转移,Bcl-2抑制细胞凋亡,TIMP3参与胞外信号引导细胞凋亡等(见图1)。miR-21通过与以上靶基因作用在细胞生长、代谢等生理过程尤其是肿瘤增殖、分化、凋亡、侵袭、转移等过程中发挥重要作用。胰腺癌的发生发展是多基因、多步骤的变化过程,如原癌基因K-ras基因激活以及p53、p16、PDCD4/ Smad4、Bcl-2等抑癌基因失活,其中很多是由miR-21直接调控的靶基因。近几年miR-21的研究中与胰腺癌相关的靶基因主要有以下几种(见表1)。
3.1. PTEN
PTEN(phosphatase and tensin homologue deleted from chromosome 10又称为MMAC1,mutated in multiple advance cancers 1)为人第10号染色体缺失的磷酸酶及张力蛋白同源基因,位于10q23.3,是miR-21直接作用的抑癌基因。PTEN基因编码一种对偶的特异性的磷酸酶,能够将磷脂酰肌醇-3,4,5-三磷酸(PIP3)去磷酸化为磷脂酰肌醇-4,5-二磷脂(PIP2)。因此,他是PI3K/Akt(磷酸肌醇3激酶/ATP-依赖的络氨酸激酶)信号途径的有效阻滞剂[18],从而调控多种细胞功能,包括细胞增殖、分化、凋亡尤其是肿瘤生长和血管生成等。抑癌因子PTEN是miR-21的直接靶标[13]。虽然,PTEN突变在胰腺癌中很少发生[19],但其表达
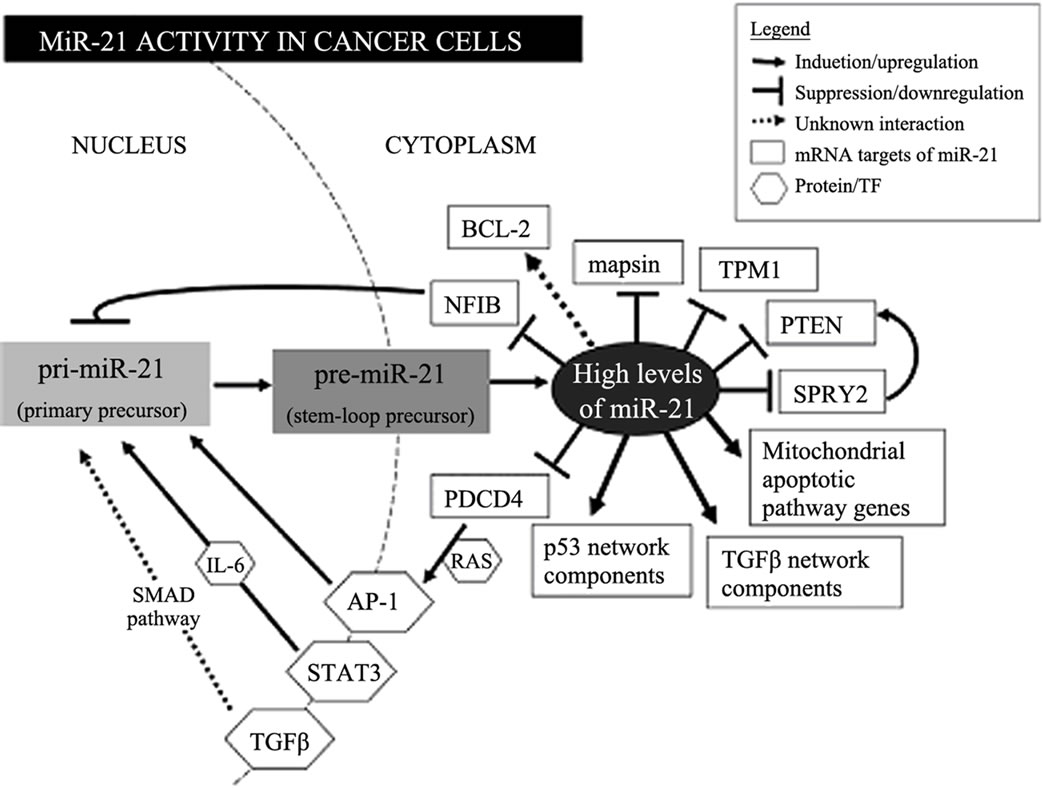
Figure 1. miR-21 activity in cancer cells[16]
图1. miR-21在肿瘤细胞中的作用机制示意图[16]

Table 1. The pancreatic cancer related target gene of miR-21
表1. miR-21与胰腺癌相关的靶基因
减少可能为癌变的胰腺细胞提供有利的生长因素[20]。M. Krausch[21]等人利用免疫组化检测了38例胰腺内分泌肿瘤病人肿瘤组织中PTEN的表达并分析了PTEN表达与临床和病理的各项参数如性别、年龄、TNM分期等的相关性,发现免疫组化PTEN染色阴性的患者的生存率要明显优于阳性的患者,且PTEN失表达与TNM分期正相关。另有研究显示PTEN和Smad4协同作用抑制小鼠胰腺导管腺癌的形成[22]。
3.2. PDCD4
PDCD4(programmed cell death 4)基因是miR-21直接作用的抑癌基因,位于人第十号染色体10q24。PDCD4蛋白在包括造血干细胞、衰老的成纤维细胞以及正常的肠和乳腺导管上皮细胞等多种细胞中均有表达,主要分布于细胞核,介导多种生物过程,如细胞周期进程、细胞存活等[23]。PDCD4蛋白通过与翻译启动子RNA和ATP依赖性RNA解旋酶——eIF4A和eIF4G相互作用靶向调控翻译过程。并且下调PDCD4表达可引起激活物蛋白-1(AP-1)依赖性转录、actine/Tcf依赖性转录和有丝分裂素蛋白激酶激酶类1的激活,并引起基质金属蛋白酶组织抑制因子的减少,从而抑制肿瘤发生、发展、增殖、侵袭和转移[24,25]。PDCD4是miR-21直接作用的抑癌基因,研究表明下调miR-21的表达可引起PDCD4表达上调。Imran Bhatti[26]等研究发现抑制胰腺癌细胞株MIA-Pa-Ca-2中miR-21的表达可引起细胞增殖减少和细胞凋亡增加,并同时伴随抑癌基因PDCD4表达水平的增高,提示miR-21可以作为上调PDCD4表达以治疗胰腺癌的可能的治疗靶点。
3.3. TIMP3
TIMP3(tissue inhibitor of metalloproteinase)属于TIMPs家族,此家族包含4个成员,特异性地抑制基质金属蛋白酶的蛋白水解活性[27]。与其他家族成员不同的是,TIMP3编码分泌的24kDa的蛋白结合于细胞外基质。TIMP3也是抑癌基因,其编码的蛋白能抑制肿瘤生长、血管生成和侵袭,并促进细胞凋亡[28]。胰腺癌存在大量TIMP3的减少或缺失,尽管其启动子甲基化的发生率较低[29]。目前研究发现,在胰腺癌中miR-21高表达与TIMP3下调相关。因此,miR-21诱导的TIMP3下调很可能是又一个胰腺癌变的机制。Yuichi Nagao[30]等人通过免疫组化分析了65例胰腺癌病人和5例正常人胰腺组织中PDCD4和TIMP3的表达,发现与正常胰腺组织相比胰腺癌PDCD4和TIMP3的表达明显减少,数据显示miR-21高表达通过下调抑癌基因PDCD4和TIMP3的表达影响胰腺导管腺癌的生物学行为。
3.4. Bcl-2
Bcl-2(B-cell lymphoma 2)属于Bcl-2基因家族,主要生物学功能是延长细胞寿命,增加细胞对各种凋亡刺激因素的抵抗力,从而抑制凋亡。Bcl-2基因家族是研究最早的与细胞凋亡相关的基因,也是目前最受关注的调控细胞凋亡的基因基因家族。Bcl-2家族包括凋亡抑制基因(Bcl-2,Bcl-xl,Bcl-w,Bfl-1,Brag-1,Mcl-1和A1)以及促凋亡基因(Bax,Bak,Bcl-xs,Bad,Bik和Hrk)[31]。细胞是否对凋亡信号有反应取决于凋亡抑制因子和促凋亡因子的比例[32]。而miR-21是否直接靶向作用于bcl-2仍然存在争议,有学者认为一些miRNA可以上调某些基因或蛋白的表达,但通常不是直接作用[33,34]。但也有研究显示miR-21是直接作用于bcl-2,参与调控肿瘤细胞凋亡。Jie Dong[35]等人将miR-21类似物转染入MIA-PaCa-2胰腺癌细胞株后,Bcl-2表达明显上调而Bax表达下调;相反将miR-21抑制剂转染入胰腺癌细胞株后出现了与以上相反的结果。所有结果证实miR-21可以上调Bcl-2的表达而下调Bax的表达;并构建具有Bcl-2 mRNA 3’UTR野生型和突变型的miR-21结合位点的质粒转染入细胞,采用荧光素酶报告监测发现与突变型的细胞相比,野生型的细胞荧光素酶的活性在转染入miR-21拟似物后显著增加,相反在转染入miR-21抑制剂后显著减少,从而指出miR-21通过直接靶向Bcl-2 mRNA 3’UTR来上调Bcl-2的表达。另外,抑制miR-21表达可以上调乳腺癌[36]、胰腺癌细胞株中Bcl-2的表达而下调胶质母细胞瘤[37]中Bcl-2的表达。这提示miR-21对Bcl-2表达的影响可能具有细胞类型特异性。
4. miR-21与胰腺癌的诊断、治疗以及预后 的关系
临床研究中,首次在人胶质母细胞瘤中发现miR-21高表达[38]。因此,miR-21的异常表达可能是肿瘤的一般特性,可以作为潜在的生物标志物,显现出很高的临床应用价值。由于胰腺癌恶性程度高,易于早期转移,难于早期诊断,预后较差,发病率逐年上升,一直以来都是困扰医学研究者的难题。miRNA 的研究为胰腺癌研究提供了新的线索,尤其是miR-21在对胰腺癌诊断、治疗以及预后等方面的作用更是进行了大量的研究。
4.1. miR-21与胰腺癌的诊断
Kong[39]等用实时定量PCR检测了35例胰腺导管腺癌、15例慢性胰腺炎和15例正常人血清miRNA表达情况,结果显示血清miR-21可以区别胰腺癌患者和正常人。由于miR-21在几乎所有的实体肿瘤中都高表达,因此单独应用miR-21作为胰腺癌诊断的标志物缺乏特异性。但有研究显示miR-21的表达水平与胰腺癌术前血清CA-199的水平直接相关[40]。联合传统的胰腺癌诊断标志物CA-199可以提高胰腺癌早期诊断的敏感性和特异性。目前,很多学者都致力于寻找可应用与早期诊断的胰腺癌特异性的miRNA表达谱,miR-21同样是其中不可缺少的miRNA. Rui Liu[41]等人收集197例胰腺癌病人的血清样本和158例正常人血清样本作为对照,筛选出7种在胰腺癌中差异表达的,其中包括miR-21。7种miRNA组成的表达谱作为胰腺癌诊断标志物在区别不同阶段胰腺癌病人和非癌症人上具有高度敏感性和特异性,并且能够正确区分胰腺癌和慢性胰腺炎的病人。
4.2. miR-21与胰腺癌的治疗
胰腺癌除了外科手术治疗,化疗也是临床常用的主要治疗手段。因此,预测化疗反应尤为重要。近期众多研究显示miRNA在胰腺癌抗药性方面起一定的作用。研究证实miR-21在胰腺癌细胞中能够诱导对化疗药吉西他滨的化疗抵抗,miR-21可以作为胰腺癌化疗抵抗的生物标志物。另有研究尝试通过降低miR-21的表达来调控胰腺癌对吉西他滨的药物抵抗——吉西他滨抵抗的胰腺癌细胞经姜黄素类似物处理以后miR-21表达下调,从而提高了吉西他滨的作用敏感性[42];Jong-Kook Park[43]等研究发现使用反义寡聚核苷酸来抑制miR-21的表达可减少胰腺癌细胞增殖、阻滞细胞周期、诱导肿瘤细胞凋亡,并且可增强吉西他滨对胰腺癌的作用敏感性。另外为了探讨5-氟尿嘧啶(5-FU)抗药性的机制以及miR-21在抗药性方面的作用,有研究反义抑制药物敏感细胞和抗药性细胞中miR-21的表达从而引起5-FU活性的增加[44]。miR-21前体转染可显著降低抗肿瘤药物的药效并且显著减低胞苷所诱导的细胞凋亡,而基质金蛋白酶MMP-2/MMP-9及血管内皮生长因子的表达明显上调。添加肌醇磷脂3激酶和抗真菌类抗生素后可减低磷酸化AKt的水平,显著改善miR-21前体所诱导的对抗癌药物的抗药性[45]。影响肿瘤细胞侵袭及转移的因素如细胞凋亡程序的调整,蛋白激酶的磷酸化,基因表达的改变共同参与了miR-21在胞苷抗药性中的作用,这些发现为胰腺癌靶向联合治疗提供了新的方法。
4.3. miR-21与胰腺癌的预后
miR-21是目前研究较多的可能与胰腺癌预后密切相关的miRNA。无论在转移的癌组织还是癌旁组织中,MiR-21高表达的胰腺癌病人的总体生存率明显降低,说明miR-21高表达与预后差密切相关[44,45]。Dillhoff[46]等在胰腺癌研究中用原位杂交的方法证实miR-21的表达与肿瘤大小、分化、淋巴结转移及T分期无关,但是在无淋巴结肿大的亚组分析中,miR-21高表达则提示预后较差。Ioannis[47]等采用RT-PCR检测了88例胰腺导管腺癌病人及98例正常对照的胰腺组织样中miR-21,miR-31,miR-122,miR-145,miR-155,miR-146a,miR-210,and miR-222的表达,经统计分析发现miR-21和miR-155与肿瘤分期和预后差密切相关,并且存在高表达组的胰腺癌病人总体生存率显著低于低表达组,并指出miR-21和miR-155可以作为判断预后的独立因素。
5. miR-21在胰腺癌研究中存在问题
虽然近几年miR-21在胰腺癌研究方面取得了一定的进展,但总体来看尚处于初步阶段。
一方面,miR-21靶基因众多。几项研究运用计算法预测miR-21的可能靶mRNA有数百种[48],其中通过实验研究证实的仅占少数。一种靶基因可受多种miRNA调控,而一种miRNA又可以调控多种靶基因,因此就形成了复杂的调控网络。并且在不同的细胞环境中,一种miRNA可能依赖一组特定的有效的靶mRNA调控不同的信号通路,从而引起不同的表型[49]。这就带来了以下几个问题:一是实验技术方法上如何简单有效的识别miR-21在胰腺癌发生发展中起关键作用的特异性的靶基因。二是给探讨其在肿瘤发生发展过程中的作用机制带来了很大的困难。因为miRNA可以调控mRNA稳定性及其翻译生产蛋白质,因此miR-21靶基因可以通过其mRNA和表达受miR-21影响的蛋白质来识别。目前多采用mRNA表达分析和蛋白组学的方法来识别miR-21的靶基因,两种方法各有利弊。
另一方面,miR-21在众多疾病包括肿瘤、心血管疾病、免疫系统疾病等发生发展过程中都存在异常表达,而且在众多肿瘤包括胰腺癌中表达上调。单独作为胰腺癌诊断标志物明显缺乏特异性,且没有统一的判断标准,但是联合其他诊断方法或寻找特异性的miRNA表达谱将可能成为今后肿瘤诊断标志物研究方面的新方向,可以作为潜在的临床诊断标志物。miR-21在胰腺癌治疗和判断预后方面具有潜在的临床应用价值,但仍处于初步阶段,还不能广泛应用于临床。
6. 结语
越来越多的研究显示miRNA与肿瘤的发生、发展有着密切的关系,在肿瘤增殖、侵袭和转移中起着重要作用。miR-21是在多种疾病包括肿瘤中起关键作用的一类miRNA。在胰腺癌中miR-21表达上调并伴随其靶基因的相应变化,这不仅为探索胰腺癌的发生发展机制提供新的研究线索,也为胰腺癌诊断、治疗以及判断预后方面提供好的临床思路。
参考文献 (References)
[1] R. C. Lee, R. L. Feinbaum and V. Ambros. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell, 1993, 75: 843-854.
[2] G. A. Calin, C. D. Dumitru, M. Shimizu, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proceedings of the National Academy of Sciences of the USA, 2002, 99: 15524-15529.
[3] Z. Liu, A. Sall and D. Yang. MicroRNA: An emerging therapeutic target and intervention tool. International Journal of Molecular Sciences, 2008, 9: 978-999.
[4] X. Fu, Y. Han, Y. Wu, et al. Prognostic role of microRNA-21 in various carcinomas: A systematic review and meta-analysis. European Journal of Clinical Investigation, 2011, 41(11): 1245-1253.
[5] S. Volinia, G. A. Calin, C. G. Liu, et al. A microRNA expression signature of human solid tumors defines cancer gene targets. Proceedings of the National Academy of Sciences of the USA, 2006, 103: 2257-2261.
[6] Y. Tomimaru, H. Eguchi, H. Nagano, et al. Circulating microRNA-21 as a novel biomarker for hepatocellular carcinoma. Journal of Hepatology, 2012, 56(1): 167-175.
[7] K. E. Resnick, H. Alder, J. P. Hagan, et al. The detection of differentioally expressed microRNAs from the serum of ovarian cancer patients using a novel real-time PCR platform. Gynecologic Oncology, 2009, 112(1): 55-59.
[8] S. Komatsu, D. Ichikawa, H. Takeshita, et al. Circulating microRNAs in plasma of patients with oesophageal squmaous cell carcinoma. British Journal of Cancer, 2011, 105(1): 104-111.
[9] H. Wang, W. Peng, X. Ouyang, et al. Circulating microRNAs as candidate biomarkers in patients with systemic lupus erythematosus. Translational Research, 2012, 160(3): 198-206.
[10] T. Thum, C. Gross, J. Fiedler, et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts. Nature, 2008, 456(7224): 980-984.
[11] C. S. Neal, M. Z. Michael, L. K. Pimlott, et al. Circulating microRNA expression is reduced in chronic kidney disease. Nephrology Dialysis Transplantation, 2011, 26(11): 3794-3802.
[12] I. G. Papaconstantinou, A. Manta, M. Gazouli, et al. Expression of MicroRNAs in patients with pancreatic cancer and its prognostic significance. Pancreas, 2013, 42(1): 67-71.
[13] C.-K. Yu, S.-N. Yu, Z.-H. Lu, et al. Research advances in microRNA in pancreatic ductal adenocarcinoma. Acta Academiae Medicinae Sinicae, 2011, 33(5): 575-581.
[14] X. Cai, C. H. Hagedorn and B. R. Cullen. Human microRNAs are processed from capped, polyadenylated transcripts that can also function as mRNAs. RNA, 2004, 10(12): 1957-1966.
[15] B. Qian, D. Katsaros, L. Lu, M. Preti, A. Durando, R. Arisio, L. Mu and H. Yu. High miR-21 expression in breast cancer associated with poor disease-free survival in early stage disease and high TGF-β1. Breast Cancer Research and Treatment, 2009, 117 (1): 131-140.
[16] S. Fujita, T. Ito, T. Mizutani, S. Minoguchi, N. Yamamichi, K. Sakurai and H. Iba. MiR-21 gene expression triggered by AP-1 is sustained through a double-negative feedback mechanism. Journal of Molecular Biology, 2008, 378: 492-504.
[17] S. D. Selcuklu, M. T. Donoghue and C. Spillane. MiR-21 as a key regulator of oncogenic processes. Biochemical Society Transactions, 2009, 37: 918-925.
[18] M. Krausch, A. Raffel, M. Anlauf, et al. Loss of PTEN expression in neuroendocrine pancreatic tumors. Hormone and Metabolic Research, 2011, 43: 865-871.
[19] A. Sakurada, A. Suzuki, M. Sato, H. Yamakawa, et al. Infrequent genetic alterations of the PTEN/MMAC1 gene in Japanese patients with primary cancers of the breast, lung, pancreas, kidney, and ovary. Japanese Journal of Cancer Research, 1997, 88: 1025- 1028.
[20] M. Escriva, S. Peiro, N. Herranz, et al. Repression of PTEN phosphatase by snail1 transcriptional factor during gamma radiation-induced apoptosis. Molecular and Cellular Biology, 2008, 28: 1528-1540.
[21] M. Krausch, A. Raff el, M. Anlauf, et al. Loss of PTEN expression in neuroendocrine pancreatic tumors. Hormone and Metabolic Research, 2011, 43: 865-871.
[22] X. Xu, B. Ehdaie, N. Ohara, et al. Synergistic action of Smad4 and PTEN in suppressing pancreatic ductal adenocarcinoma formation in mice. Oncogene, 2010, 29: 674-686.
[23] B. Lankat-Buttgereit, R. Goke. The tumour suppressor Pdcd4: Recent advances in the elucidation of function and regulation. Biology of the Cell, 2009, 101: 309-317.
[24] R. Nieves-Alicea, N. H. Colburn, A. M. Simeone, et al. Programmed cell death 4 inhibits breast cancer cell invasion by increasing tissue inhibitor of metalloproteinases-2 expression. Breast Cancer Research and Treatment, 2009, 114: 203-209.
[25] Z. T. Wei, X. Zhang, X. Y. Wang, et al. PDCD4 inhibits the malignnant phenotype of ovarian cancer cells. Cancer Science, 2009, 100: 1408-1413.
[26] I. Bhatti, A. Lee, V. James, et al. Knockdown of microRNA-21 inhibits proliferation and increases cell death by targeting programmed cell death 4 (PDCD4) in pancreatic ductal adenocarcinoma. Journal of Gastrointestinal Surgery, 2011, 15: 199-208.
[27] L. Blavier, P. Henriet, S. Imren, et al. Tissue inhibitors of matrix metalloproteinases in cancer. Annals of the New York Academy of Sciences, 1999, 878: 108-119.
[28] M. Ahonen, M. Poukkula, A. H. Baker, et al. Tissue inhibitor of metalloproteinases-3 induces apoptosis in melanoma cells by stabilization of death receptors. Oncogene, 2003, 22: 2121-2134.
[29] V. Fendrich, E. P. Slater, E. Heinmoller, et al. Alterations of the tissue inhibitor of metalloproteinase-3 (TIMP3) gene in pancreatic adenocarcinomas. Pancreas, 2005, 30: e40-e45.
[30] Y. Nagao, M. Hisaoka, A. Matsuyama, et al. Association of microRNA-21 expression with its targets, PDCD4 and TIMP3, in pancreatic ductal adenocarcinoma. Modern Pathology, 2012, 25 (1):112-121.
[31] R. J. Youle, A. Strasser. The BCL-2 protein family opposing activities that mediate cell death. Nature Reviews Molecular Cell Biology, 2008, 9: 47-59.
[32] D. Chen, X. F. Zheng, D. L. Kang, et al. Apoptosis and expression of the Bcl-2 family of proteins and P53 in human pancreatic ductal adenocarcinoma. Medical Principles and Practice, 2012, 21: 68-73.
[33] F. Meng, R. Henson, H. Wehbe-Janek, et al. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellularcancer. Gastroenterology, 2007, 133: 647-658.
[34] X. Zhou, Y. Ren, L. Moore, et al. Downregulation of miR-21 inhibits EGFR pathway and suppresses the growth of human glioblastoma cells independent of PTEN status. Laboratory Investigation, 2010, 90(2): 144-155.
[35] J. Dong, Y. P. Zhao, L. Zhou, et al. Bcl-2 upregulation induced by miR-21 via a direct interaction is associated with apoptosis and chemoresistance in MIA PaCa-2 pancreatic cancer cells. Archives of Medical Research, 2011, 42: 8-14.
[36] N. S. Wickramasinghe, T. T. Manavalan, S. M. Dougherty, et al. Estradiol downregulates miR-21 expression and increases miR- 21 target gene expression in MCF-7 breast cancer cells. Nucleic Acids Research, 2009, 37: 2584-2595.
[37] X. Zhou, Y. Ren, L. Moore, et al. Downregulation of miR-21 inhibits EGFR pathway and suppresses the growth of human glioblastoma cells independent of PTEN status. Laboratory Investigation, 2010, 90: 144-155.
[38] J. A. Chan, A. M. Krichevsky and K. S. Kosik. MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells. Cancer Research, 2005, 65: 6029-6033.
[39] X. Kong, Y. Du, G. Wang, et al. Detection of differentially expressed microRNAs in serum of pancreatic ductal adenocarcinoma patients: MiR-196a could be a potential marker for poor prognosis. Digestive Diseases and Sciences, 2010, 56(2): 602- 609.
[40] F. Tavano, F. F. di Mola, A. Piepoli, et al. Changes in miR-143 and miR-21 expression and clinic opathologicalcorrelations in pancreatic cancers. Pancreas, 2012, 41(8): 1280-1284.
[41] R. Liu, X. Chen, Y. Q. Du, et al. Serum MicroRNA expression profile as a biomarker in the diagnosis and prognosis of pancreatic cancer. Clinical Chemistry, 2012, 58: 3610-3618.
[42] S. Ali, A. Ahmad, S. Banerjee, et al. Gemcitabine sensitivity can be induced in pancreatic cancer cells through modulation of miR-200 and miR-21 expression by curcumin or its analogue CDF. Cancer Research, 2010, 70: 3606-3617.
[43] J. K. Park, E. J. Lee, C. Esau, et al. Antisense inhibition of microRNA-21 or -221 arrests cell cycle, induces apoptosis, and sensitizes the effects of gemcitabine in pancreatic adenocarcinoma. Pancreas, 2009, 38(7): e190-e199.
[44] J. H. Hwang, J. Voortman, E. Giovannetti, et al. Identification of microRNA-21 as a biomarker for chemoresistance and clinical outcome following adjuvant therapy in resectable pancreatic cancer. PLoS One, 2010, 5(5): e10630.
[45] E. Giovannetti, N. Funel, G. J. Peters, et al. MicroRNA-21 in pancreatic cancer: correlation with clinical outcome and pharmacologic aspects underlying its role in the modulation of gemcitabine activity. Cancer Research, 2010, 70(11): 4528-4538.
[46] M. Dillhoff, J. Liu, Frankel W., et al. MicroRNA-21 is overexpressed in pancreatic cancer and a potential predictor of survival. Journal of Gastrointestinal Surgery, 2008, 12(12): 2171-2176.
[47] I. G. Papaconstantinou, A. Manta, M. Gazouli, et al. Expression of microRNAs in patients with pancreatic cancer and its prognostic significance. Pancreas, 2013, 42(1): 67-71.
[48] A. Grimson, K. K. Farh, W. K. Johnston, et al. MicroRNA targeting specificity in mammals: Determinants beyond seed pairing. Molecular Cell, 2007, 27: 91-105.
[49] A. M. Krichevsky, G. Gabriely. MiR-21: A small multi-faceted RNA. Journal of Cellular and Molecular Medicine, 2009, 13(1): 39-53.