Botanical Research
Vol.2 No.1(2013), Article ID:9287,4 pages DOI:10.12677/BR.2013.21001
Genetic Diversity of Stemona shandongensis Populations*
Forestry College, Shandong Agricultural University, Taian
Email: #zangdk@sdau.edu.cn
Received: Sep. 7th, 2012; revised: Sep. 15th, 2012; accepted: Sep. 28th, 2012
ABSTRACT:
Genetic diversity and genetic structure of 120 individuals of four Stemona shandongensis populations were investigated by AFLP method. A total of 282 bands were observed with 8 primer combination, including 137 polymorphic bands. The percentage of polymorphic bands was 48.58%. In species level, Nei’s gene diversity index was 0.1441; Shannon’s information index was 0.2485; total gene diversity was 0.1646; population gene diversity was 0.1682, gene differentiation coefficient was 0.0210. UPGMA cluster based on AFLP makers was similar to the cluster based on morphological traits; there was no significant correlation between genetic distance and geographic distance. The results showed that there was genetic differentiation among populations, and it could express by morphological characteristics.
Keywords: AFLP; Stemona shandongensis; Genetic Diversity; Population
山东百部遗传多样性分析*
张 雷,马 燕,臧德奎#
山东农业大学林学院,泰安
Email: #zangdk@sdau.edu.cn
摘 要:
利用AFLP分子标记技术对山东百部4个居群120个样品进行了遗传多样性分析。8对引物组合共扩增出282条清晰可辨条带,其中多态性条带137条,多态性位点百分率48.58%;在种级水平上,Nei’s基因多样性指数为0.1441,Shannon多态性信息指数为0.2485;居群总遗传多样性(Ht)为0.1646,居群内遗传多样性为0.1682,基因分化系数为0.0210。UPGMA聚类表明,AFLP聚类结果与表型分化聚类结果一致,居群间具有一定程度的遗传分化,并通过表型性状表现出来。
收稿日期:2012年9月7日;修回日期:2012年9月15日;录用日期:2012年9月28日
关键词:AFLP;山东百部;遗传多样性;居群
1. 引言
山东百部(Stemona shandongensis)为百部科百部属植物,与直立百部(S. sessilifolia)和蔓生百部(S. japonica)近缘,产于山东中部低山丘陵[1-3],分布区狭窄且受人为干扰严重,已处于濒危状态,应及时采取措施加以保护。因此,开展山东百部的保护生物学研究已极为迫切。分子标记技术已广泛应用于植物居群的遗传结构和遗传多样性分析[4-10]。本研究拟采用AFLP分子标记,以居群为单位,通过分析山东百部的遗传多样性水平和遗传结构,探讨影响其遗传多样性和遗传结构的因素,分析濒危原因,并提出保护策略。
2. 材料与方法
2.1. 取样方法
选取济南莲台山、泰山三阳观、淄博大贤山和淄博唐山4个保存相对完整的居群,每个居群内随机选取30个样品,居群内个体间的采样间距在30 m以上以最大限度降低植株间的亲缘关系,保证取样均匀性。选择生长正常,无病虫害的单株,采其新鲜叶片迅速放入装有变色硅胶的封口袋中进行快速干燥,用于DNA提取。
2.2. 实验方法
2.2.1. 总DNA制备
采用改进的CTAB法[11]从硅胶干燥的幼叶中提取总DNA。
2.2.2. AFLP分析
利用北京鼎国生物技术公司的试剂盒及其操作指南进行。各样品基因组DNA的酶切和接头的连接在同一反应中进行。20 μL反应体系中含有DNA模板4 μL(50 ng·μL–1),Adapter 1 μL,EcoR I/Mse I (4 U·μL–1)2 μL,10 × Reaction buffer 2.5 μL,ATP(10 mmol·L–1)2.5 μL,4 Ligase(4 U·μL–1)1 μL,AFLPWater 7 μL。将上述混合液在0.5 mL离心管中混匀离心数秒,37℃保温5 h,8℃保温4 h,4℃过夜。
预扩增反应体系为25 μL。含Pre-ampmix 1 μL,dNTPs 1 μL,10 × PCR buffer 2.5 μL,Taq DNA polymerase(2 U·μL–1)0.5 μL,AFLP-Water 18 μL。预扩增反应程序为:94℃变性2 min;94℃变性30 s,56℃复性30 s,72℃延伸80 s,循环30轮;72℃延伸5 min。预扩增产物稀释20倍,–20℃保存备用。
选择性扩增反应用荧光标记的经过筛选的8对引物(表1)进行选择性扩增。反应体系为25 μL,含预扩增稀释样品2 μL,dNTPs 2.5 μL,10 × PCR buffer 0.5 μL,EcoR I引物1 μL,Mse I引物(荧光标记)1 μL,TaqDNA polymease(2 U·μL–1)0.5 μL,AFLP-Water 17.5 μL。
选择性扩增PCR扩增程序按下列参数PCR循环:94℃ 2 min;一轮扩增参数:94℃ 30 s,65℃ 30 s,72℃ 80 s;以后每轮循环退火温度递减0.7℃或1℃,扩增12轮;接着按下列参数扩增23轮:94℃ 30 s,55℃ 30 s,72℃ 80 s;最后延伸72℃ 5 min。
2.3. 数据处理
取选择性扩增后的样品在ABI 377自动测序仪上电泳分离检测,得到AFLP的DNA指纹图谱。利用GeneScan 3.1软件将8对荧光引物产生的电泳胶图转换为(0,1)矩阵。根据PCR扩增的结果,有带计为1,无带则计为0。用POPGENE version 1.32软件[12]计算多态性带数、多态性位点百分率(%)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shannon多态性信息指数(I)、总遗传多样性(Ht)、居群内遗传多样性(Hs)、基因分化系数(Gst)、Nei’s遗传一致度(IN)、遗传距离(D)等遗传多样性参数,用NTSYS2.10软件[13,14]对4个居群进行非加权算术平均法聚类UPGMA。
3. 结果与分析
3.1. 山东百部的遗传多样性
筛选出8对扩增多态性较高、且带形清晰的引物组合,扩增后得到282条清晰可辨条带,其中多态性条带137条(图1),多态性位点百分率为48.5816%,平均每对引物扩增出35.25条带,其中17.125条具有多态性。同一引物组合所检测不同位点的遗传多样性程度存在较大的差异(表1)。扩增带数最多的引物是E-AGC/M-CAA,为47条,带数最少的是引物E-AGG/M-CAC,为23条;多态性检出率最高的是E-ACA/M-CTC,多态率达59.0909%,多态性检出率最低的是E-ACA/M-CAG,多态率为37.0370%。
8对引物组合所检测位点的有效等位基因数的范围为1.1137~1.2104;Nei’s基因多样性变异范围为0.0738~ 0.1319;Shannon信息指数的变异范围为0.1203~ 0.2099(表2)。表明山东百部不同样品间AFLP分子标记多态性较高,存在较为丰富的遗传多样性。
多态位点百分率(P)是分子标记中广泛应用的多样性指标。山东百部在物种水平的多态位点百分率为93.98%,而4个居群的多态位点百分率排序为唐山居群(POP4)< 三阳观居群(POP2) < 大贤山居群(POP3) < 莲台山居群(POP1)(表3)。Shannon信息指数(I)和Nei’s基因多样性指数(H)结果则显示,莲台山居群最高,三阳观居群最低,4个居群的排序为三阳观(POP2) < 唐山(POP4) < 大贤山(POP3) < 莲台山(POP1)。
山东百部居群总遗传多样性(Ht)为0.1682,居群
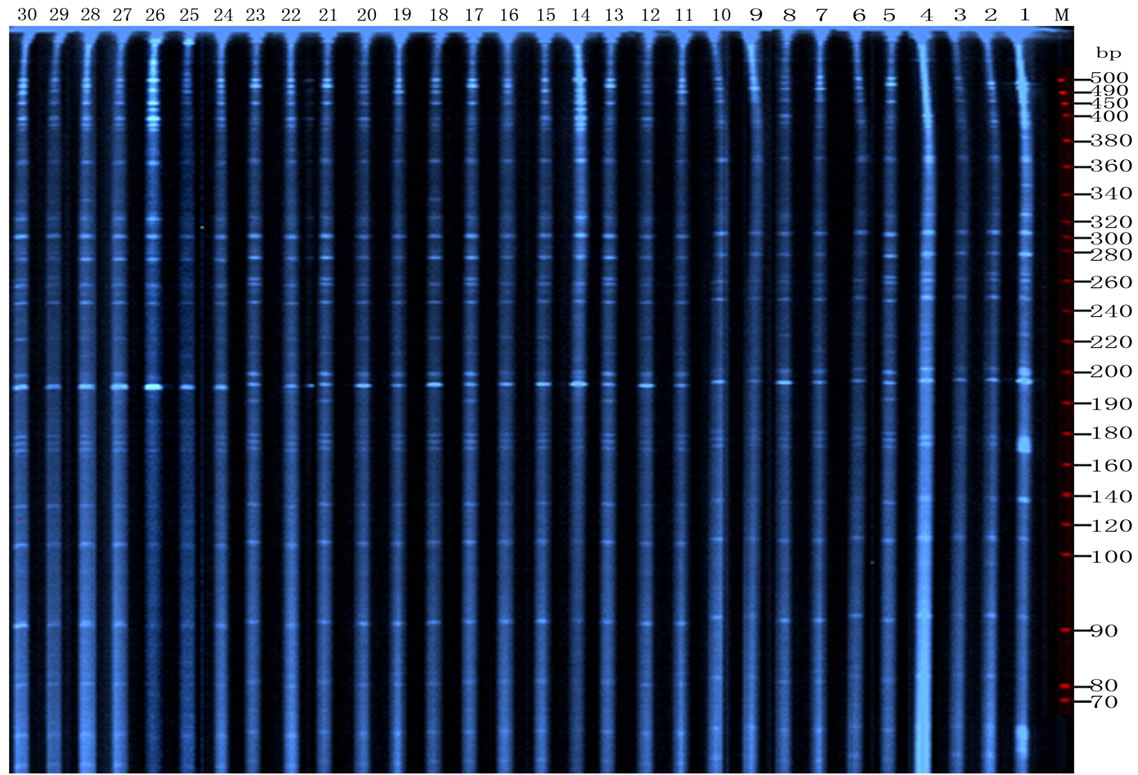
Figure 1. AFLP fingerprinting patterns of Liantaishan S. shandongensis population using the primer combination E-ACA/ M-CTC
图1. 利用E-ACA/ M-CTC引物组合对山东百部莲台山居群的AFLP扩增图谱
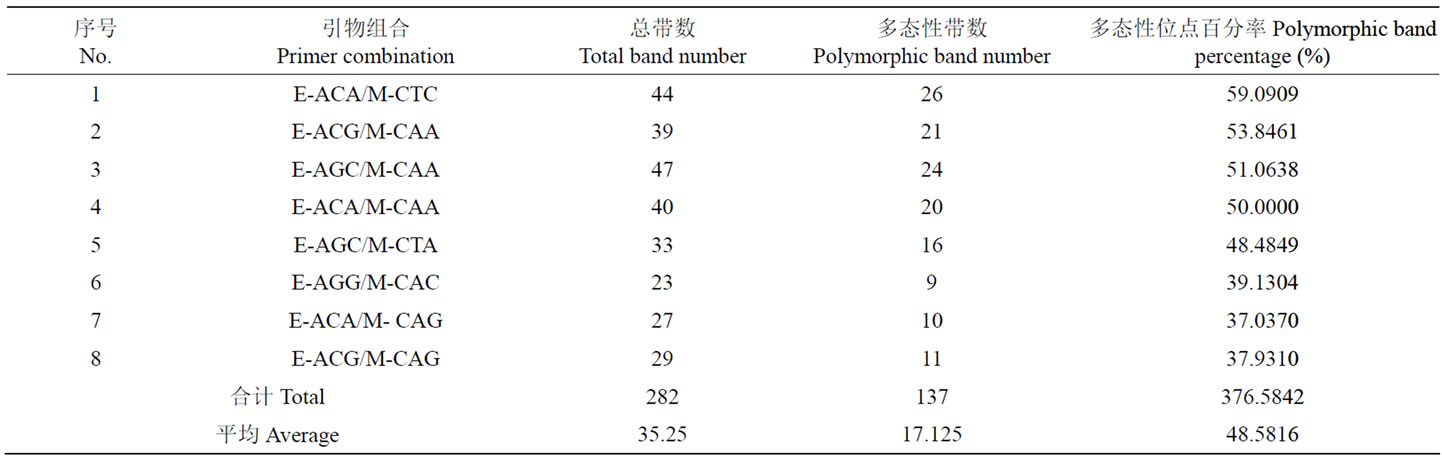
Table 1. Polymorphism of AFLP bands obtained by selective amplification based on the eight primer-combinations
表1. AFLP选择性扩增引物产生的条带多态性
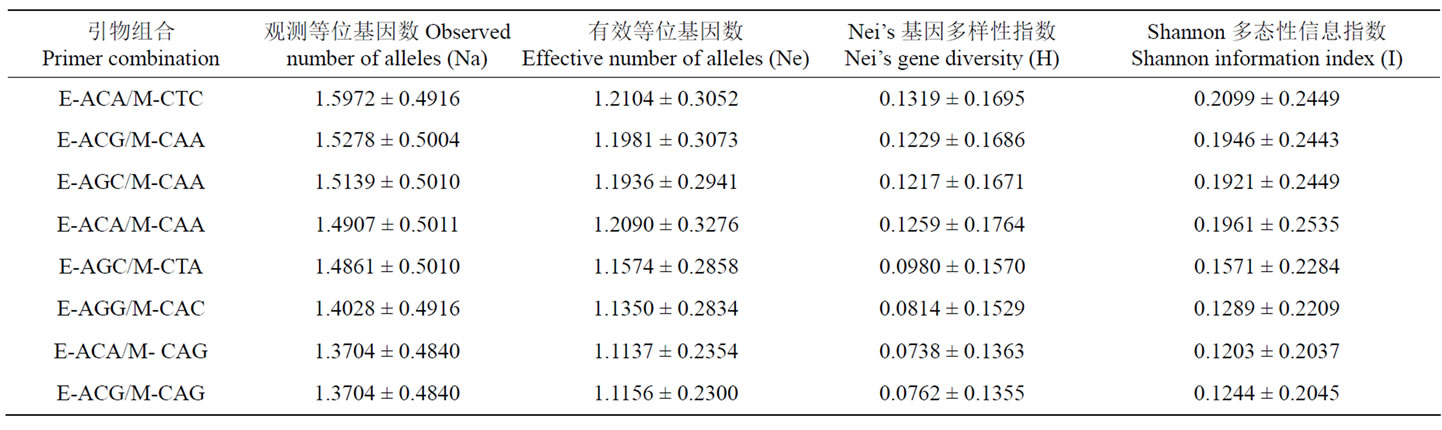
Table 2. Estimates of genetic diversity of S. shandongensis populations (Mean ± SD)
表2. 山东百部遗传多样性各度量指标(平均值 ± 标准差)
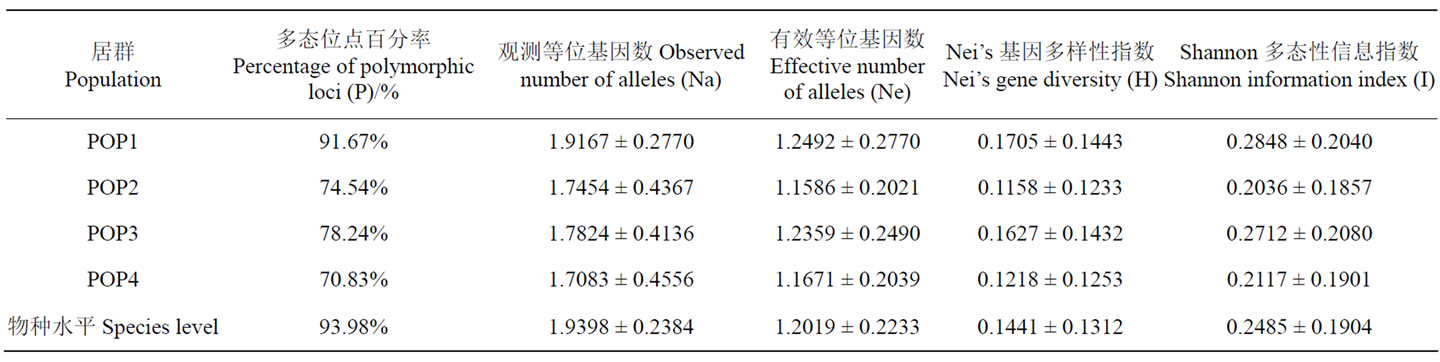
Table 3. Genetic diversity of four S. shandongensis populations detected by AFLP (Mean ± SD)
表3. AFLP检测山东百部4个居群遗传多样性水平(均值 ± 标准差)
内遗传多样性(Hs)为0.1646。根据总遗传多样性(Ht)和居群内遗传多样性(Hs)计算不同居群间的遗传分化水平,基因分化系数(Gst) 0.0210,即表明总的遗传变异中只有2.10%的变异存在居群间。
3.2. 居群间遗传一致度和UPGMA聚类分析
对山东百部居群Nei’s遗传一致度(IN)和遗传距离(D)进行计算,结果表明居群遗传一致度0.9926~ 0.9969,遗传距离0.0031~0.0074(表4),说明居群间的相似程度较高,遗传距离较小。莲台山(POP1)和三阳观(POP2)遗传相似性最高、遗传距离最小,而莲台山(POP1)和大贤山(POP3)遗传相似性最低、遗传距离最大。根据Nei’s遗传一致度进行UPGMA聚类(图2) 显示,莲台山(POP1)和三阳观(POP2)首先聚为一类,然后与大贤山(POP3)聚为一类,而唐山居群(POP4)单独聚为一类。
4. 讨论
遗传变异和环境之间的关系一直是植物居群遗传学研究中普遍关注的问题。山东百部4个居群除地理和气候差异外,依存的群落类型各不相同,济南莲台山为于黄栌、黄榆混交林,泰安三阳观为麻栎、栓皮栎混交林,淄博大贤山为侧柏疏林,而淄博唐山为刺槐疏林[15]。洪锐民认为通过无性繁殖的植物并不比有性繁殖的植物可遗传变异少,无性繁殖的植物通常在居群内和居群间能保持相当大的变异,环境异质性可能在构建无性繁殖植物居群变异中起重要作用[16]。山东百部既可进行有性繁殖,也可无性繁殖,从其分布特点[17]推断,居群遗传分化主要取决于生境的异质性。
山东百部居群间的AFLP聚类结果与表型分化聚
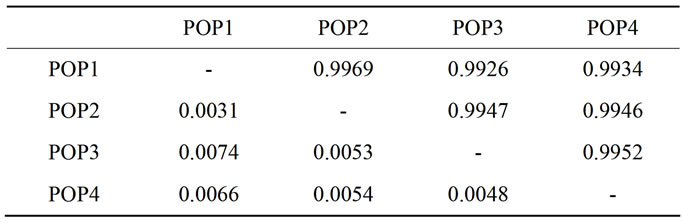
Table 4. Genetic distance between populations of S. shandongensis
表4. 山东百部居群间遗传一致度和遗传距离分析
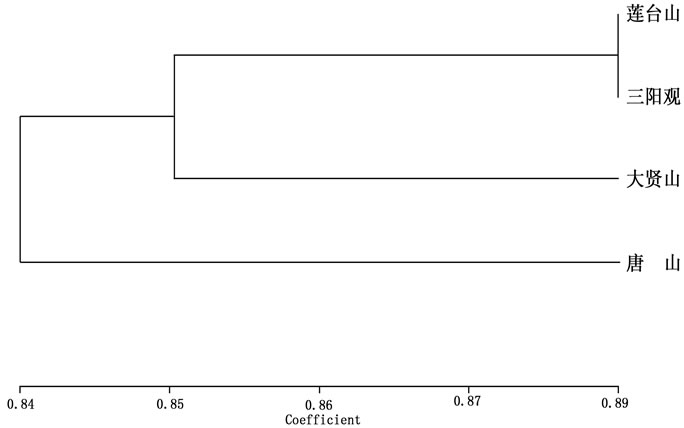
Figure 2. UPGMA cluster of four S. shandongensis populations based on AFLP makers
图2. 山东百部4个居群基于AFLP分析的UPGMA聚类结果
类结果[15]一致,表明由于地理隔离,山东百部通过对不同环境长期适应产生了遗传分化,并通过表型性状表达出来。虽然地理距离近的居群能聚类在一起(莲台山和三阳观),但也出现例外(唐山单独聚为一类),这说明居群间遗传分化并非由单一因子影响,应该是多因子综合作用的结果。
山东百部居群面积较小,分布区内人为活动频繁,居群片断化趋势明显,若不能有效控制将导致遗传多样性的丧失[18]。因此在保护策略上首应当保护其自然分布区的生境,特别是一些特殊生境的个体。对于分布集中的区域进行封育性保护,减少人为活动干扰,逐步恢复其居群个体数量。
参考文献 (References)
[1] 臧得奎, 彭卫东. 百部属一新种[J]. 植物研究, 1996, 16(4): 413-414.
[2] Z.-H. Ji, B. E. Duyfjes. E. stemona. In: Z. Y. Wu, P. H. Raven and D. Y. Hong, Eds., Flora of China, Beijing: Science Press, St. Louis: MBG Press, 2000, 24: 70-72.
[3] 李法曾, 赵遵田, 樊守金. 山东植物精要[M]. 北京: 科学出版社, 2004.
[4] 白音, 包英华, 王文权等. 国产石斛属植物亲缘关系的AFLP分析[J]. 园艺学报, 2007, 34(6): 1569-1574.
[5] 甘娜, 谭向红, 陈其兵等. 应用RAPD标记和细胞质基因组PCR-RFLP技术研究大花蕙兰的遗传多样性[J]. 园艺学报, 2006, 33(2): 349-355.
[6] 张春雨, 陈学森, 何天明. Genetic structure of Malus sieversii population from Xinjiang, China, revealed by SSR markers [J]. 遗传学报, 2007, 34(10): 947-955.
[7] 赵庆芳, 李巧峡, 马世荣等. 青藏高原东部矮生嵩草遗传多样性的RAPD研究[J]. 生态学报, 2006, 26(8): 2494-2501.
[8] 易杨杰, 张新全, 黄琳凯等. 野生狗牙根种质遗传多样性的SRAP研究[J]. 遗传, 2008, 30(1): 94-100.
[9] 陈良华, 胡庭兴, 张帆等. 用AFLP技术分析四川核桃资源的遗传多样性[J]. 植物生态学报, 2008, 32(6): 1326-1372.
[10] 黄久香, 黄妃本, 许涵等. 海南岛青梅AFLP标记的遗传多样性[J]. 林业科学, 2008, 44(5): 46-52.
[11] G. S. H. Fang, R. Grumet. A quick and inexpensive method for removing polysaccharides from plant genomic DNA. Biotechniques, 1992, 13: 52-57.
[12] F. C. Yeh, R. C. Yang and T. Boyle. POPGENE, microsoft windows-based freeware for population genetic analysis release 1.31. Edmonton: University of Alberta, 1999.
[13] M. Nei, W. H. Li. Mathematical model for studying genetic variation interims of restriction Endonucleases. Proceeding of the National Academy Sciences of the United States of the America, 1979, 76: 5269-5273.
[14] F. J. Rohlf. NTSYS pc2.1: Numerical taxonomy and multivariate analysis system version 2.1. New York: Applied Biostatistics Inc., 2000. http:∥www.exetersoftware.com/cat/ntsyspc/ntsyspc.html.
[15] 张雷, 邱乾栋, 臧德奎. 山东百部的表型分化研究[J]. 山东林业科技, 2009, 5: 29-32.
[16] 洪锐民, 王昱生, 杨建华. 羊草(Leymus chinensis)等植物居群克隆表型变异和遗传变异的分子遗传–生态学分析[J]. 东北农业大学学报, 2001, 32(4): 313-319.
[17] 张雷, 邱乾栋, 臧德奎. 山东百部居群的空间分布格局[J]. 武汉植物学研究, 2009, 27(6): 617-621.
[18] Y. Naito, A. Konuma, H. Iwata, Y. Suyama, K. Seiwa, T. Okuda, S. L. Lee, N. Muhammad and Y. Tsumura. Self and inbreeding depression in seeds and seedlings of Neobalanocarpus heimii (Dipterocarpaceae). Journal of Plant Research, 2005, 118: 423- 430.
NOTES
*基金项目:山东省自然科学基金(Y2006D12);山东省农业良种工程重大课题(鲁农良字[2010]6号)。
*通讯作者。