Journal of Organic Chemistry Research
Vol.1 No.3(2013), Article ID:12651,3 pages DOI:10.12677/JOCR.2013.13003
Uncatalyst and Solvent-Free Knoevenagel Condensation Reaction at Room Temperature*
The Key Laboratory of Functional Molecular Solids Ministry of Education, College of Chemistry and Materials Science, Anhui Normal University, Wuhu
Email: xinweihe@mail.ahnu.edu.cn, #shyj@mail.ahnu.edu.cn
Received: Sep. 23rd, 2013; revised: Oct. 3rd, 2013; accepted: Oct. 8th, 2013
Copyright © 2013 Xinwei He et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
ABSTRACT:
This paper reported the solvent-free Knoevenagel condensation of aromatic aldehydes and malononitrile at room temperature without catalyst, a series of benzylidene compounds were synthesized in high yields. Structure of all compounds was analyzed by 1HNMR, 13CNMR, and IR. The results showed that this method has advantages of mild reaction conditions and that the operation is simple, convenient post-processing, high yield, and friendly to environment.
Keywords: Knoevenagel; Malononitrile; Condensation Reactions; Aromatic Aldehydes; Solvent-Free Reaction
室温无溶剂无催化剂下的Knoevenagel缩合反应研究*
何心伟,朱东盛,蒋 畅,商永嘉#
安徽师范大学,化学与材料科学学院,功能分子固体教育部重点实验室,芜湖
Email: xinweihe@mail.ahnu.edu.cn, #shyj@mail.ahnu.edu.cn
摘 要:
本文报道了芳香醛和丙二腈在室温无催化剂无溶剂下的Knoevenagel缩合反应,合成了系列苄叉基化合物,产率良好,并利用1HNMR和13CNMR等对合成的化合物结构进行了表征。结果表明,该方法没有使用催化剂和有毒有害的有机溶剂,具有反应条件温和,实验操作及产物后处理简单,产率高,对环境无污染等优点。
收稿日期:2013年9月23日;修回日期:2013年10月3日;录用日期:2013年10月8日
关键词:Knoevenagel;丙二腈;缩合反应;芳香醛;无溶剂反应
1. 引言
Knoevenagel缩合反应是羰基化合物与活性亚甲基化合物的脱水缩合反应,用于碳碳双键的形成,能够直接合成大量有用的化合物,在工业、农业、药业及生物科学等诸多领域有着广泛的应用。此类反应一般是用Lewis酸或碱为催化剂,如:ZnCl2[1]、KF[2]、Zn(OAc)2[3]、碱性氧化铝-醋酸铵[4]、N-甲基吡啶[5]等,在液相中,特别是在有机溶剂中通过加热来进行。传统的酸或碱催化的醛与活泼亚甲基之间的Knoevenagel缩合反应时间长,副反应多,后处理过程繁琐[6],且由于挥发性有机溶剂的使用而对环境带来负面影响。因此,近年来,实现对环境友好的有机合成,已成为有机化学工作者迫切需要研究的课题。
随着新技术、新试剂及新体系的引入,人们对这类缩合反应进行了广泛研究,也有了许多新的成果。尤其是随着人们人类生存环境的日益重视,涌现了许多对环境无污染的绿色合成工艺,如无溶剂反应[7]、以水[8]或用室温离子液体[9,10]作反应溶剂及微波技术应用等[11]。无溶剂反应不仅可以很好的在玻璃仪器中进行,而且固相体系亦可以在研磨条件下进行有机化学反应,可从根本上避免大量毒害性和挥发性有机溶剂的使用,从而减少了污染,简化了反应操作和后处理过程,降低了反应成本。在无溶剂条件下的化学反应中,不少反应表现出较高的化学选择性和立体选择性。作为实现绿色化学的手段之一,无溶剂反应以其安全简便、反应迅速、产品易纯化、产率高等诸多优点,已日益引起各国化学工作者的重视,并逐渐成为化学化工领域研究的热点之一。
我们的研究发现,室温、无溶剂无催化剂条件下,活性高的芳香醛即能够与活泼亚甲基化合物如丙二腈或氰基乙酸乙酯进行Knoevenagel缩合,反应均能获得良好以上收率。反应条件温和,后处理简单,没有使用催化剂和有毒有害的有机溶剂,符合绿色化学反应的要求。
2. 实验方法
2.1. 仪器与试剂
化合物熔点在XT4A显微熔点测定仪上测定,温度计未经校正;1HNMR (300 MHz)和13CNMR (75 MHz)由Bruker Avance 300 MHz型核磁共振仪测定,CDCl3作溶剂,TMS作内标;FT-IR8400S型红外光谱仪(KBr压片);所用试剂均为分析纯(可直接使用)。
2.2. 芳醛与活泼亚甲基化合物的无溶剂缩合
将称好的芳香醛(10 mmol)和丙二腈(10 mmol)加于25 mL的圆底烧瓶或小烧杯中,室温下搅拌,不断用玻璃棒将分散的固体聚拢,TLC跟踪,反应完毕后,将得到的固体用水或冷的无水乙醇洗涤,可除去少量未反应的原料和副产物,抽滤,干燥,无需重结晶即可得到纯的产物3a~3r。
合成的18个化合物中,除3j~3l,3o~3r是未见报道的新物质外,其他的缩合产物皆为已知化合物,通过测熔点和1HNMR或13CNMR并与文献值[2,15,16]相比较即能确定产物的结构。对于3j~3l,3o~3r七个新化合物,我们利用1HNMR,13CNMR,IR对其进行了光谱学表征,确证了其结构。
2-(2-Bromobenzylidene) malononitrile (3j):淡黄色固体,产率86%,m.p. 92℃~93℃;1HNMR (300 MHz, CDCl3):δ 8.21 (s, 1H),8.11 (d, J = 7.5, 1H),7.73 (d, J = 7.8, 1H),7.44~7.52 (m, 2H) ppm;13CNMR (75 MHz, CDCl3):δ 158.7,135.0,134.0,130.8,129.8,128.4,126.4,113.2,111.9,85.9 ppm;IR (KBr) ν:2227 (CN) cm−1。
2-(3,4-Dimethoxybenzylidene) malononitrile (3k):黄色固体,产率70%,m.p. 151℃~152℃;1H NMR (300 MHz, CDCl3):δ 7.66 (s, 1H),7.63 (s, 1H),7.37 (d, J = 8.4, 1H),6.95 (t, J = 8.4, 1H),3.97 (s, 3H),3.92 (s, 3H) ppm;13CNMR (75 MHz, CDCl3):δ 159.1,154.8,149.5,129.5,128.9,128.2,124.2,120.6,120.2,114.1,111.0,110.7,78.4,56.3 ppm;IR (KBr) ν:2222 (CN) cm−1。
Ethyl 2-cyano-3-(2-nitrophenyl)acrylate (3l):白色固体,产率83%,m.p. 104℃~105℃;1HNMR (300 MHz, CDCl3):δ 8.72 (s, 1H),8.28 (d, J = 7.8, 1H),7.81~7.85 (m, 1H),7.71~7.74 (m, 1H),4.43 (q, J = 7.2, 2H),1.41 (t, J = 7.2, 3H) ppm;13CNMR (75 MHz, CDCl3):δ 161.5,153.1,147.8,134.5,132.1,130.6,128.1,125.4,113.9,108.6,63.1,14.1 ppm;IR (KBr) ν:2229 (CN),1724 (C = O) cm−1。
2-(2-Hydroxybenzylidene)malononitrile (5a):淡黄色固体,产率80%,m.p. 151℃~152℃;1HNMR (300 MHz, DMSO-d6):δ 7.49 (s, 1H),7.47,(s, 1H),7.44 (d, J = 7.8, 1H),7.40 (t, J = 7.4, 1H),7.24 (t, J = 7.4, 1H),7.10 (d, J = 7.8, 1H) ppm;13CNMR (75 MHz, DMSO-d6):δ 163.9,150.1,130.6,129.2,125.4,119.8,118.3,116.8,113.5,113.3,85.7 ppm;IR (KBr) ν:3334 (OH),2194 (CN) cm−1。
2-(5-Bromo-2-hydroxybenzylidene) malononitrile (5b):淡黄色固体,产率89%,m.p. 155℃~157℃;1HNMR (300 MHz, CDCl3):δ 10.92 (s, 1H),9.83 (s, 1H),7.73 (s, 1H),7.60 (d, J = 9.0, 1H),6.89 (d, J = 9.0, 1H) ppm;13CNMR (75 MHz, CDCl3):δ 195.4,160.5,139.7,135.6,129.4,121.7,119.8,111.3,87.5 ppm;IR (KBr) ν:3346 (OH),2189 (CN) cm−1。
2-(5-Chloro-2-hydroxybenzylidene)malononitrile (5c):淡黄色固体,产率86%,m.p. 153℃~154℃;1HNMR (300 MHz, DMSO-d6):δ 8.96 (s, 1H),8.26 (d, J = 8.5, 1H),7.67 (d, J = 9.2, 1H),7.21 (s, 1H),5.81 (s, 1H) ppm;13CNMR (75 MHz, DMSO-d6):δ 162.1,152.1,148.0,133.9,129.3,129.1,128.7,124.4,115.3,106.2,85.3 ppm;IR (KBr) ν:3307 (OH),2233 (CN) cm−1。
2-(2-Hydroxy-5-nitrobenzylidene)malononitrile (5d):淡黄色固体,产率92%,m.p. 168℃~169℃;1HNMR (300 MHz, DMSO-d6):δ 9.29 (s, 1H),8.48 (s, 1H),8.34 (d, J = 9.03, 1H),7.75 (s, 1H),7.36 (d, J = 9.0, 1H) ppm;13CNMR (75 MHz, DMSO-d6):δ 189.5,163.1,154.5,144.3,129.3,126.2,120.0,119.2,113.2,106.9,87.5 ppm;IR (KBr) ν:3408 (OH),2198 (CN) cm−1。
3. 结果与讨论
首先我们尝试了无溶剂无催化剂下对甲氧基苯甲醛与丙二腈在室温下反应,TLC跟踪发现,2 h反应即可结束,经洗涤即可得到纯的产物。随后,我们考察了底物取代基的电子效应和空间位阻的影响。从表1中我们可以看出,含有吸电子基团(如-NO2,-Cl,-Br)的芳香醛活性较高(Table 1, Entry 3-6, 13,14),有利于缩合反应的进行,产物产率较高(85%-95%)。而含有供电子基团(如-OCH3,-OH)的芳香醛活性偏低(Table 1, Entry 2,8),缩合反应产物产率良好(75%~81%)。同时,取代基的空间位置不同,对缩合反应也有一定影响,对于吸电子基团(如-NO2)而言(Table 1, Entry 4,6, 12-14),取代基空间位阻效应影响不大。当取代基为强供电子基(如-OCH3)时,空间效应影响较大(Table 1, Entry 7),不利于反应的进行,产率较低(75%)。而当苯环中无取代基时(Table 1, Entry 1),与丙二腈在室温下反应很慢,但当反应温度上升至50℃时,反应可以很快进行完全,以80%的产率得到产物,我们认为可能是取代基对该反应的影响。
当把底物换成氰基乙酸乙酯时,该反应也能很好进行,并以较高产率得到产物,我们认为该反应对底物的适用性较高。研究结果表明,底物取代基的空间效应对反应的影响较大,当取代基在邻位时,产率收率较低(78%),而当取代基为其他弱吸电子基或供电子基时(如-Br,-Cl,-OCH3等),反应很难进行,一般需要加热或者加入催化剂才可以得到产物[3,12]。
随后我们考察了水杨醛与丙二腈的Knoevenagel缩合反应,结果表明,水杨醛与丙二腈在室温无溶剂
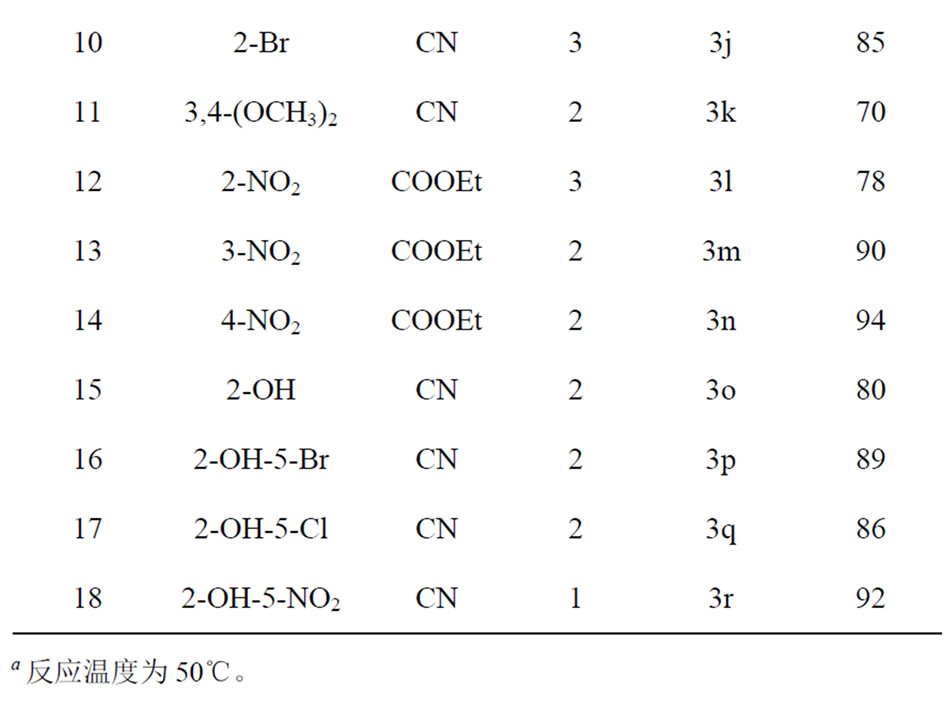
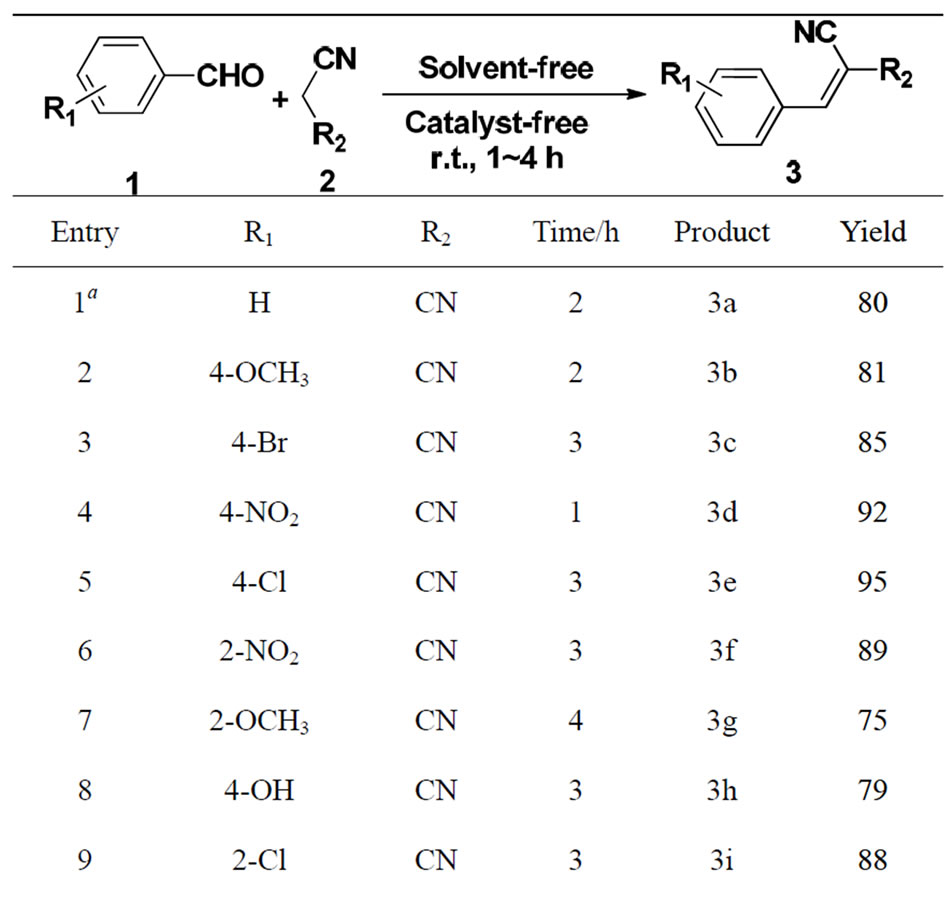
Table 1. Uncatalyst and solvent-free knoevenagel condensation reaction at room temperature
表1. 室温无溶剂下芳香醛与活泼亚甲基化合物的Knoevenagel缩合反应
无催化剂存在下也能很好的发生反应,均以80%以上收率得到产物(Table 1, Entry 15-48)。
通过查阅大量文献[13-16],结合上述研究结果,我们认为无催化剂的Knoevenagel缩合反应在无溶剂条件下的反应可能与在液相中反应的路径不同,普遍被人们接受的酸或碱催化的液相Knoevenagel缩合反应机理可能在无溶剂无催化剂条件下并不适用[12]。因此,无溶剂无催化剂下的Knoevenagel缩合反应的研究工作可能会激发更多的科研工作者阐明固相有机化学反应机理的兴趣。
4. 结论
本文报道了一种无溶剂无催化剂室温下芳香醛与氰基活泼亚甲基化合物的Knoevenagel缩合反应,探讨了底物取代基的电子效应及空间效应对该反应的影响。该反应没有使用催化剂和有毒有害的有机溶剂,具有反应时间短,条件温和,产物纯化处理简单,产率高等优点,符合绿色化学的要求。
参考文献 (References)
[1] Rao, S.P. and Venkataratnam, R.V. (1991) Zinc chloride as a new catalyst for knoevenagel condensation. Tetrahedron Letters, 32, 5821-5822.
[2] 姜恒, 刘雄伟, 宫红 (2007) 室温水介质中氟化钾催化的Knoevenagel反应. 化学研究, 18, 27-29.
[3] 刘雄伟, 姜恒, 宫红 (2007) 室温无溶剂条件下醋酸锌催化的Knoevenagel缩合反应. 有机化学, 27, 131-133.
[4] Balalaie, S. and Nemati, N. (2000) Ammonium acetate-basic alumina catalyzed Knoevenagel condensation under microwave irradiation under solvent-free condition. Synthetic Communications, 30, 869-875.
[5] Mukhopadhyay, C. and Datta, A. (2008) A simple, efficient and green procedure for the Knoevenagel condensation of aldehydes with N-methylpiperazine at room temperature under solvent-free conditions. Synthetic Communications, 38, 2103-2112.
[6] 边延江, 秦英, 肖立伟, 李记太 (2006) Knoevenagel缩合反应研究的新进展. 有机化学, 26, 1165-1172.
[7] 王利民, 盛佳, 张亮, 韩建伟, 樊兆玉, 田禾 (2005) 无溶剂条件下Yb(OTf)3催化的亚甲基化合物和醛的Knoevenagel反应. 有机化学, 25, 964-968.
[8] 程青芳, 许兴友, 马卫兴, 张辉, 刘丽沙, 刘峰, 杨绪杰 (2008) 水介质中无催化剂下醛酮与活泼亚甲基化合物的缩合反应. 有机化学, 28, 1767-1771.
[9] 胡长刚, 陈卓, 董娴, 吴建伟 (2010) 功能化离子液体支载脯氨酸催化的Knoevenagel 缩合反应. 厦门大学学报(自然科学版), 49, 889-892.
[10] Khan, F.A., Dash, J., Satapathy, R. and Upadhyay, S.K. (2004) Hydrotalcite catalysis in ionic liquid medium: A recyclable reaction system for heterogeneous Knoevenagel and nitroaldol condensation. Tetrahedron Letters, 45, 3055-3058.
[11] Li, J.-T., Zang, H.-J., Feng, J.-Y., Li, L.-J. and Li, T.-S. (2001) Synthesis of cinnamic acids catalyzed by expansive graphite under ultrasound. Synthetic Communications, 31, 653-656.
[12] 王官武, 王宝亮 (2004) 微波辐射和加热条件下的无催化剂无溶剂Knoevenagel缩合反应. 有机化学, 24, 85-87.
[13] Harjani, J.R., Nara, S.J. and Salunkhe, M.M. (2002) Lewis acidic ionic liquids for the synthesis of electrophilic alkenes via the Knoevenagel condensation. Tetrahedron Letters, 43, 1127- 1130.
[14] Tran, U.P.N., Le, K.K.A. and Phan, N.T.S. (2011) Expanding applications of metal-organic frameworks: Zeolite imidazolate framework ZIF-8 as an efficient heterogeneous catalyst for the Knoevenagel reaction. ACS Catalysis, 1, 120-127.
[15] Yamashita, K., Tanaka, T. and Hayashi, M. (2005) Use of isopropyl alcohol as a solvent in Ti(O-i-Pr)4-catalyzed Knoevenagel reactions. Tetrahedron, 61, 7981-7985.
[16] 王丽敏, 胡文姬, 皮春燕, 应安国 (2011) 无溶剂条件下DBU催化Knoevenagel缩合反应的研究. 精细与专用化学品, 19, 16-21.
NOTES
*基金项目:国家自然科学基金(No.21172001, 21372008);教育部新世纪优秀人才计划(No. NCET-10-0004)和安徽省自然科学基金(No. 1308085QB39)资助项目。
#通讯作者。