Material Sciences
Vol.
10
No.
02
(
2020
), Article ID:
34150
,
9
pages
10.12677/MS.2020.102010
Progress of Nanomaterials Regulating Tumor-Associated Macrophages for Tumor Immunotherapy
Rui Xu, Chenguang Liu*
Ocean University of China, Qingdao Shandong

Received: Jan. 16th, 2020; accepted: Feb. 3rd, 2020; published: Feb. 10th, 2020

ABSTRACT
Macrophages derived from bone marrow and tissue resident macrophages, collectively referred to as tumor associated macrophages (TAMs), are present in the tumor microenvironment and have attracted considerable attention in the treatment of tumors. Based on the clarification of the mechanism of TAMs to promote tumor growth, this article summarizes the mechanism of action and treatment strategies of targeted TAMs and focuses on how nanomedicine carriers can target tumor immunotherapy through targeted TAMs regulation. Nanodrug carriers have an antitumor effect mainly by preventing the survival of TAMs or disrupting their signal cascades, reducing the recruitment of TAMs to tumors, and reversing the tumor promoting M2 type TAMs to the antitumor type M1. The above content shows that, due to their different physical and chemical properties, nanomaterials can target TAMs and regulate TAMs in a number of ways to enhance the antitumor immune response, which has very good prospects for growth in immunotherapy.
Keywords:Tumor-Associated Macrophage, Nano-Drug Carrier, Phenotypic Polarization

纳米材料调控肿瘤相关巨噬细胞进行肿瘤免疫治疗的研究进展
徐睿,刘晨光*
中国海洋大学,山东 青岛

收稿日期:2020年1月16日;录用日期:2020年2月3日;发布日期:2020年2月10日

摘 要
骨髓源巨噬细胞和组织常驻巨噬细胞,统称为肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs),存在于肿瘤微环境中,在肿瘤治疗方面备受关注。本文在阐明TAMs促肿瘤生长机制的基础上,总结了靶向TAMs的作用机制和治疗策略,重点介绍了纳米药物载体如何通过靶向调控TAMs进行肿瘤的免疫治疗。纳米药物载体主要通过阻断TAMs的存活或影响其信号级联、限制TAMs向肿瘤的募集以及逆转促肿瘤的M2型TAMs至抗肿瘤的M1型发挥抗肿瘤作用。以上内容显示纳米材料由于其特殊的物化性质,能够靶向TAMs,并通过多种途径调控TAMs,增强抗肿瘤免疫反应,具有非常好的免疫治疗的发展前景。
关键词 :肿瘤相关巨噬细胞,纳米材料,表型极化

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肿瘤的发生是机体在致瘤因素的作用下,细胞在基因水平上失去对正常生长的控制而发生异常增殖形成生长物的过程。在肿瘤发生部位,肿瘤细胞与组织周围的成纤维细胞,炎性和免疫细胞,胶质细胞等各种细胞,细胞间质以及浸润的生物分子构成了肿瘤微环境 [1]。肿瘤细胞通过向肿瘤微环境释放细胞外信号分子,增强对微环境中免疫细胞的控制,使免疫细胞由机体防御的“保护者”转变为促进肿瘤细胞生长的“帮凶”。肿瘤相关巨噬细胞(TAMs)是肿瘤微环境的重要组成部分,与肿瘤生长、发展、转移以及手术预后不良有关 [2] [3]。因此靶向调控TAMs,重塑肿瘤微环境成为肿瘤免疫治疗的重要策略。通过了解TAMs在肿瘤生长方面的作用及调控TAMs对肿瘤免疫治疗的积极意义,结合目前针对调控TAMs极化的纳米材料的应用,我们可以有针对性的设计含有特殊配体的纳米材料通过与巨噬细胞膜表面受体的结合从而靶向TAMs,向M1型抗肿瘤方向极化,通过释放炎性分子和效应分子对肿瘤细胞产生毒性作用,启动机体的免疫反应从而达到肿瘤免疫治疗的目的。
2. TAMs特性和极化类型
TAMs的重要特征是可塑性多样性,在多种刺激因素的共同作用下,巨噬细胞的表型和功能会产生一系列的变化,产生巨噬细胞极化的差异状态。巨噬细胞的极化主要分为经典活化途径和替代活化途径,对应的细胞表型为M1型和M2型 [4]。这两种类型的细胞在受体表达,效应功能和信号通路上存在明显差异,所以TAMs是具有双重功能的免疫细胞,且TAMs的极化表型可以互相转化,如图1所示。
M1型巨噬细胞为抗肿瘤表型,一般由脂多糖LPS或干扰素IFN-γ诱导,可以产生大量的炎性细胞因子(TNF-α、IL-12、IL-23等)、趋化因子CXCL和效应分子活性氧(ROS),抗原呈递和吞噬能力增强,表面高表达MHC-Ⅱ类主要组织相容性复合物可有效呈递肿瘤抗原并诱导Th1细胞免疫应答,同时还具有吞噬和杀灭微生物和肿瘤细胞的作用 [5]。
M2型巨噬细胞为促肿瘤表型,主要由白细胞介素IL-4或IL-13诱导形成 [6],低表达白介素IL-12,高表达白介素IL-10和转化生长因子TGF-β,分泌趋化因子配体17 (CCL17),主要参与免疫抑制,血管生成和组织修复等过程,参与肿瘤微环境的组织重塑 [7],刺激肿瘤细胞的迁移和侵袭 [8],促进肿瘤生长发展等过程。

Figure 1. Classification of tumor-related macrophages and expression of related factors
图1. 肿瘤相关巨噬细胞的分型及相关因子表达
3. TAMs促肿瘤生长的作用机制
在肿瘤形成初期,肿瘤微环境中的肿瘤细胞和基质细胞会产生大量的生长因子和趋化因子,这些因子能促进血液循环系统中的单核细胞分化为巨噬细胞,并募集到肿瘤组织,对巨噬细胞募集和分化产生了重要作用 [9],如图2。

Figure 2. Mechanism of TAMs promoting tumor growth and migration
图2. TAMs促肿瘤生长和迁移的机制
3.1. TAMs抑制抗肿瘤免疫反应
TAMs促进肿瘤生长、发展有两个原因 [10] [11]。一方面主要是因为TAMs表达产生大量的表皮生长因子、转化生长因子等,有利于肿瘤细胞生长。另一方面,TAMs抗原呈递作用弱,抗肿瘤免疫效应被抑制。肿瘤组织中M2型巨噬细胞能释放TGF-β和IL-10,抑制单核细胞主要组织相容性复合体MHC-Ⅱ类依赖抗原的呈递,降低T细胞介导的肿瘤细胞毒性,造成肿瘤微环境中的免疫反应被抑制。
3.2. TAMs促血管和淋巴管的生成
当肿瘤产生早期,TAMs表现为M1型;而在肿瘤发育阶段,TAMs受微环境中刺激信号的影响转变为M2型。有研究证明M2型巨噬细胞比例与肿瘤组织血管密度有重要关系 [12],其中血管内皮生长因子(VEGF)在炎症、肿瘤血管和淋巴管生成中发挥重要作用 [13]。TAMs还会产生一系列的基质重塑分子、基质金属蛋白酶等有利于肿瘤细胞周围血管生成 [14]。
3.3. TAMs促进肿瘤侵袭和转移
肿瘤侵袭和转移主要概括为以下过程:① 肿瘤原发灶周围形成新血管;② 肿瘤细胞脱落侵入基质;③ 进入新血管系统并发生黏附;④ 侵入血管外组织;⑤ 适应环境并生长形成肿瘤转移灶。肿瘤侵袭和转移是通过肿瘤细胞合成的趋化因子2 (CCL2)和集落刺激因子-1 (CSF1),靶向TAMs的相关受体以诱导血管通透性来实现的 [15]。组织蛋白酶也是关键的促癌调节因子,能显著增强癌细胞的侵袭性 [16]。
4. 靶向TAMs的肿瘤免疫治疗策略
4.1. 抑制TAMs向肿瘤组织募集
肿瘤形成早期,肿瘤和间质细胞会通过释放趋化因子招募单核细胞并将其转变为TAMs,便于肿瘤的生长。为了减少肿瘤组织周围TAMs的数量,可以通过限制单核细胞向肿瘤组织募集,抑制肿瘤生长。巨噬细胞募集到肿瘤组织是由多种细胞因子介导的,包括血管内皮生长因子(VEGF),该因子主要通过与巨噬细胞上表达的VEGF受体(VEGFR)特异性结合发挥作用,如图3所示。

Figure 3. Inhibition of TAM recruitment to tumor tissues by blocking the binding of VEGF and VEGFR
图3. 通过阻断VEGF与VEGFR的结合抑制TAM向肿瘤组织募集
4.2. 直接靶向杀伤TAMs
鉴于TAMs对肿瘤的生长发挥重要作用,通过靶向杀伤TAMs可以有效地抑制肿瘤发展。曲贝替定是一种海洋来源的DNA粘合剂,它与DNA的小沟结合,除了能够阻断细胞周期还能影响DNA修复通路有关的基因转录,抑制趋化因子和白介素IL-6的产生,选择性地消耗体内单核吞噬细胞 [17],包括TAMs。
4.3. 逆转M2型巨噬细胞极化为M1型
由于TAMs具有异质性和可塑性 [18],极化表型也是不断变化的,因此通过逆转M2型巨噬细胞极化为M1型或减少M2型巨噬细胞的数量是进行肿瘤免疫治疗的重要策略 [19]。如图4,Huang的研究表明阳离子聚合物作为TLR-4配体通过与Toll样受体结合,能激活TLR-4信号通路,特异性分泌白介素IL-12,逆转M2型巨噬细胞向M1表型极化 [20]。目前已有多种以受体-配体特异性亲和的思路设计的纳米材料通过这种治疗策略应用到肿瘤免疫治疗方面。
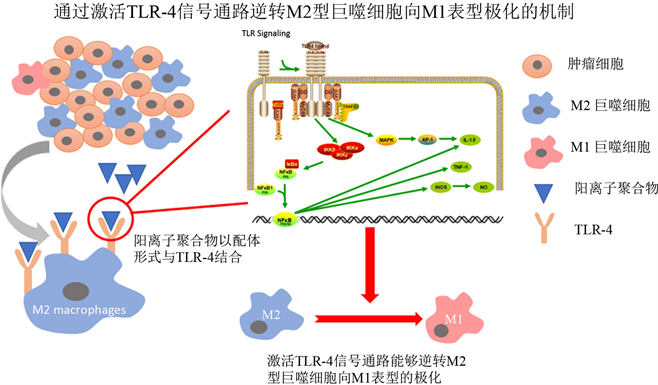
Figure 4. The mechanism of reversing M2 macrophage polarization to M1 type by activating TLR-4 signaling pathway
图4. 通过激活TLR-4信号通路逆转M2型巨噬细胞极化为M1型的机制
5. 调控TAMs的纳米药物载体
巨噬细胞有很强的吞噬能力,可吞噬进入体内的纳米粒。纳米药物载体不仅可以与TAMs细胞膜受体的结合和激活相应蛋白的表达,还能转变TAMs极化表型,在调节生物效应方面发挥积极作用 [21] [22],因此,通过设计靶向并能逆转M2型TAMs的纳米粒或纳米药物载体进行肿瘤免疫治疗,就成为一种有前景的治疗策略。
5.1. 脂质体
脂质体被广泛的用作纳米药物载体,是因为脂质体颗粒生物相容性好,并且可以同时负载亲水和疏水性药物。Cai等人设计负载唑来膦酸ZOL的阳离子脂质体,以Asn-Gly-Arg (NGR)和PEG2000为配体,对表面进行修饰得到阳离子脂质体(NGR-PEG-LP-ZOL),能够清除TAMs,抑制肿瘤血管生成,达到抗肿瘤生长的目的 [23]。利用甘露糖或叶酸受体介导的靶向M2型TAMs,设计合理的靶向给药系统,能进一步增强TAMs的M1型极化。如图5所示,Ye的研究证明甘露糖修饰的脂质体表现出良好的体外细胞内化和肿瘤组织穿透性,提高TAMs表面M1型标志物的表达,促进了M0型和M2型巨噬细胞向M1型的极化 [24]。

Figure 5. Mannose liposomes target mannose on the surface of TAMs to promote polarization of M0/M2 to M1
图5. 甘露糖脂质体靶向结合TAMs表面的甘露糖促进M0/M2型向M1型极化
5.2. 聚合物纳米粒
由于聚合物纳米粒载药量高和易于表面修饰,能有效靶向抗原呈递细胞并促进抗原的加工和呈递,因此它们可用于调节针对抗原的免疫反应。PLGA是生物可降解材料,具有良好的生物相容性、成囊和成膜的性能强,在免疫刺激剂的传递方面也有不可替代的优势。最近有研究新开发了含有黄芩苷的聚PLGA纳米颗粒,其中包含一种抗原肽和一种toll样受体激动剂(CpG),纳米粒用红细胞膜包覆后可以主动靶向TAMs,制备成仿生型纳米颗粒。在体外表现出增强的细胞摄取和体内靶向效应,有效地将TAM表型从M2逆转为M1,进一步改善了肿瘤免疫微环境,在体内T细胞的激活和CTL反应的诱导有效地抑制了黑色素瘤的生长。最终证明靶向TAMs的仿生给药系统具有逆转TAMs表型的潜力,有助于改变肿瘤免疫抑制微环境,促进肿瘤免疫治疗 [25]。
5.3. 纳米氧化铁
研究发现纳米氧化铁(ferumoxytol)与巨噬细胞和癌细胞共培养时,可通过改善肿瘤微环境间接影抑制肿瘤生长。氧化铁纳米粒可以转变巨噬细胞表型,肿瘤组织中促炎M1型巨噬细胞增加,M1型反应相关的mRNA增加,诱发癌细胞凋亡,显著抑制小鼠皮下腺癌的生长,对早期乳腺癌生长和肝癌、肺癌转移有积极的治疗作用 [26]。
为了进一步增强肿瘤免疫治疗效果,Chen采用T细胞激活和巨噬细胞极化的联合用药策略。将氧化铁嵌入有机硅纳米球的孔中制备的氧化铁纳米硅球(IO-LPMONs)如图6所示,纳米硅球的孔内可以高负载卵清蛋白(OVA)抗原,能有效呈递抗原从而激活细胞毒性T细胞,发挥抗肿瘤作用;另一方面,可作为一种免疫调节剂,使TAMs从M2型转变为肿瘤杀伤的M1型,从而诱导肿瘤细胞的有效凋亡 [27]。
5.4. 碳纳米材料
5.4.1. 碳纳米管
碳纳米管(Carbon nanotubes, CNTs)是一种纤维状碳基纳米材料,在药物传递、光热治疗和光动力治疗方面的应用都得到了充分的探索。如图7,Wu的研究发现羧基化的碳纳米管MWCNTs-COOH能够活化TAMs,并进一步解释其使M2型TAMs转变为M1型的机制是激活TLR4/NF-κB信号通路。在Lewis肺癌和黑色素瘤转移模型中,MWCNTs-COOH能够减少肿瘤转移 [28]。

Figure 6. The dual mechanisms of Iron oxide nano-silicon spheres activate T cells and polarize macrophages
图6. 氧化铁纳米硅球激活T细胞和极化巨噬细胞产生双重作用的机制

Figure 7. MWCNTs-COOH reverses M2 macrophages to M1 type by activating TLR4/NF-κB signaling
图7. MWCNTs-COOH通过激活TLR4/NF-κB信号通路逆转M2型巨噬细胞为M1型的机制
5.4.2. 氧化石墨烯
氧化石墨烯(graphene oxide, GO)具有生物相容性好,水分散性好等优点而被广泛应用。Ma等人揭示了GO与质膜之间的尺寸依赖相互作用的机制 [29],粒径大可以有效的被质膜吸附与Toll样受体结合并激活NF-κB途径;而粒径小容易被巨噬细胞摄取。GO颗粒越大,M1极化越严重,诱导M1型巨噬细胞的促炎反应具有粒径依赖性。为了进一步提高肿瘤治疗效果,Wang通过将Fe3O4纳米颗粒(FNPs)与还原氧化石墨烯(rGO)静电相互作用进行杂交,并在表面修饰PEG-NH2制备了一种聚乙二醇化纳米复合材料,通过减少TAMs的数量,从而有效地增强抗肿瘤免疫反应 [30]。
6. 问题与展望
通过纳米材料调控肿瘤相关巨噬细胞用于肿瘤免疫治疗的相关研究近年来迅速增多,同时也存在一系列的问题。第一,利用TAMs表面表达的特异性配体设计TAMs靶向的纳米粒,但是在不同组织和疾病环境中,TAMs的变异类型繁多难以实现靶向;第二,缺乏高特异性的配体区分M2型巨噬细胞和其他巨噬细胞;第三,纳米材料的生物安全性问题是限制其在临床应用的重要因素。针对上述问题,明确不同TAMs表面特异性和表达量高的受体,才能有针对性的设计亲和性高的配体-纳米药物载体,实现特异性靶向调控TAMs。尽管纳米药物载体仍然存在很多缺陷,但是随着纳米技术的发展,纳米药物载体在肿瘤免疫治疗方面会发挥越来越重要的作用。
基金项目
受山东省重点研发项目(2019GSF107031)资助。
文章引用
徐 睿,刘晨光. 纳米材料调控肿瘤相关巨噬细胞进行肿瘤免疫治疗的研究进展
Progress of Nanomaterials Regulating Tumor-Associated Macrophages for Tumor Immunotherapy[J]. 材料科学, 2020, 10(02): 75-83. https://doi.org/10.12677/MS.2020.102010
参考文献
- 1. Kerkar, S.P. and Restifo, N.P. (2012) Cellular Constituents of Immune Escape within the Tumor Microenvironment. Cancer Research, 72, 3125-3130. https://doi.org/10.1158/0008-5472.CAN-11-4094
- 2. Mantovani, A., Marchesi, F., Malesci, A., Laghi, L. and Allavena, P. (2017) Tumor-Associated Macrophages as Treatment Targets in Oncology. Nature Reviews Clinical Oncology, 14, 399-416. https://doi.org/10.1038/nrclinonc.2016.217
- 3. Cannarile, M. A., Ries, C. H., Hoves, S., & Rüttinger, D. (2014) Targeting Tumor-Associated Macrophages in Cancer Therapy and Understanding Their Complexity. Oncoimmunology, 3, Article ID: e955356. https://doi.org/10.4161/21624011.2014.955356
- 4. Zhou, X. and Li, G. (2013) Function of Tumor-Associated Macrophages in Gastric Cancer. Chinese Journal of Clinical Oncology, No. 20, 1261-1263.
- 5. Grivennikov, S.I., Greten, F.R. and Karin, M. (2010) Immunity, Inflammation, and Cancer. Cell, 140, 883-899.https://doi.org/10.1016/j.cell.2010.01.025
- 6. Martinez, F.O. and Gordon, S. (2014) The M1 and M2 Paradigm of Macrophage Activation: Time for Reassessment. F1000Prime Reports, 6, 13. https://doi.org/10.12703/P6-13
- 7. Ferrante, C.J. and Leibovich, S.J. (2012) Regulation of Macrophage Polarization and Wound Healing. Advances in Wound Care, 1, 10-16. https://doi.org/10.1089/wound.2011.0307
- 8. Murray, P.J., Allen, J.E., Biswas, S.K, Fisher, E.A, Gilroy, D.W., Goerdt, S., et al. (2014) Macrophage Activation and Polarization: Nomenclature and Experimental Guidelines. Immunity, 41, 14-20.https://doi.org/10.1016/j.immuni.2014.06.008
- 9. Allavena, P. and Mantovani, A. (2012) Immunology in the Clinic Review Series; Focus on Cancer: Tumor-Associated Macrophages: Undisputed Stars of the Inflammatory Tumor Microenvironment. Clinical & Experimental Immunology, 167, 195-205. https://doi.org/10.1111/j.1365-2249.2011.04515.x
- 10. Qian, B.Z. and Pollard, J.W. (2010) Macrophage Diversity Enhances Tumor Progression and Metastasis. Cell, 141, 39-51. https://doi.org/10.1016/j.cell.2010.03.014
- 11. Yang, L. and Zhang, Y. (2017) Tumor-Associated Macrophages: From Basic Research to Clinical Application. Journal of Hematology & Oncology, 10, 58. https://doi.org/10.1186/s13045-017-0430-2
- 12. Herwig, M.C., Bergstrom, C., Wells, J.R., Höller, T. and Grossniklaus, H.E. (2013) M2/M1 Ratio of Tumor Associated Macrophages and PPAR-Gamma Expression in Uveal Melanomas with Class 1 and Class 2 Molecular Profiles. Experimental Eye Research, 107, 52-58. https://doi.org/10.1016/j.exer.2012.11.012
- 13. Granata, F., Frattini, A., Loffredo, S., et al. (2010) Production of Vascular Endothelial Growth Factors from Human Lung Macrophages Induced by Group IIA and Group X Secreted Phospholipases A2. The Journal of Immunology, 184, 5232-5241. https://doi.org/10.4049/jimmunol.0902501
- 14. Lala, P.K., Pinki, N. and Mousumi, M. (2018) Roles of Prostaglandins in Tumor-Associated Lymph Angiogenesis with Special Reference to Breast Cancer. Cancer and Metastasis Reviews, 37, 369-384. https://doi.org/10.1007/s10555-018-9734-0
- 15. Qian, B., Li, J., Zhang, H., et al. (2011) CCL2 Recruits Inflammatory Monocytes to Facilitate Breast-Tumor Metastasis. Nature, 475, 222-225. https://doi.org/10.1038/nature10138
- 16. Gocheva, V., Wang, H.W., Gadea, B.B., et al. (2010) IL-4 Induces Cathepsin Protease Activity in Tumor-Associated Macrophages to Promote Cancer Growth and Invasion. Genes & Development, 24, 241-255.https://doi.org/10.1101/gad.1874010
- 17. Germano, G., Frapolli, R., Belgiovine, C., et al. (2013) Role of Macrophage Targeting in the Antitumor Activity of Trabectedin. Cancer Cell, 23, 249-262. https://doi.org/10.1016/j.ccr.2013.01.008
- 18. Gratchev, A., Kzhyshkowska, J., Kirsten, K., et al. (2006) Mφ1 and Mφ2 Can Be Re-Polarized by Th2 or Th1 Cytokines, Respectively, and Respond to Exogenous Danger Signals. Immunobiology, 211, 473-486.https://doi.org/10.1016/j.imbio.2006.05.017
- 19. Gordon, S. and Martinez, F.O. (2010) Alternative Activation of Macrophages: Mechanism and Functions. Immunity, 32, 593-604. https://doi.org/10.1016/j.immuni.2010.05.007
- 20. Huang, Z., Yang, Y., Jiang, Y., et al. (2013) Anti-Tumor Immune Responses of Tumor-Associated Macrophages via Toll-Like Receptor 4 Triggered by Cationic Polymers. Biomaterials, 34, 746-755.https://doi.org/10.1016/j.biomaterials.2012.09.062
- 21. Chang, Y.-N., Guo, H.L., Li, J., et al. (2013) Adjusting the Balance between Effective Loading and Vector Migration of Macrophage Vehicles to Deliver Nanoparticles. PLoS ONE, 8, e76024. https://doi.org/10.1371/journal.pone.0076024
- 22. Jiang, W., Kim, B.Y.S., Rutka, J.T. and Chan, W.C.W. (2008) Nanoparticle-Mediated Cellular Response Is Size-Dependent. Nature Nanotechnology, 3, 145-150. https://doi.org/10.1038/nnano.2008.30
- 23. Cai, X.J., Wang, Z., Cao, J.W., Ni, J.J., Xu, Y.Y., Yao, J. and Yang, G.Y. (2017) Anti-Angiogenic and Anti-Tumor Effects of Metronomic Use of Novel Liposomal Zoledronic Acid Depletes Tumor-Associated Macrophages in Triple Negative Breast Cancer. Oncotarget, 8, 84248-84257. https://doi.org/10.18632/oncotarget.20539
- 24. Ye, J., Yang, Y., Dong, W., et al. (2019) Drug-Free Mannosylated Liposomes Inhibit Tumor Growth by Promoting the Polarization of Tumor-Associated Macrophages. International Journal of Nanomedicine, 14, 3203-3220.https://doi.org/10.2147/IJN.S207589
- 25. Han, S., Wang, W., Wang, S., et al. (2019) Multifunctional Biomimetic Nanoparticles Loading Baicalin for Polarizing Tumor-Associated Macrophages. Nanoscale, 11, 20206-20220. https://doi.org/10.1039/C9NR03353J
- 26. Zanganeh, S., Hutter, G., Spitler, R., Lenkov, O., Mahmoudi, M., Shaw, A. and Daldrup-Link, H.E. (2016). Iron Oxide Nanoparticles Inhibit Tumour Growth by inducing Pro-Inflammatory Macrophage Polarization in Tumor Tissues. Nature Nanotechnology, 11, 986-994. https://doi.org/10.1038/nnano.2016.168
- 27. Chen, L., Ma, X., Dang, M., et al. (2019) Cancer Immunotherapy: Simultaneous T Cell Activation and Macrophage Polarization to Promote Potent Tumor Suppression by Iron Oxide-Embedded Large-Pore Mesoporous Organosilica Core-Shell Nanospheres. Advanced Healthcare Materials, 8, Article ID: 1900039. https://doi.org/10.1002/adhm.201900039
- 28. Wu, L., Tang, H., Zheng, H., et al. (2019) Multiwalled Carbon Nanotubes Prevent Tumor Metastasis Through Switching M2-Polarized Macrophages to M1 via TLR4 Activation. Journal of Biomedical Nanotechnology, 15, 138-150.https://doi.org/10.1166/jbn.2019.2661
- 29. Ma, J., Liu, R., Wang, X., et al. (2015) A Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-Inflammatory Responses in Cells and Animals. ACS Nano, 9, 10498-10515.https://doi.org/10.1021/acsnano.5b04751
- 30. Wang, L., Wang, M., Zhou, B., et al. (2019) PEGylated Reduced-Graphene Oxide Hybridized with Fe3O4 Nanoparticles for Cancer Photothermal-Immunotherapy. Journal of Materials Chemistry B, 7, 7406-7414.https://doi.org/10.1039/C9TB00630C
NOTES
*通讯作者。