Material Sciences
Vol.
13
No.
03
(
2023
), Article ID:
62165
,
11
pages
10.12677/MS.2023.133011
低温等离子体技术简介及在环境催化领域的 应用进展
张玉博,尹轩磊,高郁晴,于 湛*
沈阳师范大学化学化工学院,辽宁 沈阳
收稿日期:2023年2月5日;录用日期:2023年2月27日;发布日期:2023年3月7日

摘要
低温等离子体具有反应条件温和、启动快的特点,在环境催化领域有着广阔的应用前景,由于其中存在电子、自由基、中性分子等多种化学物种,催化过程复杂,催化机理仍有待进一步探索明晰。因此,需要更多的基础研究来了解这些机制。本文综述了低温等离子体的基本内容,以及近年来通过建模和实验所了解的低温等离子体在环境催化领域的最新技术及应用进展。
关键词
低温等离子体,环境催化,应用,建模

Introduction of Low Temperature Plasma and Progress of Application in Environmental Catalysis
Yubo Zhang, Xuanlei Yin, Yuqing Gao, Zhan Yu*
College of Chemistry and Chemical Engineering, Shenyang Normal University, Shenyang Liaoning
Received: Feb. 5th, 2023; accepted: Feb. 27th, 2023; published: Mar. 7th, 2023

ABSTRACT
Low-temperature plasma, with mild reaction conditions and fast initiation, is well accepted to promise applications in environmental catalysis. Due to the presence of various chemical species such as electrons, free radicals and neutral molecules, the catalytic process is so complicated that the catalytic mechanism still needs to be further explored and clarified. Therefore, more fundamental studies are needed to understand these mechanisms. In this review, we summarize the basic knowledge of low-temperature plasmas, as well as the latest technological and application advances of low-temperature plasmas in the field of environmental catalysis as understood by modeling and experiments in recent years.
Keywords:Low Temperature Plasma, Environmental Catalysis, Applications, Modelling

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
等离子体是指向气体注入足够的能量使其部分或完全电离而产生的一种包含离子、电子、自由基和中性分子等物质的混合物 [1] ,总体上呈现电中性,也被称为物质的“第四态”。产生等离子体的能量可以是电能、化学能或热能。“等离子体”这个术语是由Irving Langmuir于1928年首次提出的 [2] ,用于描述包含离子、电子和中子等的反应性混合物,这标志着等离子体物理学的诞生。从此,等离子体科学得到了快速发展,并成为工业领域众多技术的核心,从而在微电子、汽车、包装、净化和医学等领域得广泛应用 [3] 。等离子体的主要特征是它的非平衡性,等离子体中各个物种的温度是不同的,这导致在等离子内发生的反应存在大量不同的反应途径,是传统化学方法无法实现的 [1] 。
一般来说,人们使用温度对等离子体进行区分,这里的温度通常是指电子温度。高温等离子体一般用于核聚变,所产生温度达到数百万开尔文。低温等离子体(Low Temperature Plasma, LTP)的电子温度在几个(一般小于10)电子伏特范围内,这足以引发化合物的解离和电离,离子和气体的温度可以接近室温。目前,人们常使用控制气体放电方法产生稳定可控的LTP,常用的气体放电方法有辉光放电(Glow Discharge)、介质阻挡放电(Dielectric Barrier Discharge)、电晕放电(Corona Discharge)、高频放电(High-frequency Discharge)、滑动弧放电(Gliding Discharge)等。由于LTP内具有大量高能活性粒子,可以使反应物分子产生激发、电离或断键,在材料表面产生刻蚀、交联或聚合等一系列的理化反应,在材料表面改性方面具有良好的应用前景 [4] [5] 。
LTP在各种环境催化领域的应用正获得越来越多的关注 [6] [7] [8] [9] ,这些应用主要可以分为两个主要领域,即气体净化和气体转换。气体净化是指从气流中去除相对低浓度的无用成分,如挥发性有机化合物(VOCs)和氮氧化物(NOx)。气体转化是指将输入气体中高浓度部分转化为更有价值的产品,如二氧化碳分解与氢化、甲烷的干重整或部分氧化及氨气生产等。
2. LTP在气体净化领域的应用进展
LTP工艺在气体净化方面被广泛应用,包括去除气体中的VOCs、颗粒物、NOx和硫氧化物(SOx)等。在工业上,LTP工艺广泛用于静电除尘器中的电晕放电、燃煤电厂废气去除颗粒物等 [10] 。目前LTP技术已经实现商业化大规模VOCs去除,并已发展到中试规模的NOx物去除,而颗粒物和SOx的工业化去除目前仍在研究中 [11] 。
2.1. 去除VOCs
人们研究使用低温等离子体和催化材料的组合来去除VOCs已有几十年历史 [12] ,工业上一般采用的标准方法是使用介质阻挡放电离子体(DBD)与催化材料的填料床相结合。VOCs首先吸附在催化剂表面,随后被等离子体产生的物种氧化。VOCs的浓度通常不高,其吸附过程可看作是等离子体处理前的一个浓缩预处理步骤 [11] 。目前使用这种方式可以处理多种VOCs,如脂肪烃、芳香烃和氯化物等。
目前最广泛使用的催化材料是金属氧化物,如TiO2、Al2O3、SiO2和CeO2等。采用金属氧化物的原因之一是它们通常要比用于热催化和等离子体催化的金属负载催化剂廉价。热催化活性较差的MnO2也被广泛使用,因为它能有效地分解等离子体产生的臭氧以及吸附的VOCs [13] 。金属氧化物在等离子体去除VOCs过程中的作用是不同于在热催化中的作用。事实上,严格来说在这里金属氧化物并不是真正的催化剂,因为它们虽然促进了反应,但并没有降低反应的能垒。
等离子体去除VOCs主要可以分为三种方法:连续等离子体内催化、等离子体后催化和顺序等离子体内催化。这三种方法的区别在于催化床相对于等离子体的位置 [14] [15] 。Kim等人通过计算模拟得到,像O(3P)和OH这样的活性物种,寿命分别为50 μs和100 μs,因此必须在催化剂表面约60 μm范围内产生,才能发生相互作用 [15] 。因此,这些物种在等离子体后催化过程中是不活跃的,而主要的活性物种是臭氧(O3),其寿命长达几分钟。事实上,在一些过程中,LTP的唯一作用就是生成O3 [16] 。
连续等离子体内催化与顺序等离子体内催化都对VOCs有很好的去除效果。顺序等离子体内催化方法可以大大降低能源消耗,但这可能是以VOCs不完全氧化为CO2为代价的 [17] 。顺序等离子体内催化还可以使用氧气作为等离子体气体,这可有效增加VOCs的分解率,并降低了NOx形成的可能性 [18] 。
2.2. 去除NOx
传统上使用热催化方法从废气中去除NOx,包括使用氨选择性催化还原(NH3-SCR)和碳氢化合物选择性催化还原(HC-SCR)。由于HC-SCR在300℃以下活性较差,因此需要额外添加碳氢化合物,这可以由未燃烧的燃料提供。虽然NH3-SCR可以在较低的温度下运行,但需要一个单独的NH3源。而使用等离子体可以避免下述这些问题,如需要昂贵的贵金属催化剂、HC-SCR所需要的高温以及NOx的还原产物是N2O而不是N2等。
等离子体后催化被广泛应用于去除NOx的实践中,这是由于可以通过等离子体与废气的相互作用产生稳定的中间物种。等离子体可以将NO和碳氢化合物部分氧化,形成NO2和醇、醛等含氧化合物,以及亚硝基化合物,如CH3ONO和HNO2等 [11] 。随后,这些物种与催化剂相互作用,形成N2、CO2和H2O。
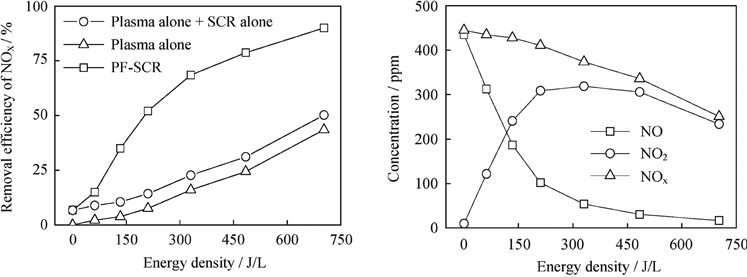
Nie等人 [18] 使用一份模拟废气,组成为435 ppm的NO、10 ppm的NO2、6000 ppm的C2H4、8%的O2,其余是N2。他们首先使用DBD反应器将NO部分氧化为NO2,并将C2H4转化为HCHO、CH3ONO2和其他有机物,混合气体通过Ag/Al2O3催化剂后有机物被去除,高达90%的NOx被还原成N2,如图1所示。在这个实际案例中,催化剂的温度为只有240℃。对于一般的NOx降解反应来说,这个反应温度太低了,是无法使C2H6活化的。然而,由于等离子体的存在产生了活性有机物种,NOx得到了显著地降解。本例中,等离子体和催化剂的协同作用是非常显著的,与之相比,单独使用催化剂的去除率只有7%。
等离子体内催化也被证明可以有效地降解NOx。碳氢化合物在等离子体中完全氧化会减少NOx的还原,这是由于不存在一些活性有机中间体,所以限制反应温度以确保只发生部分氧化对于等离子体内催化是十分重要的 [19] 。原位分析表明,等离子体可能起到清洁催化剂表面、降低催化剂失活的作用 [20] 。
在等离子体后催化和等离子体内催化中,在等离子体中形成的中间物种对于允许HC-SCR在相对较低的温度下进行是至关重要的,这保证了协同催化温度低于单独使用催化剂的活化温度。
 (A) (B)
(A) (B)
Figure 1. (A) Effect of energy density on the NOx removal efficiencies for three cases: PF-SCR (plasma-facilitated C2H4-SCR), plasma alone, summation of plasma alone and SCR alone; (B) Concentrations of NO, NO2, and NOx in the gas stream after plasma pretreatment as a function of energy density. From the reference [18]
图1. (A) 能量密度对PF-SCR (plasma-facilitated C2H4-SCR)、单独等离子体、单独的等离子体和单独的SCR的总和等三种情况下的NOx去除率的影响;(B) 在等离子体处理后,NO、NO2和NOx浓度对等离子体能量密度的依赖性(B图)。取自文献 [18]
等离子体也可以增强NH3-SCR。人们已经证明,如果NO2/NO的比例增加到50%,NH3-SCR的NOx转化率在低温下(低于250℃)也会得到增强。这表明使用等离子体部分氧化NO的等离子体后催化作用可能是有利的 [19] 。这个假设已经在部分实验中得到证实,例如Rajanikanth等人 [21] 发现,在柴油发电机的废气进入NH3-SCR反应器之前使用等离子体处理,可以将NOx的去除率从10%提高到90%,并且经过等离子体阶段之后的NO2/NO比率和NOx去除率会随着等离子体能量密度的增加而增加。此外,一旦NO2/NO比率达到50%,NOx去除率会随等离子体能量密度的增加而降低,因此50%是一个最佳比率。
3. LTP在气体转化领域的应用进展
由于等离子体具有可以快速开启、关闭的特性,并具有良好的适应性,因此等离子体处理非常适合于可再生能源,并且可根据需求设计为多种规模。相比之下,热催化过程的加热和冷却时间较长,通常只在大规模应用中可以提现出较高的效率。然而,人们已经花费几十年时间开发和优化了许多使用热催化的气体转化过程,并且达到了非常好的性能水平。因此,现在就期望应用等离子体催化等新型工艺在气体转化领域并体现很好的竞争力是不现实的。
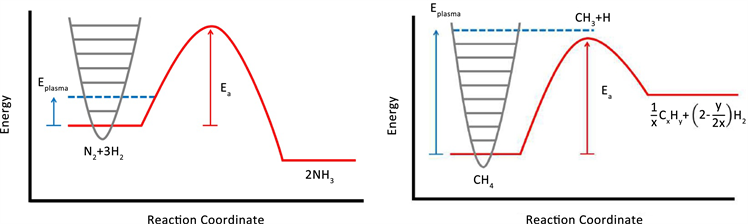
人们一般按照热力学下坡(ΔG < 0)和热力学上坡(ΔG > 0)两个过程对气体转换反应进行分类,其中G为吉布斯自由能 [11] 。本节讨论的NH3合成和CO2甲烷化是典型的热力学下坡过程,而CH4干重整则是热力学上坡过程。
对于热力学下坡反应(见图2(A)),由于相对于反应物能量的活化能降低,分子可以通过等离子体中带来的振动和电子激发来提高反应速率。这种下降可能允许反应在更低的温度操作,并且与反应物和产物的相互作用相对较弱的催化剂更适合热力学下坡反应(这将使曲线向右移动)。
对于热力学上坡反应(见图2(B)),由于催化剂对正负反应都有活性,可通过强烈的振动或直接的电子激活,在等离子体中发生断键反应。因此,此类反应中有效的催化剂对于目标反应应该是不活跃的,并且它应该加强对等离子体产生的中间产物或产物有利的下坡反应。另一种方法是在更高的温度下操作。此时,熵的增加可导致ΔG < 0。
 (A) (B)
(A) (B)
Figure 2. Energy plot for a typical thermodynamically downhill reaction (A) and a thermodynamically uphill reaction (B). From the reference [11]
图2. (A)热力学下坡反应;(B)热力学上坡反应。取自文献 [11]
3.1. NH3合成
以N2和H2出发生产NH3是等离子体催化合成的一个经典案例,这是一个放热反应。
(1)
传统的哈伯–博世(Haber-Bosch)工艺使用热催化剂,通过表面吸附的N原子和H原子之间的反应来降低能垒。催化剂必须与N2分子充分结合,使其容易解离,但又不能结合得太强,否则将限制解吸或减缓氢化反应。哈伯–博世工艺通常使用铁基催化剂,除了满足工艺要求外,价格还比较便宜。然而,这种催化剂的活化需要高温(至少700 K)。在这样的温度下,通过化学平衡生成的NH3可以忽略不计。而根据勒沙特列原理,增加压力可以提高转化率,由于反应物比产物多,因此将压力增加到200大气压,能够获得约15%的NH3产率 [22] 。
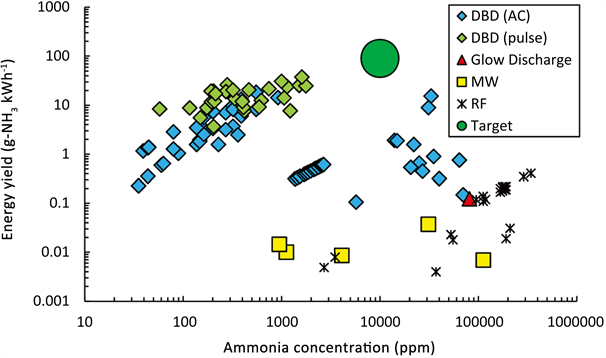
Figure 3. Some reported energy yield and NH3 concentration for different plasmas. From the reference [8]
图3. 部分已报道的等离子体催化NH3合成的能量消耗对NH3浓度图。取自文献 [8]
尽管更高的温度对反应更有利,但是非平衡态等离子体催化通常在室温和常压下进行。目前已知的大多数实验都使用了填料床DBD,也有人使用微波(MW)放电、滑动弧(GA)放电和射频(RF)放电进行了等离子体测试。图3给出了目前已经实现的LTP催化NH3合成的能量消耗和所得NH3浓度。
等离子体催化NH3合成机理如图4所示,主要有以下两种机理 [8] :
第一种机理是通过向N2分子提供额外的振动能量促进其解离性吸附。这是一个典型的热力学下坡反应中振动激发和电子激发的例子,但这可能会最佳催化剂的改变。Mehta等人 [23] [24] 使用微观动力学模型预测,由于N2的激活是限速步骤,所以与N2结合较弱的金属将更受青睐,这意味着哈伯–博世工艺中使用的铁基催化剂将向钴基和镍基催化剂转移,这些催化剂与N2的结合相对并不紧密。
第二种机理是N2在等离子体中的解离,又被称为表面增强等离子体驱动NH3合成 [8] 。N2解离主要发生在气相中,此时反应过程变得异常复杂。重要的基元反应包括N原子在催化剂上的吸附、N与表面吸附的H原子发生Langmuir-Hinshelwood反应等。

Figure 4. Reaction mechanisms of NH3 synthesis. From the reference [25]
图4. 等离子体催化NH3合成的机理图示。取自文献 [25]
目前,针对填料床DBD中进行的NH3合成反应已经有了详细的动力学模拟报道 [26] [27] [28] 。在低温下,催化剂表面被吸附的N和NH3饱和,留下有限的位点用于N2的解离吸附或N的吸附,当温度升高,特别是升高至500 K或以上时,催化剂可释放表面位点用于N吸附 [24] 。Rouwenhorst等人发现,当在较高温度下有催化剂存在的情况下,NH3的产率会得到提高,这归因于振动激发的N2的解离吸附和N的吸附,等离子体的存在能够大大增加NH3的合成,表明等离子催化体在NH3合成方面具有广阔前景。
即使在有催化剂的情况下,DBD反应器也不可能提供NH3合成所需的全部能量,因为电离和解离反应将比振动和电子激发过程更耗能。一个新的思路是使用H2O而不是H2作为前体分子,这可以节省从H2O生产H2所需的大量能量 [29] 。然而,这种方法由于存在形成氮氧化物的竞争反应而变得非常复杂,人们正在据此思路开发新的方法,如使用电化学反应器从H2O生产H2,并通过质子传导膜将其与N2等离子体耦合 [30] 。
3.2. CO2转化
利用可再生能源将CO2转化为高附加值产品是可持续低碳经济的热点研究之一。高附加值产品包括CO、CH4、烯烃和液体燃料。这个工作的主要挑战是CO2的高热力学稳定性导致其解离需要大量能量。
目前人们正在竭尽全力应用等离子体将CO2转化为其他更有用的化合物,包括CO2解裂形成CO和O2,CO2加氢生成CH4、CO和甲醇,CO2与CH4重整形成合成气(CO和H2)、高级烃和含氧化合物,以及CO2加水还原形成合成气等。本节重点讨论CO2的裂解和氢化。
CO2裂解反应如(2)所示。
(2)
虽然这个反应在室温下是吸热的,但是由于熵对吉布斯自由能的贡献,反应平衡转化率在1500 K以上仍会增加。不同的激发机制下,反应的能量需求也是不同的。
在等离子体中,当电子直接撞击CO2使之解离激发,e + CO2 → CO + O(1S) + e,需要约11.5 eV的能量。而对于产生O(3P):e + CO2 (ν > 1) →CO + O(3P) +e,能垒将降低到5.5 eV。因此可以采用阶梯式振动激发机制,即与最初振动激发相关的过量振动通过在CO2分子之间的碰撞中进行激发交换而转移到振动能级上。
对于不同的等离子体源来说,MW和GA反应器的电子能量适合于将能量转移到振动激发,相对而言,DBD反应器的电场在200 Td (1 Td = 10−21 V∙m2)以上会减少,这适合于CO2的直接电子撞击解离。
DBD对于CO2的裂解只有大约20%的能量效率,产生2至3 eV的平均电子能 [31] ,而MW和GA等离子体在CO2转换方面的能量效率远远高于DBD [16] 。这既是能量效率的原因,也是由于气体温度更高导致的更高的产率。然而,由于温度较高,MW和GA离子体通常不适用于原位等离子体催化。虽然DBD能量效率不高,但适用于原位催化,当含氢前驱体添加到CO2中时,就有可能直接生产出高附加值化合物。例如,CO2加氢可以产生CH4的反应(Sabatier反应)如下所示:
(3)
除了CH4之外,CO2氢化还可以得到一系列产品,如醇、醛和酸等。
CO2氢化的最简单的例子就是甲烷化(反应(3))。如果反应物H2是通过电解水获得的,那么这个过程就是一个很好的利用可再生能源将CO2转化为CH4的方法 [32] 。传统的CO2氢化生成甲烷是一个热催化

Figure 5. Energy costs for plasma methanation of CO2 against (A) CO2 conversion and (B) CH4 yield. From the reference [33]
图5. 等离子体催化CO2氢化的能源成本与(A) CO2转化率和(B) CH4产量的关系图。取自文献 [33]
工艺,一般要求温度为300℃至400℃并使用镍基催化剂。在350℃和1个标准大气压条件下,CO2的平衡转化率约为90%。根据Le Chatelier原理,人们已经知道可以通过增加压力或降低温度来改善NH3的产率 [33] 。因此,如果采用等离子体工艺,则提供了在较低温度下进行操作的可能性,原则上可能会带来更高的CO2转化率。
如图5所示,在DBD反应器中使用等离子体催化技术,可以获得高达80%的CO2转化率和CH4产率。请注意,CH4产率是CO2转化率和CH4选择性共同作用的结果,而CH4选择性可达100%。将等离子体与催化剂联用,可以极大地提高催化性能。例如,Ahmad等人 [34] 在150℃使用DBD等离子体结合Ni/Al2O3催化剂,获得了60%的CO2转化率和97%以上的CH4选择性。Parastaev等人 [35] 使用同位素标记的CO2和程序升温的等离子体表面反应技术,证实CO2的解离主要发生在气相中,CO吸附在催化剂上并氢化形成CH4。
尽管等离子体反应器具有低温操作和适配于可再生电力资源,但其能源成本仍然太高。另外,对热催化最有效的催化剂往往并不是对等离子体催化也是最有效的,还需要继续寻找适用于等离子体催化条件的催化剂。
另一个等离子体催化CO2氢化的例子是生成甲醇
(4)
Wang等人 [36] 证明在303 K和1个大气压的条件下,使用DBD等离子体结合Cu/Al2O3催化剂催化CO2,其转化率为21%,这与热催化结果相当。这个反应器的一个特点是使用水接地电极来保持反应器内的低温。虽然这个反应器中甲醇的选择性(54%)低于热催化,但是其能量成本比工业规模的热催化高9倍。
3.3. 烃的转化
烃的转化包括一系列反应,其中研究最广泛的是CH4的干重整,即CH4和CO2反应产生合成气(CO和H2的混合物):
(5)
在热催化条件下,此反应必须在900至1200 K的高温下进行,以确保熵的增加超过焓的减少,从而使得反应整体上呈现负的吉布斯自由能。与CO2的转化为甲烷的过程不同,这个反应中由于产物分子数量大于反应物分子数量,所以低压条件对于反应是有利的。
人们已经在使用热催化技术进行干重整方面进行了近一个世纪的研究,但是目前仍然没有进行广泛的工业实施,一个突出的问题是催化剂表面烟尘沉积及由此产生的催化剂失活 [16] 。商业化的等离子体催化CH4干重整生产合成气工艺的目标能量成本为每个CH4和CO2分子消耗4.27 eV能量,对应的能量效率为60%。目前,无填料DBD反应器已经能够实现了高达60%的转换率,但每个分子的能量成本超过20 eV。GA等离子体可以实现每分子0.75至2.6 eV的能量成本,转换率为40%~80%。此外,纳秒脉冲放电、火花放电和大气压辉光放电这些等离子技术也取得了令人鼓舞的结果。
大多数与等离子体催化有关的实验都使用了填料床DBD反应器。Mehta等人 [24] 指出,反应器的温度具有关键作用。Kim等人 [37] 报道,在低温下,对于ΔG > 0的情况,无论是否存在填料或催化剂,等离子体的存在都会导致CH4转化。相反在高温下,对于ΔG < 0的情况,单独的等离子体或带有非催化填料的等离子体都是无活性的。这些结果说明以下几个问题。首先,等离子体中的化学键断键是热力学上坡反应能够进行的必要条件。在这种情况下,等离子体促进的烃的转换反应极大可能是始于CO2和CH4的电子冲击解离的。其次,标准催化剂对热力学上坡反应无效,因为它们对正反应和副反应都有催化活性。最后需要说明的是,对于热力学下坡反应,当存在适当的催化剂,分子的振动激发可以提高反应速率。例如,高温下,等离子体和Ni基催化剂的存在可以促进CH4的转化率明显提高,这是由于振动激发的CH4与Ni位点之间的相互作用导致能垒的降低 [38] 。Sheng等人 [39] 报导道,在400℃至700℃下对装有镧修饰的Ni/Al2O3催化剂的DBD反应器的研究得出了类似的结论。他们观察到,等离子体激发频率对催化效果存在影响,100 kHz频率激发的影响强于12 kHz频率。他们将这种差异归因于CH4受振动激发的影响。CH4的弯曲模式振动激发的寿命是31 μs,100 kHz激发频率的半周期为5 μs,对CH4与催化剂之间相互作用的影响要强于半周期为42 μs的12 kHz激发频率。
在较低的操作温度,等离子体催化CO2与CH4反应可以获得类型丰富的产物,包括CO、H2、C2-C4烃和含氧化合物(甲醇、乙醇、甲酸、乙酸等)。尽管CO2和CH4的比例对最终产物存在影响,但是其实等离子体本身并没有选择性。然而,等离子体和固体催化剂的结合可以提高产物的选择性。例如,Wang等人 [40] 通过使用Cu/Al2O3、Au/Al2O3和Pt/Al2O3等催化剂来调控气态和液态产物的选择性。特别是,使用Cu/Al2O3可以对乙酸产物具有选择性,而Au/Al2O3和Pt/Al2O3则可以产生甲酸,不添加催化剂的情况下这是无法实现的。这一结果表明等离子体催化直接生产高附加值化学品的潜力。
4. 总结与展望
本文介绍了低温等离子体催化在气体净化和气体转换方面的部分研究进展,总结了近几年在去除VOCs、NOx及CO2和烃的转化方面的研究成果。目前低温等离子体技术已经广泛商业化,用于气味控制以及去除VOCs,这已经有几十年的历史,特别是在日本和中国,室内空气净化装置已被广泛采用。虽然使用低温等离子体技术减少NOx还没有在车辆等移动源上得到广泛证明,然而有报道表明,采用低温等离子体及氮氧化物吸附装置的中试规模系统可以实现NOx去除率94%,并且具有很好的能量效率。使用低温等离子体进行气体转换过程的研究与开发仍处于实验室规模,难点包括既要降低能源成本同时还要实现可接受的转化率。此外,低温等离子体中存在电子、自由基、中性分子等复杂物质,催化机理复杂,仍有待进一步探索洞明。因此,低温等离子体催化研究极具挑战性,其科学基础研究还有待加强。
基金项目
沈阳师范大学国家级大学生创新创业训练计划项目(202210004);辽宁省自然科学基金面上项目(2021-MS-239)。
文章引用
张玉博,尹轩磊,高郁晴,于 湛. 低温等离子体技术简介及在环境催化领域的应用进展
Introduction of Low Temperature Plasma and Progress of Application in Environmental Catalysis[J]. 材料科学, 2023, 13(03): 83-93. https://doi.org/10.12677/MS.2023.133011
参考文献
- 1. von Keudell, A. and Schulz-von der Gathen, V. (2017) Foundations of Low-Temperature Plasma Physics—An Introduc-tion. Plasma Sources Science and Technology, 26, Article ID: 113001. https://doi.org/10.1088/1361-6595/aa8d4c
- 2. Langmuir, I. (1928) Oscillations in Ionized Gases. Proceedings of the National Academy of Sciences, 14, 627-637. https://doi.org/10.1073/pnas.14.8.627
- 3. Schram, D.C. (2009) Is Plasma Unique? The Presence of Electrons and the Importance of Charge. Plasma Sources Science and Technology, 18, Article ID: 014003. https://doi.org/10.1088/0963-0252/18/1/014003
- 4. Kim, M.H., Cho, J.H., Ban, S.B., Choi, R.Y., Kwon, E.J., Park, S.J. and Eden, J.G. (2013) Efficient Generation of Ozone in Arrays of Microchannel Plasmas. Journal of Physics D: Applied Physics, 46, Article ID: 305201. https://doi.org/10.1088/0022-3727/46/30/305201
- 5. Eden, J.G., Park, S.J., Herring, C.M. and Bulson, J.M. (2011) Microplasma Light Tiles: Thin Sheet Lamps for General Illumination. Journal of Physics D: Applied Physics, 44, Article ID: 224011. https://doi.org/10.1088/0022-3727/44/22/224011
- 6. Chen, H.L., Lee, H.M., Chen, S.H., Chang, M.B., Yu, S.J. and Li, S.N. (2009) Removal of Volatile Organic Compounds by Single-Stage and Two-Stage Plasma Catalysis Systems: A Review of the Performance Enhancement Mechanisms, Current Status, and Suitable Applications. Environmental Sci-ence & Technology, 43, 2216-2227. https://doi.org/10.1021/es802679b
- 7. Neyts, E.C., Ostrikov, K., Sunkara, M.K. and Bogaerts, A. (2016) Correc-tion: Plasma Catalysis: Synergistic Effects at the Nanoscale. Chemical Reviews, 116, 767-767. https://doi.org/10.1021/acs.chemrev.6b00009
- 8. Rouwenhorst, K.H.R., Engelmann, Y., van’t Veer, K., Postma, R.S., Bogaerts, A. and Lefferts, L. (2020) Plasma-Driven Catalysis: Green Ammonia Synthesis with Intermittent Elec-tricity. Green Chemistry, 22, 6258-6287. https://doi.org/10.1039/D0GC02058C
- 9. Liu, S., Winter, L.R. and Chen, J.G. (2020) Review of Plasma-Assisted Catalysis for Selective Generation of Oxygenates from CO2 and CH4. ACS Catalysis, 10, 2855-2871. https://doi.org/10.1021/acscatal.9b04811
- 10. Okubo, M. (2022) Recent Development of Technology in Scale-Up of Plasma Reactors for Environmental and Energy Applications. Plasma Chemistry and Plasma Processing, 42, 3-33. https://doi.org/10.1007/s11090-021-10201-7
- 11. Bogaerts, A., Tu, X., Whitehead, J.C., Centi, G., Lefferts, L., Guaitella, O., Azzolina-Jury, F., Kim, H.-H., Murphy, A.B., Schneider, W.F., Nozaki, T., Hicks, J. C, Rousseau, A., Thevenet, F., Khacef, A. and Carreon, M. (2020) The 2020 Plasma Catalysis Roadmap. Journal of Physics D: Applied Physics, 53, Article ID: 443001. https://doi.org/10.1088/1361-6463/ab9048
- 12. Qu, M., Cheng, Z., Sun, Z., Chen, D., Yu, J. and Chen, J. (2021) Non-Thermal Plasma Coupled with Catalysis for VOCs Abatement: A Review. Process Safety and Environmental Pro-tection, 153, 139-158. https://doi.org/10.1016/j.psep.2021.06.028
- 13. Li, Y., Fan, Z., Shi, J., Liu, Z. and Shangguan, W. (2014) Post Plasma-Catalysis for VOCs Degradation over Different Phase Structure MnO2 Catalysts. Chemical Engineering Journal, 241, 251-258. https://doi.org/10.1016/j.cej.2013.12.036
- 14. Feng, X., Liu, H., He, C., Shen, Z. and Wang, T. (2018) Synergistic Effects and Mechanism of a Non-Thermal Plasma Catalysis System in Volatile Organic Compound Removal: A Review. Catalysis Science & Technology, 8, 936-954. https://doi.org/10.1039/C7CY01934C
- 15. Kim, H.-H., Teramoto, Y., Negishi, N. and Ogata, A. (2015) A Multi-disciplinary Approach to Understand the Interactions of Nonthermal Plasma and Catalyst: A Review. Catalysis Today, 256, 13-22. https://doi.org/10.1016/j.cattod.2015.04.009
- 16. Snoeckx, R. and Bogaerts, A. (2017) Plasma Technology—A Novel Solution for CO2 Conversion? Chemical Society Reviews, 46, 5805-5863. https://doi.org/10.1039/C6CS00066E
- 17. Sivachandiran, L., Thevenet, F. and Rousseau, A. (2015) Isopropanol Removal Using MnXOY Packed Bed Non- Thermal Plasma Reactor: Comparison between Continuous Treatment and Sequential Sorption/Regeneration. Chemical Engineering Journal, 270, 327-335. https://doi.org/10.1016/j.cej.2015.01.055
- 18. Nie, Y., Wang, J., Zhong, K., Wang, L. and Guan, Z. (2007) Syner-gy Study for Plasma-Facilitated C2H4 Selective Catalytic Reduction of NOx over Ag/γ-Al2O3 Catalyst. IEEE Transac-tions on Plasma Science, 35, 663-669. https://doi.org/10.1109/TPS.2007.896764
- 19. Gholami, R., Stere, C.E., Goguet, A. and Hardacre, C. (2017) Non-Thermal-Plasma-Activated de-NOx Catalysis. IEEE Transactions on Plasma SciencePhilosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, 376, Article ID: 20170054. https://doi.org/10.1098/rsta.2017.0054
- 20. Stere, C.E., Adress, W., Burch, R., Chansai, S., Goguet, A., Graham, W.G. and Hardacre, C. (2015) Probing a Non- Thermal Plasma Activated Heterogeneously Catalyzed Reaction Using in Situ DRIFTS-MS. ACS Catalysis, 5, 956-964. https://doi.org/10.1021/cs5019265
- 21. Rajanikanth, B.S., Srinivasan, A.D. and Ravi, V. (2005) Discharge Plasma Treatment for NOx Reduction from Diesel Engine Exhaust: A Laboratory Investigation. IEEE Transactions on Dielec-trics and Electrical Insulation, 12, 72-80. https://doi.org/10.1109/TDEI.2005.1394017
- 22. Rodriguez, M.M., Bill, E., Brennessel, W.W. and Holland, P.L. (2011) N2 Reduction and Hydrogenation to Ammonia by a Molecular Iron-Potassium Complex. Science, 334, 780-783. https://doi.org/10.1126/science.1211906
- 23. Mehta, P., Barboun, P., Herrera, F.A., Kim, J., Rumbach, P., Go, D.B., Hicks, J.C. and Schneider, W.F. (2018) Overcoming Ammonia Synthesis Scaling Relations with Plasma-Enabled Catalysis. Nature Catalysis, 1, 269-275. https://doi.org/10.1038/s41929-018-0045-1
- 24. Mehta, P., Barboun, P., Go, D.B., Hicks, J.C. and Schneider, W.F. (2019) Catalysis Enabled by Plasma Activation of Strong Chemical Bonds: A Review. ACS Energy Letters, 4, 1115-1133. https://doi.org/10.1021/acsenergylett.9b00263
- 25. Rouwenhorst, K.H.R., Kim, H.-H. and Lefferts, L. (2019) Vibrationally Excited Activation of N2 in Plasma-Enhanced Catalytic Ammonia Synthesis: A Kinetic Analysis. ACS Sustainable Chemistry & Engineering, 7, 17515-17522. https://doi.org/10.1021/acssuschemeng.9b04997
- 26. Hong, J., Pancheshnyi, S., Tam, E., Lowke, J.J., Prawer, S. and Murphy, A.B. (2017) Kinetic Modelling of NH3 Production in N2-H2 Non-Equilibrium Atmospheric-Pressure Plas-ma Catalysis. Journal of Physics D: Applied Physics, 50, Article ID: 154005. https://doi.org/10.1088/1361-6463/aa6229
- 27. Van’t Veer, K., Engelmann, Y., Reniers, F. and Bogaerts, A. (2020) Plasma-Catalytic Ammonia Synthesis in a DBD Plasma: Role of Microdischarges and Their Afterglows. The Journal of Physical Chemistry C, 124, 22871-22883. https://doi.org/10.1021/acs.jpcc.0c05110
- 28. Hong, J., Prawer, S. and Murphy, A.B. (2018) Plasma Catalysis as an Alternative Route for Ammonia Production: Status, Mechanisms, and Prospects for Progress. ACS Sustainable Chemistry & Engineering, 6, 15-31. https://doi.org/10.1021/acssuschemeng.7b02381
- 29. Gorbanev, Y., Vervloessem, E., Nikiforov, A. and Bogaerts, A. (2020) Nitrogen Fixation with Water Vapor by Non- Equilibrium Plasma: Toward Sustainable Ammonia Production. ACS Sustainable Chemistry & Engineering, 8, 2996- 3004. https://doi.org/10.1021/acssuschemeng.9b07849
- 30. Sharma, R.K., Patel, H., Mushtaq, U., Kyriakou, V., Zafei-ropoulos, G., Peeters, F., Welzel, S., van de Sanden, M.C.M. and Tsampas, M.N. (2021) Plasma Activated Electrochem-ical Ammonia Synthesis from Nitrogen and Water. ACS Energy Letters, 6, 313-319. https://doi.org/10.1021/acsenergylett.0c02349
- 31. Bogaerts, A., Kozák, T., van Laer, K. and Snoeckx, R. (2015) Plasma-Based Conversion of CO2: Current Status and Future Challenges. Faraday Discussions, 183, 217-232. https://doi.org/10.1039/C5FD00053J
- 32. Thema, M., Bauer, F. and Sterner, M. (2019) Power-to-Gas: Electrolysis and Methanation Status Review. Renewable and Sustainable Energy Reviews, 112, 775-787. https://doi.org/10.1016/j.rser.2019.06.030
- 33. Dębek, R., Azzolina-Jury, F., Travert, A. and Maugé, F. (2019) A Review on Plasma-Catalytic Methanation of Carbon Dioxide—Looking for an Efficient Catalyst. Renewable and Sus-tainable Energy Reviews, 116, Article ID: 109427. https://doi.org/10.1016/j.rser.2019.109427
- 34. Ahmad, F., Lovell, E.C., Masood, H., Cullen, P.J., Ostrikov, K.K., Scott, J.A. and Amal, R. (2020) Low-Temperature CO2 Methanation: Synergistic Effects in Plasma-Ni Hybrid Catalytic System. ACS Sustainable Chemistry & Engineering, 8, 1888-1898. https://doi.org/10.1021/acssuschemeng.9b06180
- 35. Parastaev, A., Hoeben, W.F.L.M., van Heesch, B.E.J.M., Kosinov, N. and Hensen, E.J.M. (2018) Temperature- Programmed Plasma Surface Reaction: An Approach to Determine Plasma-Catalytic Performance. Applied Catalysis B: Environmental, 239, 168-177. https://doi.org/10.1016/j.apcatb.2018.08.011
- 36. Wang, L., Yi, Y., Guo, H. and Tu, X. (2018) Atmospheric Pres-sure and Room Temperature Synthesis of Methanol through Plasma-Catalytic Hydrogenation of CO2. ACS Catalysis, 8, 90-100. https://doi.org/10.1021/acscatal.7b02733
- 37. Kim, J., Abbott, M.S., Go, D.B. and Hicks, J.C. (2016) En-hancing C-H Bond Activation of Methane via Temperature-Controlled, Catalyst-Plasma Interactions. ACS Energy Letters, 1, 94-99. https://doi.org/10.1021/acsenergylett.6b00051
- 38. Kim, J., Go, D.B. and Hicks, J.C. (2017) Synergistic Effects of Plasma-Catalyst Interactions for CH4 Activation. Physical Chemistry Chemical Physics, 19, 13010-13021. https://doi.org/10.1039/C7CP01322A
- 39. Sheng, Z., Watanabe, Y., Kim, H.-H., Yao, S. and Nozaki, T. (2020) Plasma-Enabled Mode-Selective Activation of CH4 for Dry Reforming: First Touch on the Kinetic Analysis. Chemical Engineering Journal, 399, Article ID: 125751. https://doi.org/10.1016/j.cej.2020.125751
- 40. Wang, L., Yi, Y., Wu, C., Guo, H. and Tu, X. (2017) One-Step Reforming of CO2 and CH4 into High-Value Liquid Chemicals and Fuels at Room Temperature by Plasma-Driven Ca-talysis. Angewandte Chemie International Edition, 56, 13679-13683. https://doi.org/10.1002/anie.201707131