Advances in Analytical Chemistry
Vol.05 No.02(2015), Article ID:15184,8
pages
10.12677/AAC.2015.52002
Ultrasonic Wave Assisted Synthesis of Silver Nanospheres and Their Catalytic Degradation on Methylene Blue
Ce Dai, Qing Li*, Lizhao Qin, Hua Lin, Ming Nie, Yuan Li
Faculty of Materials and Energy, Southwest University, Chongqing
Email: *qli@swu.edu.cn
Received: Apr. 11th, 2015; accepted: Apr. 30th, 2015; published: May 7th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
A facile environmental friendly method has been developed to prepare silver nanospheres with good dispersion and the size in the range of 300 - 400 nm. Silver nanospheres were obtained via the chemical reduction of Tollens’ reagent at room temperature, using ascorbic acid as the reducing agent and polyvinylpyrrolidone (PVP) as the surfactant. The obtained silver nanospheres were characterized by X-ray powder diffraction (XRD), energy dispersive X-ray spectroscopy (EDX), scanning electron microscopy (SEM) and UV-visible spectroscopy (UV-vis). The influence of reaction time and the amount of PVP and ammonium hydroxide on the formation of silver nanospheres was studied. The growth process of silver nanospheres was analyzed and the possible mechanism of crystal growth was proposed. The catalytic degradation activity of the obtained silver nanospheres on methylene blue was also measured. They showed excellent catalytic degradation activity on methylene blue.
Keywords:Silver Nanospheres, Ultrasonic Wave Assisted, Methylene Blue, Catalytic Degradation

超声辅助法制备银纳米球及其对亚甲基蓝的 催化降解研究
戴策,李庆*,覃礼钊,林华,聂明,李元
西南大学材料与能源学部,重庆
Email: *qli@swu.edu.cn
收稿日期:2015年4月11日;录用日期:2015年4月30日;发布日期:2015年5月7日

摘 要
本文以银氨溶液为银源,抗坏血酸(C6H8O6)为还原剂,聚乙烯吡咯烷酮(PVP)为表面活性剂,在超声辅助条件下,采用了简单环保的室温液相还原法制备出了形貌均匀、分散性良好、粒径为300~400 nm的银纳米球,用X射线粉末衍射、能量分散X射线谱、扫描电子显微镜和紫外–可见分光光度计对合成产物进行了表征。通过改变超声时间、PVP的用量和氨水体积来研究产物的形貌变化。分析了银纳米球的生长过程,提出了可能的生长机理。测试了样品对亚甲基蓝的催化降解性能,结果表明,制备的银纳米球对亚甲基蓝有良好的催化降解效果。
关键词 :银纳米球,超声辅助,亚甲基蓝,催化降解

1. 引言
近年来,金属纳米粒子因其与普通金属相比具有独特的性能而受到了人们极大的关注。在所有的金属纳米粒子中,银纳米粒子在纳米科学和纳米技术领域继续成为人们研究的热点,因为其具有良好的的导热性、导电性、表面活性和催化性能以及在各领域广泛的用途,如光学、催化、微电子、生物传感、抗菌[1] -[5] 、表面增强拉曼散射[6] 、降解环境污染物[7] 和癌症治疗[8] 等领域。
目前制备银纳米颗粒的方法有很多,包括化学法[9] 、光化学法[10] 、生物法[11] 、放射化学法[12] 和超声化学方法[13] 等。在这些方法中,化学还原法是一种最常用的制备方法,因其操作方便,所需设备简单[14] 。
银纳米颗粒的内在特性主要由它们的尺寸、形状、成分、结晶度和结构决定。因此需要设计出一种一般方法来制备一系列定义明确、形貌可控的银纳米颗粒,以充分发挥其特有的性质和独特的应用[15] 。
超声处理的化学效应取决于在塌陷的气泡中瞬间(小于1微秒)形成的高温高压[16] -[18] ,它成功地增加了转化率,提高了产量,改变了反应路径,或者使反应发启在生物、(电)化学甚至气溶胶体系中[19] [20] 。超声处理对化学反应的影响,最近已有文献报道,而且显示有两个区域的声化学活动[21] -[23] :坍塌气泡内区域以及气泡与液体之间的界面区域。如果反应发生在坍塌气泡内部并且使用水作为溶剂,这种情况下下得到的产物将是无定形的,因为在坍塌过程中达到了很高的冷却速率(>1010 Ks−1) [23] [24] 。另一方面,如果反应发生在界面处,会得到纳米级的晶体产品。如果该溶质是离子型的,并因此具有低的蒸气压,超声处理过程中离子种类的数量在气泡内部将非常低,在气泡内部得到的产品也会非常少[25] [26] 。此外,相比于微波辅助法合成银纳米颗粒[27] ,超声辅助合成法可以通过改变在溶液中的前驱体的浓度来控制产品的形态和粒度分布[28] 。
在本文中,我们提出了一个简便的在室温和超声辅助途径下,并在PVP存在条件下制备银纳米球的方法。对超声时间以及PVP和氨水的用量对产品的影响进行了讨论,并提出了可能的形成机理。对产品对亚甲基蓝的催化降解活性进行了研究。
2. 实验部分
2.1. 实验材料
硝酸银(AgNO3, ≥99%)、抗坏血酸(C6H8O6, ≥99%)和无水乙醇(C2H5OH, ≥99.7%)等化学试剂购自重庆川东化工有限公司,均为分析纯。聚乙烯吡咯烷酮(PVP)购自成都市科龙化工试剂厂,分子量约为30,000;硼氢化钠(NaBH4, ≥96%),亚甲基蓝(C16H18CIN3S3H2O)均购自上海润捷化学试剂有限公司。实验中用到的去离子水(18 MΩ)为实验室自制。
2.2. 银纳米晶体的制备
用电子天平分别称取AgNO3 0.3 g、抗坏血酸0.3 g、PVP 0.1 g,将其分别放入3个盛有10 mL去离子水的烧杯中,磁力搅拌约5 min至其完全溶解,此时AgNO3溶液为无色透明溶液,取1 mL含量为25%~28%的氨水滴加到AgNO3溶液中至溶液变澄清为止,配成银氨溶液。然后将PVP水溶液加入银氨溶液中,混合溶液搅拌5 min。将此混合溶液迅速加入到抗坏血酸溶液中,然后迅速将此混合溶液放入高能超声仪(VCX750, SONICS & MATERIALS, INC.)中,将超声仪探头没入溶液中约1 cm,超声处理1 h,功率为750 W,反应温度控制为25℃。在超声处理的过程中,溶液由无色迅速变为灰黑色,最后变为灰黄色。反应1 h后,用高速离心机分离该灰黄色沉淀,并用去离子水洗涤3次,无水乙醇洗涤2次。最后将制得的样品放在真空干燥箱中于50℃下干燥5 h,得到粉末样品备用。
2.3. 表征方法
采用X射线衍射仪(XD-3,北京浦肯野通用仪器有限公司)对制得的银纳米粉末进行了X射线粉末衍射(XRD)表征,分析条件为:以Cu Kα射线(λ = 1.54178 nm)为靶材,管电压为40 kV、管电流为200 mA、扫描速度为4˚/min,扫描的衍射角范围为10˚~90˚ (2θ);将制得的样品分散在硅片上,用FEI Quanta 250型扫描电子显微镜进行扫描电镜(SEM)和能量色散X射线能谱(EDX)分析。采用Shimadzu U-2550型紫外–可见分光光度计测试样品的紫外–可见吸收光谱(UV-vis)。
2.4. 催化实验
为了研究制备出的银纳米粒子对亚甲基蓝的催化降解活性,使用了紫外–可见分光光度计来测试反应物的吸收峰。通过比较三组实验得到的在664 nm处的峰吸收强度值来判断银纳米粒子的催化降解活性。第一组实验,将1 mL亚甲基蓝溶液(1 × 10−4 M)和2 mL去离子水先后滴加到容积为3.5 mL的石英比色皿中,混合均匀,测试其吸光度。第二组实验,将1 mL亚甲基蓝溶液(1 × 10−4 M)、0.5 mL硼氢化钠溶液(1 × 10−3 M)和1.5 mL去离子水先后滴加到容积为3.5 mL的石英比色皿中,混合均匀,测试其吸光度。第三组实验,将1 mL亚甲基蓝溶液(1 × 10−4 M)、0.5 mL硼氢化钠溶液(1 × 10−3 M)和1.5 mL纳米银溶液(0.067 mg/mL)先后滴加到容积为3.5 mL的石英比色皿中,混合均匀,10 min和20 min后分别测试其吸光度。
3. 结果与讨论
3.1. X射线粉末衍射(XRD)分析
在室温下采用超声辅助法制备银纳米材料,利用晶体形成的X射线衍射,对物质进行内部原子在空间分布状况的结构分析。图1是在常温,PVP为0.1 g,氨水为1 mL的条件下,超声反应时间1 h后产物的XRD图谱。图谱中在38.11˚,44.27˚,64.42˚,77.46˚和81.53˚处出现了5个明显的衍射峰,分别对应于银标准卡片(JCPDS 04-0783)上的(111),(200),(220),(311)和(222)晶面,说明制备的银纳米晶体具
有面心立方结构,且纯度高,结晶性良好。
3.2. 扫描电子显微镜(SEM)及能谱(EDX)分析
SEM主要用于观察块状材料的表面形貌和对样品表面进行化学成分分析。图2(a)为样品的扫描电镜图像。由图可知,图像中的银颗粒均为球状,分布均匀且粒径大小基本相同,约为300~400 nm。对应的EDX图像(图2(b))显示除Si信号外只有Ag信号,说明样品为纯的银纳米粒子(样品是沉积在硅片上进行测试的,所以有硅的信号)。
3.3. 银纳米球的形成
银纳米球形成过程的反应方程式如下:
 (1)
(1)
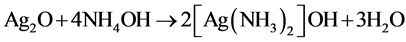 (2)
(2)
 (3)
(3)
根据前文所述,超声过程中会在溶液中瞬间形成很多细小的气泡,银纳米粒子逐渐沉积到这些小气

Figure 1. XRD pattern of the sample prepared at room temperature for 1 h
图1. 室温下反应1小时后制得样品的X射线衍射图样

Figure 2. (a) The SEM image of as-obtained Ag nanospheres; (b) Corresponding EDX spectrum
图2. 制备的银纳米球的(a) 扫描电镜图像;(b) 及其能谱图
泡表面,最终形成球状结构,这可能就是银纳米球的形成机制,这与Raji Vadakkekara [29] 等人在有气泡存在下制得银纳米球的机制类似。
当然,银纳米球的形成是多重因素共同作用的结果,超声时间、PVP和氨水的用量对银纳米球的最终形成都有着重要的影响。当超声时间为0.5 h时,溶液中逐渐形成了球状的纳米球,这时的银纳米球尺寸不一,分布不均,如图3(a1)所示;当超声时间为1.5 h时,部分银纳米球尺寸变得更小,如图3(a2)所示,这可能是长时间的瞬间高温熔融了先前形成的银纳米球的表面,因为温度可以影响材料的扩散和生长速率[30] 。当PVP为0.08 g和0.12 g时,如图3(b1)和图3(b2)所示,得到的样品尺寸大小不一且分布不均,因为表面活性剂能使晶体沿特定的方向生长[31] ,因此增加或减少表面活性剂的用量都能够改变样品的形貌。当不加氨水时,体系就变为硝酸银溶液与抗坏血酸的反应,其反应方程式如(4)所示:
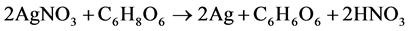 (4)
(4)
这与抗坏血酸与银氨溶液的反应(反应方程式(1)、(2)、(3))相比,反应步骤减少,速率加快,不利于纳米结构的形成,得到的样品尺寸较大,如图3(c1)所示;当氨水为2 mL时,得到的样品尺寸较小,但分布不均,如图3(c2)所示。当不加PVP和氨水时,如图3(d)所示,得到的样品尺寸很大且形貌不一,说明PVP和氨水在银纳米球的形成过程中起着至关重要的作用。
根据以上实验结果可知,银纳米球的形成是多种因素共同作用的结果,超声时间、PVP和氨水用量都对样品形貌有着重要的影响。在超声时间为1 h,PVP为0.1 g,氨水为1 mL时,反应最终产生了形貌尺寸分布均匀的球状纳米银,这是反应的最佳条件。制备的银纳米球被进一步用来探索其光学和催化活性。
3.4. 紫外–可见吸收光谱(UV-vis)分析
图4为样品的紫外–可见吸收光谱图像。图中出现一个吸收峰,其对应的波长为316 nm,其出现的原因目前还不清楚。然而,亚微细米级的银粒子可以呈现出除正常偶极共振外的多极等离子体共振,如







Figure 3. The SEM images of as-obtained products: (a1) with the reaction time of 0.5 h, (a2) with the reaction time of 1.5 h; (b1) with 0.08 g of PVP, (b2) with 0.12 g of PVP; (c1) without ammonium hydroxide, (c2) with 2 mL of ammonium hydroxide; (d) without PVP and ammonium hydroxide
图3. 不同变量下制备的样品的扫描电镜图像:(a1) 反应时间为0.5 h,(a2) 反应时间为1.5 h;(b1) PVP为0.08 g,(b2) PVP为0.12 g;(c1) 不添加氨水,(c2) 添加2 mL氨水;(d) 不添加PVP和氨水
四极、八极和十六极等离子体共振[32] 。我们得到的银纳米片的尺寸是在亚微细米尺度,因此318 nm处的峰或许可以归因于多极共振如八极或者十六极等离子体共振。
3.5. 催化降解活性分析
亚甲基蓝为阳离子噻嗪染料(图5),它在很多领域包括化学和生物学领域都有着很多用途。亚甲基蓝被广泛地用作分析化学中的氧化还原指示剂和水产养殖业中的抗疟疾和化疗剂。它也可用于在水生样品中硫化物离子的痕量级别的分析[33] 。亚甲基蓝的氧化形式的水溶液是深蓝色的,其还原形式是无色的。
尽管硼氢化钠是一种强还原剂,硼氢化钠的水溶液却无法有效地还原亚基甲蓝,这是因为这种染料和硼氢化钠之间有着明显的氧化还原电位差。其结果是,反应在动力学上被禁止,即使它在热力学上是允许的[34] [35] 。硼氢化钠对亚甲基蓝的降解分别在银纳米粒子存在和不存在下的条件下进行,其结果如图6所示。不添加银纳米粒子的实验组作为空白对照试验组,空白组实验结果显示,溶液的颜色及在664 nm处的峰吸收强度都没有明显变化。这表明亚甲基蓝不是单独由硼氢化钠降解,或者说在没有纳米催化剂的条件下它以一个难以辨别甚至可以忽略的缓慢速率进行降解。但当加入纳米银溶液10 min和20 min后,亚甲基蓝溶液颜色变浅,吸光度峰出现了显著下降。这种吸收峰的下降表明制得的银纳米粒子具有催化降解亚甲基蓝的潜力。
我们对制得的银纳米粒子对亚甲基蓝的催化机理也进行了简单的探讨。在电子转移步骤,当受主和施主之间存在一个大的氧化还原电位差时,可能会出现限制电子通过的情况。当一种催化剂具有受体和供体之间的中间氧化还原电位值时,电子的转移就会变得容易[36] 。我们发现,在作为氧化还原催化剂时,银纳米粒子充当了硼氢化钠的电子受主和亚甲基蓝的电子施主(图7)。这种效应被称为电子中继作用[35] 。

Figure 4. UV-visible absorption spectra of as-obtained silver nanospheres
图4. 制备的银纳米球的紫外–可见吸收光谱

Figure 5. Chemical structure of methylene blue
图5. 亚甲基蓝的化学结构式

Figure 6. Changes in absorbance value of methylene blue under different reaction conditions
图6. 不同反应条件下亚甲基蓝吸光度的变化
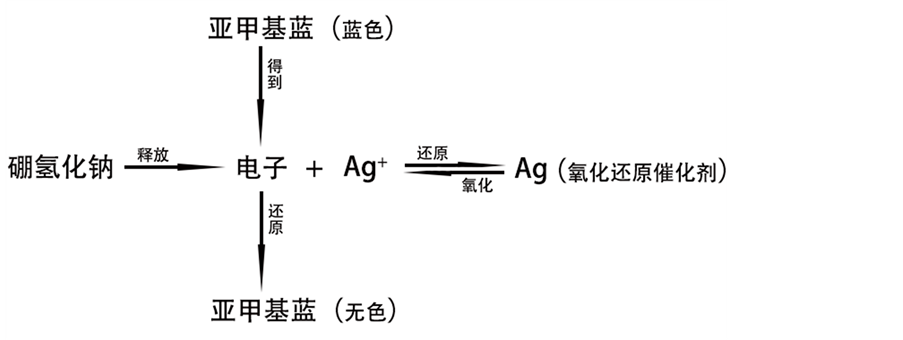
Figure 7. Mechanism of catalytic degradation of silver nanospheres on methylene blue
图7. 银纳米球对亚甲基蓝的催化降解机理
4. 结论
通过简便的超声辅助方法在PVP存在下于室温条件制备出了尺寸为300~400 nm的银纳米球。提出了产品的在坍塌的气泡表面的形成机理。实验表明,超声时间、PVP和氨水的用量对产品的形貌有重要影响。此外,催化降解实验表明,制备的银纳米球对亚甲基蓝有明显的催化降解效果。这种方法可以作为一种有效的方式用于其他的贵金属纳米球的合成。此外,考虑到制备方法和成本,这里介绍的合成方法简单、环保,这在产品的商业过程中更具有优势。
致谢
感谢重庆市重点自然科学基金(cstc2012jjB50011),中央高校基础研究重点基金(XDJK2013B017)和重庆市基础和先进科学研究项目(cstc2013jcyjA50015, cstc2012gjhz90002)对本文的资金支持。感谢覃礼钊副教授,林华老师对本文实验过程中的帮助。
文章引用
戴 策,李 庆,覃礼钊,林 华,聂 明,李 元, (2015) 超声辅助法制备银纳米球及其对亚甲基蓝的催化降解研究
Ultrasonic Wave Assisted Synthesis of Silver Nanospheres and Their Catalytic Degradation on Methylene Blue. 分析化学进展,02,7-15. doi: 10.12677/AAC.2015.52002
参考文献 (References)
- 1. You, C.C., Chompoosor, A. and Rotello, V.M. (2007) The biomacromolecule-nanoparticle interface. Nano Today, 2, 34-43.
- 2. Steffan, M., Jakob, A., Claus, P. and Lang, H. (2009) Silica supported silver nanoparticles from a silver(I) carboxylate: Highly active catalyst for regioselective hydrogenation. Catalysis Communications, 10, 437-441.
- 3. Sun, Y.G., Yin, Y.D., Mayers, B.T., Herricks, T. and Xia, Y.N. (2002) Uniform silver nanowires synthesis by reducing AgNO3 with ethylene glycol in the presence of seeds and poly(vinyl pyrrolidone). Chemistry of Materials, 14, 4736- 4745.
- 4. Chen, J.Y., Wang, D.L., Xi, J.F., Au, L., Siekkinen, A., Warsen, A., Li, Z.Y., Zhang, H., Xia, Y.N. and Li, X.D. (2007) Immuno gold nanocages with tailored optical properties for targeted photothermal destruction of cancer cells. Nano Letters, 7, 1318-1322.
- 5. Salem, A.K., Searson, P.C. and Leong, K.W. (2003) Multifunctional nanorods for gene delivery. Nature Materials, 2, 668-671.
- 6. Mirkin, C.A., Letsinger, R.L., Mucic, R.C. and Storhoff, J.J. (1996) A DNA-based method for rationally assembling nanoparticles into macroscopic materials. Nature, 382, 607-609.
- 7. Rastogi, P.K., Ganesan, V. and Krishnamoorthi, S. (2012) Microwave assisted polymer stabilized synthesis of silver nanoparticles and its application in the degradation of environmental pollutants. Materials Science And Engineering B- Advanced Functional Solid-State Materials, 177, 456-461.
- 8. Sanpui, P., Chattopadhyay, A. and Ghosh, S.S. (2011) Induction of Apoptosis in Cancer Cells at Low Silver Nanoparticle Concentrations using Chitosan Nanocarrier. Acs Applied Materials & Interfaces, 3, 218-228.
- 9. Balavandy, S.K., Shameli, K., Biak, D.R.B.A. and Abidin, Z.Z. (2014) Stirring time effect of silver nanoparticles prepared in glutathione mediated by green method. Chemistry Central Journal, 8.
- 10. Gonzalez, C.M., Liu, Y. and Scaiano, J.C. (2009) Photochemical Strategies for the Facile Synthesis of Gold-Silver Alloy and Core-Shell Bimetallic Nanoparticles. Journal Of Physical Chemistry C, 113, 11861-11867.
- 11. Shafaghat, A. (2015) Synthesis and characterization of silver nanoparticles by phytosynthesis method and their biological activity. Synthesis and Reactivity in Inorganic Metal-Organic and Nano-Metal Chemistry, 45, 381-387.
- 12. Huang, N.M., Radiman, S., Lim, H.N., Khiew, P.S., Chiu, W.S., Lee, K.H., Syahida, A., Hashim, R. and Chia, C.H. (2009) Gamma-ray assisted synthesis of silver nanoparticles in chitosan solution and the antibacterial properties. Che- mical Engineering Journal, 155, 499-507.
- 13. Darroudi, M., Zak, A.K., Muhamad, M.R., Huang, N.M. and Hakimi, M. (2012) Green synthesis of colloidal silver nanoparticles by sonochemical method. Materials Letters, 66, 117-120.
- 14. Wang, H.S., Qiao, X.L., Chen, J.G., Wang, X.J. and Ding, S.Y. (2005) Mechanisms of PVP in the preparation of silver nanoparticles. Materials Chemistry and Physics, 94, 449-453.
- 15. Byeon, J.H. and Kim, Y.W. (2012) A novel polyol method to synthesize colloidal silver nanoparticles by ultrasonic irradiation. Ultrasonics Sonochemistry, 19, 209-215.
- 16. Jiang, L.P., Wang, A.N., Zhao, Y., Zhang, J.R. and Zhu, J.J. (2004) A novel route for the preparation of monodisperse silver nanoparticles via a pulsed sonoelectrochemical technique. Inorganic Chemistry Communications, 7, 506-509.
- 17. Suslick, K.S. and Hammerton, D.A. (1986) The site of sonochemical reactions. IEEE Transactions on Ultrasonics Fer- roelectrics and Frequency Control, 33, 143-147.
- 18. Salkar, R.A., Jeevanandam, P., Aruna, S.T., Koltypin, Y. and Gedanken, A. (1999) The sonochemical preparation of amorphous silver nanoparticles. Journal of Materials Chemistry, 9, 1333-1335.
- 19. Thompson, L.H. and Doraiswamy, L.K. (1999) Sonochemistry: Science and engineering. Industrial & Engineering Chemistry Research, 38, 1215-1249.
- 20. Lee, G.W. and Byeon, J.H. (2009) Effects of ultrasonic processing on phase transition of flame-synthesized anatase TiO2 nanoparticles. Materials Characterization, 60, 1476-1481.
- 21. McNamara, W.B., Didenko, Y.T. and Suslick, K.S. (1999) Sonoluminescence temperatures during multi-bubble cavitation. Nature, 401, 772-775.
- 22. Suslick, K.S., Hammerton, D.A. and Cline, R.E. (1986) The sonochemical hot-spot. Journal of the American Chemical Society, 108, 5641-5642.
- 23. Alavi, M.A. and Morsali, A. (2010) Syntheses and characterization of Sr(OH)2 and SrCO3 nanostructures by ultrasonic method. Ultrasonics Sonochemistry, 17, 132-138.
- 24. Soltanzadeh, N. and Morsali, A. (2010) Sonochemical synthesis of a new nano-structures bismuth(III) supramolecular compound: New precursor for the preparation of bismuth(III) oxide nano-rods and bismuth(III) iodide nano-wires. Ultrasonics Sonochemistry, 17, 139-144.
- 25. Jeevanandam, P., Koltypin, Y., Palchik, O. and Gedanken, A. (2001) Synthesis of morphologically controlled lanthanum carbonate particles using ultrasound irradiation. Journal of Materials Chemistry, 11, 869-873.
- 26. Mohammadi, M. and Morsali, A. (2009) Different thallium(III) oxide nano-structures from direct thermal decomposition of two thallium(I) coordination polymers. Materials Letters, 63, 2349-2351.
- 27. Yin, H.B., Yamamoto, T., Wada, Y. and Yanagida, S. (2004) Large-scale and size-controlled synthesis of silver nanoparticles under microwave irradiation. Materials Chemistry and Physics, 83, 66-70.
- 28. Kotlyar, A., Perkas, N., Amiryan, G., Meyer, M., Zimmermann, W. and Gedanken, A. (2007) Coating silver nanoparticles on poly(methyl methacrylate) chips and spheres via ultrasound irradiation. Journal of Applied Polymer Science, 104, 2868-2876.
- 29. Vadakkekara, R., Chakraborty, M. and Parikh, P.A. (2012) Reduction of aromatic nitro compounds on colloidal hollow silver nanospheres. Colloids and Surfaces a-Physicochemical and Engineering Aspects, 399, 11-17.
- 30. Madras, G. and McCoy, B.J. (2003) Temperature effects for crystal growth: A distribution kinetics ap-proach. Acta Ma- terialia, 51, 2031-2040.
- 31. Lee, C.L., Syu, C.M., Chiou, H.P., Chen, C.H. and Yang, H.L. (2011) High-yield, size-controlled synthesis of silver nanoplates and their applications as methanol-tolerant electrocatalysts in oxygen reduction reaction. International Journal of Hydrogen Energy, 36, 10502-10512.
- 32. Kumbhar, A.S., Kinnan, M.K. and Chumanov, G. (2005) Multipole plasmon resonances of submicron silver particles. Journal of the American Chemical Society, 127, 12444-12445.
- 33. Small, J.M. and Hintelmann, H. (2007) Methylene blue derivatization then LC-MS analysis for measurement of trace levels of sulfide in aquatic samples. Analytical and Bioanalytical Chemistry, 387, 2881-2886.
- 34. Ghosh, S.K., Kundu, S., Mandal, M. and Pal, T. (2002) Silver and gold nanocluster catalyzed reduction of methylene blue by arsine in a micellar medium. Langmuir, 18, 8756-8760.
- 35. Gupta, N., Singh, H.P. and Sharma, R.K. (2011) Metal nanoparticles with high catalytic activity in degradation of methyl orange: An electron relay effect. Journal of Molecular Catalysis A: Chemical, 335, 248-252.
- 36. Mallick, K., Witcomb, M. and Scurrell, M. (2006) Silver nanoparticle catalysed redox reaction: An electron relay effect. Materials Chemistry and Physics, 97, 283-287. http://www.cajcd.edu.cn/pub/wml.html