Advances in Analytical Chemistry
Vol.
10
No.
04
(
2020
), Article ID:
38510
,
8
pages
10.12677/AAC.2020.104015
PLGA纳米微粒的制备及应用
杨忆斐,刘天龙
中国农业大学,动物医学院纳米病理学实验室,北京

收稿日期:2020年10月12日;录用日期:2020年10月29日;发布日期:2020年11月5日

摘要
聚乳酸–乙醇酸共聚物(PLGA)作为药物传递系统的其中之一,已在疾病治疗以及生物组织工程中得以广泛应用。PLGA作为FDA和欧洲药品局批准使用的注射药物系统,其安全性和有效性得到广泛证实,并在科学研究领域掀起热潮。PLGA纳米粒包备药物较常规工艺制备药物在实现缓释、提高药效、减少用药量及不良反应等方面更具优势。通过纳米颗粒的制备方法及表面修饰可增加难溶性物质的溶解度,提高药物与机体的免疫相容性,使药物更具穿透力及靶向性。本文将对过往关于PLGA纳米粒的制备方法及PLGA疾病治疗方面的应用进行总结与归纳,以便后人的初步了解与深入研究。
关键词
PLGA纳米微球,制备方法,药物治疗,应用
The Preparation and Application of PLGA Nanoparticles
Yifei Yang, Tianlong Liu
Nanopathology Laboratory, College of Veterinary Medicine, China Agricultural University, Beijing

Received: Oct. 12th, 2020; accepted: Oct. 29th, 2020; published: Nov. 5th, 2020

ABSTRACT
Polylactic acid-glycolic acid copolymer (PLGA) as one of the drug delivery systems has been widely used in disease treatment and biological tissue engineering. As an injectable drug system approved by the FDA and the European Medicines Agency, PLGA’s safety and effectiveness have been widely confirmed, and it has set off an upsurge in the field of scientific research. Compared with the drugs prepared by conventional processes, the use of PLGA nanoparticle to prepare drugs has more advantages in achieving sustained release, improving drug efficacy, reducing drug dosage and adverse reactions. The preparation methods and surface modification of nanoparticles can increase the solubility of insoluble substances, improve the histocompatibility of drugs, and make drugs more penetrating and targeted. This article will summarize the past preparation methods of PLGA nanoparticles and the application of PLGA disease treatment in order to facilitate the initial understanding and in-depth study of future researchers.
Keywords:PLGA Nanoparticles, Preparation, Medical Treatment, Application

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. PLGA纳米微球概述
PLGA因各种独特性质而备受瞩目,其配方更是被形容为能够适应各种亲水、疏水、大分子、小分子药物 [1],解决难溶于水的药物生物利用低的问题。乳酸和羟基乙酸通过随机开环聚合反应、在锡(II)-2-乙基乙醇、锡(II)-醇盐或异丙醇铝的催化作用下得到PLGA [2]。同时,PLGA的分解则是通过水解和降解作用使主链中酯键断裂,分解成产物乳酸及羟基乙酸 [3] [4]。产物乳酸通过机体的三羧酸循环转变为水与二氧化碳排出体外;羟基乙酸除三羧酸循环途径转换外,还可由机体肾脏直接排出。因此,PLGA纳米颗粒具有相当高的生物安全性,这是其特性之一,也是PLGA被广泛应用的基础与前提。
纳米球是指粒径大小在200 nm以下,由天然、合成或半合成的高分子材料制成的微球。大量实验数据表明制备获得的PLGA纳米微球粒径在一定范围内越小,其性能越优。因此将粒径作为评价PLGA纳米微球性能的重要指征之一。早在20世纪90年代已有研究指出微粒粒径大小于肠道组织对可生物降解微粒的吸收有影响作用,实验表明 [5] 肠道组织对于粒径为100 nm大小的颗粒的吸收效率是大颗粒物质的15~250倍,胃肠道黏膜组织对于大颗粒物质具有排斥现象,而对粒径大小为100 nm的微粒吸收明显增加。近年,在针对PLGA靶向抗肿瘤的实验研究过程中,也有相关研究 [6] 证实当粒径在200 nm以下的纳米微球相较于粒径在微米级的微球其吸收效率提高了6倍。
2. PLGA纳米微球的制备
PLGA纳米微球制备方法不同,针对的用药途径、作用以及药物作用速度、疗程亦不同。通过调控PLGA纳米颗粒的分子量、粒径大小、聚合物比例以及制备方法等影响药物在机体内的释放特性 [3]。目前常见的制备方法主要有乳化溶剂挥发法、喷雾干燥法、凝聚法、超临界CO2法、微流控法等。不同的制备方法对于包载药物的释放、药效及其他性能都有着显著差异,其原理及各自优势及缺陷可见表1。不同的生产单位在面对不同的需求时,需要谨慎选择纳米微球的制备方法。
2.1. 乳化溶剂挥发法
乳化溶剂挥发法是目前实验室最常见、使用范围最广泛的一种PLGA纳米微粒的制备方法。基本原理是将有机溶剂与待包埋物质经超声融合形成乳液,后通过去除有机溶剂使分散相固化形成微球。除去乳剂最常见的方法使通过搅拌使有机溶剂挥发,此外还有溶剂抽提、溶剂扩散等方法。根据乳化方式不同则可制备成多种不同型的微乳液,主要包括基本型的O/W型与W/O型以及复合型的O/W/O型、W/O/W型、W/O/O型、S/O/O型、S/O/W型等。各种不同型乳液针对其包备的药物性质也有所不同。图1为常规复合型乳化挥发法制备材料的大致步骤。
Table 1. Advantages and disadvantages of different methods of preparing PLGA nanoparticles
表1. 不同方式制备PLGA纳米微粒的优缺点
O/W乳化法也称为水包油法,适用于包备不易溶于水的物质。将难溶于水的药物与易挥发的有机溶剂如氯仿充分混合后加入至含PVA的溶液中,超声形成乳液并会发有机溶剂,最终得到包备有药物的PLGA纳米球。但获得纳米颗粒形态往往缺乏均一性,容易粘连。W/O、W/O/W法则多适用于易溶于水的物质,基本操作步骤与O/W法类似。
乳剂挥发法的制作工艺较为复杂,控制变量多,难以实现批量化、商品化。乳剂挥发法应用之初,制备获得的PLGA颗粒的载药量(基因载量)极低,后Tinsley-Bown等通过替换有机溶剂乙酸乙酯,使用二氯甲烷成功提高了载量及其他参数 [7]。与此相关的研究不断增加,针对不同运载物质的性质,乳剂挥发法也在进一步优化。
2.2. 纳米沉淀法
纳米沉淀法广泛应用于多种药物(喜树碱、紫杉醇、顺铂、青霉素等) PLGA纳米粒的制备 [8],其基本原理为通过控制有机溶剂中的疏水物质与水混合,使其局部过饱和后析出纳米颗粒 [9]。纳米沉淀法相对操作简单,全过程仅需一步,因此有利于推广和大规模生产。由于不需要借助超声、高温等外界刺激以及毒性有机溶剂,可以更大程度地保存诸如核酸、蛋白以及疫苗地生物活性 [10]。在此基础上发展出更加新颖的瞬时纳米沉淀法,即于混合腔(Confined impinging jets mixer, CIJ或Multi-inlet vortex mixer, MIVM)中将双亲性聚合物与有机溶剂喝水迅速混合,数微秒甚至毫秒内使有机溶剂过饱和,促使其形成疏水纳米核并生长 [11]。制备获得的纳米粒具有较窄的粒径范围,即制备所得的PLGA纳米球形态较为均一。
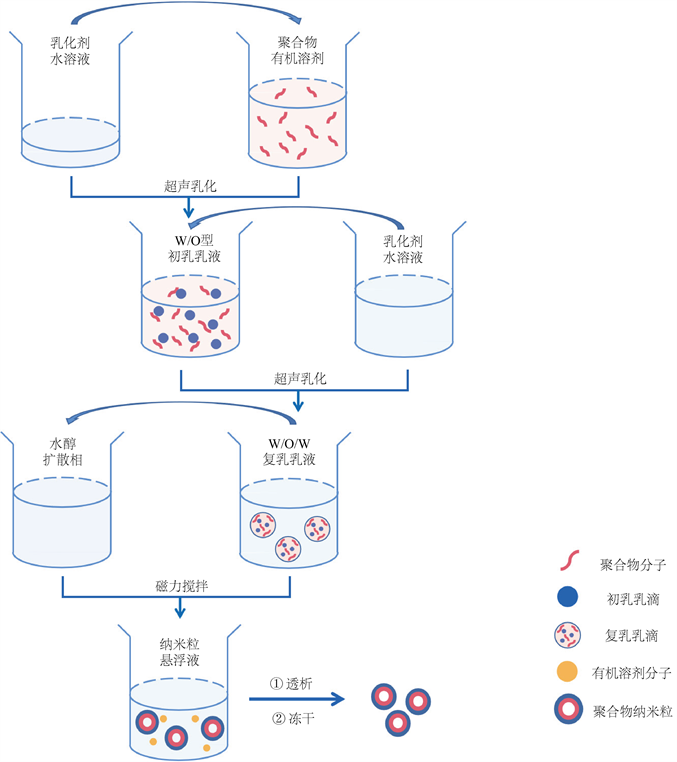
Figure 1. Conventional steps of compound emulsification solvent evaporation method
图1. 复合乳化溶剂挥发法常规步骤 [13]
2.3. 乳化溶剂扩散法
乳化溶剂扩散法是结合溶剂挥发法和沉淀法发展而来,最初由Perez等人成功开发并应用于聚乳酸–聚乙二醇(PLA-PEG)纳米粒的制备 [12]。有实验证明,以纳米微球的粒径、粒径分布状况及其形貌进行表征,乳化溶剂扩散法制备所得的纳米粒在粒径和包封率上较乳化溶剂挥发法更优,对于药物的损伤更小,更大程度地保留包载药物地活性 [13]。
但由于乳化溶剂扩散法在制备过程中同样使用了超声进行乳化,因此对DNA等极易受破坏的物质活性仍有或多或少的影响,引起物质降解,不能充分保存包载物质活性。因此,Csaba等人开发出新的纳米连接载体系统,由PLGA与聚氧乙烯衍生物混合形成共聚复合物以更好地用于质粒DNA的运载 [14]。
2.4. 喷雾干燥法
喷雾干燥法因其制备工艺简易、受限条件少、产出量较大,多用于工业生产等大型、批量生产以降低成本。其基本原理为利用热空气使聚合物中的溶剂挥发实现固化作用。喷雾干燥法主要适用于制备简单亲水性药物的纳米微球,难以满足更加复杂的多孔PLGA纳米微球制备的需求。其主要操作过程为 [15]:将待包载药物溶解于聚合物溶剂之中,再用喷雾的方法将混合物喷入惰性气体之中;进入惰性气流的小液滴迅速蒸发其中的溶剂,随后使待包载药物包埋于聚合材料物中。
喷雾干燥法制备所得的微球粒径较为均一,粘连少,包埋率较高,但干燥设备需要另外设计,且因其制备过程需要高温高压的条件而增加了操作风险,使用的惰性气体于防爆装置较为昂贵,目前仍难以大规模推广。其高温操作也不利于活性物质的包埋。
2.5. 低温喷雾萃取法
低温喷雾萃取法是在喷雾干燥法基础上进一步发展而来的一种能更好保存包载蛋白质活性的PLGA纳米球制备技术。其基本方法与喷雾干燥法类似,雾化的混合物液滴不再喷入惰性气体中,而是直接进入冰冻乙醇溶液中。混合物中的有机溶剂在乙醇溶液中溶解扩散,微球则留于表面。最后低温干燥去除乙醇,获得干燥PLGA纳米球的粉末颗粒。
低温喷雾萃取法生产获得的PLGA纳米微球包封率较喷雾干燥法高,粒径也更加均一,但由于其高额的成本、复杂的制备工艺难以推广,曾经部分尝试使用该方法制备微球的公司也已宣布停产 [16]。不过,低温萃取也为将来的制备工艺提供了新的思路,通过改善制备工艺流程来尽可能保存包载药物的活性(大量纳米球表面改性或修饰易引起粒径的扩大,不利于药物的吸收与释放)。
2.6. 水凝胶法
水凝胶模板技术作为一种新型PLGA纳米微球载药系统的方法,目前未得到广泛使用,但其优越的包封率与药物利用率,在未来有较大的拓展空间。其主要原理为利用交联形成的凝胶系统构建缓释载体,挥发聚合物中的溶剂固化形成纳米材料。主要目的是利用凝胶的溶胶–凝胶可转换的物理性质广泛用于负载小分子药物以提高疏水性药物的利用率,降低负载药物的毒副作用,实现药物长期缓释 [17]。
近年来,在水凝胶模板法基础上优化获得的温敏聚合物水凝胶作为局部载药系统引起了广泛的关注。其优势在于通过不同温度下水凝胶的转化实现药物的储存与释放,低温条件下,被运载药物可溶解于溶液中,通过注射等方式进入机体循环;高温(体温)条件下,溶液转变为凝胶从而实现药物的缓慢释放。目前有将水凝胶-PLGA复合载药体系用于长效镇痛方面的研究 [18],以期减少长效镇痛药物的毒副作用。
2.7. 微流控技术
微流控技术是近年来一种通过操控微体积液体的新型PLGA纳米微球制备方法 [19],制备过程基本示意图可见图2。其原理为互不相溶的流体在十几微米尺度的微通道内,通过流动剪切力及表面张力的相互作用,彼此碰撞最终分割为离散的微米级液滴 [20]。由相关微流体设备可对多组分乳剂进行高度精确的控制,液滴的数量、大小、构成比例均可得到精确控制 [21] 而实现标准化,具有广阔的应用前景。有研究表明微流控法制备所得的PLGA微球较乳化溶剂挥发法形态结构更加均匀,分散性更好 [20]。
2.8. 超临界CO2法
利用超临界CO2对聚合物进行塑化,使材料在较为温和的条件下(即降低可塑材料的转变温度)制备获得多孔支架 [22],从而拓展PLGA纳米颗粒的制备途径。超临界流体(supercritical fluid, SCF)是指温度与压力分别高于其临界温度(Tc)和临界压力(Pc)的流体,一般最常用的即为CO2。
其主要操作原理可见图3 [23],大致可分为三步 [24]:第一,室温下高压CO2,气体扩散溶解至聚合物内部形成CO2与聚合物的均相体系;第二,将CO2气体压力降低至正常大气压水平,聚合物内气体溶解度迅速降低,CO2热力失平衡形成气核;第三,气核生长阶段,气核不断生长形成孔洞,CO2溢出聚合物,与此同时聚合物固化,即获得多孔结构的聚合物。
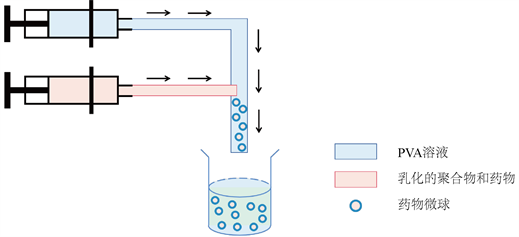
Figure 2. Preparation of nanoparticles by microfluidic technology
图2. 微流控技术制备纳米颗粒 [23]
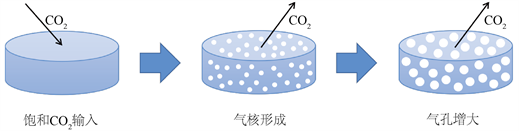
Figure 3. Process of supercritical CO2 foam
图3. 超临界CO2发泡过程 [22]
3. PLGA纳米微球的应用
3.1. 用于药物的包载
近年来,美国FDA已批准多种PLGA载药微球应用于前列腺癌、生长激素缺乏症、肢端肥大症、牙周病和精神病等的临床,如De-capeptyl®、Lupron Depot®、Suprecur®、Nutropin Depot®、So-matulin®、Sandostatin LAR®、Risperidal®和 Arestin®等 [25]。目前我国也已构建了大量基于PLGA的载药微球用于各种疾病的治疗的理论模型,如通过PLGA包备胰岛素来增强和延长治疗糖尿病的效果 [16];成功制备透过血脑屏障的脑靶向高分子聚合物纳米载体 [26];利用PLGA微球系统包备碱性成纤维细胞因子(bFGF)进行创面修复 [27] 等。
3.2. 用于疫苗载体
PLGA纳米球载药体系可用于疫苗载体,最近研究表明PLGA微球可作为药物转运系统乘载轮状病毒的菌株以及血清白蛋白稳定剂,用于刺激机体产生IgA及IgG抗体,单次口服抗原量仅需20 μg,同等药效下远低于单独使用该抗原的用药量 [28]。现阶段研究表面聚乙烯亚胺接枝PLGA的阳离子纳米颗粒作为一种新型载体,可用于相关质粒的DNA运载 [26]。
3.3. 用于癌症治疗
在癌症治疗方面,PLGA纳米粒可作为DNA治疗癌症的有效载体。通常质粒DNA在到达癌症部位前于血液循环中被核酸酶迅速消化降解,难以发挥作用 [29]。PLGA纳米粒一方面对DNA进行保护,另一方面通过对PLGA表面进行修饰而使药物获得靶向性 [30]。
4. PLGA纳米微球的未来展望
2006年前后的相关研究表明,PLGA等新型药物载药系统用于临床实际的局限性主要集中于药物的低生物利用度、有限的有效靶向性以及对其潜在的细胞毒性的不确定性 [31]。经过十多年的努力,基于PLGA的载药系统及缓释系统不断完善、不断深入,其安全性得到肯定,即实现了向广泛应用于临床的一大跨步。目前,越来越多的研究向增强药物靶向性前进,通过PLGA纳米颗粒的表面修饰及制备工艺革新,癌症的化学治疗有了新的方向和新的突破。但目前PLGA纳米颗粒仍存在相当一部分问题:第一,早期提出的低生物利用度问题始终没有得到解决。生物利用度低一方面是指PLGA纳米颗粒包备的药物量实际到达患病部位并发挥作用的量远低于预期;另一方面也指PLGA包备药物的制备过程中损耗持续存在。药物的制作成本以及耗损药物量也应在科研过程中纳入考虑范围,若制备过程中损耗的药量超过实际临床中可达到同等药效的药物量,则会大大降低其实际临床应用价值,难以推广以及应用于临床。第二,PLGA包备药物在体内的缓释具有不稳定性,易发生早释、释放速度过慢等问题。如药物于肿瘤细胞中释放速度过慢会严重影响药效甚至没有效果,近年来部分研究通过对PLGA纳米颗粒进行表面修饰,创新性地制备了一种硫辛酰基封端的星形PLGA智能聚合物以提高PLGA纳米颗粒包备药物地稳定性,并可被肿瘤细胞大量摄取 [30]。
文章引用
杨忆斐,刘天龙. PLGA纳米微粒的制备及应用
The Preparation and Application of PLGA Nanoparticles[J]. 分析化学进展, 2020, 10(04): 99-106. https://doi.org/10.12677/AAC.2020.104015
参考文献
- 1. Danhier, F., Ansorena, E., Silva, J.M., et al. (2012) PLGA-Based Nanoparticles: An Overview of Biomedical Applications. The Journal of Controlled Release, 161, 505-522.
https://doi.org/10.1016/j.jconrel.2012.01.043 - 2. Wang, C.K., Wang, W.Y., Meyer, R.F., et al. (2010) A Rapid Method for Creating Drug Implants: Translating Laboratory-Based Methods into a Scalable Manufacturing Process. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 93, 562-572.
https://doi.org/10.1002/jbm.b.31617 - 3. Jalil, R. and Nixon, J.R. (1990) Biodegradable Poly(lactic acid) and Poly(lactide-co-glycolide) Microcapsules: Problems Associated with Preparative Techniques and Release Properties. Journal of Microencapsulation, 7, 297-325.
https://doi.org/10.3109/02652049009021842 - 4. Cohen, S., Alonso, M.J. and Langer, R. (1994) Novel Approaches to Controlled-Release Antigen Delivery. International Journal of Technology Assessment in Health Care, 10, 121-130.
https://doi.org/10.1017/S0266462300014045 - 5. Desai, M.P., Labhasetwar, V., Amidon, G.L., et al. (1996) Gastrointestinal Uptake of Biodegradable Microparticles: Effect of Particle Size. Pharmaceutical Research, 13, 1838-1845.
https://doi.org/10.1023/A:1016085108889 - 6. Jeong, Y.I., Kim, D.H., Chung, C.W., et al. (2012) Self-Assembled Nanoparticles of Hyaluronic Acid/Poly(DL-lactide- co-glycolide) Block Copolymer. Colloids and Surfaces B: Biointerfaces, 90, 28-35.
https://doi.org/10.1016/j.colsurfb.2011.09.043 - 7. 张清. 生物可降解聚合物作为非病毒基因载体的研究进展[J]. 食品与药品, 2009, 11(6): 61-64.
- 8. 李艳, 罗成, 周婕. 纳米沉淀法及其在纳米药物载体领域的应用研究进展[J]. 中国生物医学工程学报, 2017, 36(4): 483-489.
- 9. Lepeltier, E., Bourgaux, C. and Couvreur, P. (2014) Nanoprecipitation and the “Ouzo Effect”: Application to Drug Delivery Devices. Advanced Drug Delivery Reviews, 71, 86-97.
https://doi.org/10.1016/j.addr.2013.12.009 - 10. Yoo, H.S., Choi, H.K. and Park, T.G. (2001) Protein-Fatty Acid Complex for Enhanced Loading and Stability within Biodegradable Nanoparticles. Journal of Pharmaceutical Sciences, 90, 194-201.
https://doi.org/10.1002/1520-6017(200102)90:2<194::AID-JPS10>3.0.CO;2-Q - 11. 李猛. 基于瞬时纳米沉淀法制备电荷反转纳米药物载体及其肿瘤成像应用[D]: [硕士学位论文]. 上海: 华东理工大学, 2018.
- 12. Perez, C., Sanchez, A., Putnam, D., et al. (2001) Poly(lactic acid)-poly(ethylene glycol) Nanoparticles as New Carriers for the Delivery of Plasmid DNA. Journal of Controlled Release, 75, 211-224.
https://doi.org/10.1016/S0168-3659(01)00397-2 - 13. 李昱霖. W/O/W复乳化溶剂扩散技术制备包载DhHP-6的PLGA纳米粒[D]: [硕士学位论文]. 长春: 吉林大学, 2014.
- 14. Csaba, N., Caamano, P., Sanchez, A., et al. (2005) PLGA: Poloxamer and PLGA: Poloxamine Blend Nanoparticles: New Carriers for Gene Delivery. Biomacromolecules, 6, 271-278.
https://doi.org/10.1021/bm049577p - 15. 梁晓飞. 壳聚糖季铵盐多功能靶向纳米微球的制备及在药物载体方面的应用[D]: [博士学位论文]. 天津: 天津大学, 2009.
- 16. 武俊紫. 基于PLGA和AAPBA构建长效葡萄糖敏感型胰岛素载药微球的研究[D]: [博士学位论文]. 上海: 东华大学, 2017.
- 17. 李长娥. 金属配合物及温敏水凝胶纳米体系的抗肿瘤活性研究[D]: [硕士学位论文]. 广州: 暨南大学, 2018.
- 18. 张文婧. 可注射原位水凝胶/微球复合载药系统在长效镇痛中的应用[D]: [硕士学位论文]. 长春: 吉林大学, 2018.
- 19. Whitesides, G.M. (2006) The Origins and the Future of Microfluidics. Nature, 442, 368-373.
https://doi.org/10.1038/nature05058 - 20. 陈红, 徐菊美, 赵世成, 等. 微流控法制备PLGA微球及其性能研究[J]. 现代化工, 2018, 38(1): 129-132.
- 21. Wang, W., Xie, R., Ju, X.J., et al. (2011) Controllable Microfluidic Production of Multicomponent Multiple Emulsions. Lab on a Chip, 11, 1587-1592.
https://doi.org/10.1039/c1lc20065h - 22. 辛新. 超临界CO2发泡法制备生物活性多孔PLGA支架及活性因子释放过程研究[D]: [博士学位论文]. 杭州: 浙江大学, 2017.
- 23. 邱晓明, 甄平, 李松凯. 聚乳酸–羟基乙酸共聚物载药微球制备工艺研究进展[J]. 中国组织工程研究, 2018, 22(10): 1599-1604.
- 24. Mooney, D.J., Baldwin, D.F., Suh, N.P., et al. (1996) Novel Approach to Fabricate Porous Sponges of Poly(D,L-lactic-co-glycolic acid) without the Use of Organic Solvents. Biomaterials, 17, 1417-1422.
https://doi.org/10.1016/0142-9612(96)87284-X - 25. Wischke, C. and Schwendeman, S.P. (2008) Principles of Encapsulating Hydrophobic Drugs in PLA/PLGA Microparticles. International Journal of Pharmaceutics, 364, 298-327.
https://doi.org/10.1016/j.ijpharm.2008.04.042 - 26. 宋远见. 脑靶向高分子聚合物纳米药物载体的制备、表征和应用[D]: [博士学位论文]. 徐州: 中国矿业大学, 2012.
- 27. 杨光. 共载纳米银及bFGF的PLGA/PCL壳核结构微球制备及促进创面修复的实验研究[D]: [博士学位论文]. 长春: 吉林大学, 2018.
- 28. Nayak, B., Panda, A.K., Ray, P., et al. (2009) Formulation, Characterization and Evaluation of Rotavirus Encapsulated PLA and PLGA Particles for Oral Vaccination. Journal of Microencapsulation, 26, 154-165.
https://doi.org/10.1080/02652040802211709 - 29. 杨成莉, 王月, 何俊, 等. 基于PLGA的纳米基因载体及其在癌症治疗中的应用进展[J]. 遵义医学院学报, 2017, 40(6): 693-696.
- 30. 王秀秀. 基于星型PLGA的还原敏感纳米药物的设计及肿瘤靶向治疗[D]: [博士学位论文]. 苏州: 苏州大学, 2018.
- 31. Goldberg, M., Langer, R. and Jia, X. (2007) Nanostructured Materials for Applications in Drug Delivery and Tissue engineering. Journal of Biomaterials Science, Polymer Edition, 18, 241-268.
https://doi.org/10.1163/156856207779996931
