Advances in Clinical Medicine
Vol.08 No.05(2018), Article ID:25773,7
pages
10.12677/ACM.2018.85074
Expression and Location Analysis of Human Telomerase Reverse Transcriptase in Infantile Hemangiomas at Different Stages
Jia Wu1,2, Tian An3, Anwei Chen4, Jianyong Dong5, Shaohua Liu4*
1School of Stomatology, Shandong University, Jinan Shandong
2Oral and Maxillofacial Surgery, Juxian People’s Hospital, Juxian Shandong
3School of Medicine, Shandong University, Jinan Shandong
4Department of Oral and Maxillofacial Surgery, Qilu Hospital, Shandong University, Jinan Shandong
5Oral and Maxillofacial Surgery, Jinan Stomatology Hospital, Jinan Shandong

Received: Jun. 4th, 2018; accepted: Jul. 2nd, 2018; published: Jul. 9th, 2018

ABSTRACT
PURPOSE: To investigate the expression and location of telomerase reverse transcriptase (hTERT) in infantile hemangiomas (IHs) at different stages. METHODS: Immunohistochemical method was used to detect the expression and location of hTERT in IHs tissues at different stages and normal tissues adjacenting to IHs respectively. Using computer collecting the images, the staining status was evaluated by IHC semi-quantitative integral method and Image-Pro Plus (IPP) V6.0 image analysis software; related statistical approaches were used to analyze the data. RESULTS: Different levels of hTERT expression were shown in all IHs samples with scattered staining pattern. The positive staining cells were mainly in hemangioma endothelial cells and localized in the cytoplasm and karyon. The average optical density in proliferating positive cells was significantly higher than that in involuting ones, and the difference was statistically significant (P < 0.05); the mean optical density of hTERT positive cells of IHs tissues at different stages was significantly correlated with the final score of IHC semi-quantitative integral method (r = 0.99, p = 0.00). CONCLUSIONS: Strongest telomerase activity exists in the proliferating stage of IHs. The position of telomerase activity basically locates in cytoplasm and karyon of hemangioma endothelial cells.
Keywords:Infantile Hemangiomas, Telomerase, Human Telomerase Reverse Transcriptase, Immunohistochemistry
不同分期血管瘤组织中端粒酶逆转录酶的 表达及定位分析
武甲1,2,安恬3,陈安威4,董建勇5,刘少华4*
1山东大学口腔医学院,山东 济南
2莒县人民医院,口腔颌面外科,山东 莒县
3山东大学医学院,山东 济南
4山东大学齐鲁医院,口腔颌面外科,山东 济南
5济南市口腔医院,口腔颌面外科,山东 济南

收稿日期:2018年6月4日;录用日期:2018年7月2日;发布日期:2018年7月9日

摘 要
目的:探讨端粒酶逆转录酶(hTERT)在不同时期婴幼儿血管瘤(His)中的表达和定位意义。方法:免疫组织化学(IHC)法检测hTERT在不同时期IHs组织及瘤周正常组织中的表达及定位,计算机采集图像,IHC半定量积分法及Image-Pro Plus(IPP) v6.0图像分析软件评估结果,相关统计方法分析数据。结果:hTERT在不同时期IHs组织中均有不同程度表达,呈散在分布;免疫组化阳性染色细胞主要是血管瘤内皮细胞,定位于胞浆及胞核;增殖期阳性细胞的平均光密度值明显高于消退期,具有显著性差异(P < 0.05);不同时期IHs的阳性细胞平均光密度值与IHC半定量积分法最终得分之间呈显著正相关(r = 0.99, P = 0.00)。结论:增殖期IHs组织中存在较强的端粒酶活性。端粒酶活性来源定位主要在血管瘤内皮细胞的胞浆及胞核。
关键词 :婴幼儿血管瘤,端粒酶,人端粒酶逆转录酶,免疫组织化学

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
婴幼儿血管瘤(infantile hemangiomas, IHs)是发生于婴幼儿的常见良性肿瘤,多在出生后不久或1岁以内发病 [1] ,病变大多能够自行消退,病变进展过程呈现增殖期、消退期和消退完成期三个阶段。目前,IHs的发病原因以及不同阶段发展过程的调控机制尚不清楚。
端粒是染色体末端高度保守的重复核苷酸序列,具有防止染色体降解、末端融合和重组等功能 [2] 。目前认为,端粒的长度与细胞老化关系密切,而其长度的调节主要受端粒酶调控。端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)是端粒酶的主要调节亚单位,作为端粒酶相关功能蛋白,hTERT的表达强度普遍用于反映端粒酶活性 [3] 。
增殖期IHs的血管内皮细胞增殖活性较高,以往研究发现IHs组织中存在端粒酶活性,并有hTERT mRNA的表达 [4] [5] ,但对于hTERT在血管瘤组织中的细胞定位及其在血管瘤各个时期的表达是否不同尚处未知。本实验采用免疫组织化学(IHC)方法检测hTERT在不同时期婴幼儿血管瘤中的表达,以研究IHs发展过程中端粒酶活性的动态变化,并通过特异性染色初步确定其在IHs组织中的定位,从而进一步探讨IHs特有的快速增殖和生长自限性机制。
2. 材料和方法
2.1. 临床资料
纳入2012~2016年间于山东大学齐鲁医院口腔科或小儿外科行手术切除的婴幼儿血管瘤病例,增殖期15例(3~12月龄),消退期8例(1~4岁龄),血管瘤周围正常组织5例,阳性对照组选取皮肤恶性黑色素瘤标本。病例纳入标准:① 根据Mulliken标准 [6] 结合病理诊断为婴幼儿血管瘤;② 手术之前未行任何其他治疗;③ 病变表面无明显破溃、感染。选取组织切片的固定、脱水、透明、包埋等步骤由山东大学齐鲁医院病理科按照统一的步骤完成。本研究经山东大学齐鲁医院伦理委员会批准并取得患儿监护人的知情同意。
2.2. 实验方法
采用免疫组织化学EnVision法,一抗为人端粒酶逆转录酶兔抗人单克隆抗体(Abcam,美国),二抗为辣根过氧化氢酶标记的山羊抗兔IgG聚合物(北京中杉金桥生物技术有限公司)。具体的操作流程如下:60℃下烤片30 min;常规二甲苯脱蜡,梯度乙醇脱水;PBS漂洗3 min × 3次;30%H202 + 甲醇(1:9)灭活内源性过氧化氢酶10 min;PBS漂洗3 min × 3次;抗原修复:0.1%的蛋白酶k消化10 min,置入0.01 M柠檬酸缓冲液(PH6.0 ± 0.1)中,微波炉加热(95℃, 10~15 min),冷却至室温,反复2次;PBS漂洗3 min × 3次;10%正常山羊血清工作液37℃封闭10 min,倾去勿洗;分别滴加一抗hTERT(1:60),空白对照组为PBS代替一抗,4℃冰箱过夜后37℃复温30 min;PBS漂洗3 min × 3次;滴加辣根过氧化氢酶标记的山羊抗兔IgG聚合物(1:50),37℃孵育40 min;PBS漂洗3 min × 3次;DAB显色;苏木素复染;脱水,透明,封片。
2.3. 图像采集、分析及结果判定
正置显微镜(Leica,德国)采集图像:调整光源为日光色温的白色光,在保证显微镜光源稳定一致前提下,分别用100倍、200倍视野观察每张切片阳性表达情况,选取染色相对集中的5个视野,在400倍视野下,使用相同的曝光时间,利用Leica LAS AF Lite 4.0软件一次拍摄完成所有照片。
Image-Pro Plus(IPP) v6.0软件分析图像:首先进行光密度校正,然后选取图片上具有阳性染色的区域(AOI, area of interesting),测量该区域的光密度参数(IOD)和有效统计区域的面积(area),最后计算选择区域内的平均光密度值IOD/area(density mean)。同样,在进行光密度校正后分别选定阳性细胞及阴性细胞,计算平均阳性着色细胞百分比。
免疫组化染色结果:hTERT的染色结果以细胞核出现棕黄色颗粒为阳性,而非核仁及细胞质中出现。阴性记为0分;浅染的棕黄色无明显颗粒记为1分;较深的棕黄色,可见明显颗粒记为2分;深棕黄色并且有浓染颗粒出现记为3分。
根据IPP软件评估和镜下观测,结果按照半定量积分法进行判定:最终得分 = 平均阳性染色强度 × 平均阳性着色细胞百分比,最后得分总值 < 1记为弱阳性(+),1~1.5为中等阳性(++),>1.5为强阳性(+++)。
2.4. 统计学分析
Pearson相关系数分析统计量之间的相关性,卡方检验、F检验、T检验分析差异性,P < 0.05为具有显著性差异。
3. 结果
在15例增殖期婴幼儿血管瘤组织中,有11例hTERT呈阳性表达,其中弱阳性(+) 6例,中等阳性(++) 4例,强阳性(+++) 1例,总阳性率73.3%;在8例消退期婴幼儿血管瘤组织中,有1例弱阳性(+)表达,阳性率为12.5%;在5例瘤周正常组织中全为阴性表达。经卡方检验分析,hTERT在增殖期婴幼儿血管瘤组织中的表达水平明显高于退化期及瘤周围正常组织,具有显著性差异(P < 0.01)。阳性表达细胞呈散在分布,形态类似血管瘤内皮细胞,定位于细胞胞浆及胞核(胞浆染为棕黄色,胞核蓝色与棕黄色重叠)见表1、图1。
hTERT阳性细胞在增殖期IHs中的平均光密度值为0.15 ± 0.11,消退期为0.02 ± 0.57,T检验分析增殖期明显高于消退期,具有显著性差异(P < 0.05)。经Pearson相关系数分析,hTERT阳性细胞平均光密度值与IHC半定量积分法最终得分之间呈显著正相关(r = 0.99, P = 0.00),见表2。
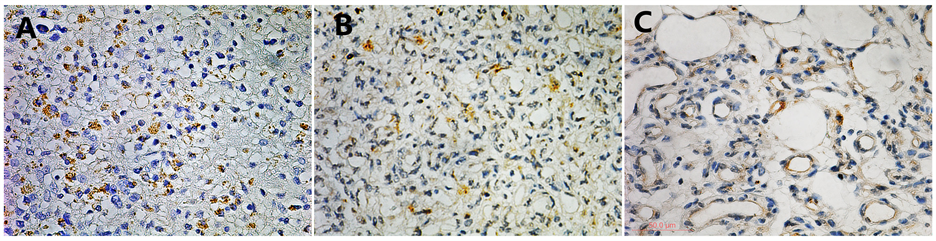
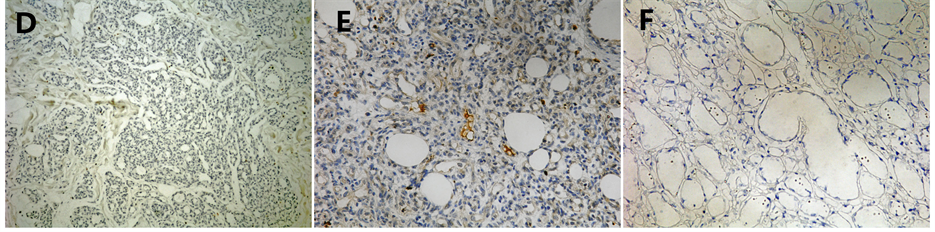
Figure 1. A. Strongly positive expression of hTERT in Malignant Melanoma (×400) B. Strongly positive expression of hTERT in proliferative hemangiomas (×400); C. Weak positive expression of hTERT in involuting hemangiomas (×400); D. Blank control of hTERT in proliferative hemangiomas (×100); E. Weak expression of hTERT in proliferative hemangiomas (×200); F. Negative expression of hTERT in involuting hemangiomas (×200)
图1. A、恶性黑色素瘤hTERT强阳性(×400);B、增殖期婴幼儿血管瘤hTERT强阳性(×400);C、消退初期婴幼儿血管瘤hTERT弱阳性(×400);D、增殖期婴幼儿血管瘤空白对照(×100);E、增殖期婴幼儿血管瘤hTERT弱阳性(×200);F、消退期婴幼儿血管瘤hTERT阴性(×200)
Table 1. Expression of hTERT in proliferative His, involuting IHs and normal tissues around IHs
表1. hTERT在增生期IH、消退期IHs及IHs周围正常组织中的表达
Table 2. The IHC final score was correlated with the mean optical density (IOD) of hTERT positive cells
表2. IHC最终得分与hTERT阳性细胞平均光密度值(IOD)
4. 讨论
研究证实,端粒酶活性是细胞永生化及肿瘤细胞在迅速增殖中保持端粒动态平衡的关键。增殖活跃的细胞,如胚性细胞和90%的肿瘤组织中具有端粒酶活性,而随着胚胎发育,端粒酶活性受到阶段性的抑制而逐渐减弱,进入新生儿期后,大多数正常组织中已检测不到端粒酶活性 [7] [8] 。端粒酶活性的存在意味着组织细胞拥有较活跃的增殖能力。
诸多证据表明端粒酶活性高表达与血管内皮细胞增殖存在着密切关联。研究发现,在前列腺癌组织中hTERT与血管内皮生长因子(VEGF)的表达存在显著相关性 [9] 。亦有学者将人端粒酶逆转录酶基因导入猪主动脉血管内皮细胞后,重建细胞较原来有较高的端粒酶活性,且增殖寿命较对照细胞延长了数代 [10] 。
婴幼儿血管瘤在增殖期时,血管瘤内皮细胞快速大量增殖,镜下可观察到较多无典型管腔样结构的血管条索及由毛细血管、微静脉和小静脉构成的血管从,内皮细胞聚集成簇。
陕声国等 [4] 及胡晓文等 [5] 在婴幼儿血管瘤组织中检测到了端粒酶活性及hTERT mRNA的表达。他们采用RT-PCR扩增及免疫组化显色检测到不同时期IHs组织中存在hTERT mRNA的表达,其中增殖期阳性率为80.0%,消退期为15%;并采用端粒重复序列扩增法(TRAP)检测不同时期IHs组织端粒酶活性,此方法的阳性结果为在凝胶电泳上显示相隔6 bp的梯状条带,条带的多、寡、深或浅表示端粒酶活性的大小,结果显示增殖期端粒酶阳性者为81.4%,消退期为21.6%。受研究方法的制约,其研究不能进行细胞定位,因而无法得知端粒酶活性的具体来源。
本研究在检测不同时期IH组织端粒酶活性时,通过免疫组织化学(IHC)法检测hTERT的表达。hTERT是端粒酶的主要调节亚单位,对端粒酶活性的表达起着决定性的作用,其表达水平与端粒酶活性水平相一致 [11] [12] 。免疫组化方法可通过抗原抗体特异性结合及酶标染色显示出hTERT在组织中的具体定位,然后利用IPP软件进行评估 [13] ,不仅可以反映组织中端粒酶活性的表达水平,而且有助于我们评估其端粒酶活性的来源 [14] 。
结果发现,hTERT在增殖期和消退期IHs中的阳性表达率分别为73.3%和12.5%,在瘤周正常组织中无表达;增殖期IHs中的平均光密度值为0.15 ± 0.11,消退期为0.02 ± 0.57;经Pearson相关系数分析,在全部标本中,hTERT阳性细胞平均光密度值与IHC半定量积分法最终得分呈显著正相关。以上数据均表明,hTERT在增殖期IH组织中的表达水平明显高于退化期及瘤周正常组织,具有统计学意义。
本实验结果不仅定量证实了hTERT在增殖期IH组织中的表达水平明显高于退化期,并表明,hTERT阳性细胞是IHs中端粒酶活性的主要来源,是决定IHs中端粒酶活性水平的关键。通过镜下观察对比发现:增殖期的hTERT阳性细胞排列无规律,细胞形态不一,胞浆丰富,胞核较大,并可见细胞核分裂象(见图2红色箭头)。其与周围细胞聚集成细胞团,未见典型的管腔结构,而在消退初期,这部分hTERT阳性细胞较增殖期数量明显减少,细胞形态趋于一致,呈长梭形,未见细胞核分裂象,与周围细胞间排列疏松,部分细胞初步形成管腔结构,但未见红细胞。综合其形态及动态变化可推测这部分hTERT阳性
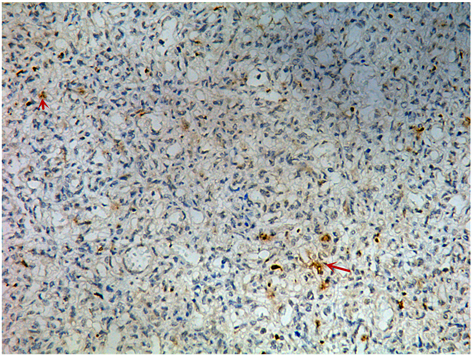
Figure 2. Strong positive expression of hTERT in proliferative hemangiomas (×400), mitosis features were indicated by the red arrow
图2. 增殖期婴幼儿血管瘤hTERT强阳性(×400),红色箭头示核分裂
细胞是一些未分化成熟的血管瘤内皮细胞或血管瘤干细胞。
结合上述实验结果认为:在IHs增殖期,血管内皮细胞大量增殖,而较高的端粒酶活性可以使内皮细胞克服因细胞增殖分裂引起的端粒缩短,使细胞能持续、大量增殖,从而导致瘤体组织生长速度加快,出现快速增殖期。而随着发育的进行,在某种机制的调控下,IHs中的端粒酶活性受到抑制而逐渐减弱。此时由于端粒动态平衡被打破,内皮细胞增殖能力逐渐减弱直至停止,细胞趋于成熟并出现衰老、死亡,进而导致瘤体生长缓慢,进入消退期,从而表现出生长自限性现象。IHs中端粒酶逆转录酶(hTERT)的重新激活或许是其发病的一个关键环节。
本实验由于病例数较少,相关结论仍需进一步实验验证。总体来说,本实验在既往成果的基础上,利用免疫组织化学方法的优势,在探讨IHs组织中端粒酶活性表达动态的同时,对其端粒酶活性来源亦进行了研究,为揭示IHs发病机制提供了更深入的实验依据。
致谢
所有作者由衷地感谢山东省齐鲁医院口腔实验室、口腔颌面外科、病理科的各位老师同事对本实验的支持与帮助。
基金项目
国家自然科学基金(81641036);山东省重点研发计划项目(2017GSF218111)。
文章引用
武 甲,安 恬,陈安威,董建勇,刘少华. 不同分期血管瘤组织中端粒酶逆转录酶的表达及定位分析
Expression and Location Analysis of Human Telomerase Reverse Transcriptase in Infantile Hemangiomas at Different Stages[J]. 临床医学进展, 2018, 08(05): 447-453. https://doi.org/10.12677/ACM.2018.85074
参考文献
- 1. Goelz, R. and Poets, C.F. (2015) Incidence and Treatment of Infantile Haemangioma in Preterm Infants. Archives of Disease in Childhood. Fetal and Neonatal Edition, 100, F85-F91.
https://doi.org/10.1136/archdischild-2014-306197 - 2. Blackburn, E.H. and Szostak, J.W. (1984) The Molecular Structure of Centromeres and Telomeres. Annual Review of Biochemistry, 53, 163-194.
https://doi.org/10.1146/annurev.bi.53.070184.001115 - 3. Hiyama, E., Hiyama, K., Yokoyama, T., et al. (2001) Immunohistochemical Detection of Telomerase (hTERT) Protein in Human Cancer Tissues and a Subset of Cells in Normal Tissues. Neoplasia, 3, 17-26.
https://doi.org/10.1038/sj.neo.7900134 - 4. 陕声国, 张端莲, 余瑛, 等. 血管瘤组织中端粒酶逆转录酶基因表达与端粒酶活性的关系[J]. 中华实验外科杂志, 2004, 21(6): 661-663.
- 5. 胡晓文, 孙宏晨, 欧阳喈. 端粒酶活性在血管瘤中表达的意义[J]. 口腔医学研究, 2002, 18(3): 180-182.
- 6. Mulliken, J.B., Fishman, S.J. and Burrows, P.E. (2000) Vascular Anomalies. Current Problems in Surgery, 37, 517-584.
https://doi.org/10.1016/S0011-3840(00)80013-1 - 7. Wright, W.E., Piatyszek, M.A., Rainey, W.E., et al. (1996) Telomerase Activity in Human Germline and Embryonic Tissues and Cells. Developmental Genetics, 18, 173-179.
https://doi.org/10.1002/(SICI)1520-6408(1996)18:2<173::AID-DVG10>3.0.CO;2-3 - 8. Ozturk, S., Sozen, B. and Demir, N. (2013) Telomere Length and Telomerase Activity during Oocyte Maturation and Early Embryo Devel-opment in Mammalian Species. Molecular Human Reproduction, 20, 15-30.
- 9. 李欣, 汪娜, 张彦, 等. 端粒酶逆转录酶与血管内皮细胞生长因子在前列腺癌中的表达及其相关性的研究[J]. 中华男科学杂志, 2005, 11(10): 724-726, 730.
- 10. 苏正元, 张彦明, 洪海霞, 等. 应用端粒酶逆转录酶基因使猪血管内皮细胞永生化的初步研究[J]. 畜牧兽医学报, 2007, 38(4): 407-411.
- 11. Bell, R.J.A., Rube, H.T., Kreig, A., et al. (2015) The Transcription Factor GABP Selectively Binds and Activates the Mutant TERT Promoter in Cancer. Science, 348, 1036-1039.
https://doi.org/10.1126/science.aab0015 - 12. Stern, J.L., Theodorescu, D., Vogelstein, B., et al. (2015) Mutation of the TERT Promoter, Switch to Active Chromatin, and Monoallelic TERT Expression in Multiple Cancers. Genes & Development, 29, 2219-2224.
https://doi.org/10.1101/gad.269498.115 - 13. Hiyama, E., Hiyama, K., Yokoyama, T., et al. (2001) Immuno-histochemical Detection of Telomerase (hTERT) Protein in Human Cancer Tissues and a Subset of Cells in Normal Tissues. Neoplasia, 3, 17-26.
https://doi.org/10.1038/sj.neo.7900134 - 14. Raghunandan, B.N., Sanjai, K., Kumaraswamy, J., et al. (2016) Ex-pression of Human Telomerase Reverse Transcriptase Protein in Oral Epithelial Dysplasia and Oral Squamous Cell Carcinoma: An Immunohistochemical Study. Journal of Oral & Maxillofacial Pathology (JOMFP), 20, 96-101.
https://doi.org/10.4103/0973-029X.180953
