Advances in Clinical Medicine
Vol.
10
No.
03
(
2020
), Article ID:
34446
,
7
pages
10.12677/ACM.2020.103027
Advances in the Study of Adenosyltransferase Gene of Methionine
Jiafu Lan1*, Jindu Li2#, Tianzi Li1
1Affiliated Hospital of Youjiang Medical University for Nationalities, Baise Guangxi
2The Tumor Hospital Affiliated of Guangxi Medical University, Nanning Guangxi

Received: Feb. 17th, 2020; accepted: Mar. 3rd, 2020; published: Mar. 10th, 2020

ABSTRACT
The results show that methionine Adenylyl transferase is a catalytic enzyme of methyl group, mercapto group and propyl group, which is involved in many important cell metabolic processes, such as methyl group, Sulfur Group and aminopropyl group, a genetic mutation that causes a lack of function for the enzyme, Methionine, causes blood concentrations to rise with the build-up of methionine. It is now thought that mutations in the MTCT gene, which is involved in gene transcription, cell proliferation, and so on, lead to abnormal levels of some of these metabolites, which can lead to arteriosclerosis, liver disease, cancer, depression, and Alzheimer’s disease, the etiological factors of Alveolar Ridge disease and osteoarthritis are the hot spots of Clinical Diagnosis, curative effect and Drug Target Research.
Keywords:Hypermethionemia, Adenosyltransferase Gene of Methionine, Methyl Cycle

甲硫氨酸腺苷转移酶基因与临床研究进展
蓝家富1*,李近都2#,李天资1
1右江民族医学院附属医院,广西 百色
2广西医科大学附属肿瘤医院,广西 南宁
收稿日期:2020年2月17日;录用日期:2020年3月3日;发布日期:2020年3月10日

摘 要
研究表明甲硫氨酸腺苷基转移酶是参与甲基、巯基和丙基等三种代谢途径的催化酶,参与生物体内的转甲基、转硫和转氨丙基等多种重要的细胞代谢过程,因基因突变造成甲硫氨酸腺苷基转移酶功能缺乏,而导致血液中甲硫氨酸的浓度因甲硫氨酸的堆积而升高。目前认为甲硫氨酸腺苷基转移酶基因位点的变异,参与基因转录,细胞增殖等导致一些中间代谢物质水平发生异常变化,成为动脉硬化,肝病,癌症,抑郁症,老年痴呆症,空泡性脊髓病和骨关节炎的发病因素,是临床诊断标识,疗效观察和药物靶标研究的热点。
关键词 :高甲硫氨酸血症,甲硫氨酸腺苷转移酶基因,甲基循环

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
有机体活动与甲基的合成,分解,转移等代谢过程密切相关,甲基代谢在生命的正常活动中不可或缺 [1]。早在1883年His经过实验发现维生素B6等吡啶类衍生物能在体内与甲基(CH3)结合生成甲基化合物并排除体外,当时认为吡啶类衍生物具有排毒的作用 [2]。1935年Brand等发现甲硫氨酸(MET)将其甲基转换到其它有机物分子上成为甲基代谢的重要物质,同时证实同型半胱氨酸(HCY)可以通过甲基化合成MET在甲基循环代谢中发挥重要作用。后来的研究证明,CH3分子在生物转化过程中,甲基中的C和H3从不分开,以整个-CH3为单位整体转移。至此生命代谢过程中甲基化转换的生物化学反应理论基本上得到了确立 [3]。目前认为,包括甲基、亚甲基、次甲基、羟甲基、甲酰基及亚氨甲基等是体内的丝氨酸,甘氨酸,色氨酸,组氨酸和蛋氨酸等氨基酸在分解代谢中产生的含有一个碳原子的基团,称之为“一碳单位”,是甲基代谢过程的关键物质,其主要的生理功能是作为嘌呤和嘧啶的合成原料,是氨基酸和核苷酸联系的纽带,参与嘌呤和嘧啶等有机物质的合成反应 [4]。参与CH3的有机化合物代谢过程的酶基因有很多,目前认为甲硫氨酸腺苷转移酶(methionine adenosyltransferase, MAT)、甲硫氨酸合成酶还原酶(MTRR)、甜菜碱同型半胱氨酸甲基转移酶(BHMT),胱硫醚β合成酶(CBS)等的基因突变导致酶活性降低,造成甲基代谢功能紊乱,患者以高甲硫氨酸血症(Hypermethionemia)为主要临床表现,其研究已经取得许多新的进展 [5],本文对MAT基因及其与高甲硫氨酸血症相关的研究情况综述如下。
2. MAT基因克隆与酶结构特征
MAT又称为S-腺苷甲硫氨酸合成酶(S-adenosyl methionine synthetase, SAMS)广泛存在于动、植物以及微生物体内胞内腺苷转移酶,早在1953年就由Cantoni GL首次报道 [6]。MAT是MET代谢循环(methionine cycle)中重要的限速步骤(rate-limiting step)之一。MAT通过两步反应,将腺嘌呤核苷三磷酸(ATP)中的腺苷转移到MET形成体内重要的内源性甲基供体S-腺苷甲硫氨酸(SAM) [7]。近期研究表明MAT是参与甲基、巯基和丙基等三种代谢途径的催化酶,参与生物体内的转甲基、转硫和转氨丙基等多种重要的细胞代谢过程 [8],1962年Tabor首次描述MAT基因的结构 [9]。目前已经从冠突散囊菌、橡胶树白粉菌、裂殖壶菌、禾谷镰刀菌、拟南芥、水稻、番茄、百脉根、羊草、棉花、杜梨、甘蔗、山羊、猪、鼠和人类等多种生物克隆到了MAT基因 [10]。用生物信息学方法对不同物种MAT基因分析表明,几乎每种生物中的MAT基因都有好几个亚型,如拟南芥4个、水稻4个、番茄3个,羊草2个,而人类有3个MAT基因亚型 [11]。用基因序列进行比对发现,MAT基因在主要开放阅读框(main-ORF)内没有内含子,而5’非编码区前导序列中有内含子,不同物种MAT基因序列进行基因同源性比对研究发现其相似程度很高,提示MAT基因在不同物种中的保守性较高 [12]。MAT酶蛋白质不存在跨膜结构域和信号肽序列,不进行蛋白质转运 [13]。MAT蛋白质的基本结构属于多结构域的酶蛋白,MAT主链构象的结构单元具有N端结构域、中间结构域和C端结构域。其中MAT的N端结构域和中间结构域分别具有4个β折叠和2个α螺旋,C端结构与前两个的差别是最后的β折叠变成了α螺旋,并且中间的一个α螺旋变成两个小α螺旋 [14]。
哺乳类动物有三种MAT,分别称为MATIV、MATXIV、MATXVII,分成2类,MATIV和MATXIV分别为同一亚基α1的四聚体(210KDa)和二聚体(110KDa),MAT XIV有α2,α2’和β三个亚基,分别由MAT1A、MAT2A和MAT2B基因编码,α2 (53KDa),α2’ (51KDa)为催化亚基,β (37kDa)为辅助亚基,MAT1A仅在成熟的肝脏组织表达,MAT2A在体内多种组织均有表达 [15]。MAT基因一级蛋白质结构特征是由同一个亚基的四聚体合成的六方体的结构。先由两个亚基间紧密的结合形成一个球形二聚物,然后这两个球形二聚物再结合成花生形四聚体。MAT的超二级蛋白质结构有六肽(hexapeptide)和九肽(nonapeptide)两个序列模体(sequence motif),其中六肽序列模体与ATP的结合有关,九肽序列模体是高度保守的富含甘氨酸的多肽 [16]。MAT的三级结构特征为每个二聚体有两个活性中心位于亚基之间,每个亚基有9个α螺旋、11个β折叠、5个310螺旋,形成N端结构域、中间结构域和C端结构域等三个结构域(domain)。N端结构域和中间结构域分别具有4个折叠和2个螺旋,C端结构域与前两个的差别是最后的折叠变成了螺旋,并且中间的一个螺旋变成了两个小螺旋。N端、中间和C端三个结构域承担MAT的生物学功能,其酶的活性部位位于三个结构域的裂缝之中,其结构域分开后,酶的活性功能仍然可以保留,见附图 [17]。
3. MAT基因及其多态性研究
人类的MAT基因属于MAT XIV,其有MAT1A、MAT2A和MAT2B等三个亚型 [11],分别在第10号、第2号和第5号染色体中。MAT三个亚基因的碱基对长度,外显子数和编码氨基酸残基数都不尽相同,其在不同组织中表达的峰度也各不相同 [18]。
MAT1A位于第10号染色体短臂22区3带上,基因全长为碱基对17,865 bp,含9个外显子,8个内含子。编码396氨基酸残基的蛋白质。MAT1A有两种同分异构体MAT I和MAT III,I是MAT1A1亚基的四聚体,III是MAT1A1亚基的二聚体,仅在肝脏中表达 [19]。从53份组织,570器官份捐赠尸体标本(donors)中,每份平衡切取53份种组织,用基因型–组织表达(Genotype-Tissue Expression, GTEx)测序显示,MAT1A基因在人体中总的表达量为485.28 RPKM,其中肝脏组织的表达量为455.13 RPKM,肝组织表达量占总表达量93.8%,提示MAT1A基因的组织特异性为肝脏组织 [20]。用表达定量性状遗传位点(expression quantitative trait loci, eQTL)测序显示,有rs1143694[C/T],rs1985908[C/T],rs2993763[A/G],rs2994388[A/G/T],rs7087728[A/C/G],rs10788546[C/T],rs10887711[A/G/T],rs10887721[C/G],rs11595587[A/G]和rs61734474[A/G]等超过2000个位点影响着MAT1A酶氨基酸序列的遗传变异位点 [21]。MAT2A基因位于第2号染色体短臂11区2带上,基因全长碱基对为6116 bp,含9个外显子,8个内含子。编码395氨基酸残基的蛋白质。根据从53份组织,570 donors,用GTEx测序显示,MAT2A基因总的表达量为2920.09 RPKM,其中甲状腺组织表达量为153.80 RPKM,甲状腺组织表达量占总表达量5.3%,提示MAT2A基因的组织特异性为广泛表达。用eQTL测序显示,有rs1078004[A/C/G],rs72940560[G/T],rs2230527[A/C/G],rs3931834[A/C/G],rs57143802[A/C/G],rs7605975[C/T],rs62165899[C/T],rs113066451[C/T],rs114500620[A/G]和rs138686161[C/T]等超过2000个位点影响着MAT2A酶氨基酸序列的遗传变异位点 [22]。MAT2B基因位于第5号染色体短臂11区2带上,基因全长为碱基对13,775 bp,含7个外显子,6个内含子。编码361个氨基酸残基的蛋白质。根据从53份组织,570份donors中分别提取的53份组织,用GTEx测序显示,MAT2B组织特异性为广泛表达,MAT2B基因总的表达量为830.05 RPKM,其中EB病毒转化的淋巴细胞(Cells-EBV-transformed lymphocytes)表达量为31.63 RPKM,EB病毒转化的淋巴细胞表达量占总表达量3.8%,提示MAT2B在多种组织中表达比较均衡。用eQTL测序显示,有rs 299299[G/T],rs964945[C/T],rs4869087[A/C],rs4869089[A/G/T],rs6898075[C/T],rs7709905[A/C/G],rsrs7710409[A/G/T],rs7726100[A/G],rs7729611[A/G]和rs7733775[A/G]等超过4000个位点影响着MAT2B酶氨基酸序列的遗传变异位点。MAT不同基因位点的变异参与不同疾病的发生和发展 [23]。在MAT活性区域的基因位点突变,或有多个基因位点发生变异的患者,其临床表现更加突出 [18]。目前认为MAT基因位点的变异,参与基因转录,细胞增殖等导致一些中间代谢物质水平发生异常变化,成为动脉硬化,肝病,癌症,抑郁症,老年痴呆症,空泡性脊髓病和骨关节炎的发病因素,是临床诊断标识,疗效观察和药物靶标研究的热点 [24]。
4. MAT基因变异与高甲硫氨酸血症
高甲硫氨酸血症,又称为高蛋氨酸血症或MAT缺乏症。是先天性氨基酸代谢异常性疾病,与肝脏疾病,高胱氨酸尿症或第一型酪氨酸血症等疾病引起的高甲硫氨酸血症不同,本病是由于MAT缺乏症所引起的血液甲硫氨酸浓度异常升高,其与腺苷高半胱氨酸酶(AHCY)和甘氨酸正甲基转移酶(GNMT)的基因突变而导致甲硫氨酸浓度异常升高的病理机制相似,因此临床上将AHCY(20q11.22)、GNMT(6p12)和MAT1A (10q22)基因突变所导致高甲硫胺酸血症合并讨论 [25]。基因突变导致MAT酶活性降低是造成持久性孤立型高甲硫氨酸血症的最常见遗传原因,本病为常染色体隐性遗传病 [26]。近期研究表明,MAT基因的Arg356Gln,Arg199Cys,Arg264Lys,Arg264His,Arg264Leu,Arg264Asp,Arg264Glu,Ile322Met,Ala55Asp,Pro357Leu,Leu305Pro和Gly378Ser等位点突变,直接影响酶的活性,导致高甲硫氨酸血症 [27]。血液中过高的甲硫氨酸浓度对大脑有毒性作用,主要为降低大脑细胞Na+,K+-ATP酶的活性,诱导氧化应激,增加乙酰胆碱酯酶活性,并导致皮层神经元树突棘减少,退化,引起脑水肿,神经元死亡及学习和记忆障碍 [28]。本病临床表现轻重不等,可有智力发育延迟、马方综合征样外观、体格发育落后、反复感染、不同程度的神经症状如惊厥等 [29]。有关高甲硫氨酸血症患病率的报道比较少,各地关于其发病率的报道也有较大差异。在中国台湾,从1,701,591位筛选人群中,确诊为单纯型高甲硫氨酸血症的患者有16例,其发病率为0.9/10万,其中MAT1A基因突变患者有8例,其发病率为0.5/10万 [30]。在西班牙,从140,814位筛选人群中,确诊为单纯型高甲硫氨酸血症的患者有6例,其发病率为4.3/10万,所报道的6例患者中5例为MAT1A基因缺陷,其发病率为3.6/10万 [31]。在湖南省怀化市,从85,604位筛选人群中,确诊为单纯型高甲硫氨酸血症的患者有4例,其发病率为4.7/10万,其中MAT1A基因突变患者有3例,其发病率为3.5/10万 [32]。在山东省临沂市,从83,570位筛选人群中,确诊为单纯型高甲硫氨酸血症的患者有1例,其发病率为1.2/10万,其中MAT1A基因突变患者有1例,其发病率为1.2/10万 [33]。在宁夏,从45,602位筛选人群中,确诊为单纯型高甲硫氨酸血症的患者有2例,其发病率为4.4/10万,其中MAT1A基因突变患者有1例,其发病率为2.2/10万 [34]。
MAT的基因表达调控,在植物中的生物胁迫反应,MAT的基因变异与一些营养代谢性疾病,慢性非传染性疾病以及恶性肿瘤中的研究也取得了许多积极的进展 [35] [36] [37] [38],相信距离临床应用时间不会有太久。
基金项目
国家自然科学基金(81060028,81560460),广西重大专项基金(桂科重1598005-9),广西中青年教师基础能力提升基金(2018KY0450),百色市科技局资助项目(百科20193109)。
文章引用
蓝家富,李近都,李天资. 甲硫氨酸腺苷转移酶基因与临床研究进展
Advances in the Study of Adenosyltransferase Gene of Methionine[J]. 临床医学进展, 2020, 10(03): 165-171. https://doi.org/10.12677/ACM.2020.103027
参考文献
- 1. Sarkar, M.R., Dasgupta, S., Pyke, S.M., et al. (2019) Selective Biocatalytic Hydroxylation of Unactivated Methylene C-H Bonds in Cyclic Alkyl Substrates. Chemical Communications, 55, 5029-5032. https://doi.org/10.1039/C9CC02060H
- 2. Pakavathkumar, P., Sharma, G., Kaushal., V., et al. (2015) Methylene Blue Inhibits Caspases by Oxidation of the Catalytic Cysteine. Scientific Reports, 124, Article No. 13730. https://doi.org/10.1038/srep13730
- 3. James, P., Sajjadi, S., Tomar, A.S., et al. (2018) Candidate Genes Linking Maternal Nutrient Exposure to Offspring Health via DNA Methylation: A Review of Existing Evidence in Humans with Specific Focus on One-Carbon Metabolism. International Journal of Epidemiology, 47, 1910-1937. https://doi.org/10.1093/ije/dyy153
- 4. Dever, J.T. and Elfarra, A.A. (2010) The Biochemical and Toxicological Significance of Hypermethioninemia: New Insights and Clinical Relevance. Expert Opinion on Drug Metabolism & Toxicology, 6, 1333-1346. https://doi.org/10.1517/17425255.2010.522177
- 5. 王倩倩, 陈志红. 高甲硫氨酸血症的研究现状[J]. 国际儿科学杂志, 2018, 45(11): 855-859.
- 6. Van de Poll, M.C., Dejong, C.H. and Soeters, P.B. (2006) Adequate Range for Sulfur-Containing Amino Acids and Biomarkers for Their Excess: Lessons from Enteral and Parenteral Nutrition. The Journal of Nutrition, 136, 1694S-1700S. https://doi.org/10.1093/jn/136.6.1694S
- 7. Tomasi, M.L., Cossu, C., Spissu, Y., et al. (2017) S-Adenosylmethionine and Methylthioadenosine Inhibit Cancer Metastasis by Targeting microRNA 34a/b-Methionine Adenosyltransferase 2A/2B Axis. Oncotarget, 8, 78851-78869. https://doi.org/10.18632/oncotarget.20234
- 8. Zhang, Q., Bertics, S.J., Luchini, N.D., et al. (2016) The Effect of Increasing Concentrations of DL-Methionine and 2-hydroxy-4-(methylthio) Butanoic Acid on Hepatic Genes Controlling Methionine Regeneration and Gluconeogenesis. Journal of Dairy Science, 99, 8451-8460. https://doi.org/10.3168/jds.2016-11312
- 9. Aggrey, S.E., González-Cerón, F., Rekaya, R., et al. (2018) Gene Expression Differences in the Methionine Remethylation and Transsulphuration Pathways under Methionine Restriction and Recovery with DL-Methionine or DL-Hmtba in Meat-Type Chickens. Journal of Animal Physiology and Animal Nutrition, 102, e468-e475. https://doi.org/10.1111/jpn.12779
- 10. Ikeda, S., Kawahara-Miki, R., Iwata, H., et al. (2017) Role of Methionine Adenosyltransferase 2A in Bovine Preimplantation Development and Its Associated Genomic Regions. Scientific Reports, 7, Article No. 3800. https://doi.org/10.1038/s41598-017-04003-1
- 11. Liang, Y., Zou, C.H., Li, J.D., et al. (2019) Research Progress of Medicinal Secondary Metabolites and Gene Cloning of Dendrobium officinale. Medicinal Plant, 10, 16-18, 23.
- 12. Ramani, K., Donoyan, S., Tomasi, M.L., et al. (2015) Role of Methionine Adenosyltransferase α2 and β Phosphorylation and Stabilization in Human Hepatic Stellate Cell Trans-Differentiation. Journal of Cellular Physiology, 230, 1075-1085. https://doi.org/10.1002/jcp.24839
- 13. Nagao, M., Tanaka, T. and Furujo, M. (2013) Spectrum of Mutations Associated with Methionine Adenosyltransferase I/III Deficiency among Individuals Identified during Newborn Screening in Japan. Molecular Genetics and Metabolism, 110, 460-464. https://doi.org/10.1016/j.ymgme.2013.10.013
- 14. Hirabayashi, K., Shiohara, M., Yamada, K., et al. (2013) Neurologically Normal Development of a Patient with Severe Methionine Adenosyltransferase I/III Deficiency after Continuing Dietary Methionine Restriction. Gene, 530, 104-108. https://doi.org/10.1016/j.gene.2013.08.025
- 15. Tomasi, M.L., Ryoo, M., Skay, A., et al. (2013) Polyamine and Methionine Adenosyltransferase 2A Crosstalk in Human Colon and Liver Cancer. Experimental Cell Research, 319, 1902-1911. https://doi.org/10.1016/j.yexcr.2013.04.005
- 16. 李鸿翔, 梁烨, 李天资, 等. 原发性高血压危险因素的易感基因及其非编码RNA研究进展[J]. 中西医结合心脑血管病杂志, 2014, 12(7): 879-881.
- 17. Furujo, M., Kinoshita, M., Nagao, M., et al. (2012) Methionine Adenosyltransferase I/III Deficiency: Neurological Manifestations and Rele-vance of S-Adenosylmethionine. Molecular Genetics and Metabolism, 107, 253-256. https://doi.org/10.1016/j.ymgme.2012.08.002
- 18. Ramani, K. and Tomasi, M.L. (2012) Transcriptional Regulation of Methionine Adenosyltransferase 2A by Peroxisome Proliferator-Activated Receptors in rat Hepatic Stellate Cells. Hepatology, 55, 1942-1953. https://doi.org/10.1002/hep.25594
- 19. Schröder, P.C., Fernández-Irigoyen, J., Bigaud, E., et al. (2012) Proteomic Analysis of Human Hepatoma Cells Expressing Methionine Adenosyltransferase I/III: Characterization of DDX3X as a Target of S-Adenosylmethionine. Journal of Proteomics, 75, 2855-2868. https://doi.org/10.1016/j.jprot.2012.01.009
- 20. Cano, A., Buqué, X., Martínez-Uña, M., et al. (2011) Methionine Adenosyltransferase 1A Gene Deletion Disrupts Hepatic Very Low-Density Lipoprotein Assembly in Mice. Hepatology, 54, 1975-1986. https://doi.org/10.1002/hep.24607
- 21. Garrido, F., Estrela, S., Alves, C., et al. (2011) Refolding and Characteri-zation of Methionine Adenosyltransferase from Euglena gracilis. Protein Expression and Purification, 79, 128-136. https://doi.org/10.1016/j.pep.2011.05.004
- 22. 吴承蓉, 刘权焰. MAT2A基因与肝癌[J]. 武汉大学学报: 医学版, 2008, 29(4): 559-562.
- 23. 张顺, 陈琦, 郭智彬, 等. MAT2A基因在胃癌中的表达及临床意义[J]. 中国普通外科杂志, 2014, 23(12): 1711-1713.
- 24. 刘权焰, 刘志苏, 邬开朗, 等. 靶向甲硫氨酸腺苷转移酶2A基因小干扰RNA抑制肝癌细胞生长的研究[J]. 中华肝脏病杂志, 2005, 13(5): 335-338.
- 25. Favier, A. and Caillat, D. (1977) Determination of Urinary Alpha-Keto-Gamma-Methylthiobutyric Acid in Hypermethionemia by Use of Gas Chroma-tography and Flame Photometry (Author’s Transl). Clinica Chimica Acta, 79, 419-423. https://doi.org/10.1016/0009-8981(77)90438-7
- 26. Katoh, Y. and Kera, Y. (2014) Coupling of Epigenome and Gene Regulation on Chromatin by Methionine Adenosyltransferase II. Seikagaku, 86, 683-686.
- 27. 李子涵, 熊婷, 熊晓丽, 等. 甲硫氨酸腺苷转移酶1A/2A平衡与肝细胞癌[J]. 生物化学与生物物理进展, 2018, 45(12): 1232-1239.
- 28. 马艳艳, 李东晓, 李溪远, 等. 甲硫氨酸腺苷转移酶活性缺陷致高甲硫氨酸血症3例报告[J]. 临床儿科杂志, 2018, 36(1): 57-60.
- 29. 杨威, 陈琼, 沈凌花, 等. 甲硫氨酸腺苷转移酶I/III缺陷导致高甲硫氨酸血症1例[J]. 中华实用儿科临床杂志, 2019, 34(4): 311-313.
- 30. Martins, E., Marcão, A., Bandeira, A., et al. (2012) Methionine Adenosyltransferase I/III Deficiency in Portugal: High Frequency of a Dominantly Inherited Form in a Small Area of Douro High Lands. JIMD Reports, 6, 107-112. https://doi.org/10.1007/8904_2011_124
- 31. 刘立, 刘志苏, 刘权焰, 等. 缺氧应激对HepG2细胞中甲硫氨酸腺苷转移酶2A基因表达的影响[J]. 中华实验外科杂志, 2011, 28(4): 553-556.
- 32. Muriello, M.J., Viall, S., Bottiglieri, T., et al. (2017) Confirmation That MAT1A p.Ala259Val Mutation Causes Autosomal Dominant Hypermethioninemia. Molecular Genetics and Metabolism Reports, 13, 9-12. https://doi.org/10.1016/j.ymgmr.2017.07.004
- 33. Mumbrekar, K.D., Bola Sadashiva, S.R., Kabekkodu, S.P., et al. (2017) Genetic Variants in CD44 and MAT1A Confer Susceptibility to Acute Skin Reaction in Breast Cancer Patients Undergoing Radiation Therapy. International Journal of Radiation Oncology, Biology, Physics, 97, 118-127. https://doi.org/10.1016/j.ijrobp.2016.09.017
- 34. Chadwick, S., Fitzgerald, K., Weiss, B., et al. (2014) Thirteen Patients with MAT1A Mutations Detected through Newborn Screening: 13 Years’ Experience. JIMD Reports, 14, 71-76. https://doi.org/10.1007/8904_2013_286
- 35. 梁烨, 邹才华, 李近都, 等. 石斛药用次生代谢产物及其基因克隆研究进展[J]. 中华中医药杂志, 2018, 33(12): 5511-5514.
- 36. 李近都, 李天资, 黄照权, 等. 肝癌标本体外置留时间与核糖核酸测序质量的关系[J]. 中华实验外科杂志, 2018, 35(10): 1841.
- 37. 何思陆, 李天资. FXYD5在高血压病动脉粥样硬化中调控机制的研究进展[J]. 中西医结合心脑血管病杂志, 2015, 13(15): 1730-1732.
- 38. 梁烨, 李天资, 卢冠铭, 等. 常温下肝癌切除组织RNA离体时间与RNA质量的关系[J]. 中华病理学杂志, 2018, 47(6): 467-468.
附录

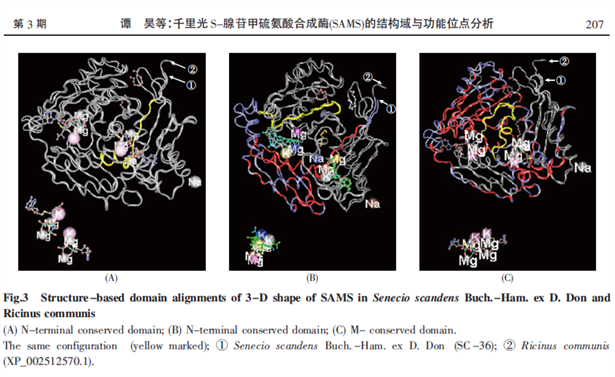
注:[引自]谭昊,文春菊,钱倩, 等.千里光S-腺苷甲硫氨酸合成酶(SAMS)的结构域与功能位点分析[J].生命科学研究,2015,19(3):203-209.