Hans Journal of Computational Biology
Vol.06 No.01(2016), Article ID:17099,7
pages
10.12677/HJCB.2016.61001
Cloning and Expression Analysis of F3'5'H Gene from Mango (Mangifera indica)
Zhichang Zhao1.2*, Aiping Gao1.2, Yeyuan Chen1.2, Jianfeng Huang1.2, Zhiguo Dang1.2, Ruixiong Luo1.2
1Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Crop Gene Resources and Germplasm Enhancement in Southern China, Danzhou Hainan
2National Cultivar Improvement Center of Tropical Fruit Tree, Danzhou Hainan

Received: Feb. 19th, 2016; accepted: Mar. 4th, 2016; published: Mar. 9th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Flavonoid-3',5'-hydroxylase (F3'5'H), was the key enzyme gene for synthesizing delphinidin glycosides; due to the lack of F3'5'H, plants cannot form a blue flower, which was also known as the “blue gene”. According to the design of degenerate primers of F3’5’H gene sequence reported, full- length cDNA sequence of F3'5'H gene of mango fruit was obtained with 3'RACE and 5'RACE method. The full-length cDNA sequence of F3'5'H was 1598 bp, whose open reading frame of the gene was 1539 bp, encoding 512 amino acids, with the molecular weight of 57.20 KD. The 1633 bp length fragment was amplified from genome and analysis, which contained one intron, in 909 - 1003 bp. It was found that the gene encoding for the protein had close relationship with dendrobium, verbena plant through phylogenetic analysis. Expression of F3'5'H gene in different mango varieties showed: the high expression of the “Guifei” varieties, and the expression of green Guiqi varieties with low volume.
Keywords:Mango, Anthocyanins, F3'5'H, Gene Cloning

芒果F3'5'H基因的克隆及其表达分析
赵志常1,2*,高爱平1,2,陈业渊1,2,黄建峰1,2,党志国1,2,罗睿雄1,2
1中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点开发实验室, 海南 儋州
2国家热带果树品种改良中心,海南 儋州

收稿日期:2016年2月19日;录用日期:2016年3月4日;发布日期:2016年3月9日

摘 要
黄酮-3',5'-羟基化酶(flavonoid-3',5'-hydroxylase, F3'5'H)是合成飞燕草色素苷的关键酶基因,缺乏F3'5'H的植物不能形成蓝色花,故又被称为“蓝色基因”。本研究根据已经报道的F3'5'H基因的序列设计兼并引物,采用3'RACE和5'RACE方法,克隆得到了一个全长cDNA序列为1598 bp的芒果果实F3'5'H基因。该基因开放阅读框为1539 bp,编码512个氨基酸,分子重量为57.20 KD。对基因组扩增得到了1633 bp长度的片段,分析发现该基因含有一个内含子。通过系统发育分析发现该基因编码的蛋白与石斛、马鞭草等植物具有较近的亲缘关系。对不同芒果品种的F3'5'H基因的表达进行分析发现:红色的贵妃品种中表达量较高,而绿色的桂七品种中表达量较低。
关键词 :芒果,花色素苷,F3’5’H,基因克隆

1. 引言
芒果是重要的热带、亚热带果树,其果实色彩多样,如:绿色、黄色、浅黄色、红色、橙红色等。芒果果实富含类胡萝卜素和花色素苷等物质,其中花色素苷合成途径是红色芒果果实着色的一个主要的代谢途径。类黄酮3',5'羟基化酶(F3'5'H)属于细胞色素P450酶家族[1] [2] ,是类黄酮代谢途径中合成飞燕草色素苷及其衍生物的关键酶,它催化黄烷酮、圣草酚、二氢槲皮素和二氢崁非醇形成二氢杨梅素色素,为蓝色色素前体物质[3] [4] 。缺乏F3'5'H的植物,如郁金香、玫瑰和香石竹等,不能形成蓝色花,因而F3'5'H又被称为“蓝色基因”[5] -[7] 。
到目前为止,已经在矮牵牛、鹤望兰、香石竹、茄子、龙胆、荞麦、和洋桔梗、棉花等植物中克隆到F3'5'H基因[7] -[12] 。很多研究结果表明,F3'5'H是花色素苷合成的关键基因,与花蓝色形成密切相关。黄敏玲等[9] 在鹤望兰的半定量分析发现,该基因在蓝色花瓣中表达量最高,在黄色花萼中几乎没有什么表达。芒果果实的F3'5'H基因的研究工作未见报道,本研究采用RACE方法从芒果的果实中克隆得到了一个F3'5'H基因,希望深入探讨该基因在芒果果实花色素苷合成的作用机理及其对果实着色的影响,借以深入揭示该基因在芒果果实花色素苷生物合成的分子机理,能为芒果果实着色提供一定的理论依据。
2. 材料与方法
2.1. 材料
以“贵妃”芒果果实为试材,取自中国热带农业科学院热带作物品种资源研究所的农业部芒果种质资源圃。大肠杆菌DH5а为本实验保存,引物合成自英俊生物工程技术服务有限公司、其它药品如:DEPC、IPTG、dNTP、X-GaL、Tryptone、Yeast extract、Amp、Taq DNA聚合酶、T4 DNA连接酶、各种限制性内切酶和pMD-19T载体均购置于大连宝生物公司。
2.2. 实验方法
1) 芒果DNA提取参照王家保[13] 等所述的方法提取,用无菌的双蒸水溶解,核酸蛋白测定仪进行测定,并−20℃保存备用。
2) 芒果总RNA提取采用天根生化科技有限公司生产的总RNA提取试剂盒提取,用RNase-free无菌水溶解,用大连宝生物公司的DNase试剂盒进行DNA去除,用核酸蛋白测定仪对所得RNA的OD260/230、OD260/280及浓度进行测定,用TaKaRa公司的3'和5'-RACE 试剂盒进行目的基因的3'和5'的扩增。
3) PCR反应程序为:94℃预变性4 min,95℃变性50 s,50℃复性50 s,72℃延伸2 min,30个循环,最后72℃延伸7 min;反应体系为25 µL,其中含10× PCR buffer (含Mg2+) 2.5 µL、25 ng DNA模板、20 µmol引物、1.0 U Taq DNA聚合酶、5.0 mmol dNTPs;扩增反应结束后取10 µl进行扩增产物的电泳,采用gelred染色后在紫外凝胶成像仪上观察、拍照分析。
2.3. F3'5'H基因全长cDNA和基因组DNA序列的获得
以“贵妃”芒果的果实总RNA作为模板,采用SMARTer™ RACE cDNA Amplification Kit (Clontech)反转录合成第一链cDNA,并参照该试剂盒的说明书进行cDNA 3′端和5′末端cDNA的扩增。根据已知的片段和得到的cDNA 3′端和5′末端的序列结果拼接该基因的全长cDNA。以上述cDNA和提取的基因组DNA为模板,设计特异引物,进行全长cDNA和基因组DNA序列的扩增。
2.4. F3'5'H基因氨基酸序列的结构特征和分子进化的分析
将所扩增得到的全长得序列进行NCBI序列比对,确定该基因是否为F3'5'H基因。采用DNAMAN软件分析基因核苷酸和氨基酸的结构特征和同源性,进行其他物种F3'5'H基因的比对。分析该基因所推定氨基酸序列进行多序列比较,同时构建系统树。
2.5. 表达分析
对不同芒果品种的RNA,反转录为cDNA并采用primer 5.0设计引物进行RT-PCR的扩增。RT-PCR分析采用的内参引物序列为:actin-F 5'AATGGAACTGGAATGGTCAAGGC'3,actin-R5'TGCCAGATC TTCTCCATGTCATCCCA'3;目的基因扩增采用的引物为F3'5'H-F,5'GCACTCCAGATATACATAGC CC'3,F3'5'H-R 5'ACTATCCGATATAGAGCAATGAA'3,PCR产物在1.0%的琼脂糖凝胶上进行电泳,并采用Quantity One 软件进行数据分析,做出相对表达量。
3. 结果与分析
3.1. F3'5'H基因的获得
根据得到的3'端和5'端序列信息进行拼接,最后的到了F3'5'H基因的全长cDNA序列。设计特异引物进行全长cDNA和基因组DNA序列的进行扩增,电泳结果如图1所示。将电泳条带回收测序后的到了F3'5'H基因全长序列cDNA为1598 bp,分析发现开放阅读框为1539 bp,编码512个氨基酸序列(如图2所示)。通过NCBI上已经登录的柿子、番茄、葡萄的F3'5'H蛋白序列进行了比对(如图3所示),发现克隆的基因为芒果F3'5'H基因。对基因组DNA扩增得到了大约1633 bp的片段,通过与cDNA序列比对发现该基因含有一个内含子,分别位于909~1003 bp之间(如图4所示)。
3.2. 芒果F3'5'H基因的部分生物信息学分析
采用DNAMAN进行二级结构的预测,发现芒果F3'5'H蛋白的二级结果主要以蛋白二级结构元件以无规则卷曲和β-折叠为主,也具有少量的α-螺旋结构(如图5所示)。采用bioedit软件的Kyte和Doolittle算法对F3'5'H蛋白的亲水/疏水性(正值表示疏水性,负值表示亲水性)进行了分析,F3'5'H蛋白所含的氨
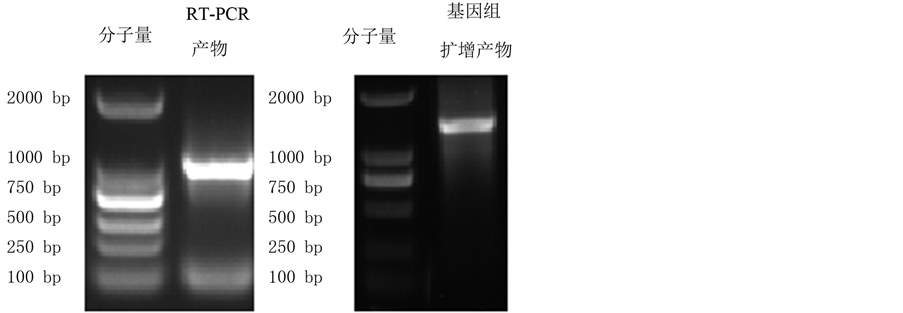
Figure 1. Electrophoresis results of cDNA and DNA of F3'5'H
图1. F3'5'H基因cDNA与基因组DNA电泳结果(左边为cDNA;右边为DNA)

Figure 2. Amino acid sequence of F3'5'H gene
图2. F3'5'H基因翻译成的蛋白序列

Figure 3. Sequence alignment of several F3'5'H protein
图3. 几种F3'5'H蛋白的序列比对
基酸主要介于+2.6~−2.5之间(如图6所示),采用DNAMAN软件分析发现,芒果F3'5'H蛋白与石斛、马鞭草等植物的蛋白序列聚为一类(如图7所示)。
3.3. F3'5'H基因的RT-PCR分析
通过不同着色的芒果果皮的RT-PCR分析的发现:该基因在红色贵妃的果实中表达较多,黄色果皮中次之,而绿皮果皮中相对表达较少(图8所示),初步推断F3'5'H基因可能与红色果实的花色素苷合成

Figure 4. Structure diagram of F3'5'H gene
图4. F3'5'H基因组的结构图(黑框为内含子序列)

Figure 5. The prediction result of two structure of F3'5'H protein
图5. F3'5'H蛋白的二级结构预测结果

Figure 6. The hydrophobic region of F3'5'H protein
图6. F3'5'H蛋白疏水区的分布

Figure 7. Phylogenetic relationship of some F3'5'H protein sequences
图7. 部分基因的F3'5'H蛋白序列的系统发育关系

Figure 8. Expression of F3'5'H gene in mango fruit
图8. F3'5'H基因在不同颜色芒果果实中的表达
有密切的关系。
4. 讨论
本研究成功地从芒果果实中分离得到了一个全长F3'5'H基因,该基因的cDNA的开放阅读框为1539 bp,编码512个氨基酸,对基因组分析发现该基因含有一个内含子。通过软件对cDNA和蛋白序列分析证实了该序列是植物F3'5'H基因的一员,其含有细胞色素P450家族基因的特征保守氨基酸序列:“PPGP”和血红素区域序列“FGAGRRICAG”。芒果F3'5'H基因与所选其他物种F3'5'H基因序列相比较发现,无论在全长cDNA序列上还是其编码氨基酸序列上都具有较高的保守的结构域。同时,通过与其他部分物种的氨基酸序列构建系统发生树发现,芒果F3'5'H基因编码的蛋白与石斛、马鞭草等植物可以聚为一类。对不同着色品种的芒果F3'5'H基因的表达分析发现,该基因在红色品种表达较高,而在绿色品种表达较低。白蓝等[10] 对香石竹研究发现,F3'5'H基因的表达有时间差异性,花蕾期间表达量高,盛花期基本不表达。李光等[11] 发现棉花的F3'5'H基因在棉花各个组织器官中都有表达,但主要在纤维中表达,白色品种的表达量低于同时期的绿色品种的表达量。F3'5'H基因在大多数植物中已经被克隆,并且通过转基因技术转入不含或含量很少F3'5'H基因的模式植物中,发现转化株比野生型能积累更多的飞燕草色素[14] 。引入外源F3'5'H基因来改变植物花色,已在多种植物上获得成功[15] 。芒果F3'5'H基因是芒果花色素苷合成代谢途径中的一个关键的基因,其对芒果果皮红色的形成具有重要的作用,而其对芒果果实着色的功能深入研究需要进一步的转基因植物表达的验证
基金项目
国家自然科学基金资助项目(31471850),农业部热带作物种质资源保护(15RZZY-07),948项目(2011-G13),非营利性科研机构改革启动经费(CATAS, PZS-201225),(CATAS-TCGRI,1630032013003)。
文章引用
赵志常,高爱平,陈业渊,黄建峰,党志国,罗睿雄. 芒果F3'5'H基因的克隆及其表达分析
Cloning and Expression Analysis of F3'5'H Gene from Mango (Mangifera indica)[J]. 计算生物学, 2016, 06(01): 1-7. http://dx.doi.org/10.12677/HJCB.2016.61001
参考文献 (References)
- 1. Shimada, Y., Nakano, S.K., Ohbayashi, M., et al. (1999) Expression of Chimeric P450 Genes Encoding Flavonoid-3', 5'-Hydroxylase in Transgenic Tobacco and Petunia Plants. FEBS Letters, 461, 241-245. http://dx.doi.org/10.1016/S0014-5793(99)01425-8
- 2. 赵剑, 杨文杰, 朱蔚华. 细胞色素P450与植物的次生代谢[J]. 生命科学, 1999, 11(3): 127-131.
- 3. Mori, S., Kobayashi, H., Hoshi, Y., et al. (2004) Heterologous Expression of the Flavonoid-3′,5′-hydroxylase Gene of Vinca Major Alters Flower Color in Transgenic Petunia Hybrid. Plant Cell Reports, 22, 415-421. http://dx.doi.org/10.1007/s00299-003-0709-3
- 4. 孟丽, 戴思兰. F3′5′H 基因与蓝色花的形成[J]. 分子植物育种, 2004, 2(3): 413-420.
- 5. Tanaka, Y., Sasaki, N. and Ohmiya, A. (2008) Biosynthesis of Plant Pigments: Anthocyanins, Betalains and Carotenoids. The Plant Journal, 54, 733-749. http://dx.doi.org/10.1111/j.1365-313X.2008.03447.x
- 6. Tanaka, Y., Bruglira, F., Kalc, G., et al. (2010) Flower Color Modification by Engineering of the Flavonoid Biosynthetic Pathway: Practical Perspectives. Bioscience, Biotechnology, and Biochemistry, 74, 1760-1769. http://dx.doi.org/10.1271/bbb.100358
- 7. 徐清燏, 戴思兰. 蓝色花卉分子育种[J]. 分子植物育种, 2004, 2(1): 93-99.
- 8. Toguri, T., Umemoto, N., Kobayashi, O., et al. (1993) Activation of Anthocyanin Synthesis Genes by White Light in Eggplant Hypocotyls Tissues, and Identification of an Inducible P-450 cDNA. Plant Molecular Biology, 23, 933-946. http://dx.doi.org/10.1007/BF00021810
- 9. 黄敏玲, 樊荣辉. 鹤望兰类黄酮3′,5′-羟化酶基因SrF3′5′H的克隆及表达分析[J]. 中国细胞生物学学报, 2012, 34(11): 1117-1122.
- 10. 白蓝, 贾军伟, 孙建萍, 等. 转基因香石竹中F3’5’H基因的克隆、表达和免疫学鉴定[J]. 植物生理学通讯, 2010, 46(2): 108-112.
- 11. 李光, 余霜, 陈庆富. 金荞麦F 3’5’H基因的生物信息学分析[J]. 种子, 2014, 33(12): 6-10.
- 12. 田新惠, 李艳军, 张新宇, 等. 绿色棉纤维类黄酮3',5'羟基化酶基因GhF3'5'H的克隆及实时定量表达分析[J]. 棉花学报, 2010, 22(5): 403-408.
- 13. 王家保, 王令霞, 刘志媛, 等. 芒果DNA提取方法比较及ISSR反应体系的优化[J]. 生物技术, 2005, 15(5): 37-41.
- 14. Mellway, R.D., Tran, L.T., Prouse, M.B., et al. (2009) The Wound Pathogen, and Ultraviolet B-Responsive MYB134 Gene Encodes an R2R3 MYB Transcription Factor That Regulates Proanthocyanidin Synthesis in Poplar. Plant Physiology, 150, 924-941. http://dx.doi.org/10.1104/pp.109.139071
- 15. Tanaka, Y., Tsuda, S. and Kusumi, T. (1998) Metabolic Engineering to Modify Flower Color. Plant and Cell Physiology, 39, 1119-1126. http://dx.doi.org/10.1093/oxfordjournals.pcp.a029312