Operations Research and Fuzziology
Vol.07 No.04(2017), Article ID:22312,13
pages
10.12677/ORF.2017.74011
Control and Prediction of Cellular Automata Epidemic Model under a Complex System
Lijuan Zhang
Institute of Disaster Prevention Science and Technology, China Earthquake Administration, Sanhe Hebei
Received: Sep. 26th, 2017; accepted: Oct. 6th, 2017; published: Oct. 16th, 2017

ABSTRACT
Based on the complex network, we put out a CA model with medical intervention. By increasing the mobility of individual autonomy to construct dynamic social network, we simulate the transmission process of infectious disease, in the two-dimensional regular network, and depict the different time of the outbreak of the disease and flow characteristic. The propagation characteristic of different infectious diseases, such as the involuting propagation, eruption, can be reflected in the simulation. The simulation results show that: Medical intervention played a certain effect on the transmission of infectious diseases, and also gave a quantification of a medical intervention, which provided reference and basis to take reasonable prevention and intervention methods. The model can reflect the dynamic social network and individual adaptability behavior on disease transmission effect, and maintain consistency with the actual situation.
Keywords:Cellular Automata, Infectious Disease, Social Network, Syphilis
一类复杂系统下元胞自动机传染病模型 的控制和预测
张丽娟
中国地震局,防灾科技学院,河北 三河
收稿日期:2017年9月26日;录用日期:2017年10月6日;发布日期:2017年10月16日

摘 要
本文以复杂网络系统为基础,构造了带有干预机制的元胞自动机模型。在二维网格 上,通过增加个体自主移动性构建了动态社会网络,模拟了在医疗干预下传染病的传播过程,动态刻画了不同时段的疾病爆发情况,体现了传染病传播特性。传染病的传播特征如消退型传播、爆发等,均能在模拟中体现出来,符合传染病传播规律。仿真结果表明医疗干预等措施对传染病传播能起到一定的抑制作用,为采取合理的预防及干预手段提供了参考和依据。最后利用该模型模拟了中国境内梅毒疫情的发病和传播情况,并预测了未来发展趋势,从而证明了该模型能够较好的反映动态社会网络和个体适应性行为对疾病传播的影响,模型结论并可运用于疫情预测。
关键词 :元胞自动机,传染病,社会网络,梅毒

Copyright © 2017 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
对传染病传播规律的描述和预测长期以来是人们关注的研究课题。从20世纪四五十年代开始,以微分方程为主的决定性模型在传染病相关研究中逐渐受到重视,并占有非常重要的学术地位 [1] 。
传染病传播过程中充满了多种因素的影响,它的传播显然是一种复杂现象。比如:传染病传播载体间的交流、接触、联系所形成的系统是复杂的;易感者和感染者全部都是有能动性的,它们的行为方式对于病情的发展有重要影响,同时也会随外界环境的变化产生适应性的改变,以上因素都使传染病的传播变的复杂 [2] [3] [4] [5] 。
对传染病爆发的干预和控制措施对于传染病传播和扩散的影响过程也极为复杂。不同的传染病,不同的措施效果可能不同,如何来确定对于特定类型的传染病,哪种控制措施效果最好,找到答案并不容易,但无疑是非常重要的。这些问题的解决,将有助于合理的控制决策:如何采取措施能够有效的控制传染病的传播,或者在传染病发展的不同阶段采取哪些措施会比较有效。
元胞自动机作为一种有效方法,已渐渐被应用到对传染病的模拟中来。李璐 [6] 等人用经典的二维元胞自动机模拟了HIV/AIDS的传播过程,并考虑了人群数量,初始感染率等因素对疾病传播的影响。关超 [7] 等人在经典SEIR模型的基础上提出了带干预极值的传染病模型,模拟了在医疗干预下传染病的传播过程。国外也相继涌现了很多此方面的研究,如:Brendan D. Cowled [8] 等人研究了如何在野生环境中用有限捕杀的方法控制猪瘟,Peter M.A. Sloot [9] 等人构造了4状态元胞自动机模型,利用欧洲艾滋病分布数据,研究了艾滋病的传播特征,Keith R. Bisset [10] 等人建立了社会网络关于传染病扩散系统,并结合计算机GIS技术对传染病的扩散问题进行了简单的仿真实验。上述所涉及模型均未考虑疾病传播过程中的个体的复杂性行为,并且也未讨论各种因素对疾病传播的影响,不能达到有效预测的目的。
近年来,复杂网络上的疾病传播已成为研究的热点。研究表明,当网络规模无限增大时,无标度网络的临界值趋于0,这意味这既使是微小的传染源也足以在庞大的网络中蔓延 [8] 。目前,将复杂网络用于研究传染病的传播成果很少,Arpan Chaudhury等人 [11] 用复杂网络的节点技术研究了信息在社会网络中的传播规律,Philippe J.等 [12] 提出了用复杂网络关于信息传播的理论研究传染病的方法,并给出了一些简单案例,但并未详细用复杂网络的有关知识对某一种传染病给出详细解决过程。Pastor-Satorras R. [13] 提出一个改进的SIS传染病模型,基于二维规则网格,并考虑个体运动,研究疾病在动态网络结构中的传播行为,得出有意义的结果。因此,研究具有动态网络特性又具有个体自主行为,而且动态网络和个体自主行为相互影响的流行病传播模型,对深刻理解真实社会网络中疾病传播行为具有重要的现实意义。真实的疾病传播网络拓扑结构通常是由网络节点的自主性驱动的动态演化,如疾病传播时人群移动会改变原来的疾病传播网络拓扑结构,个体的一些主动控制策略影响网络的拓扑特性。本文模型的特点在于:
1) 把病情发展过程分五个阶段,建立了SEIDR传播模型,扩展了SIR模型。
2) 社会网络中研究疾病传播,借助于Philippe J. [12] 中关于复杂系统的有关理论,在二维网络上通过增加个体的自主移动特性构建社会网络。
3) 考虑了个体的异质性和适应性行为对疾病传播的影响。
2. 模型建立
2.1. 社会网络的拓扑结构
本文借鉴HilippeJ提出的网络生长机制——局部优先连接机制,构造一个社会网络生长模型,并利用元胞自动机模拟传染病在社会网络内的传播。
构建的社会网络拓扑关系,社会网络满足条件
1) 增长。初始有一个概率为 的随机网络,网络的节点数比较少,在每个时间步,向网络里加入一个新节点。
2) 局部优先连接。新加入的点与已存在点的连接规则如下:首先随机连上一个点A,然后以一定的概率 与点 的邻居相连,接着以更小的概率 与刚连上的 的邻居的邻居相连。网络构建的参数设定: ; , (最初为10个节点的网络,再加入5000个点)。
2.2. 元胞自动机传播模型的相关参数
2.2.1. 网络节点状态参量
构建SEIDR传播模型,考虑一 的网格,每一格点 最多只能容一人,记 为社会网络内处于格点 的个体(令 )在 时刻所处的状态,并规定:
1) :易感状态 (Susceptible),即个体未被感染,并且没有免疫力;病毒从处于易感状态 出发,沿网络连接向四周传播。
2) :潜伏状态 (Exposed),病毒入侵后被感染的个体处于潜伏状态 ,由于不同个体自身对疾病的重视程度不同,处于潜伏期 的部分个体会分别以概率 进入状态 和 。
3) :染病状态 (Infected),即个体已被感染,此时个体具有传染性。
4) :治疗状态 (Diagnosed),患病者被确诊,并接受治疗,由于医疗作用以概率 进入免疫状态,即状态5。
5) :免疫状态 (Recovered),在病毒传播开来后,部分处于易感状态 的个体通过提前注射疫苗等措施对该病毒产生预免疫,进入免疫状态 。而被感染的个体也经过一系列治疗措施,转变为免疫状态 。个体在病毒传播期间的状态变化情况如图2所示。
2.2.2. 网络节点免疫情形
社会网络内群体免疫系数 反映了现实中人们对病毒的重视程度,对疾病的传播有重要的影响,定义处于免疫期内的个体其免疫强度 。引入时间函数 ,其中 为个体从感染病毒到接受治疗的反应时间,显然,越小越有利于阻止疾病的传播; 为免疫持续时间,个体疾病传播期间的免疫持续时间 越长,感染疾病概率越低,疾病的扩散速度越慢,在一定程度上 也反映了病毒的变异频率。
2.2.3. 网络节点传染强度
1) 潜伏期的传染强度为 ( ), 越大,病原体越容易把疾病传染给邻元。
2) 发病期传染强度为 ( ),一般情况下 。
2.3. 元胞自动机病毒传播模型的演化规则
1) 当 时,被感染的概率 ,记个体在单位时间内接触的人数呈泊松分布,则个体 单位时间内接触 个人的概率为:
其中, 为网络内节点k的度, 为单位时间内个体与个体接触平均次数。
令 为个体的连接矩阵,如果节点i与k相连 否则 个体被感染的概率
其中n为节点总数
此时个体处于潜伏状态或者染病状态,即:
2) 当 时,个体的转移概率
病毒入侵后被感染的个体处于潜伏状态 ,不同个体对疾病的警惕程度不同,处于潜伏期 的部分个体以不同概率进入状态 和 。接触次数越多的个体对疾病病毒警惕性越高,即处于潜伏期且接触人数的个体转化为患病状态 和免疫状态 的概率也较大,但同时接触人数越多的个体感染病毒的概率也较大。为便于讨论问题,假设此时的状态转移概率
均为 。
3) 当 时,计算个体状态转移概率。
处于感染状态个体在潜伏期内,经过积极治疗等一系列医疗手段,以概率 转移为诊断治疗状态 ,此时个体仍为患病期。由于复杂网络的特点,由感染状态,转移为状态 的概率可忽略不计。此时接受积极治疗的概率也从另外一个侧面反映了社会大众对疾病的认知程度和医疗负担能力。
4) 当 时,计算个体的状态转移概率。
社会网络中已免疫的部分个体由于病毒产生变种等原因,又重新转变为易感状态 。免疫持续时间为 ,则 ,还有一部分是被感染之后处于潜伏期的个体,由于自身警惕性较高而及早进行治疗等措施,获得免疫力进入免疫期。
5) 当 时,计算个体的转移概率。整个网络按照上述规则进行演化。免疫持续时间 过后,免疫群体以概率 返回到易感者。
3. 模拟结果与分析
采用SEIDR模型构造元胞自动机模拟方法,对病毒在社会拓扑网络内的传播过程进行模拟仿真,并在此基础上研究了个体反应时间、疫苗注射比率与病毒变异对疾病传播的影响。根据模拟构造的社会网络,泊松分布中平均接触数 为网络中接触数的平均值, 。并令潜伏期个体的传染强度 ,发病期传染强度 ,病原体为网络内无免疫且接触数较大的一个个体。
3.1. 疫苗注射比率对疾病传播的影响
疫苗在现代传染病预防中起到重要作用。为了研究疫苗对传染病扩散的控制效果,设计了一组仿真实验。初始无免疫(图1),然后对全体成员进行随机免疫,免疫人数为人口总数的30% (图2),50% (图3),90% (图4)。
从仿真结果来看,一定比率的疫苗注射能控制疫情蔓延,从图4还可看出,当疫苗注射比率不能达到一定比率时,虽然疫情开始会得到控制,随着时间的推移,疫情依然会有所起伏,患病人数在一段时间以后持续走高,总体上疫苗注射比率的加大,患病者人数逐渐走低。可见比率较小疫苗注射作用只是暂时对疫情有所控制,而并不能从根本上消灭疫情,这种情况一般多见于传染性极强的传染病如乙型肝炎,因此,如果通过疫苗注射有效控制疫情需要对人群有相当比比率的疫苗注射,这就意味着医疗成本投入相当大,无论对个人还是对国家都会造成沉重的负担。图5反映了患病者人数在疫苗注射率分别为0.1,0.3,0.9时的变化规律。
本文提出目标注射的概念,即有目的的对接触数较多的人群进行疫苗注射,因为社会网络中节点数量对病毒传播疾病破坏力最强,这对我们进行有效的疾预防提供了一个新思路 [10] ,选择节点数(即社会交往频繁)的人群进行目标注射(注射比率为0.1),从长期来看目标注射可以较大幅度降低患病人数,控制疾病传播的效果更明显,这样既可以降低医疗成本,又能提高效率。
3.2. 接受治疗比率对疾病传播的影响
从 的变化来观察疾病发展趋势,在抗病毒治疗力度( )确定的前提下,患病人数对染病者接受治疗的比率敏感度随着接受治疗比率提高,患病者有小幅波动下降(图6)。从爆发时间来看,接受治疗比率的增大对患病者人数增长速率的影响比较明显,接受治疗比率越大患病者增长越缓慢,最终趋于稳定,稳定值变化不明显。从仿真结果来看,单方面依赖药物治疗对传染病的控制作用仅仅是延缓了疾病的发展,并未从根本上根除疾病传播,因此应当适当治疗的同时辅助以其他控制手段。
3.3. 医疗水平对疾病传播的影响
用治疗力度来反应医疗水平,分别以 取0.2,0.5,0.9得仿真图7,从结果来看,当治疗医疗水平确定的情况下(即 恒定取0.6),治疗水平为0.2时,患病人数成周期波动变化,峰值逐渐降低,随着治疗水平逐渐提高,即抗病毒治疗增大到一定程度时,如果抗病毒治疗力度继续加大,开始可以对疾病有暂时控制作,随着时间的推移患病者人数将会出现较大浮动,因此,笔者认为抗病毒治疗应当适可而止。
3.4. 传染强度对疾病传播的影响
考虑传染强度对患病者人数影响即考虑 和 ,依次取 , 为(0.2,0.4),(0.4,0.7) (0.7,0.9)仿真图见图8,由结果可见,患病人数随着传染强度的增强,增长速率越来越来高,最终的稳定值也逐渐增高。由此可见,对某一种传染病来说,控制传染强度,如:采取隔离等措施强制防止传染力发挥作用,能起到控制传染源并抑制疫情蔓延的作用。

Figure 1. Vaccine injection rate 0
图1. 无疫苗注射

Figure 2. Vaccine injection rate 0.3
图2. 疫苗注射比率为0.3

Figure 3. Vaccine injection rate 0.5
图3. 疫苗注射比率为0.5

Figure 4. Vaccine injection rate of 0.9
图4. 疫苗注射比率为0.9

Figure 5. Comparison of the patients (the injection rate was 0.1, 0.3, 0.9)
图5. 患病者对比(疫苗注射比率分别为0.1,0.3,0.9)

Figure 6. Effects of treatment proportion on infected patients
图6. 治疗比例对染病者影响

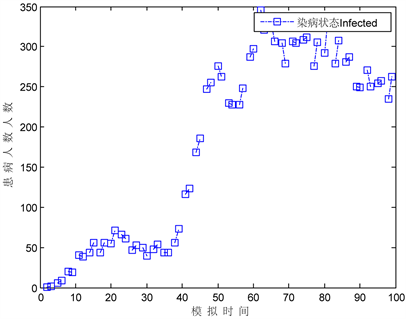
Figure 7. Effect of treatment intensity on the affected population
图7. 治疗力度对患病者影响

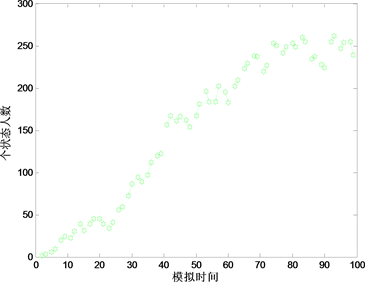

Figure 8. Influence of infectious intensity on the number of people affected
图8. 传染强度对患病者人数的影响
3.5. 及时就医对疾病传播的影响
定义1:反应时间为个体从感染疾病到发现并及时治疗所花费的时间。
从图5,图6可以看到个体对疾病反应时间越短染病者人数越少,免疫群体的人数增加幅度比较明显,因此有理由认为个体对病毒的重视程度对疾病的传播影响不容忽视,当某种传染病到来时应该及时对民众进行普及知识教育,提高大众认知也很重要。
反应时间在一定程度上反应了个体对病毒的重视程度,以个体反应时间分别为1,3,7天为例进行了计算机仿真(图9),从图中可以看到,随着反应时间的加长会伴随患病者人数加倍增加,可见及时就医对抑制疾病传播效果显著。
4. 案例分析
为了验证模型的有效性,笔者对梅毒这种特殊传染病进行分析和讨论。梅毒是由性接触,血液和母婴等方式传播的慢性系统性传染病。在中国,梅毒患病者几乎分布全国各地,目前全国范围内梅毒都在危害人类健康,其中河南,云南,广西三省最为严重,对于这一通过特殊传播方式传播的疾病,逐渐呈泛滥趋势的今天,若想得到有效控制甚至灭绝,仍需要作出很多努力。为更清楚的观测梅毒患病人数发展趋势,笔者搜集了2006年1月到2012年6月全国法定传染病统计数据报告关于梅毒患病人数统计数据 [13] ,共78个数据整理作图(图10)。
从图中可以看到,梅毒患病人数呈周期波动,高峰期每年位于8,9,10月份左右,每年1,2月份发病人数最少,属于低谷期,但是周期波动的峰值有逐渐走高的趋势。从图11来看,无论是峰值,还是低谷值都大致呈直线上升趋势。
目前,对于梅毒的大部分研究主要在于症状,病例,或者发病原因等的病理性分析 [14] [15] ,没有相关的预测模型的研究。作为理论验证,并且考虑到社会和经济发展对人类活动的影响逐渐变化,考虑阶段性预测,同时剔除掉低谷数据,采用近期数据(2011年1月~2012年6月),令 , , ,患病期接触感染率为0.9,潜伏期感染率为0, 状态即治愈期免疫周期为0,反应时间为3,得到预测图(如图12),可通过前期数据对2012年7月之后的患病人数进行预测。
对于低谷期数据大体也呈直线上升态势,笔者运用数据拟合进行预测分析,抽取所得数据的一系列低估值,得拟合图(图13)。

Figure 9. Reaction time (1, 3, 7 days)
图9. 反应时间(1,3,7天)

Figure 10. Prevalence data of syphilis
图10. 梅毒患病历史数据

Figure 11. Scatter chart of syphilis disease
图11. 梅毒患病数据散点图

Figure 12. Phase prediction chart
图12. 阶段预测图
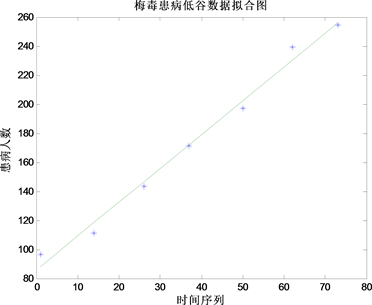
Figure 13. Fit chart of the syphilis data
图13. 梅毒低谷数据拟合图
通过以上方法预测,可以对梅毒这种复杂传染病的患病人数进行预测。为制定预防和控制传染病的公共卫生政策提供参考,从而验证了本文模型的应用价值。
5. 结论
本文从复杂适应系统的观点,用元胞自动机进行计算机模拟疾病传播这个复杂的过程。并进行了一系列仿真实验,考虑了疫苗注射比率,感染强度和治疗力度,及时就医等因素对疾病传播的影响。尽量缩短发病到就医的时间间隔,及时采取隔离措施,都会有效遏制疾病传播。同时还得到结论:提高疫苗注射比率作为一种控制疾病传播的方法是行之有效的,为了降低医疗成本,提高效率,可以有目标的对接触数较多的人群进行有目标的疫苗注射,抗病毒治疗比率调高在一定范围内可以明显控制疫情蔓延,但是当治疗强度达到一定程度只会暂时控制疫情,长期来看疫情依旧未有明显遏制,因此抗病毒治疗应该适可而止。最后通过对中国国内梅毒传染病进行讨论分析,证明了模型的应用价值。
在实际中,疫情爆发初期,可以通过相关部门的调研,统计等方法,对某一地区的必要参数进行预设定,进行计算机模拟仿真,观测疾病发展趋势,再现传染过程,用已有历史数据对未来的疫情进行预测,以期为采取相应措施提供依据。
基金项目
基于数学建模的微分方程案例教学模式探究(JY2017B10);双语教学课程建设项目(Sy201709)。
文章引用
张丽娟. 一类复杂系统下元胞自动机传染病模型的控制和预测
Control and Prediction of Cellular Automata Epidemic Model under a Complex System[J]. 运筹与模糊学, 2017, 07(04): 91-103. http://dx.doi.org/10.12677/ORF.2017.74011
参考文献 (References)
- 1. Barker, J.L., Abrams, R.B., Ball, D.L., et al. (1983) Radiometric Calibration and Processing Procedure for Reflective Bands on Landsat-4 Protoflight Thematic Mapper. NASA Publication, Washington DC.
- 2. Desachy, J. (1985) Investigation of Landsat-4 TM Line-to-Line and Band-to-Band Registration and Telative Detector Calibration. Photogrammetric Engineering & Remote Sensing, 1291-1298.
- 3. 陈宝林. 最优化理论与算法[M]. 北京: 清华大学出版社, 2002.
- 4. 陈希孺. 线性模型参数的估计理论[M]. 北京: 科学出版社, 1985.
- 5. 赵英时. 遥感应用分析原理和方法[M]. 北京: 科学出版社, 2003.
- 6. 李璐, 宣慧玉, 高宝俊. 基于元胞自动机的异质个体HIV/AIDS传播模型[J]. 系统管理学报, 2008, 17(6): 704- 710.
- 7. 关超, 彭云, 袁文燕. 基于元胞自动机带有干预机制的传染病模型[J]. 北京化工大学学报, 2011, 38(6): 109-113.
- 8. Brendan, D., Cowled, M., Garner, G., Negus, K. and Ward, M.P. (2012) Controlling Disease Outbreaks in Wildlife Using Limited Culling: Modeling Classical Swine Fever Incursions in Wild Pigs in Australia. Veterinary Research, 43, 1-3.
- 9. Peter, M.A., Sloot, A., Boukhanovsky, V. and Alfredo, W.K. (2005) A Grid-Based HIV Expert System. Journal of Clinical Monitoring and Computing, 19, 263-278. https://doi.org/10.1007/s10877-005-0673-2
- 10. Bisset, K.R., Aji, A.M. Marathe, M.V. and Feng, W.C. (2012) High-Performance Biocomputing for Simulating the Spread of Contagion over Large Contact Networks. BMC Genomics, 2012, 1471-2164. https://doi.org/10.1186/1471-2164-13-S2-S3
- 11. Chaudhury, A., Huri, P.B. and Majumder, S. (2012) Spread of Information in a Social Network Using Influential Nodes. Springer-Verlag, Berlin Heidelberg, 121-132. https://doi.org/10.1007/978-3-642-30220-6_11
- 12. Giabbanelli, P.J. (2013) A Novel Framework for Complex Networks and Chronic Diseases. Springer-Verlag, Berlin Heidelberg, 207-215. https://doi.org/10.1007/978-3-642-30287-9_22
- 13. Pastor-Satorras, R. and Vespignani, A. (2001) Epidemic Dynamical and Endemic States in Complex Networks. Physical Review E, 63, 66-117. https://doi.org/10.1103/PhysRevE.63.066117
- 14. 李军, 王琳娜, 郑和义. 梅毒血清IgM抗体与传染性的关系[J]. 中国皮肤病学杂志, 2012, 7(26): 591-593.
- 15. 王毅, 徐杰, 李志军, 等. 绵阳市男男性行为人群队列基线HIV/梅毒感染及影响因素分析[J]. 中国皮肤病学杂志, 2012, 5(26): 410-144.