Hans Journal of Food and Nutrition Science
Vol.
09
No.
01
(
2020
), Article ID:
33691
,
7
pages
10.12677/HJFNS.2020.91001
Inhibition of GCK on High Fat Diet-Induced Mouse Obesity
Jianqin Mao1, Xiaofang Zhong1, Lifei Liu1,2,*
1Zhejiang HISUN Pharmaceutical CO., Ltd., Taizhou Zhejiang
2Wuhan Optics Valley Yatai Pharmaceutical Research Institute Co, Ltd., Wuhan Hubei
Received: Dec. 12th, 2019; accepted: Dec. 23rd, 2019; published: Dec. 30th, 2019

ABSTRACT
Objective: To investigate the effect of GCK on high fat diet-induced mouse obesity model. Methods: Mice were fed a high-fat diet for 12 months to develop an obesity model. GCK was intragastrical administered for 6 weeks, while the food intake and body weight were recorded. The mice were sacrificed at the end of the experiment. The plasma levels of ALT, AST, TC and TG were detected by automatic biochemical analyzer. The liver was prepared by paraffin section and stained by HE staining kit. The RNA was extracted from the liver homogenate, and the levels of lipid metabolism related proteins FAS and PPARα were detected by RT-PCR. Results: GCK did not affect the food intake of mice, but high dose of GCK could cause weight loss in obese mice. GCK can effectively reduce plasma ALT, AST, TC, TG levels in mice; GCK can reduce the fat content in mouse liver. The mechanism of those effects may be to induce the FAS decrease and PPARα increase. Conclusion: GCK can inhibit the HFD-induced obesity.
Keywords:Ginsenoside Compound k, Mouse Obesity Model, Fat Loss, Lipid Metabolism-Related Gene

GCK对高脂饲料诱导的小鼠肥胖模型的 降脂减肥作用
毛剑琴1,钟晓芳1,刘礼飞1,2*
1浙江海正药业股份有限公司,浙江 台州
2武汉光谷亚太医药研究院有限公司,湖北 武汉

收稿日期:2019年12月12日;录用日期:2019年12月23日;发布日期:2019年12月30日

摘 要
目的:探讨GCK对高脂饲料诱导的小鼠肥胖模型的干预作用。方法:小鼠用高脂饲料喂养12个月造成肥胖模型。GCK口服给药6周,同时记录小鼠摄食量、体重变化;实验终点处死小鼠取血浆,全自动生化仪检测血浆中ALT、AST、TC、TG水平;取肝脏制作石蜡切片HE染色后显微镜下观察肝脏中脂肪滴含量;肝脏匀浆提取RNA,RT-PCR检测脂代谢相关蛋白FAS和PPARα水平。结果:GCK不影响小鼠摄食量,但是高剂量GCK能够导致肥胖小鼠体重减少;GCK能够有效降低小鼠血浆ALT、AST、TC、TG水平;GCK能够减少小鼠肝脏中的脂肪含量,其作用机制可能是诱导FAS的降低和PPARα的升高。结论:GCK能够在一定程度上抑制高脂饲料造成的肥胖。
关键词 :人参皂苷复合物K,小鼠肥胖模型,降脂减肥,脂代谢相关基因

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
流行病学研究发现,肥胖会增加如II型糖尿病、脂肪肝、高血压、心肌梗塞、中风、骨关节炎、阻塞性睡眠呼吸暂停等疾病的风险,从而导致人生活质量的下降和预期寿命的缩短,严重威胁人类健康 [1]。然而在过去的五十年里,肥胖的发生率一直呈上升趋势。卫计委调查显示,截止2017年,中国平均肥胖率达到了12%,而肥胖人口总数已经超过美国位居首位。从目前来看,肥胖的预防和治疗策略无论是在个人还是在人群上均没有达到显著效果,因此新型、高效、低副作用的肥胖抑制药物拥有巨大市场。
人参皂苷是一类三萜烯皂苷,是人参重要的活性成分,迄今为止已经分离和鉴定出有超过150种人参皂苷。其中,二醇型人参皂苷肠道微生物代谢产物——人参皂苷复合物K (ginsenoside compound K, GCK)在抗过敏 [2] 、抗炎 [3] 、治疗糖尿病 [4] 、抗衰老 [5] 、保肝 [6] 等方面具有一定效果。由于其毒性低并具有多重生物学功能,GCK有望被开发成多种疾病的治疗药物。
本实验旨在研究GCK对肥胖小鼠的减肥作用,为其新适应症的开发提供理论依据。
2. 材料与方法
2.1. 动物及主要试剂
C57BL/6小鼠购自南京模式动物研究所;GCK原料药(批号:S151201)由浙江海正药业股份有限公司生产;所有生化检测试剂盒购自上海科华生物工程股份有限公司;荧光定量PCR试剂盒购自北京天根(FP303-01);反转录试剂盒购自北京全式金生物技术有限公司(AH311-03);羧甲基纤维素钠(Carboxymethylcellulose sodium salt, CMC-Na)购自sigma-aldrich公司(C5013);肝素钠购自国药试剂公司(63007132);高脂饲料购自Researchdiets公司(D12492, 60% kcal);TRIzol购自Thermo Fisher公司(15596018);其他试剂均为国产分析纯。PCR引物由上海捷瑞生物工程有限公司,序列如下:FAS-F: GGCTCTATGGATTACCCAAGC;FAS-R:CCAGTGTTCGTTCCTCGGA; PPARα-F:AGAGCCCCATCTGTCCTCTC;PPARα-R:ACTGGTAGTCTGCAAAACCAAA。
2.2. 小鼠模型的建立及给药
C57BL/6J小鼠,雄性,6~8周,18~22 g,适应性饲养7天后将普通饲料更换为60% kcal的高脂饲料,喂养12个月制造肥胖小鼠模型,对照组(Ctrl)仍然用普通饲料喂养。造模结束后,根据体重均分为模型组(Model)、低剂量组(Low)和高剂量组(High)每组8只,而Ctrl组选取体重相近的8只。将GCK混悬于0.5% CMC-Na中,低剂量组每日给药剂量为25 mg/kg,高剂量组每日给药剂量为250 mg/kg,Ctrl组和Model组给予相当体积的0.5% CMC-Na。所有小鼠每3 d称量一次体重,并每周计算平均摄食量。给药6周后,眼球取血,脱颈处死小鼠,解剖,观察大体情况,取肝大叶,至少三倍体积福尔马林固定,一周后HE染色;另取少许组织立即保存于−80℃,用于RNA提取。
2.3. 血生化检测
小鼠血液置于抗凝管中,4℃、1500 r/min离心10 min,取上清即得到血浆;将小鼠血浆置于生化反应皿,每个样品200 μL,全自动生化仪检测血浆ALT、AST、TC、TG水平。
2.4. 肝脏的切片和HE染色
将固定好的肝大叶切成合适大小置于包埋盒中,莱卡脱水机按照75%乙醇1 h → 85%乙醇1 h → 95%乙醇2 h → 95%乙醇2 h → 二甲苯2 h → 石蜡3 h的程序脱水;脱水完成后石蜡包埋,再切成5 μM的切片;按照HE染色试剂盒说明书操作进行HE染色;树脂天青封片;100×显微镜下观察并拍照。
2.5. 肝脏RNA的提取
保存于−80℃的肝脏组织取0.2 g左右,加入三倍体积的TRIzol,玻璃匀浆器匀浆;再加入1/5体积的氯仿,震摇混匀,室温静置至分层后4℃ 12000 r/min离心10 min,取上清加入等体积异丙醇混匀,4℃ 12000 r/min离心10 min取沉淀;75%乙醇洗涤两次,晾干;加入无RNA酶的去离子水溶解,并测定浓度。
2.6. 荧光定量PCR检测
取上述RNA每个样品2 μg,用反转试剂盒反转录为cDNA;再按照荧光定量试剂盒说明书操作,Bio-Rad CFX96荧光定量PCR仪检测,结果以相对表达量(Relative quantity,RQ)表示,RQ = 2 – ΔΔCt (ΔΔCt = 待测标本的ΔCt − 对照标本ΔCt;ΔCt = 目的基因Ct值 − 内对照Ct值)。
2.7. 统计分析
所有实验数据采用 ± SD表示,采用SPSS 22软件进行One-way ANOVA分析。当方差齐时用LSD进行组间比较,当方差不齐时用Dunnett’s T3进行组间比较,P值小于0.05认为差异具有统计学意义。
2.8. 动物伦理
所有动物实验均严格按照《海正药业实验动物饲养和操作指南》进行,并获得海正药业动物伦理委员会批准。
3. 结果
3.1. GCK不影响小鼠食物摄取
模型完成后,高脂饲料喂养的小鼠体型是正常小鼠的2倍,其皮下白色脂肪丰富,活动量较正常饲料喂养的少。
本实验在造模和给药阶段均未限制小鼠的水食摄取,给药后,每周一给予足够的饲料并记录饲料重量,次周一记录剩余饲料重量,从而计算每只小鼠每天的平均进食量,结果如图1所示,高脂饲料喂养的Model组、Low组、High组的摄食量均在2.9 g/d/mouse左右波动,组间未见明显差异;而正常饲料喂养的Ctrl组小鼠由于食物热量低,进食量明显大于高脂饲料组,在5.37 g/d/mouse左右波动,提示GCK给药对小鼠进食量无影响。
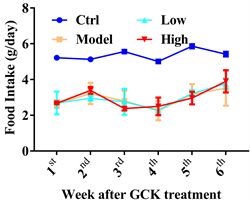
Figure 1. Average food intake of each mouse after GCK treatment
图1. 给药后小鼠平均进食量
3.2. GCK导致小鼠体重明显下降
小鼠每3天检测一次体重,如图2所示,Ctrl组小鼠体重基本不变,Model组和Low组呈升高趋势,而高剂量给药组的体重出现明显的下降。说明GCK能够促进肥胖小鼠体重下降。

Figure 2. Body weight of mice after GCK treatment
图2. 小鼠给药后体重变化
3.3. GCK对小鼠血液生化指标的影响
给药6周后眼球取血,制备血浆,用于检测血浆AST、ALT、TC、TG水平,如图3所示,GCK能够恢复高脂饲料诱导的血液中AST、ALT、TC、TG水平的升高,且呈一定的剂量依赖效应。
3.4. GCK对小鼠肝脏脂肪含量的影响
将小鼠肝大叶切片,HE染色后,200×镜下观察可见Ctrl组小鼠肝脏组织肝索清晰,无明显脂肪组织(图4,圆形空白为脂肪滴),而Model组肝索几乎无法看清,有大量圆形脂滴,并伴有大量肝气球样变性;给药Low组有一定缓解作用,而High组脂滴数量和肝细胞气球样变性都明显减少。说明GCK具有减少小鼠肝脏脂肪沉积的作用。
 ##: P < 0.01, vs Ctrl; *: P < 0.05, vs Model;**: P < 0.01, vs Model.
##: P < 0.01, vs Ctrl; *: P < 0.05, vs Model;**: P < 0.01, vs Model.
Figure 3. Mice blood biochemical test
图3. 小鼠血生化检测

Figure 4. GCK reduces the HFD-induced fat accumulation in mice liver (200×)
图4. GCK减少高脂饲料诱导的小鼠肝脏脂肪蓄积(200×)
 #: P < 0.05, vs Ctrl; *: P < 0.05, vs Model.
#: P < 0.05, vs Ctrl; *: P < 0.05, vs Model.
Figure 5. Relative levels of FAS and PPARα in mice liver
图5. 小鼠肝脏FAS和PPARα相对水平
3.5. GCK对小鼠肝脏脂肪代谢相关蛋白的影响
肝脏组织荧光定量PCR (图5)显示:高脂饲料能够导致小鼠肝脏脂肪相关蛋白FAS的升高和PPARα 的降低;而给予GCK干预后FAS和PPARα得到不同程度的回复,且High剂量组具有显著差异。这可能是GCK促使肝脏脂肪量减少和小鼠体重减轻的分子机制。
4. 讨论
我们前期GCK药代动力学试验表明小鼠单次给予GCK的剂量爬坡至250 mg/kg即进入吸收平台期,且小鼠毒理学试验和人临床实验表明此剂量无明显毒性,因此我们采用250 mg/kg/d作为高剂量组。结果显示250 mg/kg/d给药6周能够明显抑制高脂饲料诱导的小鼠肥胖。
GCK是天然二醇型人参皂苷的微生物代谢产物,是其在体内主要的活性形式。张雷鸣等 [7] 采用CCl4造成大鼠慢性肝损伤模型,在给与GCK后能够有效降低血清中ALT、AST水平;聂忠富等 [8] 发现GCK能够降低高脂饲料诱导的动脉粥样硬化大鼠血浆TC、TG水平。本实验研究发现GCK亦能够降低高脂饲料诱导的肥胖小鼠血浆中的ALT、AST、TC、TG水平,与文献报道一致。
目前,高脂血症、肥胖、脂肪肝及其相关疾病已成为世界性难题,热量摄入过多和运动量少是肥胖形成的主要原因,但是一些基因也与肥胖密切相关 [9]。在肥胖发生的过程中,脂代谢相关的蛋白如载脂蛋白和脂肪代谢酶类起到了重要作用。如过氧化物酶体增殖物激活受体α (peroxisome proliferators activated receptors alpha, PPARα)的缺乏会造成甘油三酯沉积于肝脏,脂类、碳水化合物代谢紊乱 [10];FAS基因在肝脏中的过度表达会导致脂肪肝的产生和肝细胞的胰岛素抵抗,甚至在正常体重的个体也会产生这种情况 [11]。我们的研究发现小鼠在高脂饲料喂养一年后肝脏会出现大量的脂肪沉积,且PPARα水平明显下降,FAS水平明显上升,但是在给与高剂量GCK后PPARα和FAS的mRNA水平的得到了不同程度的恢复。GCK是如何影响这些基因表达的有待进一步研究。
文章引用
毛剑琴,钟晓芳,刘礼飞. GCK对高脂饲料诱导的小鼠肥胖模型的降脂减肥作用
Inhibition of GCK on High Fat Diet-Induced Mouse Obesity[J]. 食品与营养科学, 2020, 09(01): 1-7. https://doi.org/10.12677/HJFNS.2020.91001
参考文献
- 1. Bluher, M. (2019) Obesity: Global Epidemiology and Pathogenesis. Nature Reviews Endocrinology, 15, 288-298.
https://doi.org/10.1038/s41574-019-0176-8 - 2. Shin, Y.W. and Kim, D.H. (2005) Antipruritic Effect of Ginse-noside Rb1 and Compound K in Scratching Behavior Mouse Models. Journal of Pharmacological Sciences, 99, 83-88.
https://doi.org/10.1254/jphs.FP0050260 - 3. Joh, E.H., Lee, I.A., Jung, I.H., et al. (2011) Ginsenoside Rb1 and Its Metabolite Compound K Inhibit IRAK-1 Activation—The Key-Step of Inflammation. Biochemical Pharmacology, 82, 278-286.
https://doi.org/10.1016/j.bcp.2011.05.003 - 4. Kim, K., Park, M., Lee, Y.M., et al. (2014) Ginsenoside Metabolite Compound K Stimulates Glucagon-Like Peptide-1 Secretion in NCI-H716 Cells via Bile Acid Receptor Activation. Archives of Pharmacal Research, 37, 1193-1200.
https://doi.org/10.1007/s12272-014-0362-0 - 5. Kim, S., Kang, B.Y., Cho, S.Y., et al. (2004) Compound K In-duces Expression of Hyaluronan Synthase 2 Gene in Transformed Human Keratinocytes and Increases Hyaluronan in Hairless Mouse Skin. Biochemical and Biophysical Research Communications, 316, 348-355.
https://doi.org/10.1016/j.bbrc.2004.02.046 - 6. Lee, H.U., Bae, E.A., Han, M.J., et al. (2005) Hepatoprotective Effect of Ginsenoside Rb1 and Compound K on Tert-Butyl Hydroperoxide-Induced Liver Injury. Liver International, 25, 1069-1073.
https://doi.org/10.1111/j.1478-3231.2005.01068.x - 7. 张雷明, 傅风华, 王天, 等. 人参皂苷CK对四氯化碳致大鼠慢性肝损伤的影响[J]. 时珍国医国药, 2006(1): 38-39.
- 8. 聂忠富, 孙小燕, 张太平, 等. 人参皂苷Compound K对动脉粥样硬化大鼠氧化应激、炎症因子和血管活性物质的影响[J]. 河北中医, 2019, 41(7): 1042-1047.
- 9. Riveros-McKay, F., Mistry, V., Bounds, R., et al. (2019) Genetic Architecture of Human Thinness Compared to Severe Obesity. PLOS Genetics, 15, e1007603.
https://doi.org/10.1371/journal.pgen.1007603 - 10. Sugden, M.C., Bulmer, K., Gibbons, G.F., et al. (2002) Pe-roxisome-Proliferator-Activated Receptor-Alpha (PPARalpha) Deficiency Leads to Dysregulation of Hepatic Lipid and Carbohydrate Metabolism by Fatty Acids and Insulin. Biochemical Journal, 364, 361-368.
https://doi.org/10.1042/bj20011699 - 11. Item, F., Wueest, S., Lemos, V., et al. (2017) Fas Cell Surface Death Receptor Controls Hepatic Lipid Metabolism by Regulating Mitochondrial Function. Nature Communications, 8, Article No. 480.
https://doi.org/10.1038/s41467-017-00566-9
NOTES
*通讯作者。