Advances in Geosciences
Vol.4 No.06(2014), Article ID:14535,11 pages
DOI:10.12677/AG.2014.46042
Effect of Plant Physiological Ecology Factors on the Formation of Metalliferous Deposit Biogeochemical Anomaly
1Guangxi Key Laboratory of Hidden Metallic Ore Deposits Exploration, College of Earth Sciences, Guilin University of Technology, Guilin
2School of Computers, Guangdong University of Technology, Guangzhou
3China Nonferrous Metal Guilin Research Institute of Geology for Mineral Resources, Guilin
Email: gldysca@126.com, color_unsw@126.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Oct. 15th, 2014; revised: Nov. 17th, 2014; accepted: Nov. 28th, 2014
ABSTRACT
We studied the characteristics of biogeochemical anomaly and plant cell microscopic features by chemical spectroscopy and transmission electron microscope in several gold deposits and lead zinc deposits, Guangxi. Through this study we found that biogeochemical anomaly in the mining area has obvious internal identity with soil geochemical anomaly in material quantity and quality, the plant grown in mining area has two physiological ecology characteristics which are stress absorption and shielding effects, and a large number of metal aggregates appear on the cells of plant grown in ore deposits soil, and they subside in cell vacuole or along cell wall and film border, making internal structure of the cells be subjected to a certain degree of damage. A high metal content of environment and plant stress absorption/shielding effects is external and internal factors of biogeochemical anomaly formation, and toxicity to plant caused by general biogeochemical anomaly may only reach the level of cell or tissue. The metal amounts of the plant body in mining area is the aggregation amounts when shielding-effect is still working and plant organ or individual damage has not yet occurred. Mechanisms of accumulation or tolerance of metal in plant body are mainly cell compartmentalization or cell wall fixation, and plant’s tolerance amount can be roughly estimated through the analytical results of metal aggregates in the plant cells by energy spectrometer or the maximum or lower value of biogeochemical anomaly.
Keywords:Physiological Ecology Factors, Biogeochemical Anomaly, Metalliferous Deposit

植物生理生态学因素对金属矿床生物地球
化学异常形成的影响
宋慈安1,宋 玮2,雷良奇1,杨仲平3
1桂林理工大学,地球科学学院,广西隐伏金属矿产勘查重点实验室,桂林
2广东工业大学计算机学院,广州
3中国有色桂林矿产地质研究院有限公司,桂林
Email: gldysca@126.com, color_unsw@126.com
收稿日期:2014年10月15日;修回日期:2014年11月17日;录用日期:2014年11月28日

摘 要
采用化学光谱和透射电子显微镜等测试手段研究了广西几个金矿和铅锌矿的生物地球化学异常及植物细胞微观特征。发现:矿区生物地球化学异常和土壤地球化学异常在量和质上具有明显的内在同一性;矿区植物对元素的吸收过程具有被胁迫吸收和屏障效应的双重生理生态特征;矿床上部生长的植物细胞中出现了大量的金属聚集体,在液胞中或沿植物细胞壁及膜边缘沉淀,使细胞内部结构遭受一定程度的破坏。高金属异常环境与植物的被胁迫吸收/屏障效应是植物地球化学异常形成的外因和内因。一般的生物地球化学异常造成的对植物的毒害可能只达到细胞或组织结构的水平。矿区植物体内的金属量是在屏蔽效应还起作用,植物的器官或个体还未出现明显受害症状时的聚集量。金属在植物体内聚集或耐受的机制主要是细胞液胞的区室化和细胞壁的固定作用,植物所能耐受的量,可以从植物细胞中金属聚集体的能谱成分分析数据或生物地球化学的异常的极大值或异常下限值进行大致地估计。
关键词
生理生态学因素,生物地球化学异常,金属矿床

1. 引言
生物地球化学找矿是一种有效的找矿方法手段。生物地球化学异常具有较好的清晰度,能确定矿化带或者矿床(体)的位置,具有一定的探测深度,这种方法已在国内外森林、荒漠等特殊景观区得到一定的应用[1] -[7] 。但直到现在这种方法并没有成为国内外化探方法的主流。究其原因,除了生产技术方法、经济成本比传统化探方法要复杂、要高外,另外一个重要的原因就是生物地球化学异常的形成既同地学因素有关,也同植物生理生态学因素有关,这就增加了对生物地球化学异常解释评价的难度,从而影响到找矿的效果。生物地球化学异常作为一种“物质”是以什么性状积聚于植物中的?为什么生长于金属矿床上的植物其体内和成矿有关的微量元素的含量高出正常区很多倍,但植物并未明显中毒,植物仍能正常生长[1] [8] -[11] ?植物机体在生理生态上是怎样忍耐或抵制金属毒性的?研究这些问题将对合理地解释生物地球化学异常的形成,评价其找矿的可信度具有重要的意义。
2. 研究的矿床及研究方法
本次选择了广西太平村、龙水金矿及佛子冲、灵川铅锌矿四个矿床作为研究的矿床。其地质概况列于表1。所研究的矿床均位于广西东部亚热带红壤发育地区,气候温热,雨量丰富,植被发育,具有相
同的自然景观条件。该区矿种和矿床类型繁多,金和铅锌是其主要矿种,故选择金和铅锌矿床作为研究实例。通过对这些矿床生物地球化学异常、植物吸收基本特征及植物细胞微观表现的研究,探讨植物生理生态因素对生物地球化学异常形成的影响。
研究方法:1) 样品采集。采集研究矿床上部及外围背景区的土壤(A + B层)和芒萁(Dicranopteris pedata)、杉木(Cunninghamia lanceolata)和马尾松(Pinus massoniana)几种常见植物的叶作为试验样品,在
表1. 几个金属矿床的地质概况
采样点周围5~10 m2范围内取数株组合为1个样,样重0.4 kg。2) 样品加工。样品采取后,立即用当地食用水(元素含量低于背景水平)洗净,自然晾干及烘干(60℃),粉碎至0.2 mm。土壤样按常规化探样加工。3) 样品分析。称样,灰化(450℃)后(As,Sb分析用湿法消化处理样品)定量分析,元素含量以占干植物重表示。分析方法是:Au,泡塑料吸附-化学光谱(国产WPG-100型一米光栅摄谱仪);As,原子荧光光谱仪(国产AFS-120型);其他元素,直读光谱仪(美国90-750Ⅱ型)。土壤分析测试仪器与植物相同。4) 测试数据处理分析。计算金属矿床及背景区土壤、植物叶中微量元素的平均质量分数;计算土壤衬度系数(KTCD)(KTCD = 矿床上部土壤中某元素的平均质量分数/背景区土壤中该元素的平均质量分数);计算植物衬度系数(KZHCD)(KZHCD = 矿床上部植物中某元素的平均质量分数/背景区植物中该元素的平均质量分数;计算植物对土壤中元素的吸收系数(KXSH)(KXSH = 矿区或背景区植物中某元素的平均质量分数/矿区或背景区该植物生长土壤中的某元素平均质量分数)。5)电子显微镜研究。从新鲜植物中剪取3~4小片叶片放入固定液(戊二醛(25%),磷酸缓冲液配制成的PH = 6~8的溶液)保存待用。将植物叶片切制成薄片(ULTRACUFE型超薄切片机),在透射电子显微镜(TEM-1200EX型)下观察植物叶片细胞特征,并用能谱仪(PV9900型)测定微区成分。
3. 生物地球化学异常及植物对元素的吸收特征
由表2~表4可见:1) 无论是金矿还是铅锌矿,矿床上部土壤中成矿及伴生元素的含量都明显高于背景区土壤,说明土壤形成了地球化学异常。土壤地球化学异常的富集元素组合反映了矿化的特点:太平村红土型金矿富Au、Sn、As、Ag;龙水石英脉型金(铜)矿富Au、Cu、Pb、Ag;佛子冲矽卡岩型铅锌矿富Pb、Zn、As、Cu;灵川脉型铅锌矿富Pb、Zn、Cu、Ag。这些元素在不同的矿床具有较高的土壤衬度系数(KTCD)(表3)。2) 植物中元素的富集性状与土壤极其相似,矿床上部植物中成矿及伴生元素的含量都明显高于背景区植物,说明形成了生物地球化学异常。生物地球化学异常的富集元素组合也反映了矿化的特点。不同矿床土壤衬度系数较高的那些元素,也具有较高的植物衬度系数(KZHCD)(表3)。说明生物地球化学异常和土壤地球化学异常在物质上存在着内在的同一性。3) 考查植物对土壤中成矿及伴生元素的吸收系数(KXSH)(表4)可发现,各种植物Au、Ag、Zn的KXSH值较大(大于1或近于1),而Pb、As的KXSH值较小(一般小于0.5),这说明植物对元素的吸收是有选择性的。还可发现,矿上植物的KXSH值相对背景区都有不同程度的减小,说明生长在高金属元素含量环境中的植物对元素的吸收存在着某种“屏障效应”。4) 屏障效应只能使植物在过量金属含量的环境中降低对元素吸收的程度,实际上矿区高金属含量的环境仍然会胁迫植物吸收较多的金属元素,使得植物实际吸收的量仍然高于背景区,以致形成生物地球化学异常。可见植物在矿区对元素的吸收过程具有被胁迫吸收和屏障效应的双重生理生态特征[2] [7] [12] -[19] 。
4. 生物地球化学异常的物质在植物细胞中的微观表现
由矿上和背景区生长的植物叶细胞超显微结构(图1)可见,无矿化的背景区生长的植物,叶细胞的细胞壁、叶绿体膜、白色体膜等膜性结构及叶绿体的内部定向片层状结构清楚完好(图1中A)。但生长在金属矿床上的植物叶细胞中出现大量“电子致高密度体”物质(各色各样的“不干净”的黑色物质) [20] -[24] 。这些物质使得植物细胞内部显微结构遭受到一定程度的破坏。最显著的特征是这些物质呈不规则的10 nm~500 nm的大小不等的点状、片状、团块状、放射状大量淀积在液胞中;或者沿着细胞壁、叶绿体膜、白色体膜等边缘淀积,致使植物细胞壁及膜性结构变得粗糙或断裂受损;或者淀积于叶绿体内部对叶绿体的定向片层状结构造成破坏(图1中B、C、D、E、F、G、H、I)。
对植物细胞中出现的电子致高密度体物质进行了微区能谱成分分析,结果列于表5。由表可见:在
Table 2. Trace element mean contents (w(Au)/10−9, wB/10−6) in soil and plant leaf in the metal deposits and the background area
表2. 几个金属矿床及背景区土壤、植物叶中微量元素的平均质量分数w(Au)/10−9,wB/10−6
注:桂林矿产地质研究院分析测试中心分析。分析方法见正文。
Table 3. Contrast coefficient (KCD) of trace element contents in soil and plants contrast the metal deposits with the background area
表3. 几个金属矿床上部土壤和植物中微量元素含量相对于背景区的衬度系数(KCD)
电子显微镜下以电子致高密度体形式出现的物质实际上是一种金属元素高度集中的聚集体,而且这些聚
集体元素中除了主要的生物物质(如P、S、K、Ca、Si、Fe等)外,占有很大的比例的是那些生物地球化学异常中的金属元素,如太平村红土型金矿植物细胞中的电子致高密度体物质富Au、Sn、Ag,其含量占各元素总量的33.00%~41.69%;龙水石英脉型金(铜)矿富Au、Cu、Pb、Ag,其含量占总量的29.63%~52.12%;学异常中的金属元素,如太平村红土型金矿植物细胞中的电子致高密度体物质富Au、Sn、Ag,其含量占各元素总量的33.00%~41.69%;龙水石英脉型金(铜)矿富Au、Cu、Pb、Ag,其含量占总量的29.63%~52.12%;佛子冲矽卡岩型铅锌矿富Pb、Ag、(Cu),其含量占总量的41.03%~44.36%;灵川脉型铅锌矿富Pb、Ag。其含量占总量的46.80%。这种现象充分说明各个矿床产生的生物地球化学异常物质是以不同的金属聚集体的性状存在于植物细胞中的。
5. 生理生态学因素对生物地球化学异常形成影响的分析
5.1. 高金属环境与植物被胁迫吸收/屏障效应——形成生物地球化学异常的外因和内因
根据植物生理学的研究,植物对矿质元素的吸收可以同时存在被动和主动吸收两种方式[25] 。被动吸收主要通过基质—植物体系的质点(离子、分子)沿电化学势梯度方向扩散转移或离子交换而被植物吸收,在矿区这样高金属基质的环境中,由于金属离子的活度增大导致电化学势增高的情况下,植物的被动吸收占取主导地位[22] [25] ,这种吸收对植物而言是被胁迫的。从矿床植物中元素的质量分数和衬度系数(表2、表3)可以看出:在金矿土壤中w (Au)达159.17 × 10−9 - 349.21 × 10−9(高于背景w (Au)的152~155倍)的情况下,矿上的芒萁、杉木、马尾松中w (Au) 也高,分别可达101.62 × 10−9 - 354.43 × 10−9、135.56 × 10−9 - 310.70 × 10−9和87.40 × 10−9 - 193.54 × 10−9,比背景区的相应植物高出38~147倍、107~135倍和42~111倍。
Table 4. The absorption coefficient of plants to trace elements in the metal deposits and the background area
表4. 几个金属矿床及背景区植物对微量元素的吸收系数(KXSH)
在铅锌矿土壤中w (Pb)达269.5 - 986.00 × 10−6(高于背景w (Pb)的13~39倍)的情况下,矿上芒萁、杉木、马尾松中w (Pb)分别可达74.20 × 10−6 - 118.00 × 10−6、57.20 × 10−6 - 130.00 × 10−6和62.40 × 10−6 - 222.00 × 10−6,是背景区的相应植物质量分数的5~8倍、8~19倍和6~22倍。金矿或铅锌矿土壤中含量较高的那些伴生元素,也具有这样的特征。很明显,矿区土壤高金属含量的环境胁迫植物的被动吸收是形成生物地球化学异常主要原因。
主动吸收是植物的一种正常吸收,植物对矿质的吸收在一定的范围内,会因外界离子质点浓度的增高而增加,但达到一定程度后就不会再吸收[25] ,反映到植物吸收特性上就是它的屏障效应,具体表现是植物对元素的吸收系数在矿区的降低现象。从矿床植物中元素的吸收系数(表4)可以看出:芒萁、杉木、马尾松对Au的吸收系数,背景区分别是2.581~1.071、1.210~1.022和1.961~0.773;矿区分别是0.638~1.015、0.852~0.890和0.549~0.554;矿区相对于背景区降低幅度分别是75.3%~0.2%、29.6%~12.9%和
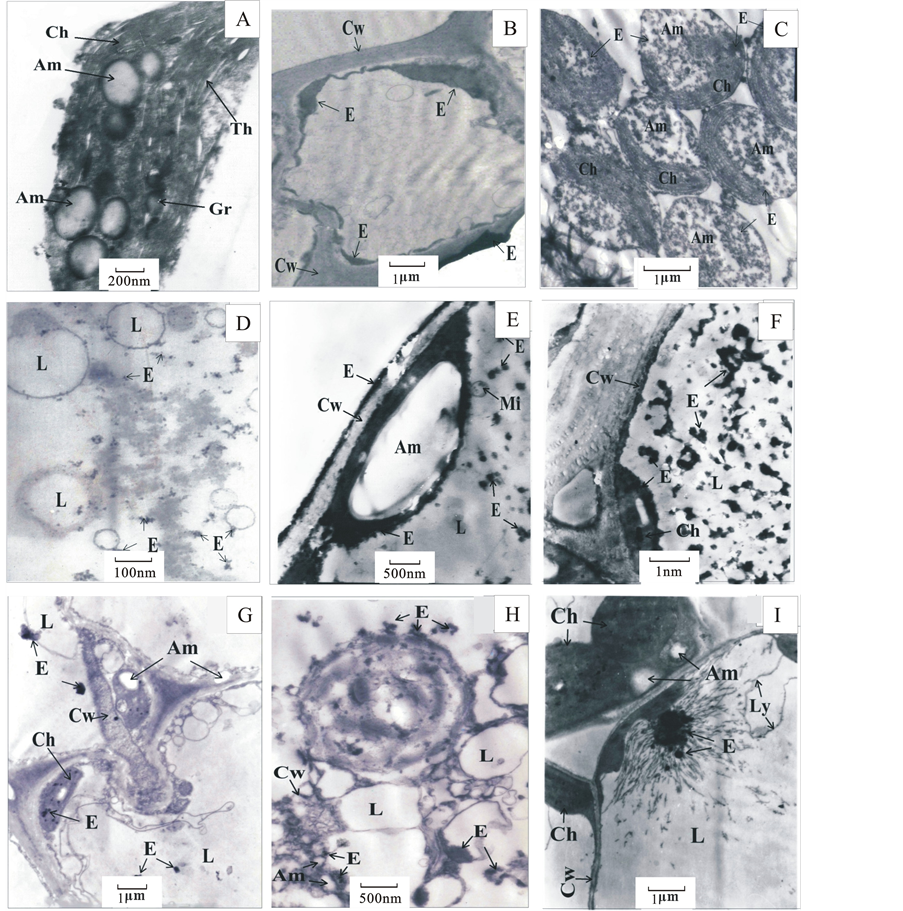
Figure 1. Microstructure characteristic of plant leaf cell in the metal deposits and the background area
图1. 几个金属矿床及背景区植物叶细胞显微结构特征
E-电子致高密度体物质;Cw-细胞壁;Nu-细胞核;Nus-核仁;Ch-叶绿体;Mi-线粒体;Am-白色体;L-液胞;Gr-基粒;Ly-溶酶体;(A) 区域背景区生长的杉木叶:白色体的膜性完整,叶绿体的内部结构完好,呈片层状定向排列,无紊乱现象;(B) 太平村金矿矿上生长的杉木叶:高密体沿细胞壁内外大量沉淀,厚薄不匀,呈飘带状,细胞壁局部出现断裂;(C) 太平村金矿矿上生长的马尾松叶:高密体沉淀在叶绿体、白色体中,叶绿体尚能保持其片层状结构,但白色体中沉淀高密体物质较多,呈不规则斑块状,使白色体结构模糊不清;(D) 太平村金矿矿上生长的芒萁叶:高倍放大清晰可见液胞中高密体沉淀的形态,呈密度不同的片状和云雾状分布,小液胞的壁加粗变得粗糙;(E) 龙水金铜矿矿上生长的杉木叶:高密体沿细胞壁沉淀,使细胞壁出现断裂;白色体膜边缘亦有大量黑色高密体沉淀,其膜结构模糊,表面变得粗糙,局部出现断裂现象;液胞中沉淀大量片状、点状高密体;(F) 龙水金铜矿矿上生长的芒萁叶:液胞中沉淀大量不规则片状高密体;高密体沿细胞壁、叶绿体膜边缘沉淀;叶绿体内部亦沉淀较多高密体,定向片层状结构被破坏;(G) 佛子冲铅锌矿矿上生长的杉木叶:高密体呈斑块状、不规则团块状沉淀在液胞中;或沿液胞间隙中“填隙”式分布,或沉淀于叶绿体中;(H)佛子冲铅锌矿矿上生长的马尾松叶:高密体在细胞壁上、白色体边沿沉淀,或沿液胞间隙中“填隙”式沉淀;或在液胞中沉淀;(I) 灵川铅锌矿矿上生长的芒萁叶:高密体呈不规则团块状、放射状大量沉淀在液胞中。
72.0%~28.3%。芒萁、杉木、马尾松对Pb的吸收系数,背景区分别是0.646~0.594、0.354~0.271和0.507~0.394;矿区分别是0.275~0.120、0.212~0.132和0.232~0.225;矿区相对于背景区降低幅度分别是57.4%~79.8%、
Table 5. Analytical results (wB/10−2) of centralized electron high-density substance by energy spectrometer in plant leaf cell in the metal deposits
表5. 几个金属矿床植物叶细胞中电子致高密度体物质微区能谱成分分析结果wB/10−2
48.1%~51.3%和54.2%~42.9%。金矿或铅锌矿土壤中含量较高的那些伴生元素,也具有这样的特征。
植物对元素的吸收系数在矿区的降低现象,反映出植物在抵抗逆境胁迫时具有一种生理防护机能,在基质环境异常胁迫作用下,植物可以通过主动地自控性吸收,在一定的时间范围内减少甚至抵制吸收有毒的金属元素以免受其害[26] -[32] 。这可能就是植物具有屏障效应的主要原因。无论是被胁迫吸收还是屏障效应,都是在高金属环境条件下植物的吸收生理性能发生改变的表现,而高金属基质环境与植物的被胁迫吸收/屏障效应是生物地球化学异常形成的外因和内因。
5.2. 植物被胁迫吸收产生的不同层次的生物地球化学异常
生长于矿区高金属环境的植物,当被胁迫吸收超过其需要的限度时就会对其产生毒性。金属对植物的毒性程度可以在生物分子、细胞、组织、器官、个体、种群、群落等不同生物学水平上表现出来[22] [33] -[37] 。对于植物被胁迫吸收形成的生物地球化学异常来说,主要表现在一般的生物地球化学异常、地植物学异常、指示植物三个层次上。金属矿床一般的生物地球化学异常层次造成的对植物的伤害可能只达到细胞或组织结构的水平程度。如图1中显示出的细胞壁变粗,局部出现断裂和裂隙;叶绿体、白色体等膜性结构受损;叶绿体的定向片层状结构受到破坏等现象。此时,植物对金属元素被胁迫吸收的量还未超过其能忍受的毒性含量,还能生长发育。本区金矿芒萁、杉木、马尾松中Au的101.62 × 10−9 - 354.43 × 10−9、135.56 × 10−9 - 310.70 × 10−9和87.40 × 10−9 - 193.54 × 10−9含量,铅锌矿芒萁、杉木、马尾松中Pb的74.20 × 10−6 - 118.00 × 10−6、57.20 × 10−6 - 130.00 × 10−6和62.40 × 10−6 - 222.00 × 10−6含量,可能就反映了本区这些植物所能忍受的毒性含量。当基质中金属的含量太高,植物被胁迫吸收的量超过了其毒性含量,植物的器官就会产生各种中毒症状,如叶出现焦黄、锈斑、坏死斑等;个体生长发育受到障碍,导致植株矮小;重则抑制植物的发育,甚至引起植物死亡[20] -[22] [25] [38] ,这就是地植物学异常层次,属于肉眼可见的生物地球化学异常。有些生长在高金属含量矿区环境中的植物个体或种群,通过长期的对环境的适应和自然选择,对某些金属元素产生了很大的耐性并生存繁衍下来,其生态特征发生变异,形成了具有找矿意义的指示植物[3] [38] -[40] 。这些植物种属或种群其体内某些金属元素的含量可达到惊人的程度。如长江中下游发现的铜矿指示植物海州香薷(Elscholtzia haichowcnsis),喜欢生长在w (Cu)大于400 × 10−6的土壤中,其灰分中w (Cu) 可达1070 × 10−6 - 5320 × 10−6[38] [39] 。指示植物实际上是一种以生物的生态变异形式表现出来的强烈的生物地球化学异常。
本次研究的矿床几种植物中,既未发现肉眼可见的植物中毒现象,也不是标型的指示植物,植物异常还只达到一般的生物地球化学异常层次。但这种异常已具备了较高的衬度,能清晰地区分背景和矿致异常,对于找矿来说这种层次的生物地球化学异常可能具有更广泛的意义。
5.3. 植物对金属元素的聚集和耐性——一般生物地球化学异常物质的聚集量
矿区生长的植物虽然由于屏障效应减少了对部分金属元素的吸收,但矿区高的金属浓度,胁迫植物吸收的实际量仍然高于背景区。因此一般矿区植物体内的金属量实际上是在屏障效应还起作用,植物还能生长发育的聚集量。如果这一量值超过了某一极限值,植物的屏障效应实际上已失去作用,植物将会中毒甚至死亡。利用一般生物地球化学异常进行找矿,通常注重的主要是在屏蔽效应还起作用的情况下,金属在植物体内聚集的状态和机制,以及到底可以聚集或耐受多少金属量。这对于一般生物地球化学异常形成的解释是有意义的。
金属在植物体内的积累或耐性机制极为复杂,其中一种就是金属在植物体内的沉淀机制,一旦金属进入了植物的体内,植物总是尽可能阻止或避免有毒金属元素进入到细胞内的敏感部位。普遍认为细胞液胞的区室化作用和细胞壁的固定作用,是金属在植物体内沉淀主要机制。液胞是成熟细胞内最大的细胞器,金属离子在细胞液胞的区室化,可减轻或避免金属离子对功能性结构的损伤和代谢过程的干扰。细胞壁是有毒金属进入细胞内部的第一道屏障,金属离子被限制在细胞壁上沉淀而不能进入细胞质影响代谢活动[40] -[46] 。从图1可以看出,高金属的聚集体主要是沉淀于液胞中,其次是沉淀于细胞壁上,在叶绿体膜、白色体膜等边缘或叶绿体内也有沉淀。因此从细胞学的角度来看,生物地球化学异常物质的聚集机制实质上就是金属在植物细胞内被限制的沉淀机制。这种机制可以使植物器官或个体在一定的程度上免受或减轻金属的毒害。金属在植物细胞内被限制沉淀的所能聚集或耐受的量,可以从本次研究的矿床植物细胞中高金属的聚集体的金属能谱成分分析数据得到估计(表5):太平村金矿Au、Sn、Ag含量33.00%~41.69%;龙水金(铜)矿Au、Cu、Pb、Ag含量29.63%~52.12%;佛子冲铅锌矿Pb、Ag、(Cu)含量41.03%~44.36%;灵川铅锌矿Pb、Ag含量46.80%。金属在植物细胞内所能聚集或耐受的量由此可见一斑。在宏观上,可以用一般生物地球化学的异常的极大值或异常下限值对金属在植物中所能聚集或耐受的量进行大致的估计。如本区金矿上芒萁、杉木、马尾松中w (Au)的异常极大值354.43 × 10−9、310.70 × 10−9和193.54 × 10−9可能就是区内这些植物所能耐受的Au的最大量。同样,铅锌矿上芒萁、杉木、马尾松中w (Pb)的异常极大值118.00 × 10−6、130.00 × 10−6和222.00 × 10−6可能就是区内这些植物所能耐受的Pb的最大量。
6. 结论
1) 矿区生长的植物富集金属元素的特征与土壤极其相似;生物地球化学异常和土壤地球化学异常在量和质上具有明显的内在同一性。矿区植物对元素的吸收过程具有被胁迫吸收和屏障效应的双重生理生态特征。
2) 矿区生长的植物叶细胞中出现大量电子致高密度体物质,沉淀在液胞中或植物细胞壁等膜性结构的边缘,使细胞内部结构遭受一定程度的破坏。电子致高密度体是矿床生物地球化学异常的物质存在于植物细胞中的不同成分组成的金属聚集体。
3) 矿床生物地球化学异常反映出来的被胁迫吸收和屏障效应,是植物在高金属逆境生长过程中被动吸收和主动吸收的一种特征行为。高金属异常环境和被胁迫吸收/屏障效应是植物地球化学异常形成的外因和内因。
4) 植物被胁迫吸收形成的生物地球化学异常主要表现在一般的生物地球化学异常、地植物学异常和指示植物三个层次上。一般的生物地球化学异常造成的对植物的毒害可能只达到细胞或组织结构的程度,此时植物的被胁迫吸收的含量还未超过其能忍受的毒性含量。本次研究矿床植物还只达到一般生物地球化学异常的层次。
5) 矿区植物体内积聚的金属量是在屏障效应还起作用,植物还未出现明显的器官或个体受害症状时的聚集量。金属在植物体内聚集或耐受的机制主要是细胞液胞的区室化和细胞壁的固定作用。本次研究矿床植物体内所能耐受的金属量可以从植物细胞中金属聚集体的能谱成分分析数据或宏观生物地球化学异常的极大值或异常下限值进行大致的估计。
基金项目
国家自然科学基金项目41363003,40972220;广东省自然科学基金博士启动项目s2012040007439。
参考文献 (References)
- [1] Dunn C. E. (2007) Handbook of exploration and environmental geochemistry. Elsevier Science, Canada.
- [2] Dunn C.E. (2007) New perspectives on biogeochemical exploration. Proceedings of Exploration 07: Fifth Decennial International Conference on Mineral Exploration, 249-261.
- [3] 宋慈安, 雷良奇 (2009) 我国勘查植物地球化学的研究现状及发展方向. 桂林工学院学报, 1, 1-11.
- [4] 唐金荣, 崔熙琳, 施俊法 (2009) 非传统化探方法研究的新进展. 地质通报, 2-3, 232-244.
- [5] Reid, N. and Hill, S.M. (2012) Spinifex biogeochemistry across arid Australia: Mineral exploration potential and chromium accumulation. Applied Geochemistry, 29, 92-101.
- [6] Viladevall, M., Puigserver, D., Saavedra, J. and carmona, J.M. (2012) Biogeochemical exploration using the thola shrub in the andean altiplano, Bolivia. Geochemistry: Exploration, Environment, Analysis, 12, 33-44.
- [7] 贾大成, 姜涛, 陈圣波, 包国章, 高文, 张潇, 毛永新 (2013) 大兴安岭多宝山铜成矿区植物地球化学特征及找矿意义.吉林大学学报(地球科学版), 1, 76-86.
- [8] Boyle, R.W. (1979) The geochemistry of gold and its deposits (Bulletin 280). Geological Survey of Canada, Ottawa, 579-584.
- [9] Brooks, R.R. (1998) Plants that hyperaccumulate heavy metals. CAB International, Wallingford, New York.
- [10] Shtangeeva, I. (2005) Trace and ultratrace elements in plants and soil. WIT Press, Southampton, Boston.
- [11] Kabata-Pendias, A. (2011) Trace elements in soils and plants. 4th Edition, CRC Press, Boca Raton.
- [12] Kovalevskii, A.L. (1984) Biogeochemical prospecting for ore deposits in the USSR. Journal of Geochemical Exploration, 21, 63-72.
- [13] 孔牧, 任天祥 (1996) 黑龙江小西林铅锌矿植物体内铅锌积累机制初步研究. 有色金属矿产与勘查, 1, 54-58.
- [14] 权恒, 张宏, 张炯飞, 等 (1998) 大兴安岭森林覆盖区植物化探找矿方法研究. 贵金属地质, 4, 241-249.
- [15] 宋慈安, 雷良奇, 杨启军, 等 (2000) 甘肃公婆泉铜矿区植物地球化学特征. 地球化学, 4, 343-350.
- [16] Dunn, C.E. (2000) Pine bark biogeochemical signatures of the Edako molybdenum camp and surrounding areas, central British Columbia: Implications for mineral exploration and environmental baselines. Geological society of america bulletin, 6, 11-12.
- [17] Prasad, M.N.V. (2004) Heavy metal stress in plants: From biomolecules to ecosystems. 2nd Edition, Springer-Verlag Berlin, Heidelberg, 182-217.
- [18] 胡西顺, 孟广路 (2005) 植物地球化学测量方法的试验效果. 矿产与地质, 6, 610-616.
- [19] 宋慈安, 杨仲平, 雷良奇, 文宗振 (2010) 西双版纳南坡铜矿区植物地球化学特征及找矿有效指示植物研究. 桂林理工大学学报, 1, 1-14.
- [20] 徐金鸿, 徐瑞松, 夏斌 (2006) 广东鼎湖山斑岩钼矿区生物地球化学特征. 地球与环境, 1, 23-28.
- [21] 陈英旭 (2008) 土壤重金属的植物污染化学. 科学出版社, 北京, 41-141.
- [22] 侯晓龙, 陈加松, 刘爱琴, 蔡丽平 (2012) Pb胁迫对金丝草体内Pb化学形态及细胞分布的影响. 生态与农村环境学报, 3, 271-276.
- [23] 王钧, 邬卉, 薛生国, 吴雪娥, 刘平 (2014) 锰胁迫对杠板归细胞超微结构的影响. 生态学报, 4, 798-806.
- [24] dos Santos, R.W., Schmidt, É.C., de L Felix, M.R., Polo, L.K., Kreusch, M., Pereira, D.T., et al. (2014) Bioabsorption of cadmium, copper and lead by the red macroalga gelidium floridanum: Physiological responses and ultrastructure features. Ecotoxicology and Environmental Safety, 105, 80-89.
- [25] 武维华 (2003) 植物生理学. 科学出版社, 北京, 115-131.
- [26] Meharg, A.A. and Macnair, M.R. (1992) Suppression of the high affinity phosphate uptake system: Mechanism of arsenate tolerance in Holcus lanatus L. Journal of Experimental Botany, 43, 519-524.
- [27] 江行玉, 赵可夫 (2001) 植物重金属伤害及其抗性机理. 应用与环境生物学报, 1, 92-99.
- [28] 郝瑞芝, 余洋, 武佳叶, 安新民, 荆艳萍 (2012) 树木对重金属的抗性机理研究进展. 中国农学通报, 10, 6-12.
- [29] Mench, M., Morel, J.L. and Guckert, A. (1988) Metal binding with root exudates of lowmolecular weight. Journal of Soil Science, 39, 521-527.
- [30] Pellet, D.M., Papernik, L.A. and Kochian, L.V. (1996) Multiple aluminum resistance mechanism in wheat. The roles of root apical phosphate and malate exudation. Plant Physiology, 112, 591-597.
- [31] 薛生国, 朱锋, 叶晨, 王钧, 吴雪娥 (2011) 紫茉莉对铅胁迫生理响应的FTIR研究. 生态学报, 20, 6143-6148.
- [32] Baker, A.J.M. (1987) Metal tolerance. New Phytologist, 106, 93-111.
- [33] Hsu, B. and Lee, J. (1988) Toxic effects of copper on photosystem II of spinach chloroplasts. Plant Physiology, 87, 116-119.
- [34] 张国军, 邱栋梁, 刘星辉 (2004) Cu对植物毒害研究进展. 福建农林大学学报(自然科学版), 3, 289-294.
- [35] 孔繁翔, 尹大强, 严国安 (2000) 环境生物学. 高等教育出版社, 北京.
- [36] 王宏镔, 束文圣, 蓝崇钰 (2005) 重金属污染生态学研究现状与展望. 生态学报, 3, 596-605.
- [37] 张杏锋 (2013) 鸭跖草对镉的耐性及富集特征. 广东农业科学, 1, 167-169.
- [38] 阮天健, 朱有光 (1985) 地球化学找矿. 地质出版社, 北京, 169-185.
- [39] 谢学锦, 徐邦梁 (1954) 铜矿指示植物海州香薷. 地质学报, 4, 360-368.
- [40] 张红晓, 宋玉峰, 王桂萍, 等 (2011) 铜胁迫下海州香蕾根中铜诱导蛋白的鉴定. 西北植物学报, 7, 1335-1339.
- [41] Ernst, W.H.O., Verkleij, J.A.C. and Schat, H. (1994) Metal tolerance in plants. Acta Botanica Neerlandica, 41, 229-248.
- [42] Meharg, A.A. (1994) Integrated tolerance mechanisms: Constitutive and adaptive plant responses to elevated metal concentration in the environment. Plant, Cell & Environment, 17, 989-993.
- [43] Salt, D.E., Prince, R.C., Pickering, I.J. and Raskin, I. (1995) Mechanisms of cadmium mobility and accumulation in Indian mustard. Plant Physiology, 109, 1427-1433.
- [44] 张旭红, 高艳玲, 林爱军, 崔玉静, 朱永官 (2008) 植物根系细胞壁在提高植物抵抗金属离子毒性中的作用. 生态毒理学报, 1, 9-14.
- [45] 丁宝莲, 谈宏鹤, 朱素琴 (2001) 胁迫与植物细胞壁关系研究进展. 广西科学院学报, 2, 87-90.
- [46] 张海, 彭程, 杨建军, 施积炎 (2013) 金属型纳米颗粒对植物的生态毒理效应研究进展. 应用生态学报, 3, 885-892.
