Bioprocess
Vol.05 No.04(2015), Article ID:16518,6
pages
10.12677/BP.2015.54006
Seasonal Variations of Hair in Eothenomys miletus
Jiahao Fu1*, Tao Yang1*, Lin Zhang1, Jinlong Chen2, Zhengkun Wang1, Wanlong Zhu1#
1Key Laboratory of Ecological Adaptive Evolution and Conservation on Animals-Plants in Southwest Mountain Ecosystem of Yunnan Province Higher Institutes College, School of Life Sciences, Yunnan Normal University, Kunming Yunnan
2Kunming Haikou Forest Farm, Kunming Yunnan
Received: Nov. 25th, 2015; accepted: Dec. 10th, 2015; published: Dec. 15th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The role of seasonal change of hair in the regulation of body mass regulation and thermoregulation was examined in Eothenomys miletus in the present study. Mass of hair, body temperature and nonshivering thermogenesis (NST) were measured in E. miletus that were wild-captured over four seasons. The results showed that body temperature was significantly lower in winter, and mass of hair and NST were also higher than those in summer, mass of hair was 35.48% higher in winter compared with that in summer. These findings suggest that seasonal changes in the hair are employed by the wild small mammals in response to seasonal environment fluctuations, and thus play important roles in the regulations of body mass regulation and thermoregulation.
Keywords:Eothenomys miletus, Hair, Nonshivering Thermogenesis

大绒鼠被毛的季节性变化
付家豪1*,杨涛1*,张麟1,陈金龙2,王政昆1,朱万龙1#
1云南师范大学生命科学学院,云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室,云南 昆明
2昆明市海口林场,云南 昆明

收稿日期:2015年11月25日;录用日期:2015年12月10日;发布日期:2015年12月15日

摘 要
为阐明大绒鼠被毛的季节性变化及其在体重调节和体温调节中的作用,本研究测定了季节性变化条件下大绒鼠的体温、被毛重量和非颤抖性产热。结果表明:冬季大绒鼠的体温显著降低,冬季被毛重量和非颤抖性产热显著高于夏季。其中冬季被毛重量较夏季高35.48%。所有结果暗示被毛的适应性变化是野生小型哺乳动物应对环境温度季节性波动的主要适应策略之一,在其体重调节和体温调节中具有重要作用和意义。
关键词 :大绒鼠,被毛,非颤抖性产热

1. 引言
表型可塑性是指动物表型性状应对环境变化可塑性变化的能力[1] 。近年来,表型可塑性的变化可以从各种层次进行研究,如酶学 [2] 到组织水平 [3] ,器官到个体水平 [4] 。研究表明动物的能量获得和能量支出收到环境因素的影响 [5] 。许多研究证实小型哺乳动物的能量代谢具有季节性可塑性变化[6] ,其中生理特征的调整在体温调节过程中起着重要的作用 [7] 。动物体重的平衡取决于能量的获得和支出 [8] 。已有研究表明小型哺乳动物在面对低温或者冬季寒冷环境时会降低体重、体脂和增加能量摄入,这可能是因为在冬季能量消耗增加,动物需要降低体重来减少能耗 [9] 。
皮毛可以作为小型哺乳动物的“隔热层”来显著减少动物在低温或冬季条件下的热量的散失 [10] 。之前的研究表明:很多小型哺乳动物的被毛重量会出现明显的季节性变化,尤其是在冬季,被毛的密度和厚度显著增加,最终降低动物的热量散失 [11] 。也有研究表明无被毛的动物其能量摄入显著低于被毛的动物 [12] 。以上的研究暗示在低温环境下被毛也是动物节约能量损失、减少热量散失,最终来维持体温调节稳态的有效策略之一 [13] 。
大绒鼠(Eothenomys miletus)为中国特有种,主要分布于横断山区及其附近地区,为横断山区固有种 [14] 。大绒鼠的产热能力的季节性研究表明:大绒鼠在冬季体重、体脂下降,静止代谢率、非颤抖性产热、解偶联蛋白1含量等生化指标增加,而在夏季相应指标出现相反的趋势,大绒鼠的体重变化和北方的小型哺乳动物的明显不同,大绒鼠在冬季并没有出现储存脂肪的现象,这可能与横断山区食物资源相对比较丰富,在冬季没有雪覆盖,因此大绒鼠在冬季比较容易的获得食物,还有可能是因为较小的体型有利于在冬季食物资源相对较差的环境中躲避天敌[15] 。其中大绒鼠在季节性变化过程中瘦素含量在冬季或者低温条件下较低,瘦素与体脂呈正相关,与摄入能负相关,瘦素含量与产热能力负相关 [15] 。因此,本研究在之前研究基础上对大绒鼠的被毛的季节性变化进行测定,以确定大绒鼠这一横断山区固有种对该地区的适应模式。
2. 材料和方法
2.1. 动物来源
实验动物于2012年3月、6月、9月和12月(分别以春、夏、秋、冬表示)用鼠笼捕自云南省剑川县石龙村(北纬26˚22',东经99˚48')海拔2550~2615m的农田、灌丛中。该地区位于云岭山脉的中部(属横断山),北纬26˚15'~26˚45',东经99˚40'~99˚55',境内玉龙雪山最高峰海拔5596 m,西部山区平均海拔高度在3000 m以上,地势高差悬殊,山脉南北走向。年平均气温9.1℃;1月平均最低温度为−4.0℃,7月平均最高温度为24.1℃,低于同纬度平原地区;气温随海拔高度的增加而显著降低。该地区干湿季节分明,常冬无夏,表现出明显的温带季风气候特征
捕捉的动物带回云南师范大学生命科学学院(昆明)动物饲养房饲养,置于透明鼠盒内(260 × 160 × 150 mm3),单盒饲养,中度光照(12L:12D),温度控制在25℃ ± 1℃;每日喂以标准的饲料(昆明医科大学生产),用塑料瓶供水,食物和水可以自由取食。实验动物为非繁殖期成年个体。选取实验动物春季13只(6♀,7♂)、夏季16只(8♀,8♂)、秋季11只(5♀,6♂)和冬季9只(5♀,4♂),4天内测定体温、被毛重量和非颤抖性产热。
2.2. 体温和被毛重量的测定
用北京师范大学司南仪器厂生产的数字式体温计插入直肠约3 cm测量动物的体温,每次测温探头在直肠内静置约45 s左右读数。动物经乙醚麻醉后剃除全身被毛(除头和尾),将剃除的被毛称重(精确至0.1 mg) [16] 。
2.3. 非颤抖性产热的测定
用澳大利亚生产AD ML870的开放式呼吸仪测定动物的非颤抖性产热,ML206的气体分析仪进行气体分析,温度用上海博迅医疗设备厂生产的SPX-300型人工气候箱控制。代谢率的计算方法见Hill (1972)。呼吸室为500 ml,进入呼吸室的气体流量为200 ml/min,实验温度控制在25℃ ± 0.5℃。皮下注射去甲肾上腺素(NE)测定动物在25℃下的最大非颤抖性产热(NSTmax)。NE注射剂量经预备实验确定为0.8 mg/kgBW,将注射NE后30 min内出现的最大持续耗氧量视为动物的NSTmax [17] 。
2.4. 统计分析
数据处理分析采用SPSS13.0软件包。体温、被毛重量和非颤抖性产热的季节性变化以单因素方差(ANOVA)或者协方差分析法(ANCOVA)进行分析,以体重为协变量。组间差异以Duncan多重比较分析。数据表示为平均值 ± 标准误(Mean ± SE),P < 0.05为差异显著,P < 0.01为差异极显著。
3. 结果
3.1. 体温和被毛重量
大绒鼠的体温出现了明显的季节性变化(F = 3.56,P < 0.05,图1),其中冬季最低,经分析,冬季的体温与春季的体温差异不显著,夏季和秋季体温较高,夏秋季节的体温也差异不显著(表1)。被毛重量也表现出显著的季节性变化(F = 2.95,P < 0.05,图2),其中冬季的被毛重量最大,较夏季高35.48%,夏季和秋季被毛重量差异不显著,春季被毛重量和其它三个季节差异均是不显著。
3.2. 非颤抖性产热
大绒鼠的非颤抖性产热出现了明显的季节性变化(F = 6.35,P < 0.01,图3),其中冬季最高,春季次之,而秋季最低。冬季和春季差异不显著,夏季和秋季差异不显著(表1)。

Figure 1. Seasonal changes in body temperature in Eothenomys miletus. Different letters indicate significant differences between the four seasons (P < 0.05)
图1. 大绒鼠体温的季节性变化。柱上不同字母表示组间差异显著(P < 0.05)
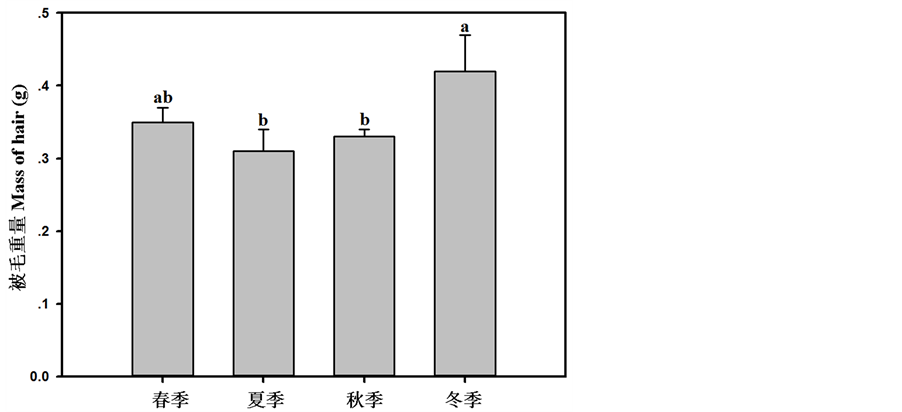
Figure 2. Seasonal changes in mass of hair in Eothenomys miletus. Different letters indicate significant differences between the four seasons (P < 0.05)
图2. 大绒鼠被毛重量的季节性变化。柱上不同字母表示组间差异显著(P < 0.05)
Table 1. Seasonal changes in body temperature, mass of hair and nonshivering thermogenesis (NST) in Eothenomys miletus
表1. 大绒鼠体温、被毛重量和非颤抖性产热的季节性变化
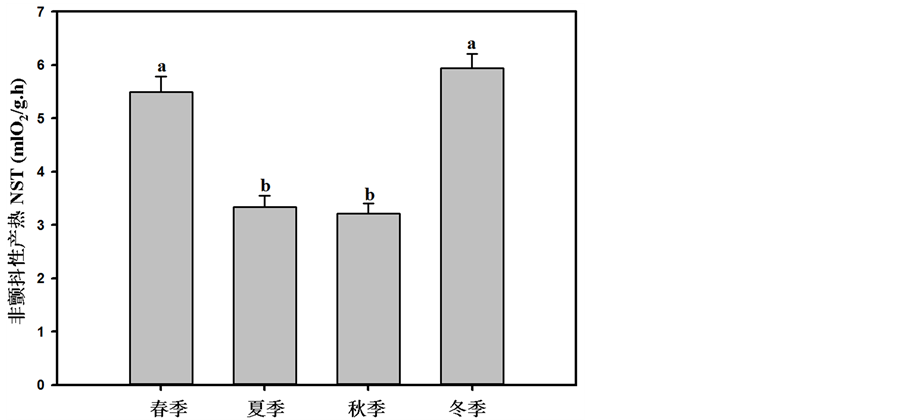
Figure 3. Seasonal changes in nonshivering thermogenesis (NST) in Eothenomys miletus. Different letters indicate significant differences between the four seasons (P < 0.05)
图3. 大绒鼠非颤抖性产热的季节性变化。柱上不同字母表示组间差异显著(P < 0.05)
4. 讨论
小型哺乳动物的体温调节与其能量分配利用和生活史对策等方面密切相关,反映了其对环境的适应模式和生理能力 [18] 。某些啮齿动物在适应季节性环境变化的过程中其体温具有明显的季节性变化,如灰仓鼠 [19] 。本研究的结果表明:横断山区的大绒鼠冬春季节体温差异不显著,夏秋季节体温差异不显著,但是大绒鼠的冬季体温显著比夏季低,这可能是对横断山区特殊的生活环境的一种适应,因为横断山区的气候条件是年温差小,日温差大,加之大绒鼠为横断山区的固有种,因此大绒鼠在体温调节上可能保留了与当地相适应的特征,因为日温差大,大绒鼠每天都要经历低温和高温的胁迫,必需调节自身的体温来适应这种环境,在夜晚环境温度较低,而此时低的体温可以减少与环境之间的温差,节省热能 [15] 。
非颤抖性产热(NST)是小型哺乳动物适应严寒环境的有效而经济的产热方式,许多小型哺乳动物在低温驯化时可以显著增加NST的产热[20] 。之前的研究表明NST存在着季节性变化,如根田鼠[21] 、还有侏儒仓鼠、子午沙鼠、小毛足鼠等[15] 。本研究结果表明大绒鼠的NST同样存在着季节性变化,这看同样与在冬季适应低温环境有关。在冬季环境温度较低,大绒鼠需要增加其适应性产热来维持生存,即通过增加NST来维持能量稳态。
此外,大绒鼠的被毛重量也出现显著的季节性变化,冬季被毛重量最大,冬季被毛重量较夏季增加了35.48%。被毛为小型哺乳动物提供“绝热层”,具有保温隔热的作用,冬季大绒鼠的被毛密度和厚度显著增加,可以显著增强保温隔热作用,从而降低热散失,这些都有利于维持稳定的体温,夏季被毛重量较少可能有利于增加对流散热[12] 。
总之,大绒鼠表现出体温调节和被毛重量的季节性变化,冬季产热显著增加,被毛重量显著高于夏季,说明被毛在其体重调节和体温调节中具有重要作用和意义。
致谢
感谢国家自然科学基金项目(No. 31260097; 31560126)资助。
文章引用
付家豪,杨涛,张麟,陈金龙,王政昆,朱万龙. 大绒鼠被毛的季节性变化
Seasonal Variations of Hair in Eothenomys miletus[J]. 生物过程, 2015, 05(04): 39-44. http://dx.doi.org/10.12677/BP.2015.54006
参考文献 (References)
- 1. Piersma, T. and Drent, J. (2003) Phenotypic Flexibility and the Evolution of Organismal Design. Trends in Ecology & Evolution, 18, 228-233. http://dx.doi.org/10.1016/S0169-5347(03)00036-3
- 2. Sabat, P. and Bozinovic, F. (2000) Digestive Plasticity and the Cost of Acclimation to Dietary Chemistry in the Omnivorous Leaf-Eared Mouse Phyllotis darwini. Journal of Comparative Physiology B, 170, 411-417. http://dx.doi.org/10.1007/s003600000118
- 3. Villarin, J.J., Schaeffer, P.J., Markle, R.A. and Lindstedt, S.L. (2003) Chronic Cold Exposure Increases Liver Oxidative Capacity in the Marsupial Monodelphis domestica. Compar-ative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 136, 621-630. http://dx.doi.org/10.1016/S1095-6433(03)00210-1
- 4. Kristan, D.M. and Hammond, K.A. (2006) Effects of Three Simultaneous Demands on Glucose Transport, Resting Metabolism and Morphology of Laboratory Mice. Journal of Comparative Physiology B, 176, 139-151. http://dx.doi.org/10.1007/s00360-005-0036-9
- 5. Naya, D.E., Bacigalupe, L.D., Bustamante, D.M. and Bozinovic, F. (2005) Dynamic Digestive Responses to Increased Energy Demands in the Leaf-Eared Mouse (Phyllotis darwini). Journal of Comparative Physiology B, 175, 31-36. http://dx.doi.org/10.1007/s00360-004-0459-8
- 6. Smith, J.G., Christian, K. and Green, B. (2008) Physiological Ecology of the Mangrove-Dwelling Varanid Varanus indicus. Physiological and Biochemical Zoology: Ecological and Evolutionary Approaches, 81, 561-569. http://dx.doi.org/10.1086/590372
- 7. Dawson, W.R. (2003) Plasticity in Avian Responses to Thermal Chal-lenges—An Essay in Honor of Jacob Marder. Israel Journal of Zoology, 49, 95-109. http://dx.doi.org/10.1560/97CA-41H8-F9P2-1CTE
- 8. Merritt, J.F., Zegers, D.A. and Rose, L.R. (2001) Sea-sonal Thermogenesis of Southern Flying Squirrels (Glaucomys volans). Journal of Mammalogy, 82, 51-64. http://dx.doi.org/10.1093/jmammal/82.1.51
- 9. Lovegrove, B.G. (2005) Seasonal Thermoregulatory Responses in Mammals. Journal of Comparative Physiology B, 175, 231-247. http://dx.doi.org/10.1007/s00360-005-0477-1
- 10. Hill, R.W. (1983) Thermal Physiology and Energetics of Pe-romyscus: Ontogeny, Body Temperature, Metabolism, Insulation and Microclimatology. Journal of Mammalogy, 64, 19-37. http://dx.doi.org/10.2307/1380747
- 11. Butler, M.P. and Zucker, I. (2009) Seasonal Pelage Changes Are Synchronized by Simulated Natural Photoperiods in Siberian Hamsters (Phodopus sungorus). Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 311, 475-482. http://dx.doi.org/10.1002/jez.544
- 12. Kauffman, A.S., Paul, M.J. and Zucker, I. (2004) Increased Heat Loss Af-fects Hibernation in Golden-Mantled Ground Squirrels. American Journal of Physiology, 287, 167-173. http://dx.doi.org/10.1152/ajpregu.00670.2003
- 13. Hart, J.S. (1956) Seasonal Changes in Insulation of the Fur. Canadian Journal of Zoology, 34, 53-57. http://dx.doi.org/10.1139/z56-007
- 14. Zhu, W.L., Jia, T., Lian, X. and Wang, Z.K. (2008) Evaporative Water Loss and Energy Metabolic in Two Small Mammals, Voles (Eothenomys miletus) and Mice (Apodemus chevrieri) in Hengduan Mountains Region. Journal of Thermal Biology, 33, 324-331. http://dx.doi.org/10.1016/j.jtherbio.2008.04.002
- 15. Zhu, W.L., Zhang, H., Zhang, L. and Wang, Z.K. (2014) Thermogenic Properties of Yunnan Red-Backed Voles (Eothenomys miletus) from the Hengduan Mountain Region. Animal Biology, 64, 59-73. http://dx.doi.org/10.1163/15707563-00002430
- 16. 赵志军, 曹静. 被毛在黑线仓鼠能量代谢、产热和体温调节中的作用[J]. 兽类学报, 2014, 34(1): 8-16.
- 17. Zhu, W.L., Cai, J.H., Lian, X. and Wang, Z.K. (2010) Adaptive Character of Metabolism in Eothenomys miletus in Hengduan Mountains Region during Cold Acclimation. Journal of Thermal Biology, 35, 417-421. http://dx.doi.org/10.1016/j.jtherbio.2010.09.002
- 18. McNab, B.K. (1980) Food Habits, Energetics, and the Pop-ulation Biology of Mammals. The American Naturalist, 116, 106-124. http://dx.doi.org/10.1086/283614
- 19. Haim, A. and Izhaki, I. (1995) Comparative Physiology of Thermoregulation in Rodents: Adaptations to Arid and Mesic Environments. Journal of Arid Environments, 31, 431-440. http://dx.doi.org/10.1016/S0140-1963(05)80126-0
- 20. Jansky, L. (1973) Nonshivering Thermogenesis and Its Thermoregulatory Significance. Biological Reviews, 48, 85-132. http://dx.doi.org/10.1111/j.1469-185X.1973.tb01115.x
- 21. 王德华, 王祖望. 小哺乳动物在高寒环境中的生存对策: II. 高原鼠兔和根田鼠非颤抖性产热(NST)的季节性变化[J]. 兽类学报, 1990, 10(1): 40-53.
*并列为第一作者。
#通讯作者。
