World Journal of Cancer Research
Vol.4 No.03(2014), Article ID:13875,6 pages
DOI:10.12677/WJCR.2014.43007
Relation between Gastroesophageal Reflux Disease and Malignant Tumor Chemotherapy
1Departmen of Gastroenterology, Jiangsu Provincial Corps Hospital, Chinese People’s Armed Police Forces, Yangzhou
2Department of Gastroenterology, Clinic College of Medicine of Yangzhou University, Yangzhou
Email: liuandy_27.student@sina.com.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Apr. 22nd, 2014; revised: May 23rd, 2014; accepted: Jun. 1st, 2014
ABSTRACT
Objective: To explore the relationship between gastroesophageal reflux disease (GERD) and malignant tumor chemotherapy, as well as the efficacy of proton pump inhibitor (PPI) omeprazol enteric-coated tablet in chemotherapy-induced GERD. Methods: Malignant tumor patients who received chemotherapy were recruited in this study from January 2013 to December 2013. All patients were randomly divided into chemotherapy group (group A, n = 100) and chemotherapy + PPI group (group B, n = 100). According to reflux disease questionnaire (RDQ) score, the RDQ score changes of two groups were collected before and after chemotherapy. Patients with the RDQ total score ≥12 points were diagnosed with GERD. The change of GERD incidence and RDQ mean score was compared in the two groups before and after chemotherapy, respectively. Results: Before chemotherapy, there were 7 patients in group A and 7 patients in group B whose RDQ total score was ≥12 points, while 32 patients in group A and 10 patients in group B after chemotherapy. The RDQ mean score before and after chemotherapy was 5.96 ± 3.08/10.99 ± 4.19 in group A and 6.74 ± 2.91/7.89 ± 2.43 in group B. GERD incidence before and after chemotherapy was 7.61%/34.78% in group A and 7.45%/10.64% in group B. There was a significant difference (P < 0.05) of the change of the RDQ mean score and GERD incidence in group A, but, there was no significant difference in group B (P > 0.05). The study indicated that GERD was significantly associated with chemotherapy. Chemotherapy combined with PPI could evidently reduce the RDQ total score and GERD incidence. Conclusions: Patients who received chemotherapy had a significantly higher incidence of GERD, and PPI could relieve GERD symptoms, reduce chemotherapy-related adverse reactions, and improve the quality of life of malignant tumor patients.
Keywords:Gastroesophageal Reflux Disease, Malignant Tumor, Chemotherapy, Relationship

胃食管反流病与恶性肿瘤化疗关系的探讨
刘汉山1,朱海杭2
1武警江苏总队医院消化内科,扬州
2扬州大学医学院临床学院消化内科,扬州
Email: liuandy_27.student@sina.com.cn
收稿日期:2014年4月22日;修回日期:2014年5月23日;录用日期:2014年6月1日

摘 要
目的:探讨胃食管反流病(GERD)和恶性肿瘤化疗的关系,以及质子泵抑制剂(PPI)在化疗诱导的GERD中的疗效。方法:于2013年1月~2013年12月期间连续征集有化疗适应症的住院的恶性肿瘤患者200例,采用前瞻性研究方法,随机分为化疗组(A组),化疗 + PPI组(B组),两组各100例。采用反流性疾病调查问卷(RDQ)评分,总分≥12分者临床诊断为GERD,分别比较两组化疗前后RDQ总分变化、GERD发生率。结果:化疗前A组有7例、B组有7例RDQ总分≥12分,化疗后A组有32例、B组有10例RDQ总分≥12分,分别增加了25例、3例。化疗前后RDQ均分分别为A组5.96 ± 3.08/10.99 ± 4.19、B组6.74 ± 2.91/7.89 ± 2.43,化疗前后GERD发生率分别为A组7.61%/34.78%、B组7.45%/10.64%。比较化疗前后RDQ均分变化、GERD发生率,A组有显著性差异(P < 0.05),B组无显著性差异(P > 0.05),两组间比较具有差异显著性(P < 0.05),提示GERD与化疗有明显相关性,化疗同时使用PPI制剂能明显改善RDQ评分及GERD发生率。结论:恶性肿瘤化疗诱导的GERD发生率明显增高,化疗同时使用PPI有助于缓解化疗相关GERD症状,减轻化疗相关不良反应,改善恶性肿瘤患者生活质量。
关键词
胃食管反流病,恶性肿瘤,化疗,关系

1. 引言
恶心肿瘤发病率呈逐年上升趋势,肿瘤相关死亡占所有死亡原因第2位[1] 。多数肿瘤早期无明显症状,发病时多为中晚期,化疗成为不能手术切除或局限晚期肿瘤患者的一个重要治疗手段。化疗相关的不良反应有腹痛、腹胀、恶心、呕吐、腹泻、便秘、骨髓抑制、胃肠粘膜炎等,其中胃肠道症状是最常见的不良事件[2] 。这些不良事件的出现不仅直接增加恶性肿瘤患者痛苦,还影响患者的生活质量。通常用地塞米松、胃复安、5-羟色胺3(5-hydroxy tryptamin, 5-HT3)受体阻滞剂或高度选性的相关物质抗体P物质抗体等来减轻化疗诱导的恶心、呕吐、腹泻等症状[3] 。
胃食管反流病(gastroesophageal reflux disease, GERD)是指胃、十二指肠内容物反流入食管引起不适症状和(或)并发症的一种疾病[4] ,其发病率有逐年增长的趋势[5] ,严重影响人们的生活质量。烧心和反流是GERD的最主要症状,其他不典型的相关症状包括腹痛、胸痛、嗳气、腹胀、上腹部不适、咽部异物感、吞咽痛、吞咽困难等,此外还有食管外症状,如慢性咳嗽、咽喉炎、哮喘等,质子泵抑制剂(proton-pump inhibitor, PPI)已被证实为胃食管反流病的首选用药[6] 。
胃食管反流病与一些疾病存在一定相关性,流行病学研究较一致地显示,GERD与哮喘[7] 及慢性咳嗽[8] 有中度相关性。文献报道[9] [10] ,慢性阻塞性肺病易合并GERD,后者又可以诱导慢性阻塞性肺病急性发作,导致慢性阻塞性肺病难以控制,两者之间形成恶性循环。国内胡家安等[11] 研究发现,慢性阻塞性肺病患者气道慢性粘液高分泌症与GERD呈显著正相关。徐志洁等[12] 研究发现,焦虑症和抑郁症与胃食管反流病发生有明显相关性。
目前尚无关于胃食管反流病和恶性肿瘤化疗的关系的报道。本研究的目的就是调查在恶性肿瘤中化疗诱导的胃食管反流病的发生率并观察质子泵抑制剂在化疗诱导的胃食管反流病过程中的疗效。
2. 资料和方法
2.1. 资料和分组
本研究采用单中心、前瞻性研究,于2013年1月~2013年12月期间在扬州武警医院住院的患者中,连续征集依据病情需要化疗的恶性肿瘤患者200例。随机分为化疗组(A组),化疗 + PPI组(B组)。入组条件:1)住院前均经术前或术后病理明确诊断为恶性肿瘤中晚期;2)东部肿瘤协作组(eastern cooperative oncology group ECOG)评分0~2分,预计生存期大于3个月;3)常规化验、检查无化疗禁忌;4)所有患者体重指数(BMI)在18.5~24.9 Kg/m2之间;5)所有病人均签署知情同意书,化疗前RDQ评分诊断GERD者同意先治疗原发病,暂不治疗GERD。排除标准:a)1个月内服用过或正在服用任何一种质子泵抑制剂、胃动力药或影响胃排空药者;b)需要预防性使用5-HT3受体阻滞剂(如昂丹司琼)者;c)合并有心肌缺血、冠心病者;d)食道梗阻症状重,不能口服药物者;e)有精神或心理疾患,不能正确填写问卷调查,无法正常沟通者,两组各100例。
2.2. 方法
2.2.1. 基本检查
两组入院均常规化验、检查,包括血常规、肝肾功能、电解质、血糖,心电图、腹部B超、胸片等,记录年龄、身高、体重、体表面积等。
2.2.2. 问卷调查
采用反流性疾病问卷(reflux diagnositic questionnaire, RDQ)[5] [13] 症状评分标准,两组患者在化疗前、化疗后均完成反流性疾病诊断问卷调查表。RDQ问卷调查是一个以询问胸骨后烧心感、胸骨后疼痛、反酸及反食4种症状,并根据症状发作频率和症状程度进行计分的问卷,症状发作频率和症状程度每周最高分分别可达20分,两者总分最高可达40分。12分(包括12分)以上临床诊断为GERD。
2.2.3. RDQ症状评分标准
1) 按发作频率计分:按烧心感、胸骨后疼痛、反酸、反食等四种为统计症状,过去4周中无症状为0分,症状出现频度<1天/周、1天/周、2~3天/周、4~5天/周以及6~7天/周,分别记为1、2、3、4及5分。因而最高分可达20分(详见附件)。
2) 按症状程度计分:统计上述四种症状,症状不明显,在医师提醒下发现为1分;症状明显,影响日常生活,偶尔服药为3分;症状非常明显,影响日常生活,需长期服药治疗为5分。症状介于1分和3分之间为2分,介于3分和5分之间为4分。因而最高得分也可达20分(详见附件)。
2.2.4. 化疗药物
两组化疗方案的选择均按照各种肿瘤化疗指南进行,多数以氟尿嘧啶或/和顺铂联合第三代化疗药物紫杉醇或多西紫杉醇、奥沙利铂、吉西他滨等药为一线方案。
2.2.5. PPI
B组患者在化疗同时使用质子泵抑制剂奥美拉唑肠溶片(扬州联环药业生产,20 mg/片)治疗,20 mg口服2/日,化疗结束后停用。
2.2.6. 最终入组情况
A组有8例、B组有6例因为化疗毒副反应明显、不能耐受而退出本研究。主要毒副反应表现为重度骨髓抑制、严重呕吐腹泻、药物过敏等。两组均未出现治疗相关死亡。
2.2.7. 统计学处理
采用SPSS 16.0统计软件进行统计分析,计量数据以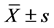 表示。组内及组间均数比较采用非参数秩和t检验,率的比较采用卡方检验;P
< 0.05表示差异有统计学意义。
表示。组内及组间均数比较采用非参数秩和t检验,率的比较采用卡方检验;P
< 0.05表示差异有统计学意义。
3. 结果
病人的临床基本特征、RDQ均分及GERD发生率(见表1~2)。两组人群基本资料无显著性差异。化疗前A组有7例、B组有7例RDQ总分 ≥ 12分,化疗后A组有32例、B组有10例RDQ总分 ≥ 12分,分别增加了25例和3例。表2提示,A组化疗前后RDQ评分及GERD发生率具有显著性差异(P < 0.05),提示GERD与化疗有明显相关性。B组化疗同时服用奥美拉唑肠溶片,RDQ评分变化、GERD发生率变化无明显差异(P > 0.05)。两组间比较提示服用PPI制剂能显著降低RDQ评分及GERD发生率,具有显著性差异(P < 0.05)。
表1. 两组患者基本资料
Table 2. GERD incidence and RDQ mean score were compared between the two groups before and after chemotherapy
表2. 两组化疗前后RDQ均分、GERD发生率比较
4. 讨论
恶性肿瘤化疗最常见的不良反应是胃肠道反应,是化疗药物对胃肠道粘膜的损伤、引起炎症反应的病理生理过程[14] 。它的机制有:1) 胃粘膜受到化疗药物损伤、刺激后,胃粘膜屏障受到损害、胃排空延迟、胃腔压力升高,导致胃壁细胞释放H+增多、胃腔储留胃酸增多、胃动力紊乱,引发恶心、呕吐、反食、反酸、烧心、上腹部痛等。2) 胃肠粘膜受到损伤后,嗜铬细胞释放5-HT,与5-HT3受体结合产生神经冲动由迷走神经传入呕吐中枢导致呕吐。另外,P物质在胃肠道与5-HT共存于迷走神经嗜铬细胞中,P物质可通过结合神经激肽(neurokinin)1受体(NK-1受体)在化疗所致恶心、呕吐中发挥重要作用[15] [16] 。
GERD的发病机制有食管下段括约肌(Low esophgeal sphincter, LES)防御机制障碍,如括约肌压力降低、括约肌术后、暂时性食管下段括约肌松弛(transient lower esophageal sphincter relaxation, TLESR)等,以及食管清除力下降,如动力减弱、唾液分泌减少、胃排空延迟、食管感觉异常等等[17] [18] 。主要损伤因素为过多的胃内容物主要是胃酸反流入食管引起食管粘膜损伤,胆汁和消化酶也可对食管粘膜造成损伤[19] 。目前GERD缺乏可靠的诊断“金标准”,国外已证实RDQ有助于GERD的诊断尝试[5] ,中国胃食管反流病研究协作组对多个城市中的10家医院进行多中心研究[13] ,运用RDQ统一问卷计分、内镜与24 h食管pH检测证实的方法对评分进行评估,证实以RDQ分值12分为临界值,≥12分临床即可诊断为GERD。所以,有关本病患病率的文章报道多建立在症状学的基础上。本研究即以国内外通用的RDQ量表作为临床诊断标准,来统计化疗前后GERD发生率。
目前,GERD与化疗的关系还不明了,描述化疗通用不良反应术语标准3.0版中,并未把GERD作为化疗相关不良事件[20] 。日本学者的一项研究[21] ,选择29例胰腺癌化疗病人,采用FSSG (the Frequency Scale for Symptoms of GERD)评分法[22] 分析化疗前后分值变化,发现化疗后近40%病人出现GERD。
本研究发现,A组化疗后RDQ均分、GERD发生率较治疗前明显上升,差异有统计学意义,提示化疗会诱导GERD发生,具体发病机制尚未无完全阐明。本文作者分析有下面几个方面,一方面恶性肿瘤化疗后容易引起胃肠动力紊乱、胃排空延迟、胃腔压力升高、胃扩张等,腹内压升高使跨膈压差增加、引起胃食管反流,且胃扩张可引起暂时过性食管下段括约肌松弛(TLESR),亦易引起反流发生。由于化疗药物对胃粘膜的损伤,胃壁细胞分泌胃酸增多,随着化疗相关恶心、呕吐的发生,富含胃酸的胃内容物频繁反流入食道、刺激食管粘膜,引起烧心、胸痛等症状。且胃排空延迟者的餐后酸反流较胃排空正常者明显增加,有更多的长时间酸反流[23] 。其次是化疗后促进5-HT、P物质等介质的释放。P物质、5-HT等在胃肠运动和感觉调节中发挥了重要的作用。5-HT具有致痛效应[24] ,可能介入食管感觉的调控机制,摄入选择性5-HT受体抑制剂可以降低食管机械和化学刺激的敏感性,而服用5-HT受体拮抗剂昂丹司琼可升高非心源性胸痛患者的食管球囊扩张阈值。P物质是构成慢性痛异位电活动的递质和激发源。P物质在外周除作为向中枢传导的疼痛递质外,还可以引起血管扩张,白细胞聚集,中性粒细胞和巨噬细胞吞噬,加速炎症介质的生长和释放,促进肥大细胞释出组胺等,组胺参与介导疼痛反应,形成神经源性炎症,该现象被称为传入神经的传出功能,这可能是P物质参与食管内脏高敏感性形成的重要机制之一[25] ,在敏感的GERD患者中,P物质过度表达、异常升高时,发挥了过度的生物学效应,即刺激信号被异常放大,或神经冲动被增强,或两种效应同时存在,从而引起食管对机械刺激或酸刺激感觉过敏,这可能与GERD患者一系列的临床表现密切相关。
质子泵抑制剂(PPI)是一种强烈的抑酸剂,是治疗GERD的一线药物。本研究发现,B组化疗前后RDQ评分、GERD发生率无明显变化,但同A组相比,化疗后RDQ均分、GERD发生率有明显下降,这进一步表明化疗会导致胃酸高分泌、胃蠕动功能失调等,最终发展成为GERD,使用PPI后明显缓解,这同日本学者研究的结论是一致的[26] 。
总之,我们发现化疗诱导的胃食管反流病发生率高,化疗同时使用PPI制剂能改善化疗后RDQ评分,降低GERD发生率,既可以缓解化疗产生的不适症状,又能改善恶性肿瘤病人的生活重量,增加了患者的治疗依从性和战胜疾病的信心。提示,恶性肿瘤肿瘤患者在化疗同时使用PPI制剂对化疗诱导的胃食管反流病能起到有效的预防和治疗作用。
参考文献 (References)
- [1] 陈竺 (2008) 全国第三次死因回顾性调查报告. 中国协和医科大学出版社, 北京.
- [2] Mitchell, E.P. (2006) Gastrointestinal toxicity of chemotherapeutic agents. Seminars in Oncology, 33, 106-120.
- [3] 周爱萍, 王奇璐 (2002) 抗肿瘤药物对消化系统的不良反应及其防治. 实用肿瘤学杂志, 17, 79-80.
- [4] Vakil, N., van Zanten, S.V., Kahrilas, P., Dent, J. and Jones, R. (2006) The Montreal definition and classification of gastroesophageal reflux disease: A global evidence-based consensus. The American Journal of Gastroenterology, 101, 1900-1920.
- [5] Shaw, M.J., Talley, N.J., Beebe, T.J., Rockwood, T., Carlsson, R., Adlis, S., et al. (2001) Initial validation of a diagnostic questionnaire for gastroesophageal reflux disease. The American Journal of Gastroenterology, 96, 52-57.
- [6] De Vault, K.R. and Castell, D.O. (2005) American College of Gastroenterology. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. The American Journal of Gastroenterology, 100, 190-200.
- [7] Molle, L.D., Goldani, H.A.S., Fagondes, S.C., et al. (2009) Noctumal reflux in children and adolescens with persistent asthma and gastroesophgeal reflux. Journal of Asthma, 46, 347-350.
- [8] Barraclough, K. (2009) Chronic cough in adults. BMJ, 338, b1218.
- [9] Wang, J.H., Luo, J.Y., Dong, I., et al. (2004) Epidemiology of gastroesophgeal reflux disease a general population-based study in Xi,an of Northwest China. World Journal of Gastroenterology, 10, 1647-1651.
- [10] Garda Rodriguez, L.A., Ruigomez, A., Martin-Merino, E., Johansson, S. and Wallander, M.-A. (2008) Relationship between gastroesophageal reflux disease and COPD in UK primary care. Chest, 134, 1223-1230.
- [11] 胡家安, 曹振英, 徐志红, 黄绍光, 张伯膺 (2009) 胃食管反流病与慢性阻塞性肺病及其加重关系的探讨. 上海交通大学学报(医学版), 9, 1070-1073.
- [12] 徐志洁, 段丽萍, 王琨, 夏志伟, 林三仁 (2005) 焦虑和抑郁与胃食管反流病症状发生的相关研究讨. 中华医学杂志, 45, 3210-3215.
- [13] 中国胃食管反流病研究协作组 (2003) 反流性疾病问卷在胃食管反流病诊断中的价值. 中华消化杂志, 11, 651- 654.
- [14] 王胜, 朱晶, 张蕊, 马丽霞 (2012) 泮托拉唑防治化疗药物所致胃肠道反应的疗效观察. 实用临床医药杂志, 7, 93-94.
- [15] Grunberg, S.M. and Hesketh, P.J. (1993) Control of chemotherapy-induced emesis. New England Journal of Medicine, 329, 1790.
- [16] 何舒 (2003) 化疗呕吐研究进展. 宁夏医学杂志, 3, 186-188.
- [17] 史燕妹, 赵公芳, 黄华 (2012) 胃食管反流病的发病机制及其诊治进展. 世界华人消化杂志, 36, 3713-3718.
- [18] 涂蕾, 侯晓华 (2011) 胃食管反流病的病因和发病机制. 现代消化及介入治疗, 1, 37-41.
- [19] 林三仁, 许国铭, 胡品津, 等 (2007) 中国胃食管反流病共识意见. 胃肠病学, 4, 233-229.
- [20] Trotti, A., Colevas, A.D., Setser, A., Rusch, V., Jaques, D., Budach, V., et al. (2003) CTCAE v3.0: Development of a comprehensive grading system for the adverse effects of cancer treatment. Seminars in Radiation Oncology, 13, 176- 181.
- [21] Uwagawa, T., Misawa, T., Iida, T., Sakamoto, T., Gocho, T., Wakiyama, S., Hirohara, S. and Yanaga, K. (2010) Proton-pump inhibitor as palliative care for chemotherapy-induced gastroesophageal reflux disease in pancreatic cancer patients. Journal of Palliative Medicine, 13, 815-817.
- [22] Kusano, M., Shimoyama, Y., Sugimoto, S., Kawamura, O., Maeda, M., et al. (2004) Development and evaluation of FSSG: Frequency scale for the symptoms of GERD. Journal of Gastroenterology, 39, 888-891.
- [23] Estevao-Costa, J., Campos, M., Dias, J.A., Trindade, E., Medina, A.M. and Carvalho, J.L. (2001) Delayed gastric emptying and gastroesophageal reflux: A pathophysiologic relationship. Journal of Pediatric Gastroenterology and Nutrition, 32, 471-474.
- [24] Coelho, A.M., Fioramonti, J. and Bueno, L. (1998) Mast cell degranulation induces delayed rectal allodynia in rats: Role of histamine and 5-HT. Digestive Diseases and Sciences, 43, 727-737.
- [25] 汤玉铭, 袁耀宗 (2008) 胃食管反流病的蒙特利尔定义浅析. 临床消化病杂志, 1, 4-5.
- [26] 杨敏, 房殿春, 李兆申, 等 (2005) 非糜烂性胃食管反流病患者食管内脏感觉过敏与P物质表达的关系. 解放军医学杂志, 7, 603-606.

附件:RDQ症状评分表及判断标准
