World Journal of Cancer Research
Vol.05 No.03(2015), Article ID:15628,8
pages
10.12677/WJCR.2015.53007
In Vivo Screening with Ph.D.-7TM and Identification of Ovarian Cancer A2780 Cell Targeted Heptapeptides
Yucan Li, Guangfu Yin*, Ximing Pu, Fei You
College of Materials Science and Engineering, Sichuan University, Chengdu Sichuan
Email: *nic0700@scu.edu.cn
Received: Jun. 20th, 2015; accepted: Jul. 6th, 2015; published: Jul. 9th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In order to select the specific ligands for ovarian cancer, the in vivo phage display technology has been applied to screen the peptide targeting to ovarian cancer A2780 cells. Firstly, ovarian cancer A2780 cells were inoculated into the armpit of nude mice to establish a tumor-bearing animal model. Then in vivo biopanning was conducted for 3 rounds with the Ph.D.-7TM phage-displayed peptide library, and individual phage clones were picked for DNA sequencing after the 3rd round. Among the picked phage clones, the clone PC-H displaying heptapeptide HGGVRLY (peptide HGG) accounted for as high as 27 percent. The identification results by ELISA tests, in vivo and in vitro phage binding assays, competitive binding assays, and immunofluorescence assays indicated that both the phage clone PC-H and the peptide HGG could be preferentially bounded to A2780 cells and then concentrated in tumor tissues. Furthermore, the results of MTT assay and scratch assay revealed that peptide HGG possessed low cytotoxicity. Altogether, the peptide HGG screened with the Ph.D.-7TM exhibited the high affinity to A2780 cells and the targeting to the ovarian cancer tissues, and would have great potentials in the targeting drug delivery system for ovarian cancer.
Keywords:Ovarian Cancer A2780 Cells, In Vivo Biopanning, Phage-Displayed Peptide Library, Targeting, Heptapeptide

Ph.D.-7TM肽库体内淘选卵巢癌 A2780细胞特异性结合肽
李钰璨,尹光福*,蒲曦鸣,尤飞
四川大学材料科学与工程学院,四川 成都
Email: *nic0700@scu.edu.cn
收稿日期:2015年6月20日;录用日期:2015年7月6日;发布日期:2015年7月9日

摘 要
卵巢癌是女性生殖器官常见的恶性肿瘤之一,卵巢上皮癌死亡率居各类妇科肿瘤的首位。探索高效安全的治疗手段,已经成为卵巢癌治疗领域的热点问题。目的:应用噬菌体展示技术体内筛选、鉴定并评价卵巢癌特异性结合七肽,为卵巢癌靶向给药系统的构建及肿瘤靶向诊疗技术的研究奠定基础。方法:噬菌体展示七肽库Ph.D.-7TM在卵巢癌A2780荷瘤模型体内进行3轮淘选。经ELISA、体内外结合、结合抑制和免疫荧光试验鉴定肿瘤阳性噬菌体单克隆及其对应展示肽的特异性,MTT试验、划痕试验考察靶向肽对相关细胞行为的影响。结果:测序结果中表达HGGVRLY肽(HGG肽)的噬菌体单克隆PC-H所占比例达到27%,ELISA中PC-H对A2780细胞显示出高亲和力及显著特异性(P < 0.05)。体内、体外反筛结果表明PC-H对A2780细胞和肿瘤组织具有很强亲和力。结合抑制实验及荧光显微成像证明了HGG肽对A2780细胞的靶向性,且HGG肽对肿瘤细胞的行为无显著影响,对正常细胞无抑制。结论:应用体内噬菌体肽库技术成功筛选出可与卵巢癌A2780细胞特异性结合的靶向肽HGGVRLY,其细胞相容性良好,可用于卵巢癌的诊断和靶向治疗。
关键词 :卵巢癌A2780细胞,体内淘选,噬菌体展示,靶向,七肽

1. 引言
癌症因具有较强的恶性增殖和侵袭转移能力,在世界范围内致死率排名第二。发病率与死亡率呈持续上升趋势,全球2012年新发癌症病例约1400万,因癌症死亡约820万[1] 。卵巢癌是女性生殖器官常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而列居第三位,但卵巢上皮癌死亡率却占各类妇科肿瘤的首位,在美国更是首位妇科致死性癌症[2] 。卵巢癌病例中绝大部分(>85%)属于上皮性的肿瘤[3] 。而上皮性卵巢癌通常难以检测且具有较高的致病率和死亡率,目前治疗手段主要是手术切除术结合放疗、化疗[4] ,尽管最初响应率可以达到80%,但其存在的正常组织毒性及免疫抑制[5] 、耐药性[6] 、腹腔分散[7] 等问题严重制约了其临床治疗效果。
靶向给药系统借助载体、配体或抗体将药物选择性地浓集定位于靶组织或靶细胞,在维持所需组织药物水平的同时有效避免药物对人体的毒副作用,已经成为最有潜力的治疗手段之一,而构建靶向给药系统的关键是筛选出肿瘤组织特异性结合配体。相对正常卵巢,卵巢癌细胞具有多重变异,比如某些受体结合位点的暴露或高表达,并且卵巢癌细胞还存在许多潜在或被证实的靶标分子,例如生长因子ErbB/EGF受体[8] [9] 、细胞周期操纵子cyclin D1 [10] [11] 、跨膜炎症整合素ITGB1 [12] 等,因此,有可能针对卵巢癌细胞或组织的特异性受体筛选靶向配体。相对于单克隆抗体和生物大分子配体,多肽配体易于大量合成并可进行配向性衍生化[13] ,同时可避免被网状内皮系统捕获而倍受青睐。
肿瘤靶向多肽的传统淘选是在体外建立的蛋白质或者多肽平台上,大量淘选后进行体内检验,包括基因组学和蛋白质组学方法。传统淘选方法虽能对确定标靶进行淘选,但由于工作量大、准确率低且获得的多肽特异性低,而逐渐被其它方法取代。噬菌体展示肽库技术是将多肽或蛋白质片段展示于丝状噬菌体上,进而从组建的文库中提取具有所需性质多肽序列的一种筛选技术,具有可多轮筛选、快速扩增,无需预知靶标信息等诸多优势。体内噬菌体展示多肽技术能在复杂的生物体内环境下进行,最大可能地模拟细胞受体于活体内的状况,因而在获取肿瘤特异性配基方面优势显著[14] 。已成功筛选出胃癌[15] [16] 、肝癌[17] 、乳腺癌[18] -[20] 等十多种癌症的靶向多肽配基,部分多肽已在成像、载药等研究中获得应用。
A2780细胞系作为最常见且恶性程度高的上皮性卵巢癌亚型之一,对基质膜的粘附能力弱因而迁移侵袭能力强[7] 。本研究以A2780为靶标,采用噬菌体展示7肽库Ph.D.-7TM体内淘选鉴定与卵巢癌A2780细胞特异性结合的多肽,探索其作为卵巢癌靶向治疗特异性配体的可行性,为卵巢癌靶向给药系统的构建及肿瘤靶向诊疗技术的研究奠定基础。
2. 材料与方法
2.1. 试剂材料
2.1.1. 试剂
噬菌体展示随机七肽库Ph.D.-7TM购自美国New England Biolabs公司,肽库所展示7肽融合于pIII蛋白,含约2 × 109 pfu克隆。用于噬菌体扩增的宿主大肠杆菌ER 2738 (雄性F+菌种)包含于该试剂盒。RPIM1640/DMEM培养基购自Gibco公司,小牛血清(NCS)、胰蛋白酶出自Hyclone公司,胰蛋白胨、酵母提取物购自OXOID公司,琼脂糖、琼脂粉为Amresco公司生产,HRP/anti-M13购自GE Healthcare公司,NP-40、FITC标记链霉亲和素购自Sigma公司,其他试剂均为化学纯。
2.1.2. 细胞系及细胞培养
A2780、SKOV3、HUVEC、A549以及L929五种细胞购自四川大学移植工程与移植免疫重点实验室。细胞培养条件:10%NCS-RPMI1640培养基,在37℃、5%CO2恒温培养箱中培养。
2.1.3. 动物及异植瘤建模
BALB/c的4~6周龄雌性裸鼠,购买并寄养于四川大学动物中心,严格按照动物中心的试验规范【SYXK(川)2009-045】进行SPF级饲养和试验。肿瘤种植当日,消化A2780细胞,至107个/200 µL,注射入裸鼠右侧腋窝。肿瘤细胞潜伏期10天,15~20天长成直径1 cm的球形异植瘤,成瘤率99%。
2.2. 试验方法
2.2.1. 噬菌体展示肽库的体内筛选
尾静脉注射噬菌体原始肽库至裸鼠体内(输入量4.0 × 1010 pfu),循环10 min时用10%的水合氯醛麻醉,5 min后剪开胸腹腔,用约50 mL PBS进行心脏灌流。取肿瘤及卵巢,剪碎、匀浆、测定滴度。再将肿瘤回收噬菌体扩增,重新尾静脉注射于裸鼠,如此重复进行第二、三轮筛选(输入量分别为2.7 × 1010 pfu和8.1 × 109 pfu)。
2.2.2. 测序、单克隆扩增、七肽合成
从第三轮肿瘤回收噬菌体菌板中随机挑取蓝斑单克隆,按照肽库说明书,进行噬菌体单克隆的DNA提取及扩增。已确定序列的候选靶向肽HGGVRLY与随机对照肽VINYYQQ均委托上海波泰生物科技有限公司合成,HPLC检测纯度达95%以上。
2.2.3. 噬菌体单克隆的ELISA鉴定
将A2780、SKOV3、A549、HUVEC以及L929五种细胞分别接种于96孔板,长至80%覆盖率后,无血清RPMI1640孵育1 h,4%多聚甲醛固定20 min,3%H2O2作用5~15 min去除内源酶活性,PBS-2% BSA在室温下封闭细胞2 h,加入3 × 108 pfu的所挑选噬菌体单克隆溶液100μL/孔孵育1 h。洗板后,加入用PBS-2%BSA稀释的HRP/抗M13噬菌体单抗复合物(1:2000) 100 μL/孔,37℃下孵育1 h。洗板后,加入TMB显色液100 μL/孔,室温避光孵育15 min,直至显色至预期深浅。加50 μL/孔的2 M H2SO4溶液终止反应10~30 min,终止后使用酶标仪在450 nm处测定各孔吸光值。
2.2.4. 噬菌体体外回输验证
将A2780细胞接种到24孔板中,过夜覆盖率为80%,无血清RPMI1640培养基孵育1 h。PBS-1%BSA在37℃封闭1 h,加入稀释的1010 pfu所挑选噬菌体单克隆孵育1 h。期间洗板用PBS-0.2%BSA清洗2-3次,每次5 min。最终加入1%NP-40裂解细胞200 μL/孔,收集于微量离心管中。记录其总体积量,并检测滴度。每个实验组2~3个平行,进行2次重复实验。
2.2.5. 噬菌体体内回输验证
体内回输法具体步骤同上,将候选肿瘤阳性噬菌体单克隆与空白噬菌体M13KE分别尾静脉注射入荷瘤裸鼠体内(输入量为1010 pfu),15 min循环后进行心脏灌流。每组的实验裸鼠数n = 3,且在收集肿瘤组织时,同时收集正常组织(脑、心、肝、脾、肺、肾、卵巢)的大部分组织进行组织匀浆并测定各器官中富集噬菌体的滴度。
2.2.6. 七肽-噬菌体竞争试验
A2780细胞按105个/孔接种于24孔板,置37℃、5% CO2恒温培养箱过夜,至覆盖度80%,无血清RPMI1640培养1 h,2%NCS-RPMI1640封闭1 h,此后将多肽(浓度梯度:0.01,0.1,1,10,100 µM)与细胞共孵育1 h,加入候选肿瘤阳性噬菌体单克隆(109 pfu) 1 h。期间0.2%BSA-PBS洗涤2~3次,每次5 min。最终加入1%NP-40裂解细胞,收集噬菌体测定滴度。
2.2.7. 生物素标记七肽的细胞免疫荧光鉴定
A2780、HUVEC分别接种于玻片上,培养至覆盖度达50%。无血清RPMI1640培养1 h,4%多聚甲醛固定10 min,2%BSA-0.05%triton-PBS封闭2 h,每孔加50 μM的生物素标记七肽室温结合1 h,FITC标记链霉亲和素室温避光孵育1 h,PBS洗涤,DAPI染细胞核10 min,PBS洗涤后激光共聚焦成像观察。
2.2.8. 七肽对细胞增殖、迁移的影响
MTT试验:A2780、HUVEC和L929细胞分别接种到96孔板,过夜,加入完全培养基稀释的多肽溶液(浓度梯度0.01,0.1,1,10 µM),24 h后按10%的比例加入MTT试剂(5 mg/mL),4 h后弃培养液,加入DMSO溶解沉淀,待完全混匀后酶标仪读取490 nm处吸光值。实验以未加多肽组为对照组。
划痕试验:A2780和HUVEC细胞分别接种到6孔板中,过夜,至覆盖度80%。用移液枪头水平划线,PBS清洗2次去除残落细胞,加入无血清RPMI1640稀释的50 µM多肽溶液培养24 h,由Image J软件测定迁移距离。实验以未加多肽组为对照组。
2.3. 数据分析
结果由PASW Statistics18统计分析,Graph Pad 5.0作图,DNAStar预测七肽的基本性质。数值以mean ± SD表示,显著水平为P < 0.05:显著级别按 < 0.001 < 0.01 < 0.05分别由“#,**,*”逐级表示。
3. 结果与讨论
3.1. A2780卵巢癌异植瘤模型的建立
荷瘤裸鼠无腹水及其它器官转移现象。肿瘤组织HE染色切片如图1,所建肿瘤模型为实体性肿瘤,细胞间界限不清,呈巢团状分布;细胞密集、体积大,异型显著,分化差;细胞核大小形态不一,核仁明显,核分裂像易见(约3~5个/HP),以上皆说明该肿瘤组织细胞分化低,恶性高,组织形态特点与A2780型囊腺瘤特点相符,即人卵巢癌动物模型成功建立。
3.2. 噬菌体肽库在肿瘤组织的富集
在输入量逐轮递减的情况下,3轮体内筛选后,噬菌体多肽库在对照正常卵巢组织中回收率基本无变化,但在肿瘤部位的富集度(回收率Round3/Round 1)达到6.8倍。输入量递减,尽管可能使得肿瘤部位回收率未出现10倍以上的增加,但保证了在靶标量一定的情况下,真正高亲和肿瘤组织的噬菌体单克隆结合的积累。筛选结果如图2,三轮筛选后噬菌体肽库在肿瘤部位的富集效果显著,因此推测潜在肿瘤阳性噬菌体单克隆在肿瘤部位存在特异性积累,故终止筛选。
3.3. 噬菌体DNA测序结果
在测序成功的26个噬菌体单克隆中,展示七肽HGGVRLY (HGG)的单克隆PC-H出现几率高达27%,展示其它多肽序列的单克隆如PC-G,PC-M,PC-W,PC-L等出现几率较低。HGG肽经DNAStar预测,其等电点9.0,在中性溶液中带1个正电荷,亲水性良好,二级结构倾向为转角-β折叠。生理条件下,带正电的HGG肽易与肿瘤细胞表面带负电荷的磷脂分子结合,良好的亲水性和相对简单的二级结构更利于其可能参与整合的靶向平台的溶解和功能作用。
3.4. Cell Based-ELISA初步鉴定阳性噬菌体单克隆
选取测序比例较高的5个噬菌体单克隆以及空白噬菌体M13KE进行ELISA快速鉴定,结果如图3所示。各种肿瘤阳性噬菌体单克隆对A2780细胞的结合均显著高于M13KE,揭示噬菌体单克隆通过其展示的多肽与A2780结合。另一方面,各种肿瘤阳性噬菌体单克隆对A2780细胞的结合显著高于其它细胞系,证实了其结合的特异性,同时也印证了体内噬菌体筛选的有效性。此外,PC-H与A2780细胞的结合力显著高于其它肿瘤阳性噬菌体单克隆,故将其作为候选(最优)阳性噬菌体单克隆。
3.5. 噬菌体的体外、体内结合
体外结合结果如图4,PC-H与靶标的结合率是随机噬菌体单克隆PC-V的10倍,是空白噬菌体M13KE的4倍。体内结合实验中,噬菌体PC-H和空白噬菌体M13KE分别回输到荷瘤裸鼠,各组织回收结果如图5,肿瘤部位PC-H的富集量是M13KE的25倍,而其他组织中二者均无显著性差异。作为噬菌体单克隆特异性验证的主要实验手段,体外与体内结合结果证明PC-H对A2780细胞、肿瘤组织的具有显著性的强亲和能力且无关正常组织。因此,PC-H对A2780细胞及肿瘤组织的靶向性得到有力支持。
3.6. 七肽–噬菌体结合抑制实验
多肽–噬菌体结合抑制试验结果(图6)表明,对照多肽VIN对噬菌体单克隆PC-H与A2780的相对结合量呈不规律性的轻微抑制;而HGG肽对PC-H的结合呈现浓度依赖性抑制,即抑制效果的显著性随浓度增加而加强,最大抑制率可达50%以上。此结合抑制试验结果与前述PC-H对A2780细胞结合显著高

Figure 1. Image of HE stained tumor section
图1. 人卵巢癌异植瘤组织切片HE染色

Figure 2. Enrichments of phage in three rounds
图2. 噬菌体在三轮中的富集效应

Figure 3. Phage clones’ cell-based ELISA
图3. 噬菌体单克隆基于细胞包被的ELISA
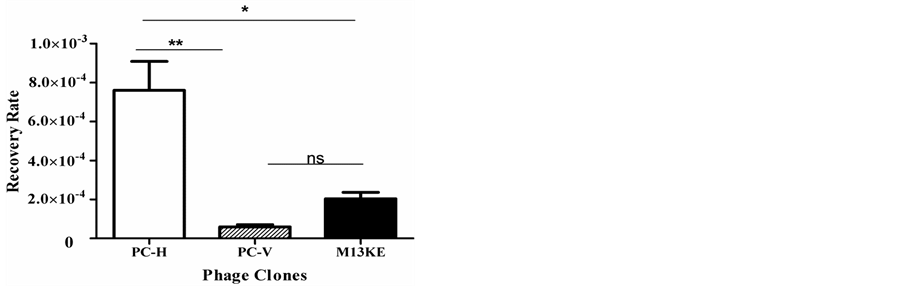
Figure 4. In vitro recovery rate of different phage clones
图4. 噬菌体体外回收结果
于M13KE的试验结果共同印证了噬菌体单克隆通过其展示的多肽而不是通过其衣壳蛋白与A2780结合,同时证实了HGG肽可以独立于噬菌体衣壳蛋白与A2780细胞非随机性高亲和作用。
3.7. 生物素标记七肽的细胞免疫荧光鉴定
生物素标记多肽与细胞结合的免疫荧光观察结果示于图7。生物素标记HGG肽能够高强度结合A2780,但与HUVEC的结合非常微弱。而生物素标记VIN肽则对A2780细胞和HUVEC细胞结合都很少。结果既表明了HGG肽对A2780细胞的高度亲和性,同时也证实了HGG肽对A2780细胞的特异性和选择性。
3.8. 靶肽HGG对肿瘤细胞行为的影响
MTT实验结果如图8所示,HGG肽对卵巢癌细胞A2780的增殖无影响,而对正常细胞HUVEC和L929细胞均起到一定促进增殖的作用。迁移实验统计结果示于图9,HGG肽对A2780与HUVEC两种细
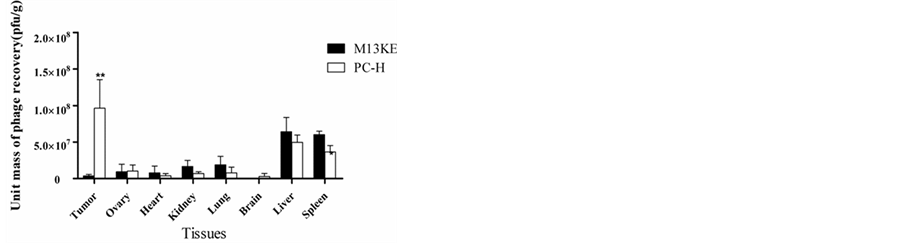
Figure 5. In vivo recovery rate of PC-H and M13KE
图5. PC-H和M13KE噬菌体体内回收结果

Figure 6. Inhibition of peptides on PC-H binding to A2780
图6. 多肽对PC-H结合A2780细胞的抑制效应

Figure 7. Fluorescent study of peptides to cells (scale bars 10 µm)
图7. HGG与VIN的与细胞结合的免疫荧光结果(标尺为10 µm)

Figure 8. Influence of HGG on cell proliferation
图8. HGG肽对不同细胞增殖活性的影响

Figure 9. Influence of HGG on cell migration (scales represent 100 µm)
图9. HGG肽对细胞迁移的影响(标尺为100 µm)
胞的迁移水平无显著影响。由此可知,HGG肽对正常细胞的增殖活性、迁移能力无不良影响,对肿瘤细胞也无促进或抑制效果。据此推测,HGG肽自身可能并不具备肿瘤抑制效应,但细胞相容性良好,可作为生物安全的靶向配基。
4. 结论
本研究针对高恶性程度的卵巢癌A2780细胞,通过建立裸鼠荷瘤模型,应用噬菌体展示七肽库Ph.D.-7TM进行了三轮体内筛选,获得了肿瘤细胞高特异性的阳性噬菌体单克隆PC-H及对应展示的HGG肽。系列验证实验结果显示,PC-H单克隆及HGG肽对A2780细胞具有高特异性的亲和能力,进而可选择性富集于卵巢癌肿瘤组织,显现出明显的靶向性,同时其细胞相容性良好。研究表明,采用噬菌体展示肽库技术筛选所得HGG肽具有较强的靶向卵巢癌A2780细胞的能力,可作为卵巢癌特异性靶向配体应用于靶向诊疗制剂的研究与开发。
基金项目
国家自然科学基金(No. 51372157)资助项目。
文章引用
李钰璨,尹光福,蒲曦鸣,尤 飞, (2015) Ph.D.-7TM肽库体内淘选卵巢癌A2780细胞特异性结合肽
In Vivo Screening with Ph.D.-7TM and Identification of Ovarian Cancer A2780 Cell Targeted Heptapeptides. 世界肿瘤研究,03,43-51. doi: 10.12677/WJCR.2015.53007
参考文献 (References)
- 1. International Agency for Research on Cancer (2014) World cancer report 2014. In: Stewart, B.W. and Wild, C.P., Eds., WHO Press, Lyon, 16-53.
- 2. Kalir, T., Firpo-Betancourt, A. and Nezhat, F. (2013) Update on ovarian cancer patho-genesis: History, controversies, emerging issues and future impact. Expert Review of Obstetrics & Gynecology, 8, 539-547. http://dx.doi.org/10.1586/17474108.2013.847638
- 3. Auersperg, N., Wong, A.S.T., Choi, K.C., et al. (2001) Ovarian surface epithelium: Biology, endocrinology, and pathology. Endocrine Reviews, 22, 255-288.
- 4. Marchetti, C., Pisano, C., Facchini, G., Bruni, G.S., Magazzino, F.P., Losito, S. and Pignata, S. (2010) Fist-line treatment of ovarian cancer: Current research and perspectives. Expert Review, 10, 47-60. http://dx.doi.org/10.1586/era.09.167
- 5. Hajitou, A., Pasqualini, R. and Arap, W. (2006) Vascular targeting: Recent advances and therapeutic perspectives. Trends in Cardiovascular Medicine, 16, 80-88. http://dx.doi.org/10.1016/j.tcm.2006.01.003
- 6. Kigawa, J. (2013) New Strategy for Overcoming Resistance to Chemotherapy of Ovarian Cancer. Yonago Acta Medica, 56, 43-50.
- 7. Janczar, S., Graham, J.S., Paige, A.J.W. and Gabra, H. (2009) Targeting locoreginal peritoneal dissemination in ovarian cancer. Expert Review of Obstetrics & Gy-necology, 4, 133-147. http://dx.doi.org/10.1586/17474108.4.2.133
- 8. Lafky, J.M., Wilken, J.A., Baron, A.I., et al. (2008) Clinical implications of the ErbB/epidermal growth factor (EGF) receptor family and its ligands in ovarian cancer. Biochimica et Biophysica Acta-Reviews on Cancer, 1785, 232-265. http://dx.doi.org/10.1016/j.bbcan.2008.01.001
- 9. Wilken, J.A., Badri, T., Cross, S., et al. (2012) EGFR/HER-targeted therapeutics in ovarian cancer. Future Medicinal Chemistry, 4, 447-469. http://dx.doi.org/10.4155/fmc.12.11
- 10. Xia, B., Yang, S., Liu, T., et al. (2015) miR-211 suppresses epithelial ovarian cancer proliferation and cell-cycle progression by targeting Cyclin D1 and CDK6. Molecular Cancer, 14, 57. http://dx.doi.org/10.1186/s12943-015-0322-4
- 11. Zhang, H.Y., Zhang, X.L., Ji, S.F., et al. (2014) Sohlh2 inhibits ovarian cancer cell proliferation by up regulation of p21 and down regulation of cyclin D1. Carcinogenesis, 35, 1863-1871. http://dx.doi.org/10.1093/carcin/bgu113
- 12. Yang, Z.Y., Zhou, X.S., Liu, Y., et al. (2014) Activation of integrin beta 1 mediates the increased malignant potential of ovarian cancer cells exerted by inflammatory cytokines. Anti-Cancer Agents in Medicinal Chemistry, 14, 955-962. http://dx.doi.org/10.2174/1871520614666140613123108
- 13. Adams, G.P. and Weiner, L.M. (2005) Monoclonal antibody therapy of cancer. Nature Biotechnology, 23, 1147-1157. http://dx.doi.org/10.1038/nbt1137
- 14. Brown, K.C. (2010) Peptidic tumor targeting agents: the road from phage display peptide selections to clinical applications. Current Pharmaceutical Design, 16, 1040-1054. http://dx.doi.org/10.2174/138161210790963788
- 15. Akita, N., Maruta, F., Seymour, L.W., Kerr, D.J., Parker, A.L., et al. (2006) Identification of oligopeptides binding to peritoneal tumors of gastric cancer. Cancer Science, 97, 1075-1081. http://dx.doi.org/10.1111/j.1349-7006.2006.00291.x
- 16. Chen, B., Cao, S., Zhang, Y., et al. (2009) A novel pep-tide (GX1) homing to gastric cancer vasculature inhibits angiogenesis and cooperates with TNF alpha in anti-tumor therapy. BMC Cell Biology, 10, 63. http://dx.doi.org/10.1186/1471-2121-10-63
- 17. Du, B., Han, H., Wang, Z., et al. (2010) Targeted drug delivery to hepatocarcinoma in vivo by phage-displayed specific binding peptide. Molecular Cancer Research, 8, 135-144. http://dx.doi.org/10.1158/1541-7786.MCR-09-0339
- 18. Laakkonen, P., Porkka, K., Hoffman, J.A., et al. (2002) A tumor-homing peptide with a targeting specificity related to lymphatic vessels. Nature Medicine, 8, 751-755. http://dx.doi.org/10.1038/nm720
- 19. Arap, W., Pasqualini, R. and Ruoslahti, E. (1998) Cancer treatment by tar-geted drug delivery to tumor vasculature in a mouse model. Science, 279, 377-380. http://dx.doi.org/10.1126/science.279.5349.377
- 20. Hajitou, A., Trepel, M., Lilley, C.E., et al. (2006) A hybrid vector for ligand-directed tumor targeting and molecular imaging. Cell, 125, 385-398. http://dx.doi.org/10.1016/j.cell.2006.02.042