World Journal of Cancer Research
Vol.
10
No.
01
(
2020
), Article ID:
33344
,
9
pages
10.12677/WJCR.2020.101001
The Safety and Efficacy of Lipiodol with or without Ethanol Chemoembolization in the Treatment of Advanced Hepatocellular
Longyang Jiang1*, Qing He2#, Yongjiu Xie2, Jingyu Zhang2
1Department of Oncology, Pengzhou People’s Hospital, Pengzhou Sichuan
2Department of Head and Neck Oncology, West China Hospital of Sichuan University, Chengdu Sichuan

Received: Nov. 19th, 2019; accepted: Dec. 2nd, 2019; published: Dec. 9th, 2019

ABSTRACT
Objective: To evaluate the safety and efficacy of ethanol-Lipiodol in the treatment of advanced hepatocellular carcinoma (HCC). Methods: 45 HCC patients who received TACE and were followed up at least once were enrolled. 23 in the treatment group were administered with ethanol-lipiodol (mixture 1:10 of Ethanol and Lipiodol) based transarterial chemo-embolization (TACE), while 22 patients in the control group were treated with lipiodol based TACE. Adverse and curative effects of two groups were compared. Results: In the treatment group, cancerous pain of one week post-operation was alleviated significantly (P < 0.05). The mean progression-free survival time (PFS) of the treatment group was significantly longer (6.44 ± 0.65 vs. 4.68 ± 0.56 months P < 0.05). The PFS hazard ratio (HR) was 0.59. Although the risk of disease progression in the observation group was smaller, there was no statistical significance (P > 0.05). There were no significant differences detected between the two groups in the incidence of adverse reactions (P > 0.05), the improvement of ECOG one week post-operation (P > 0.05), the deposition of iodized oil 1 - 3 months post-operation (P ≥ 0.05), the mRECIST of 1 - 3 months (P > 0.05) and the interval between the first to the second TACE (P > 0.05). Ethanol-lipiodol group had a net health benefit of 53.4. Conclusion: Compared to lipiodol TACE, ethanol-Lipiodol TACE was superior in cancerous pain lessening and PFS. Ethanol-Lipiodol TACE is safe, feasible and prolongs PFS. Large-scale randomized controlled trials were needed to identify whether the ethanol-Lipiodol TACE can prolong overall survival of HCCs.
Keywords:Hepatocellular Carcinoma, Transcatheter Arterial Chemoembolization, Anhydrous Ethanol, Lipiodol, Embolic Agents
碘化油联合或不联合无水乙醇灌注化疗栓塞治疗中晚期肝细胞癌的安全性和有效性分析
蒋龙扬1*,贺庆2#,谢永久2,张靖雨2
1彭州市人民医院肿瘤科,四川 彭州
2四川大学华西医院头颈肿瘤科,四川 成都

收稿日期:2019年11月19日;录用日期:2019年12月2日;发布日期:2019年12月9日

摘 要
目的:验证碘化油加无水乙醇行肝动脉灌注化疗栓塞治疗中晚期肝细胞癌的安全性以及效果是否优于单用碘化油。方法:收集随访资料完整的中晚期肝细胞癌患者45例。根据碘化油是否混合无水乙醇进行栓塞分为观察组(碘化油乙醇混合液,23例)和对照组(碘化油,22例)。比较两组患者的毒副反应以及疗效。结果:观察组平均无进展生存时间(PFS)为6.44 ± 0.65月,对照组为4.68 ± 0.56月,差异有统计学意义(P < 0.05);观察组与对照组疾病进展风险比(HR)为0.59,观察组疾病进展风险更小,但无统计学差异(P > 0.05)。术后一周内观察组患者肝区肿瘤性疼痛症状减轻较对照组明显,有统计学差异(P < 0.05)。此外,不良反应发生率、术后一周ECOG改善情况、术后1个月碘化油沉积情况、3个月mRECIST疗效评价及第二次介入治疗间隔时间均未观察到统计学差异(P > 0.05)。采用无水乙醇加碘化油栓塞对碘化油栓塞的临床净获益为53.4。结论:碘化油加无水乙醇行肝动脉灌注化疗栓塞治疗中晚期肝细胞癌可延长患者无疾病进展生存时间,显著地改善肿瘤相关疼痛,经济负担小并且安全、简便、实用,值得推广。但是否有总生存的获益还需要长期、大样本的随机对照研究证实。
关键词 :肝细胞癌,肝动脉灌注化疗栓塞,无水乙醇,碘化油,栓塞剂

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
原发性肝癌是我国常见的消化道恶性肿瘤之一。主要治疗手段包括外科手术、介入治疗、放化疗及靶向和细胞免疫治疗等 [1]。对于无手术指征的中晚期肝细胞癌,介入治疗是目前各种指南推荐的标准治疗方案,包括肝动脉灌注化疗栓塞(TACE)、物理消融或化学消融 [2]。碘化油是目前亚洲地区最常使用的栓塞剂之一,本身具有嗜肿瘤特性;无水乙醇可使周围(包括肿瘤以及血管床)组织蛋白质凝固坏死,具有杀灭肿瘤的效果,可以显著地缩小肿瘤体积;将碘化油与无水乙醇充分混合有望既发挥碘油的嗜肿瘤特性,又充分体现无水乙醇抗肿瘤和缩小肿瘤体积的作用,可能增加TACE治疗中晚期肝细胞癌的效果。故本文就碘化油无水乙醇混合物肝动脉灌注化疗栓塞治疗中晚期原发性肝细胞癌的安全性以及是否优于单用碘化油进行对比分析。
2. 资料与方法
2.1. 资料
研究对象
回顾性分析四川大学华西医院介入治疗中心2016年1月至 2017年9月期间临床及病理诊断为中晚期肝癌,接受TACE并至少有一次随访资料的患者45例。根据栓塞剂碘化油是否混合无水乙醇,分为观察组(无水乙醇碘化油栓塞) 23例和对照组(碘化油栓塞) 22例。两组患者基线各项均无统计学差异(表1)。
Table 1. Baseline characteristics
表1. 患者基线状况
注:TBIL:总胆红素,ALT:丙氨酸氨基转移酶,AST:天门冬氨酸氨基转移酶,ALB:白蛋白,ALP:碱性磷酸酶,CRE:肌酐,HGB:血红蛋白,PLT:血小板,WBC:白细胞,PT:凝血酶原时间。
2.2. 方法
2.2.1. 治疗方法
在DSA引导下,经股动脉穿刺插管,选择性插入肿瘤供血动脉后行动脉造影,了解供血动脉和肿瘤血管的分布情况并灌注化疗药物,氟尿嘧啶1000 mg、羟喜树碱40 mg或表柔比星40 mg。视肿瘤体积大小及患者反应观察组经导管予无水乙醇碘化油混合液3 ml~10 ml (无水乙醇:碘化油 = 1:10)栓塞。对照组予单独碘化油3 ml~10 ml栓塞。并根据肝功、肝动静脉供血情况考虑用明胶海绵颗粒栓塞,栓塞终点为不可耐受的肝区不适,门静脉小分支显影或者肿瘤血管明显减少或者消失。术后给予常规保肝、对症支持处理。
2.2.2. 观察指标
术后3天内不良反应、术后一周肿瘤相关症状以及ECOG评分变化。术后1~3个月入院复查检查各项指标,若出现肿瘤标志物升高、新增病灶、原有病灶增大等疾病进展表现则建议患者再次介入治疗。
1) 碘化油沉积评价:
根据复查CT结果,碘化油容积占肿瘤总体积0%~25%为碘化油沉积差,25%~50%为部分沉积,50%~75%为沉积良好,大于75%为致密沉积。
2) 疗效评估:
近期疗效按实体瘤mRECIST评价标准 [3] 进行疗效评价,CR + PR为有效,CR + PR + SD为疾病获益。并观察无进展生存时间(PFS)。
3) 不良反应:
应用常用药物毒性标准评估不良反应。
2.3. 统计学方法
数据计量资料实验数据用(x ± s)表示,采用两独立样本t检验,计数资料采用卡方检验,生存时间采用Kaplan-Meier法,疾病进展风险比采用COX回归模型,用SPSS 20.0统计软件进行统计学分析,以P < 0.05认为差异有统计学意义。
3. 结果
1) 术后3天内对照组患者3级以下和以上不良反应发生率似乎更高,但无统计学差异,两组均没有危及生命的严重并发症(表2)。
Table 2. Post-operative adverse events of two groups
表2. 两组患者术后不良反应比较 例(%)
2) 两组患者术后一周肿瘤相关症状缓解情况(表3)。
Table 3. The remission of tumor-related symptoms one week after TACE
表3. 两组患者术后一周肿瘤相关症状缓解情况比较(例(%))
表3显示碘化油加无水乙醇栓塞具有更显著的肿瘤性疼痛缓解率,有统计学差异。
3) 两组患者术后一周ECOG评分变化
观察组有16例患者在术后一周体力状况较术前改善,对照组有12例改善,两组比较无统计学差异 (表4)。
Table 4. Changes of ECOG score one week after TACE
表4. 术后一周ECOG评分变化
4) 术后1~3月两组肿瘤病灶碘化油沉积情况无统计学差异(表5)。
Table 5. Comparison of lipiodol deposition
表5. 两组病灶碘化油沉积情况比较(例(%))
5) 术后1~3月mRECIST疗效(表6)。
观察组整体有效率更高,但差异无统计学意义。
Table 6. Comparison of therapeutic effect evaluated according to mRECIST within 3 months
表6. 两组3个月mRECIST疗效比较(例(%))
6) 两组患者第二次介入治疗间隔时间。
观察组第二次介入治疗时间平均为2.57 ± 1.73个月,对照组为2.18 ± 1.54个月,两组比较无统计学差异(F = 1.557, P = 0.445)。
7) 两组患者生存情况分析结果。
观察组平均无进展生存时间更长:6.44 ± 0.65个月,对照组4.68 ± 0.56个月,两组比较有统计学差异(χ2 = 3.967, P = 0.046) (图1)。

Figure 1. Kaplan-Meier curve of survival of treatment and control groups
图1. 两组生存曲线
观察组比对照组患者疾病进展风险比(HR)为0.59,95%可信区间为0.323~1.076,回归系数−0.528,χ2 = 2.934,P = 0.085,观察组疾病进展风险更小,但差异没有达到统计学意义,增大观察的样本含量可能会得到阳性结果。
按照2016年ASCO临床获益标准计算采用无水乙醇加碘化油栓塞对碘化油栓塞的临床净获益为53.4见表7。
Table 7. Net health benefit of ethanol-lipiodol TACE compare to lipiodol TAEC in advanced HCC
表7. 碘化油加无水乙醇TACE治疗中晚期肝癌相对碘化油TACE的净获益
4. 讨论
肝细胞癌有90%以上的血供来源于肝动脉,仅少量经门静脉血提供,而正常肝细胞仅有25%~30%血供来源于肝动脉 [4]。TACE广泛应用于中晚期肝癌的治疗 [5] [6]。TACE治疗原发性肝细胞癌疗效确切,副作用小,可改善患者的生存期 [7] [8]。TACE治疗原发性肝癌使肿瘤细胞受到局部高浓度化疗药物作用的同时,遭受缺血、缺氧的双重打击而发生坏死。
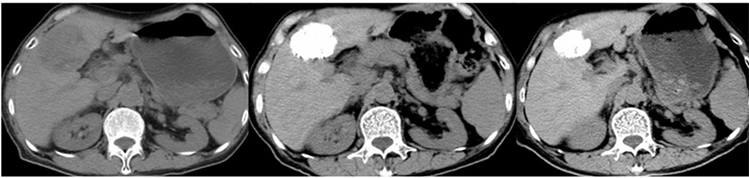
Figure 2. The patient is a 54 year old male. A. Preoperative CT showed slightly low density soft tissue shadow in left inner lobe of liver; B. After embolization with ethanol Lipiodol, lipiodol was almost completely filled in the tumor; C. After 3 months, the tumor was smaller than before
图2. 患者男,54岁,肝细胞性肝癌伴肺转移。A. 术前CT显示肝左内叶稍低密度软组织影;B. 乙醇碘油栓塞后碘油几乎完全充填于肿瘤内;C. 3月后肿瘤较前缩小
碘化油是TACE常用的栓塞剂,碘化油为油态具有可流动和延展性,可以同时栓塞肿瘤的动、静脉末梢,实现对肿瘤的短暂双重栓塞,使肝细胞缺血更加彻底而坏死 [9]。无水乙醇可使肝肿瘤组织迅速脱水,肿瘤内的血管收缩,使其血管壁发生变形、破坏其内皮细胞,进而形成局部血栓,即在使肿瘤组织坏死的同时破坏其肿瘤细胞 [10]。无水乙醇与碘化油混合形成的乳剂具有协同作用 [11],前者能延缓后者在病灶内的清除,后者能增加栓塞效果及药物的浓度并延迟药物的释放 [12] (图2)。朱兴龙 [13] 报道采用经肝动脉碘化油–无水乙醇混合剂栓塞治疗原发性肝癌,5年生存率达到了16.4%,明显高于常规TACE的9.6%。
总体来说,本研究两组肿瘤病灶内碘化油沉积都不理想,除与肿瘤病灶本身血供来源复杂相关外也与肿瘤体积偏大有关。在准确评估肝功能前提下,适当增加栓塞剂剂量或许能够得到改善。本研究中多数患者肿瘤分期较晚,肿瘤负荷重。虽然两组患者mRECIST没有检测到统计学差异,但观察组无进展生存时间较对照组明显延长,(6.44 ± 0.65)月VS (4.68 ± 0.56)月,说明碘化油结合无水乙醇的确能够提高肿瘤控制效果。
本研究中,常见的不良反应是肝功能降低及肝区疼痛,少数有发生白细胞减少的表现,均能在对症治疗后很快恢复。没有患者出现腹泻、肾功能损伤及过敏反应,体现了介入手术本身副作用小的优点。两组患者术后不良反应表现均较轻微,无统计学差异,这表明在碘油用加入无水乙醇,在增加疗效的同时,并未增加治疗带来的不良反应,与李明 [14] 的研究结果一致。
有研究者表明应根据每次治疗效果,在适当的时间间隔安排多次TACE [15],当首次或第二次TACE治疗后患者不能耐受或肿瘤治疗反应差时,通常建议改用其它抗肿瘤治疗手段例如:靶向或者免疫治疗等 [16] [17],但由于四川地区普遍经济能力较低且研究期间肝癌靶向药物尚未纳入医保,故虽然大部分患者都有靶向治疗指针但本研究纳入患者并没有接受靶向药物的治疗。本研究中两组患者第二次TACE治疗时间间隔平均为2个多月,观察组较对照组略长,但无统计学差异。
本研究中两组患者所用化疗药物不尽相同,虽然大部分学者认为化疗药物的使用可以增加TACE的治疗效果,但TACE中化疗药物是否能够增加抗肿瘤效果,目前还存在争议。化疗药物的最佳方案也没有定论,但是一般都不超过两联。有Meta分析 [18] 表明:与TAE比较,TACE既未降低死亡率,也未能改善生存期。从目前证据来看,TACE术起主要作用的是栓塞。对于是否需要采用化疗药物以及何种化疗药物方案能更有效地改善肝癌患者预后还需要进一步的探索。
碘化油和无水乙醇的最佳配比比例目前尚无定论。理论上说,无水乙醇的比例越大对小血管破坏的作用越明显,作用的血管往往比无水乙醇比例较小的更远离末梢小动脉,不利于达到“终末栓塞/致死性栓塞”的效果,所以我们采用以碘油为主,碘油与无水乙醇10:1比例混合栓塞而非1:1,也是想验证不同配比比例的栓塞剂是否有疗效以及副反应上的明显差异。并且本研究首次按照2016年ASCO临床获益标准计算确切的净健康获益为53.4。将碘化油混合无水乙醇作为栓塞剂治疗肝癌的临床获益数据化,具体化,更直观,更准确,使类似研究结果的可比性更高,为后续研究打下坚实基础。
5. 结论
综上所述,在行肝动脉灌注化疗栓塞术治疗肝细胞癌时,在栓塞剂碘化油中加入无水乙醇可延长患者疾病无进展生存时间,提高疗效。手术操作简单,安全性好,无水乙醇价格低廉,几乎不增加患者经济负担,值得推广。考虑到本研究为回顾性研究并且入选的样本量较小,大样本的随机对照研究可能发现更多的阳性结果并验证是否有总生存的获益。
基金项目
四川大学青年教师科研启动基金(2016SCU11033)。
文章引用
蒋龙扬,贺 庆,谢永久,张靖雨. 碘化油联合或不联合无水乙醇灌注化疗栓塞治疗中晚期肝细胞癌的安全性和有效性分析
The Safety and Efficacy of Lipiodol with or without Ethanol Chemoembolization in the Treatment of Advanced Hepatocellular[J]. 世界肿瘤研究, 2020, 10(01): 1-9. https://doi.org/10.12677/WJCR.2020.101001
参考文献
- 1. Forner, A., Llovet, J.M. and Bruix, J. (2012) Hepatocellular Carcinoma. The Lancet, 379, 1245-1255.
https://doi.org/10.1016/S0140-6736(11)61347-0 - 2. Bruix, J. and Sherman, M. (2011) Management of Hepatocellular Carcinoma: An Update. Hepatology, 53, 1020-1022.
https://doi.org/10.1002/hep.24199 - 3. 姚雪松, 李槐. 不可手术切除的肝细胞癌的疗效评价标准——改良RECIST标准更可靠[J]. 介入放射学杂志, 2012, 21(3): 177-179.
- 4. 祁波, 徐后莹, 王艳芹. 无水乙醇在肝癌综合介入治疗中的应用与研究进展[J]. 临床普外科电子杂志, 2015, 3(2): 5-9.
- 5. European Association for the Study of the Liver, European Organisation for Research, Treatment of Cancer (2012) EASL-EORTC Clinical Practice Guidelines: Management of Hepatocellular Carcinoma. European Journal of Cancer, 48, 599-641.
https://doi.org/10.1016/j.ejca.2011.12.021 - 6. Kudo, M., Han, K.H., Kokudo, N., et al. (2010) Liver Cancer Working Group Report. Japanese Journal of Clinical Oncology, 40, 119-127.
https://doi.org/10.1093/jjco/hyq123 - 7. 顾朋, 黄伍奎, 刘墨, 等. 海藻酸钠栓塞对原发性肝癌介入治疗早期肝功能损伤及并发症的影响[J]. 中国实用医药, 2017, 12(1): 14-16.
- 8. 宋和平. 健康教育在肝癌患者介入治疗前的应用[J]. 中国卫生产业, 2016, 13(21): 90-92.
- 9. 姚冬雪, 秦成勇. 原发性肝癌非手术治疗的研究进展[J]. 医学综述, 2015, 22(20): 3708-3710.
- 10. 赵华, 郝朋朋, 李晓霞, 等. 浅谈用介入疗法治疗肝癌的现状[J]. 当代医药论从, 2015, 13(9): 14-15.
- 11. Yu, S.C., Hui, J.W., Hui, E.P., et al. (2014) Unresectable Hepatocellular Carcinoma: Randomized Controlled Trial of Transarterial Ethanol Ablation versus Transcatheter Arterial Chemoembolization. Radiology, 270, 607-620.
https://doi.org/10.1148/radiol.13130498 - 12. Vogl, T.J., Naguib, N.N., Nour-Eldin, N.E., et al. (2009) Review on Transarterial Chemoembolization in Hepatocellular Carcinoma: Palliative, Combined, Neoadjuvant, Bridging, and Symptomatic Indications. European Journal of Radiology, 72, 505-516.
https://doi.org/10.1016/j.ejrad.2008.08.007 - 13. 朱兴龙. 无水乙醇-碘油栓塞治疗晚期肝癌43例的临床观察[J]. 中国当代医药, 2011, 18(29): 109-110.
- 14. 李明. 原发性肝癌患者应用介入化疗栓塞术联合无水乙醇灌注治疗的效果分析[J]. 中国现代药物应用, 2015, 9(6): 183-184.
- 15. Raoul, J.L., Sangro, B., Forner, A., et al. (2011) Evolving Strategies for the Management of Intermediate-Stage Hepatocellular Carcinoma: Available Evidence and Expert Opinion on the Use of Transarterial Chemoembolization. Cancer Treatment Reviews, 37, 212-220.
https://doi.org/10.1016/j.ctrv.2010.07.006 - 16. Chan, S.L., Wong, A.M., Lee, K., et al. (2016) Personalized Therapy for Hepatocellular Carcinoma: Where Are We Now? Cancer Treatment Reviews, 45, 77-86.
https://doi.org/10.1016/j.ctrv.2016.02.008 - 17. Sieghart, W., Hucke, F., Pinter, M., et al. (2013) The ART of Decision Making: Retreatment with Transarterial Chemoembolization in Patients with Hepatocellular Carcinoma. Hepatology, 57, 2261-2273.
https://doi.org/10.1002/hep.26256 - 18. Xie, Z.B., Ma, L., Wang, X.B., et al. (2014) Transarterial Embolization with or without Chemotherapy for Advanced Hepatocellular Carcinoma: A Systematic Review. Tumor Biology, 35, 8451-8459.
https://doi.org/10.1007/s13277-014-2340-z
NOTES
*第一作者。
#通讯作者。
