Hans Journal of Agricultural Sciences
Vol.4 No.04(2014), Article ID:13927,7 pages
DOI:10.12677/HJAS.2014.44012
Ultrastructural Observation and Neurotransmitter Analysis of Tissue Regeneration after Amputation of Zebrafish Lower Jaw
1Key Laboratory of Freshwater Fishery Germplasm Resources, Ministry of Agriculture, College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai
2Guangxi Fangchenggang Subversion Bureau of Quality and Technique, Fangchenggang
3Department of Biology, College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai
4Putou District Fisheries Management Center, Zhoushan City
Email: hwu@shou.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: May 27th, 2014; revised: Jun. 16th, 2014; accepted: Jun. 23rd, 2014
ABSTRACT
Zebrafish is an ideal model for studying organ regeneration, particularly in complicated nerve tissue structures like lower jaw and caudal fin. In this study, we dynamically observe ultrastructural changes of wound tissues and analyze four neurotransmitter contents during the early stage of lower jaw regeneration after removal of one third of mandible and associate soft tissues. Two hours post-amputation (2 hpa), contraction occurs around the edges of the wound causing the wound size to become smaller. In comparison with non-amputation, the level of dopamine, γ-Aminobutyric acid (GABA), glutamic acid and glycine increase in the wound tissues. The content of four neurotransmitters reaches to the peak when epidermis reconstitution is complete at 2 dpa. At 5 dpa, the missing structure is largely recovered while the 4 neurotransmitters retain the high level or slightly reduce. These results suggest that neurotransmitters play important roles in introducing lower jaw regeneration.
Keywords:Zebrafish, Lower Jaw, Regeneration, Neurotransmitter

斑马鱼下颌损伤后的再生组织的
超微结构观察及神经递质分析
吴 昊1,李 利2,李先瑞3,王箕雨3,陈丹群4,严继舟3
1上海海洋大学水产与生命学院农业部淡水水产种质资源重点实验室,上海
2广西防城港市质量技术监督局,防城港
3上海海洋大学水产与生命学院生物系
4浙江舟山市普陀区渔业经营管理站,舟山
Email: hwu@shou.edu.cn
收稿日期:2014年5月27日;修回日期:2014年6月16日;录用日期:2014年6月23日

摘 要
斑马鱼(Danio rerio)具有很强的再生能力是生物再生研究的良好模型,尤其是下颌组织和尾鳍有复杂的组织学结构。本文结合形态观察检测递质类化合物的动态变化。斑马鱼下颌组织被切除掉约1/3后,2小时创面细胞收缩,神经递质类化合物的释放增加。在修复的第2天创面形成较完整的表皮组织,递质类物质如多巴胺(DA)、γ-氨基丁酸(GABA)谷氨酸(Glu)以及甘氨酸(Gly)等的含量达到峰值。到5天的时候下颌被剪除部位外部形态已经大部分恢复,且递质类化合物的含量呈现高位维持或缓慢下降。结果提示神经递质在斑马鱼下颌再生过程中发挥重要作用。
关键词
斑马鱼,下颌,修复,神经递质

1. 引言
具有很强自我修复能力的斑马鱼是再生研究的良好模型生物,而斑马鱼的下颌同尾鳍和心脏或者蝾螈的腿一样在损伤后也能够自行修复[1] 。已有研究[2] -[4] 比较多的主要有两类组织再生方式一种是像水螅、涡虫的组织再生方式,它们体内保持有处于未分化状态的干细胞,当机体受到损伤时这些干细胞就被激活进而分化、发育成所需的组织;另一类则是像斑马鱼、蝾螈等的修复方式,通过损伤部位的芽基(blastema)细胞的再分化来完成组织再生,其中芽基被认为是由一种或多种细胞的增殖、去分化集聚而形成,对组织器官再生有重要作用的多潜能细胞群结构,很多脊椎动物的组织再生就是通过形成芽基完成。也会有同一个体同时具有以上两种组织再生方式的,例如棘皮动物门的海参等[5] [6] ;。对于斑马鱼下颌修复的研究可以为生物体软骨组织方面的自我修复研究提供重要的借鉴意义。王学龙等研究[7] 结果表明若切除约1/3的斑马鱼下颌组织后,创口表面组织可快速愈合,在3到4天的时候表皮下会出现大量的成纤维细胞样梭形细胞即芽基细胞,通过芽基细胞的进一步增殖分化,包括齿骨在内的各组织可在1个月重新长出并恢复原样。
在参与组织修复再生的分子调控机制中,包括糖类、氨基酸等大量的小分子化合物参与其中,甚至部分神经递质亦在此修复过程中扮演着特定的角色。在芽基细胞分化增殖需要生物体给予物质和能量方面的支持,因此诸如糖酵解过程、磷酸戊糖途径、糖原的合成与分解、蛋白质的合成与脂肪酸等代谢途径有可能参与了再生修复这一系统工程。通过对部分化合物的监测来间接了解各个通路代谢转化的情况是一种研究途径,尤其是针对兼具多重角色的化合物如谷氨酸等,它既可能是蛋白质合成的原料也可能是在传递着调控的信息。同时关于递质类物质如多巴胺、γ-氨基丁酸等在调节神经元活性或传导修复信息时发挥着何种作用等都是值得关注的研究内容。关于斑马鱼下颌自我修复的分子机制尚无相关文献,我们前期的试验结果显示,在修复的过程中组织中的谷氨酸、甘氨酸和天冬氨酸等含量出现了明显的波动,代谢或中间产物如丙三醇和柠檬酸以及脑部及组织中的多巴胺、γ-氨基丁酸的含量在修复过程中亦呈现规律性变化。其中的天冬氨酸及柠檬酸等数据因涉及到另外的课题研究将在其它的论文中予以描述,本文试图以上述谷氨酸、甘氨酸和递质类的小分子化合物为研究对象,通过观察它们在斑马鱼下颌修复过程中的变化情况,来初步诊断或分析它们在再生过程中的作用。
2. 材料与方法
2.1. 试验生物
试验以3个月左右的斑马鱼为研究对象,体长1.5 ± 0.3 cm,并养殖于斑马鱼养殖系统。研究分一个对照组和三个试验组,每组设置15条鱼并以5条所剪的组织合并成一个检测样本,由此设置成一个试验组的三个平行。3个试验组分别是斑马鱼减去约1/3的下颌组织后第2小时、第2天和第5天的时候,再次剪取下颌正在修复的部位,所减组织重量约0.5 mg左右,因此单个检测样本重量约为2.5 mg,能够使气质联用仪的检测器能够检测到目标化合物。同时以未做减除下颌处理的斑马鱼作为对照组试验样本,各试验组在下文中分别命名为对照0小时、修复2小时、修复2天和修复5天这四个组。
2.2. 下颌修复过程的形态观察
取对照和3个实验组的下颌组织样本,放入戊二醛固定液中,4℃条件下固定24小时,以10%为梯度用乙醇溶液进行脱水处理,每次脱水时间为20分钟,样品用100%乙醇脱水后用丙酮进行置换乙醇的处理,置换5分钟后将试验样品置于临界点干燥仪进行干燥处理,之后用离子溅射仪(HITACHI-E1010)进行喷金处理,然后进行扫描电镜(HITACHI-S3400N II型)观察。
2.3. 斑马鱼脑部、下颌组织和肝脏部位的小分子化合物分析
剪除下颌后第2小时、第2天和第5天,剪取斑马鱼的脑部、下颌以及肝脏组织,称重后迅速加液氮冷冻,匀浆并加入提取试剂(甲醇-氯仿水溶液),在零下20℃静置提取1小时,旋涡振荡后在12,000 rpm、4℃条件下离心10分钟,取上层清液于气相色谱瓶中,低温干燥后样品进行硅烷化处理,用GC-MS进行分析。仪器为安捷伦7890气相色谱和5975C质谱仪组成的气质联用仪,色谱柱为DB-17MS,进样口温度260℃,起始温度50℃,以10℃/min为梯度升到310℃,质谱离子源为EI,结果以全扫描模式进行监测,扫描范围质核比(m/z)从55到650。
数据统计用spss statistics 20进行分析,用ANOVA进行不同试验组的差异性分析,Tukey检验进行各时间点实验组的两两比较分析。
3. 结果
3.1. 斑马鱼下颌修复过程中修复表面组织的微观观察
斑马鱼下颌被剪除1/3的组织后即开始了修复的过程,到第5天的时候被剪除的组织从外部观察基本上都已恢复。由于试验样本一旦取样并被戊二醛溶液固定并用来进行观察便意味着无法继续生长,所以下图(图1)所呈现的并非同一条鱼。多条斑马鱼下颌被剪除的部位略有差异,但基本上整个下颌在第五天的时候都已经生长完全了。
对未剪除下颌的对照试验组斑马鱼表皮细胞进行微观观察,发现表皮细胞中存在两种不同表面形态的细胞,如下图(图2)所示分别为颗粒状突起和棱状突起,下文将对这两种细胞采用同样的描述。通过大部分表皮组织的扫描电镜观察,其中棱状突起的细胞占了大多数。
在剪除下颌后2个小时,对创面进行的微观观察发现表皮细胞出现萎缩,在下图3圈出来的部位经放大后可以明显看到原本应该是紧密排列且形态饱满的细胞呈现干瘪的状态,似有要脱落的趋势。且将要脱落细胞的表面无正常生长时所出现的棱形或者颗粒状突起。
修复到2天的时候,创面形态相对于2小时则显得较为光滑,在剪切部位所观察到的表皮细胞多数为有棱形状结构,如下图4所示,但棱形突起的高度跟图2和图5相比要低一些,整个细胞膜表面看起
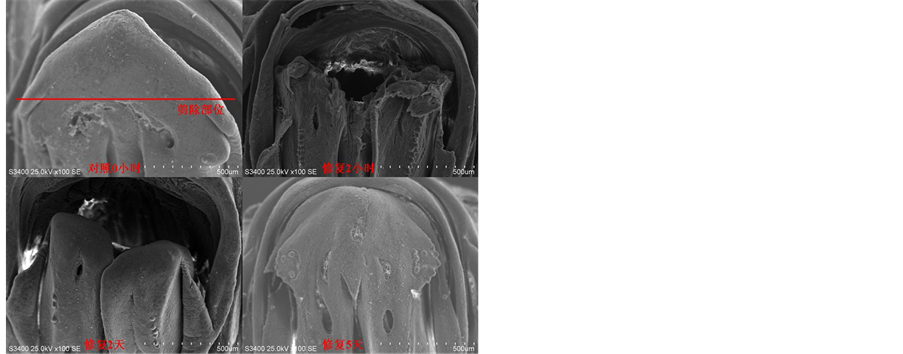
Figure 1. Three stages of tissue regeneration in zebrafish mandible
图1. 斑马鱼下颌组织再生的三个阶段
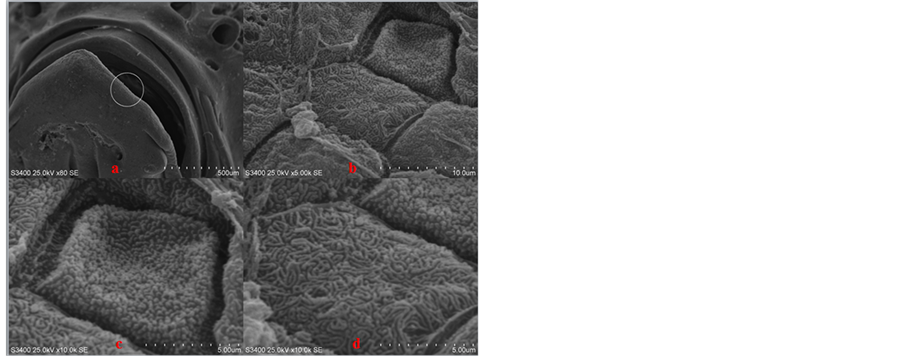
Figure 2. Histological observation of epidermal cells in zebrafish mandible intact under state
(a) 下颌未经过剪除处理的对照斑马鱼,放大倍数80倍,画圈部位为将要进一步放大的区域;(b) (a)图圈中区域放大5000倍之后的表皮细胞图,表皮细胞之间排列紧密;(c)和(d)表皮组织放大10,000倍之后分别可以找到两种膜表面呈不同形态的表皮细胞,其中(c)图为细胞膜呈颗粒状突起,而(d)图细胞膜表面呈线条状突起。
图2. 斑马鱼下颌未受损伤状态下表皮细胞的组织学观察

Figure 3. The status of zebrafish mandible after regeneration 2 hours
(a) 下颌被剪除后2小时放大倍数100倍,画圈部位为剪除的切面;(b) 剪除的切面部位放大1000倍之后能看到部分表皮细胞萎缩并且细胞之间排列松散;(c) 萎缩的细胞放大5000倍之后的形态卷曲且不规则收缩;(d) 萎缩细胞进一步放大到10,000倍之后能看到随着萎缩的进一步发展,表皮细胞有从表皮组织脱落的趋势。
图3. 斑马鱼下颌剪除2小时的状态
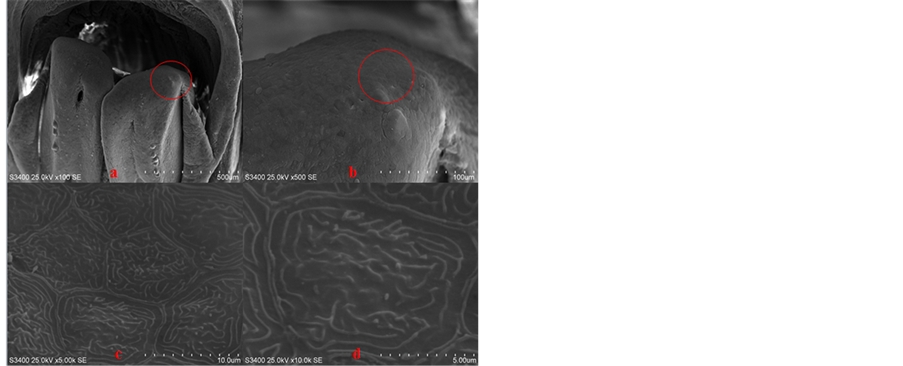
Figure 4. The status of zebrafish mandible after regeneration 2 days
(a) 下颌被剪除2天后下颌放大100倍,剪除的切面已从杂乱恢复到光滑;(b) 剪除的切面部位放大500倍之后原先被剪切掉的组织已初步露出原本的形态;(c) 修复后的表皮细胞之间排列紧密;(d) 10,000倍视野下新生表皮细胞膜表面的突起呈线状但比较浅。
图4. 斑马鱼下颌剪除2天的状态
来相对平缓和光滑,说明表皮细胞还处于生长阶段尚未达到完全成熟。
修复到5天时,基本上被剪除的下颌组织的表面都已经恢复,在剪切部位表皮细胞的棱形突起相对于修复2天的时候数量更多、更紧密。但细胞膜上含颗粒状突起的细胞依旧在修复5天时被发现。
3.2. 修复过程中下颌、脑和肝脏中递质类化合物分析
在下颌修复过程中斑马鱼脑部组织的多巴胺含量呈现出显著性变化,从2小时开始出现增加,2天时达到高峰而到5天修复接近完成时则含量出现下降趋势,同时GABA的含量亦呈现相同的变化趋势。
在对各器官组织所检测到的小分子化合物的数据进行分析后发现,下颌、脑部和肝脏部位从修复2小时开始氨基酸类化合物含量便呈现上升的趋势,且到2天时达到高峰,随后便呈现缓慢下降的趋势。在下颌部位修复过程中兴奋性氨基酸和抑制性氨基酸的含量变化幅度呈现出了差异性,兴奋性氨基酸谷氨酸(Glu)的含量增加速度明显快于抑制性氨基酸甘氨酸(Gly),我们以同一时间点上谷氨酸含量相对于甘氨酸含量的比值为分析对象,经计算统计可知下颌部位修复2天、修复5天组的Glu/Gly含量增加的速率和对照及修复2小时组相比(图6)为差异显著,说明从第二天开始到第五天谷氨酸在下颌部位的释放量要大于甘氨酸的释放量。
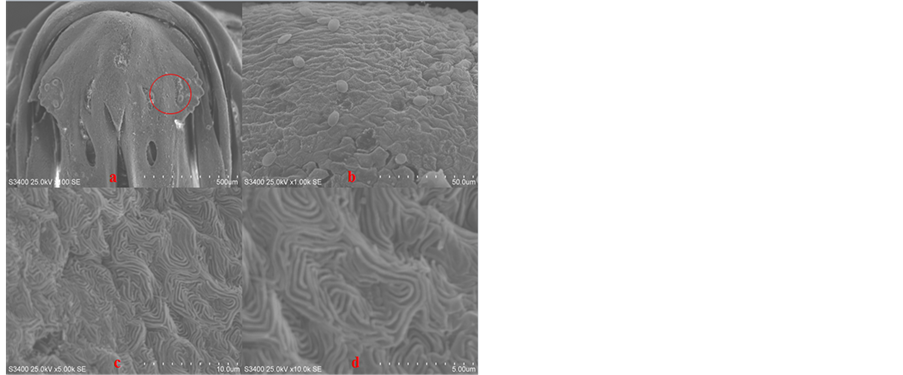
Figure 5. The status of zebrafish mandible after regeneration 5 days
(a) 下颌被剪除5天后下颌放大100倍,和图2对照组比剪除的部位基本上已经都恢复了;(b) 视野放大到1000倍之后,全部组织都已经愈合,观察剪除的切面部位发现已观察不到切面;(c) 修复后的表皮细胞在5000倍视野下排列紧密;(d) 10,000倍视野下新生表皮细胞膜表面的突起呈线状,与图4相比膜上突起的棱条结构更加清晰和突出。
图5. 斑马鱼下颌剪除5天的状态
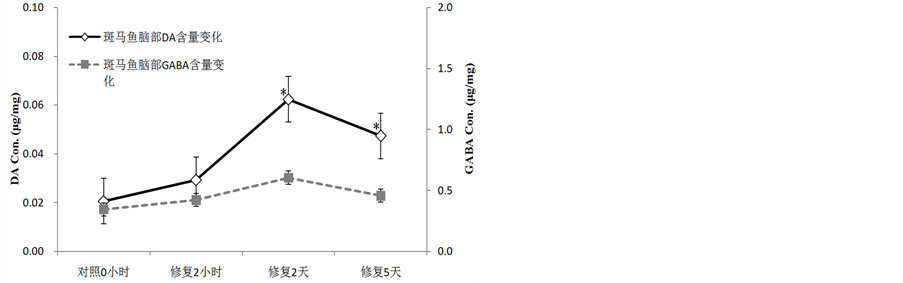
Figure 6. Concentration changes of DA and GABA on brain with regeneration process of zebrafish mandible
图6. 斑马鱼下颌损伤修复过程中脑部DA和GABA含量的变化
注:*表示差异显著,p < 0.05。
4. 讨论
诸多的研究[7] [8] 已经表明表皮的修复再生是芽基形成和再生的关键。在尾鳍修复研究中发现表皮细胞、纤维母细胞和成骨细胞等多种细胞均能够促进尾鳍的再生。本文的四个时间点在斑马鱼下颌表皮细胞的微观观察中都发现了细胞膜上的颗粒状突起和棱形突起,甚至存在两种形态兼有的细胞如下图(图7b)所示,结合上文图3关于脱落细胞的细胞膜表面是光滑无突起的描述和王学龙等的研究,推测细胞膜上表现出来的突起可能是镶嵌在细胞膜上的蛋白质,不同的形态或许是源于不同的生长时期或者是代表着不同的细胞功能,且在某些条件下能够实现不同细胞形态的转化,但具体的机理或机制还待进一步的研究。
神经递质类物质在各器官组织间的含量变化表明了斑马鱼下颌部位的末梢神经在损伤发生后就把信息传导给了大脑,且大脑也对生物体损伤自动修复机制的启动进行了反应和调控,神经递质类化合物含量的增加说明了调控或信号传导的加强,同时如图6、图8所示兴奋性递质如DA和Glu含量增加的速度明显高于抑制性递质GABA和Gly,即兴奋性递质的释放很可能是在传递着下颌细胞增殖和组织修复的信号。当然下颌中Glu及Gly等不仅以递质的形式存在,同时还可能是物质和能量代谢循环的重要成员,甚至是细胞合成蛋白质的原料。但由于实验室尚无进一步研究的设备,我们的分析只是针对各个取样部位的化合物总含量来进行测定,对单个化合物的个体行为或角色尚无法准确定位和追踪。已有研究结果显示DA同时具有刺激促生长激素分泌的作用[9] 。结合本试验修复过程中DA的释放量增加现象,可以

Figure 7. The changes of ratio of glutamate concentration to glycine concentration with zebrafish brain, mandible and liver when mandible repairing
图7. 斑马鱼下颌损伤修复过程中,鱼脑部、下颌和肝脏中谷氨酸对比甘氨酸含量的变化情况
注:*表示差异显著,p < 0.05。
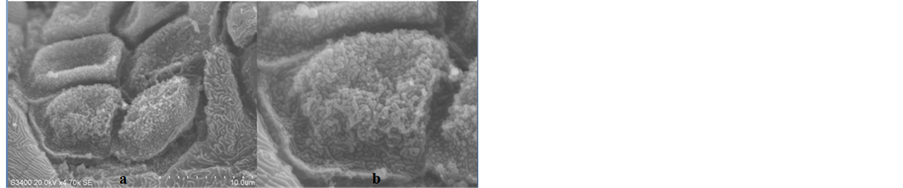
Figure 8. Epidermal cells of zebrafish mandible SEM observation
(a) 在4700倍数下组织修复部位的表皮细胞,中间的为新生的表皮细胞细胞膜上的突起多呈颗粒状,周围则是原先的表皮组织,其细胞膜表面呈现状突起。(b) 对新生的表皮细胞进一步放大观察可明显的看到细胞膜表面呈现出的突起形态。
图8. 斑马鱼下颌表皮细胞的电镜观察
推测释放的DA刺激了斑马鱼下颌组织促生长激素的分泌,并由此促进芽基细胞的增殖和分化以形成新的组织。
5. 结论
1) 斑马鱼下颌若有1/3的损伤则需要5天左右的时间即可实现大部分外部组织的自行修复,且修复5天后的表皮细胞已达到成熟阶段。
2) 多巴胺、γ-氨基丁酸、谷氨酸和甘氨酸等递质参与调控了修复过程,化合物含量在损伤开始2小时后释放量便开始增加,修复2天时达到峰值,此后随着修复的完成含量逐渐回落。
基金项目
上海市教委、上海海洋大学实验技术队伍建设计划经费,B1-5407-13-0000-5。
参考文献 (References)
- [1] Poss, K.D. (2010) Advances in understanding tissue regenerative capacity and mechanisms in animals. Nature Reviews Genetics, 11, 710-722.
- [2] Newmark, P.A. and Alvarado, A.S. (2002) Not your father’s planarian: A classic model enters the era of functional genomics. Nature Reviews Genetics, 2, 210-219.
- [3] Spallanzani, L. (1768) Prodromo di unopera da imprimersi sopra le riproduzioni animali dato in luce dallabate spallanzani. Nella Stamperia di Giovanni Montanari, Modena.
- [4] Muller, W.A. (1998) 黄秀英等, 译. Developmental biology. 高等教育出版社, 北京.
- [5] 聂竹兰, 李霞 (2006) 海参再生的研究. 海洋科学, 5, 78-82.
- [6] Vandenspiegel, D., Jangoux, M. and Flammang, P. (2000) Maintaining the line of defense: Regeneration of Cuvierian tubules in the sea cucumber Holothuria forskali (Echinodermata, Holothuroidea). The Biological Bulletin, 198, 34-49.
- [7] Wang, X., He, H., Tang, W., et al. (2012) Two origins of blastemal progenitors define blastemal regeneration of zebrafish lower jaw. PloS One, 7, Article ID: e45380.
- [8] Knopf, F., Hammond, C., Chekuru, A., et al. (2011) Bone regenerates via dedifferentiation of osteoblasts in the zebrafish fin. Developmental Cell, 20, 713-724.
- [9] Chang, J.P., Marchant, T.A., Cook, A.F., et al. (1985) Influences of catecholamines on growth hormone release in female goldfish, Carassius auratus. Neuroendocrinology, 40, 463-470.