World Journal of Forestry
Vol.3 No.04(2014), Article ID:14237,10 pages
DOI:10.12677/WJF.2014.34010
Research Progress on Identification Methods of Grape Chromosome Ploidy
1College of Life Science and Technology, Gansu Agricultural University, Lanzhou
2Agriculture Science Committee, The Senior Professor Association of Gansu Province, Lanzhou
3College of Horticulture, Gansu Agricultural University, Lanzhou
Email: caozy@gsau.edu.cn
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Sep. 23rd, 2014; revised Oct. 15th, 2014; accepted: Oct. 19th, 2014
ABSTRACT
It summarized indirect and direct identification methods of grape chromosome ploidy, and evaluated that the ploidy identification should be rough. In the early stage, we have to use the simple appraisal method with less destruction. Then, we should use the accurate method to do comprehensive appraisal, adopting different means for grape ploidy from different sources. Determining the grape ploidy accurately can serve for grape breeding practice.
Keywords:Grape, Chromosome, Ploidy Determination, Tabletting Method, Flow Cytometry Instrument

葡萄染色体倍性鉴定方法研究进展
曹孜义1,2,陈佰鸿3
1甘肃农业大学,生命科学技术学院,兰州
2甘肃省老教授协会农业委员会,兰州
3甘肃农业大学,园艺学院,兰州
Email: caozy@gsau.edu.cn
收稿日期:2014年9月23日;修回日期:2014年10月15日;录用日期:2014年10月19日

摘 要
对葡萄染色体倍性的间接、直接鉴定方法进行了综述,并对各种方法的优越性和不足之处进行了评价。指出葡萄染色体倍性鉴定应因陋就简,早期采用简单鉴定和破坏性较小的鉴定方法,其后用准确的鉴定方法进行综合鉴定。对不同来源的葡萄倍性采用不同的鉴定办法,准确确定倍性为葡萄育种实践服务。
关键词
葡萄,染色体,倍性鉴定,压片法,流式细胞仪

1. 引言
植物多倍体由于染色体组的增加,出现了许多优良性状,故而引起人们的重视,在果树倍性育种方面应用较多[1] [2] 。葡萄有二倍体、三倍体或四倍体,唯一没有单倍体[2] -[6] ,葡萄通过花药培养、胚挽救、杂交、芽变、诱变等育成无籽的三倍体葡萄或大粒四倍体葡萄,多倍体葡萄品种已在生产上大量应用[1] [2] [7] -[9] 。倍性育种都要鉴定葡萄染色体倍性,倍性鉴定是葡萄倍性育种的基础和应用的前题,鉴定葡萄倍性有多种方法[1] [2] [4] [5] [8] -[13] 。由于葡萄细胞小、染色体小、数量多,给染色体倍性鉴定带来重大困难[11] -[13] ,但近年来流式细胞仪的应用方便了倍性鉴定有了较大进展,并有较多的研究报道[8] [14] -[21] 。
2009年陶抵辉等综述了植物染色体倍性鉴定方法研究进展[10] ,同时也有多倍体综述的报道[7] [8] [17] ,但葡萄染色体倍性鉴定方法研究进展尚未见有综述[2] [7] 。本文对葡萄染色体倍性鉴定方法研究进展进行了综述,以促进葡萄倍性育种的发展。
葡萄染色体倍性鉴定方法可分为直接鉴定和简接鉴定。
2. 简接鉴定
简接鉴定方法有形态鉴定、气孔鉴定、花粉鉴定、生长势鉴定、细胞学鉴定、分子鉴定等。
2.1. 形态鉴定
葡萄染色体倍性增加后,变为四倍体即同质四倍体,LI-LII-LIII三层分生组织全为四倍体,也有某层加倍而有的层未加倍成为嵌合体。同质四倍体与原二倍体形态上不同,表现叶片大、叶厚、叶缘锯齿大、叶柄和枝条粗[2] [7] [8] [11] [14] ,如大无核白,叶面积是二倍体无核白的2.25倍;玫瑰香一年生枝条平均直径是0.702 cm,二年生枝条直径是1.52 cm,大玫瑰香一年生枝条为1.064 cm,二年生为2.352 cm,后者是前者的2.17倍和1.54倍,从形态上可以区别出四倍体与二倍体[2] 。赵淑兰等发现完全花山葡萄四倍体比原二倍体山葡萄叶片大而厚,叶泽深绿,节间长[20] 。
四倍体葡萄染色体倍性增加后,果粒巨大,如四倍体大玫瑰香平均果粒重7克,是二倍体玫瑰香的1.77倍。大无核白果粒重2.75克,是二倍体无核白的2.22倍;二倍体拜尔早生的果重4.9克,而康拜尔早生芽变石原早生果粒重为7.8克,胜宝为9克,高井早生为8克。康浓玫瑰杂交获得的伊亚锦品种单粒重17克以上[2] [7] [11] [17] 。世界各国,尤其日本采用杂交育种和芽变选种的方法,选育出了巨峰、黑奥林、红瑞宝、先锋、龙宝、大宝、藤稔等几十个葡萄多倍体大粒品种,我国也相继培育出紫珍香、玫香怡、京亚等品种,这种方法已广泛应用葡萄多倍体新品种的选育,葡萄由二倍体加倍成四倍体,普遍果粒增大,这是许多大粒葡萄的共同特性,也是葡萄多倍体育种应用多的主要原因。日本采用杂交育种和芽变选育葡萄多倍体品种成就最多[2] [7] [17] 。
2.2. 气孔鉴定
葡萄多倍体与叶面气孔呈高度相关[21] -[24] ,气孔在葡萄表皮,故可鉴定LI层,方法简单,作为初选方法应用,以确定是否是多倍体。葡萄染色体倍性增加后,变为四倍体即分生组织全为四倍体,有同质四倍体或嵌合体。气孔鉴定,可用撒取法、印膜法、解离法和粘取法等,在显微镜观察和测定气孔大小和密度[2] [7] 。大无核白平均气孔为31.34微米,每平方毫米有58.34个;无核白气孔为26.21微米,每平方毫米有86.79个。赵淑兰等发现完全花山葡萄四倍体气孔为29.5 ± 4.5微米,每平方毫米为106.9 ± 8.0个;原二倍体山葡萄,气孔为18.8 ± 1.1微米,每平方毫米有72.0个[20] 。
我们在确定三倍体葡萄花药植物植株是完全性三倍体时,发现气孔大小和气孔密度介于四倍体和二倍体之间[25] 。
用三倍体葡萄花药植株试管苗,叶剥取法,I-KI染色在显微镜下观察不同来源的叶片,测定气孔密度和保卫细胞叶绿体数、气孔大小,可用来鉴定L1层细胞的倍性。结果见表1和图1;表明:四倍体葡萄品种藤稔的保卫细胞长度、保卫细胞中叶绿体数目明显高于二倍体品种歌海娜;而气孔指数则相反;三倍体花药株系的各种指标均介于二者之间,说明花药三倍体植株LⅠ层是三倍体。保卫细胞叶绿体数呈
Table 1. Cell ploidy in root tips of plant from different anthers of Grenache (from Li wei et al., 1994)
表1. 不同材料花药再生植株的染色体倍性(引自李唯等,1994)
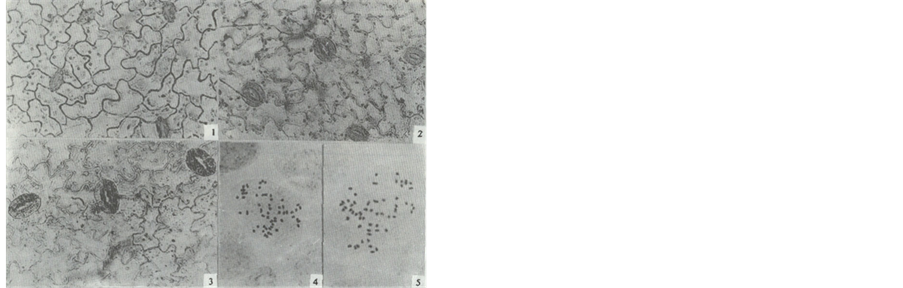
Figure 1. The anther plant of triploid grape on leaf epidermis, root and stem tip chromosomes 1~3: Stomata (1 Diploid grape-Grenache 2 3 Tetraploid grape Fujiminori); 4 - 5: Ploid of cell of the anther triploid plant (4. Root tip 3n = 57; 5. Shot tip 3n = 57) (from Cao Ziyi 1996)
图1. 三倍体葡萄花药植株试管苗叶表皮、根尖和茎尖染色体(引自曹孜义等,1996);1~3、叶表皮气孔(1、二倍体葡萄—歌海娜;2、花药三倍体植株;3、四倍体葡萄—藤稔);4~5、花药三倍体植株细胞的倍性(4、根尖3n = 57;5、茎尖3n = 57)。
现不规律,不能做为倍性鉴定方法,关于保卫细胞叶绿体数这与有些研究者报道不一[2] [16] [17] 。
陈俊等研究气孔保卫细胞大小和叶绿粒数的测定和统计,以推断LⅠ层的细胞倍性,对10份材料(含对照)随机测定60个保卫细胞的长宽,统计其中的叶绿粒数。测定结果表明,保卫细胞的长、宽和叶绿粒数三项数据资料的显著性测验与倍性十分吻合,据多项指标认为:四倍体瑰宝葡萄品系2-36-5、6-72-Il、4-36-8、4-72-2的LI层为四倍体;4-36-8的倍性结构为4-4-4型;瑰宝葡萄品系2-96-1、3-24-4、6-72-3、2-24-4的表皮为二倍体,为2-4-4嵌合体型[17] 。
常永义和陈秀蓉在葡萄倍性鉴定上,应用气孔性状建立线型判别葡萄染色体倍性,提高了倍性鉴定的准确率[23] 。
2.3. 花粉鉴定
花粉粒由LII层衍生孢原组织形成,其大小与倍性密切相关。四倍体花粉粒明显大于二倍体葡萄品种,如四倍体玫瑰香葡萄花粉直径是二倍体玫瑰香葡萄1.37倍,四倍体吉香葡萄花粉粒长度是二倍体白香蕉葡萄1.17倍,大无核白葡萄的葡萄花粉直径是二倍体无核白的1.46倍[2] [10] [17] 。
陈俊等测定了诱导四倍体瑰宝品种花粉粒大小。多倍体瑰宝品系材料4-36-8和2-96-l花粉粒长度与宽度均极显著地大于二倍体的瑰宝品种 且花粉粒形状极不规则,呈三角形、梯形、椭圆等形状,证明其LII层为四倍体[17] 。
常金华等用扫描电镜观察,发现诱变株的花粉粒形态不规则,椭圆形花粉粒较多,而二倍体植株的花粉粒形态大多近似圆形;对花粉粒大小进行测定,诱变株花粉粒显著大于二倍体对照[24] 。
花粉粒大小测定能确定葡萄的倍性,方法简便,适于早期测定,但取材受到限制,还要求花粉粒形状规则,否在难以确定[10] [17] 。
2.4. 长势鉴定
葡萄多倍体表现叶片大、叶厚,叶柄和枝条粗,果大,比二倍长势慢[2] [6] [16] 。方法适于初步观察,但不够准确。陈俊等研究多倍体材料25-8株系发现叶片小或成畸形,枝条纤细,生长势弱等不良性状[17] 。我们诱导的三倍体葡萄花药植株,长势也弱[25] 。
葡萄倍性鉴定用气孔、花粉等只能做初期鉴定定[17] -[24] [26] ,最终要靠直接测定细胞中DNA含量和染色体倍性来确定。
2.5. 分子鉴定
直接测定细胞中DNA含量,可用于葡萄细胞内染色体倍性的确定,主要用流式细胞仪测定[12] -[21] 。
朱道圩等[15] 报道流式细胞仪工作原理,使用供试细胞群体一般需要分散后对待测的某种成分进行特异染色,然后将悬液中的细胞一个个地通过流式细胞仪,此时检测器便可测出并记录每个细胞中的待测成分的含量。并根据要求将该成分含量不同的细胞分离出来。
马爱红等[8] 首次将流式细胞仪鉴定多倍体技术应用在葡萄诱变育种的倍性鉴定,结果表明,除检测迅速外,而且可检测生长点和叶片等非生长点部位,结果可靠、全面、更具有代表性。
石艳等[16] 在利用胚挽救技术创制葡萄多倍体种质的研究论文中介绍了流式细胞术法分析方法:使用德国Prate公司生产的流式细胞仪loidyAnalyser(PA-I型),以已知倍性的二倍体霞多丽葡萄品种为对照,选取其幼嫩的叶片,切下1 cm左右的小块放入Prate公司专制的培养皿中,加入0.5~1.0 mL的DNA提取液HRA,用锋利的刀片将叶片切碎,A液的处理时间为2~5 min。上机测样,把测试管插入分析仪,然后将产生的分析峰在横轴上的荧光值FL设定为50,并把参数固定。DNA的含量分布图由流式细胞仪自动生成图象,结果见图2。
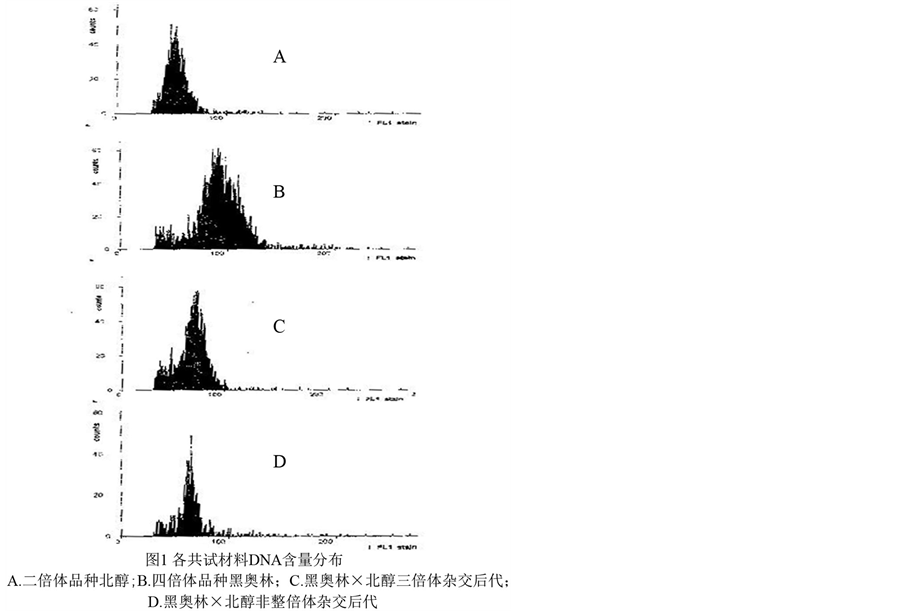
Figure 2. Identification figure of ploigy by the flow cytomotry (from shi yan et al., 2012)
图2. 流式细胞仪倍性鉴定图(引自石艳等,2012)
赵艳华等用二倍体和四倍体杂交以获得三倍体,采用流式细胞仪和根尖倍性鉴定,得到三倍体和其他倍体,二种方法检查倍性结果基本一致[12] 。孙马和王跃进用流式细胞仪和染色体计数法对野生葡萄染色体倍性鉴定进行了比较研究,说明染色体倍性鉴定可靠性高,但操作复杂,要经验和时间;而流式细胞仪染色体倍性鉴定快速、简单,结果与染色体计数法相近,认为今后有大的发展前途[19] 。赵淑华等用流式细胞仪证实完全型花山葡萄是四倍体[20] 。
张丙秀等[14] 用流式细胞仪测定了诱变植株葡萄京秀的四倍体、二、四倍嵌合体和二倍体的DNA含量分布图。发现四倍体植株在接近峰值100的位置上出现一个单峰;二、四倍嵌合体具有2个峰:除50附近的位置有1个峰外,在位于其DNA含量一倍的地方还有一个峰;二倍体对照植株仅在荧光强度值为50的位置上出现一个单峰。经FACSAria型流式细胞仪中软件分析,得到嵌合体中不同倍性细胞的相对比例。京秀嵌合体和二倍体细胞占比例为47.13%,四倍体细胞占52.87%,以此结果了解诱变株中不同细胞的情况。
以前对葡萄多倍体诱导研究中,对诱变所获得的植株多采用在显微镜下染色体数目鉴定倍性,该方法直观、清楚,准确,但材料仅限于茎尖和根尖。如果是扇形嵌合体,采用茎尖检查其染色体数目也可能会得出错误的结论。因此采用显微镜下染色体数目鉴定的方法有时难以获得全面可靠的结论。采用流式细胞仪,在数分钟内即可完成测定和分析,因此,流式细胞仪对于杂交后代鉴定,也是一种简便而准确的方法,但仪器贵重,投资大[12] [16] [19] -[21] 。对于染色体多一个或少一个则无法确定,如对染色体75条的四倍体葡萄高尾的染色体数。
3. 直接鉴定
直接鉴定就是葡萄细胞内染色体直接计数。
3.1. 染色体直接计数
染色体直接计数的主要原则,取材时间要正处于分裂中期的分裂细胞,进行预处理,以形成粗壮的染色体便于计数。取正在旺盛生长的根、茎、幼叶、卷须或花等器官为材料,这要在生长季节的田间取材,受季节的限制[7] [13] 。若在智能化温室栽培,最好用试管苗,这可以在一年任何时间都可剪取旺盛生长的材料,十分方便[5] [11] [27] 。
3.1.1. 常规压片法
一般检查葡萄染色体取材时间一般在早晨9.00~11.00和下午2.00~4.00时间,取生长旺盛、粗壮、长约l cm的新生根尖、茎尖,剪取0.5 cm,置于饱和对二氯苯或4℃的冷水中或0.1%秋水仙素溶液中处理6~24小时,再经卡诺固定液(酒精:冰醋酸为3:1)固定12~24小时,盐酸酒精1:1解离液,在室温下解离8~15分钟,水洗3次,然后用苏木精或卡宝品红染液染色4小时以上,用45%的醋酸压片观察[24] [26] [28] 。
常规压片法关键是l mol/L HC1 60℃水浴中解离的温度和时间要适当,解离不够,难以压片;解离过头,染色体消失。再者压片要适当,既要分散开染色体,又要保持细胞完整,要多实践、耐心,才能取得好的结果。我们葡萄花药培养诱导出花药植株不论三倍体、二倍体或是非整体都用这种方法检查葡萄染色体,准确(图3:表1),但费时、费工,难以大量应用[3] [28] 。
邹昌杰,李佩芬在进行葡萄花药培养时,检查葡萄的花药植株,由于葡萄染色体制片技术不过关,把看不清的约30条以上的二倍体染色体图片,注成n = 19条的葡萄花粉单倍体,并说是落叶果树世界上第一个诱导出单倍体植株,在任何杂志和图书上都找不到质量这样差的染色体图片[2] [5] [13] [19] [20] ,还刊在植物学报正刊上[29] ,至今还出现在中学生网站和大学教材中,让人费解,见对比图4。
3.1.2. 改良压片法
1988年Mary-Howell等[30] 介绍一种压片法效果较好,现简要介绍于下:
用赤霞珠休眠枝条室内扦插生根,备用。处理过程如下:
A) 处理时间:上午8点~ll点;
B) 预处理:经0.2 M 8-羟基喹啉水溶液处理l小时,温度18℃;
C) 固定剂:冰醋酸和95%乙醇按1:2:2配制(即Famer固定液)26℃下固定4小时。
D) 解离液:用解剖刀人工切碎根尖,在lN HCI中水解l小时、温度60℃,将材料置于lNHCI和醋酸洋红中在火焰上方缓缓加热;
E) 染色剂:用改良卡宝品红染色:即醋酸洋红1:1加入卡宝品红的染色剂;
F) 压片镜检:取出染色的根子尖在载玻璃片上仔细压片,后镜检。
这一方法加快了葡萄有丝分裂细胞的检查。用0.02 M 8-羟基喹啉浓度预处理,Farmer固定液固定后,在1N HC1中以60℃水解1小时,改良卡宝品红染色的组合的方法,可获得数目较多和清晰可数的有丝分裂细胞[30] 。
陈俊等在葡萄多倍体诱导方法及倍性鉴定的研究中,采用的方法获得气孔保卫细胞大小和叶绿粒数的测定和统计,以及卡宝品红染色,常规压片,镜检观察的结果表明染色体数多为混倍体类型.为搞清其倍性结构。根据组织发生层学说,叶表气孔保卫细胞的大小和其中的叶绿体数目的多少、花粉粒的形状和大小、根尖细胞染色体数目可用于推断LI、LII、LIII层的倍性,经对20多份多倍体材料的观察测定,统计分析表明,大部为嵌合体,少数为同质四倍体[17] 。
唐晓萍等报道了葡萄新品种早夏黑的倍性结构,用气孔、花粉粒的形状和大小、梢端组织切片和根尖染色体数目确定了早夏黑是同质四倍体[21] 。

Figure 3. Chromosome in root tips of anther plantles (from Cao Ziyi, 1994). 1. n = 19; 2. n = 27; 3. 2n = 38; 4. 3n = 57
图3. 葡萄花药培养诱导植株染色体倍性(引自曹孜义1994);1、n = 19;2、n = 27;3、2n = 38;4、3n = 57
 (a)
(a) (b)
(b)
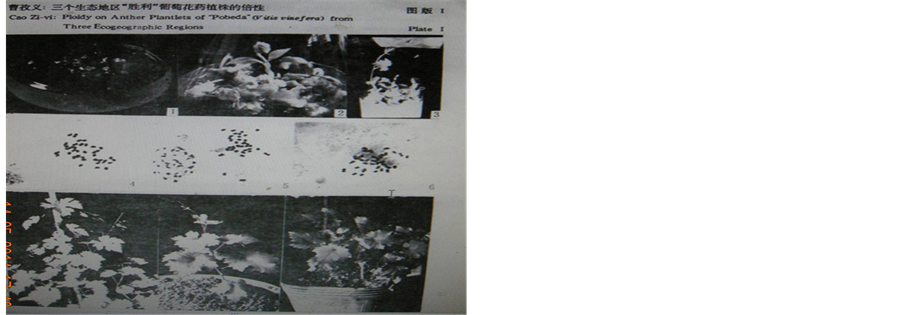
Figure 4. Thromosome contrast on two kinds of grape anther plant; (a) Induction of pollen plants of grape. Figure 5: A root tip cell with chromosome number of 19 (from Zou Chang Jie and Li pai fen,1981); (b) Ploidy on anther planlets of Pobeda from three ecgeographic regions(from Cao Ziyi, 1994). Figure 5: 4 - 6 Chromosome number of anther planlets 2n = 38(from Cao Zi, 1994)
图4. 两种葡萄花药植株染色体对比图;(a)《葡萄花粉植株的诱导》只有一张数不清楚的染色体片(标明n = 19) (见邹昌杰,李佩芬1981);(b)《三个生态地区“胜利”葡萄花药植株的倍性》(见曹孜义,1994)
3.1.3. 去壁低渗法
常规压片法染色体计数观察染色体数,不容易使葡萄染色体分散,后改进为此法,孙马和王跃进[19] 在中国野生葡萄染色体倍性研究中的采用低渗法进行染色体计数,其步骤做以简要介绍:
具体步骤如下:
取材→预处理→前低渗→前固定→酶解→再固定→染色→压片和镜检[19] 。
常金华等对人工诱变的玫瑰香葡萄2个品系进行了染色体数目、气孔特征和花粉粒特性等与倍性有关的性状进行了鉴定。结果表明,诱变产生的四倍体玫瑰香I为4-4-4型四倍体,玫瑰香II为2-4-4型嵌合体。试验还表明,利用气孔、花蕾特征、卷须和茎尖染色体计数可有效鉴定变异株[24] 。
赵淑兰等在完全花山葡萄四倍体种质的发现及鉴定论文中,提供有二倍体山葡萄和四倍体山葡萄染色体数图和花粉图(图5),图象清楚,说明确切获得了四倍体山葡萄[20] 。赵艳华等发表的葡萄三倍体种
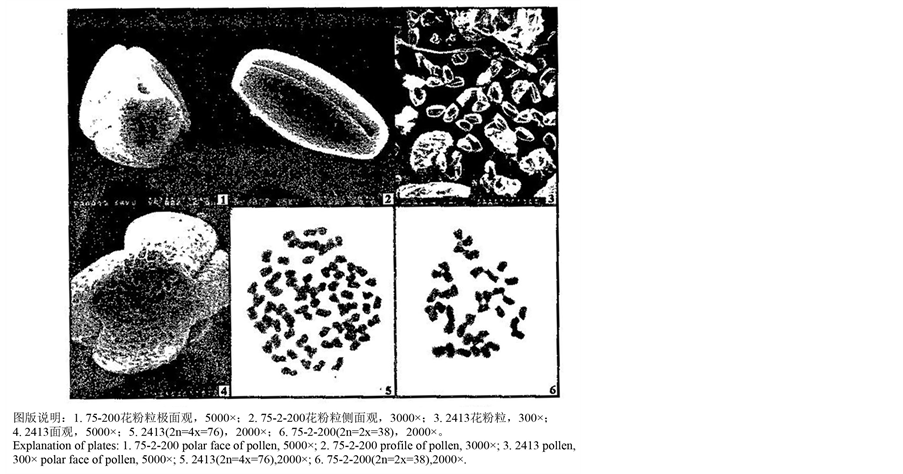
Figure 5. Diploid and tetraploid amur grape chromosome number and pollen figure (from shu-lan zhao, 2003)
图5. 二倍体山葡萄和四倍体山葡萄染色体数图和花粉图(引自赵淑兰等,2003)
质创新及倍性快速鉴定论文中对有四倍体和二倍体山葡萄除用形态学鉴定外,还进行了染色体计数[12] 。
3.1.4. 优化制片法
王小利[13] 在葡萄染色体计数上,做了许多研究,对比了各种取材方法、应用多种染色剂,熟练掌握了葡萄染色体计数技术,发表了葡萄染色体制片技术优化论文。
现将葡萄染色体制片技术优化法做一介绍:
1) 取材:于3月下旬、4月上旬上午7:30~10:30间从温室中取下在生长的根尖。
2) 预处理:将采集的材料立即投入饱和的对二氯苯溶液中常温下处理3~4 h。
3) 前低渗:用吸管吸去预处理药液,直接换入0.075 mol/L KCl低渗液中,处理30分钟。
4) 前固定:倒净前低渗液,用蒸馏水冲洗数遍,然后往瓶中注入新配制的甲醇:冰乙酸3:1(V/V)的固定液,常温下处理12~24 h。
5) 酶解:吸去固定液,用蒸馏水将材料冲洗干净,然后将材料剪切成1 mm左右的小块放入1.5 mL的离心管中,再往离心管中分别加入3.5的纤维素酶和果胶酶(1:1)的混合酶液,酶液和材料的比例为30:1,在25℃恒温下酶解12 h。
6) 后低渗:用吸管小心吸去酶液,用蒸馏水将酶液冲洗干净,最后在蒸馏水中停留10分钟。
7) 再固定:吸去蒸馏水,注入固定液再固定20分钟。
8) 染色:将材料用蒸馏水冲洗后在丙酸一水合氯醛一铁矾苏木精染色液中染色2 h以上。
9) 压片和镜检:取几小块材料放在载玻片上,滴少许丙酸:水合氯醛:铁矾苏木精染色液,用镊子捣碎,盖上盖玻片并在一角垫一刀片,然后用木制小棒敲打盖玻片,将组织分散成雾状,最后去掉刀片并用吸水纸吸去多余的染色液,酒精灯上干燥后用Motic显微数码摄影系统照相。
王小利总结出采集幼芽、茎尖、幼叶或卷须的材料立即投入饱和的对二氯苯溶液中常温下预处理,用去壁低渗-压片法,丙酸–水合氯醛–铁矾苏木精染色液进行染色,直接记数有丝分裂处于中期的细胞染色体,结果以幼芽、茎尖最多,其次卷须,染色体着色较深,结果见图5。
去壁低渗–压片法用幼芽、茎尖、幼叶或卷须,由于是非分生组织或受贮藏物质的影响,制片底色较浓,用去壁低渗–压片法,较复杂,但可减少这些不利的影响,采用甲醇固定,细胞壁和染色体硬化程度比乙醇强,便于染色体分散。其次控制0.075 mol/L KCl浓度和时间十分重要,太浓和太长,容易损坏染色体。酶解与酶的质量和时间也十分关键,酶解时间不够,或酶质量差,细胞壁消化不完全,染色体难以分散;酶解时间过长或酶解过强,细胞壁过度消化,细胞太分散或染色体丢失,都效果不佳。
王小利[13] 还强调掌握葡萄染色体技术,需要在实践中不断摸索与总结,要根据取材难易和试剂准备情况而定,做好取材、预处、固定、酶解和染色的同时,熟练压片技术,才能获得葡萄染色体满意的结果(见图6)。
3.1.5. 石蜡包埋切片法
石蜡包埋根尖、生长旺盛的芽尖以及嫩叶分生组织,经复杂切片过程用于葡萄染色体的计数,但这项些技术复杂、用时多,困难,现已多不应用。唐晓萍等研究报道了葡萄新品种早夏黑梢端组织石蜡切片和表皮气孔大小、花粉粒的大小和根尖细胞染色体数目,确定了早夏黑是同质四倍体[21] 。李佩芬等也用石蜡包埋芽尖鉴定葡萄细胞悬浮培养诱变为同质四倍体[31] 。任清等利用石蜡切片对人工诱变的四倍体葡萄四玫I和四玫II进行研究,发现其实生苗均为4-4-4型[32] 。
3.2. 核仁数目和染色体核型分析也能鉴定
核仁数目和染色体核型分析也能鉴定葡萄的倍性,染色体核型分析包括染色体数目、大小、形态、倍性、着丝粒位置等。带型分析即经细胞学处理,使染色体的各个不同的部位显现深浅不同的稳定带纹,从面使染色体可以识别,包括C带、N带、G带。
李唯和曹孜义对三倍体花药植株细胞染色体的数量与染色体组型进行了分析,三倍体细胞染色体为57条,数量多而小,在制片过程中不可避免会有一些粘连和重迭,容易出现统计误差。为此与德国栽培植物育种研究所合作,对三倍体花药植株细胞的染色体组型进行了分析。结果表明,被分析细胞的染色体数字为57条,其体积较小,最长的只有58微米,最小的仅为1.34微米。不同染色体的形状和染色程度差异较大[5] 。李佩芬等也对诱变的葡萄同质四倍体的核仁数目与原二倍体植株细胞做了比较[31] 。孙 马和王跃进也讨论了中国野生葡萄染色体组型分析[19] 。
3.3. 激光共聚焦显微镜鉴定
用激光共聚焦显微镜鉴定,可以在活体上观察细胞分裂过程,可以鉴定葡萄染色体,但激光显微镜价值昂贵,操作更复杂,国内尚未见用于鉴定葡萄染色体的报道。
4. 小 结
葡萄细胞小、染色体数量小而多,给鉴定倍性带来一定困难,近年虽取得较大进展,但鉴定还需要做大的改进:
1) 葡萄倍性鉴定方法较多,用什么方法鉴定倍性取决于倍性鉴定的目的、条件、技术水平、取材要求和精确度等而定。
2) 葡萄倍性初步和早期可用形态法、气孔法、花粉法等方法鉴定,倍性的精确度虽低,但技术难度低、简单、易做,能大量做,条件要求不高,有显微镜就行。
3) 要准确鉴定葡萄倍性,只有用压片法、改良压片法、低渗压片法、优化压片法和流式细胞仪鉴定,这些方法虽准确,但要求条件、设备和技术水平高。压片法取葡萄各组织正处于旺盛生长期或花粉减数分裂期才行,这受季节的限制,同时处理费事、时间长,不适于大量鉴定。流式细胞仪适于大量鉴定,快速,较准确,但要贵重的流式细胞仪,也不适宜葡萄染色体组型鉴定和准确染色体计数(如75条染色
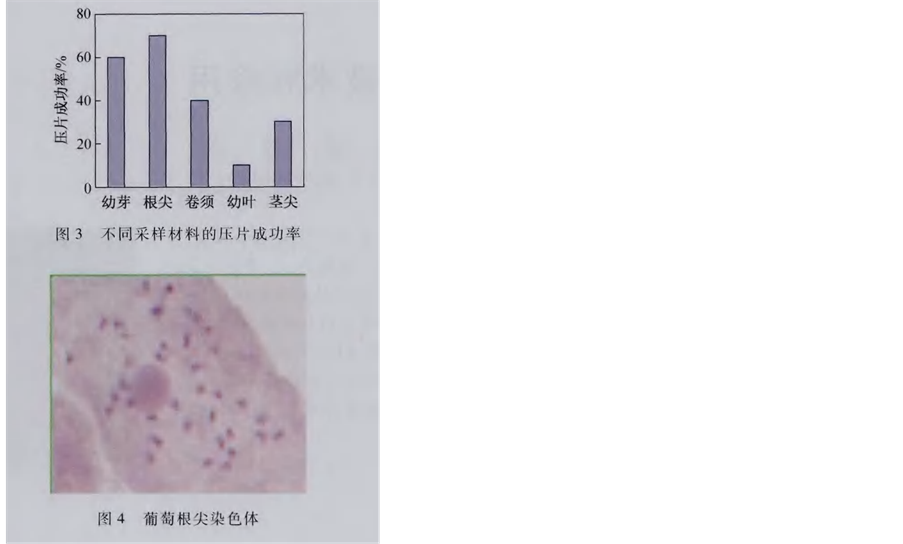
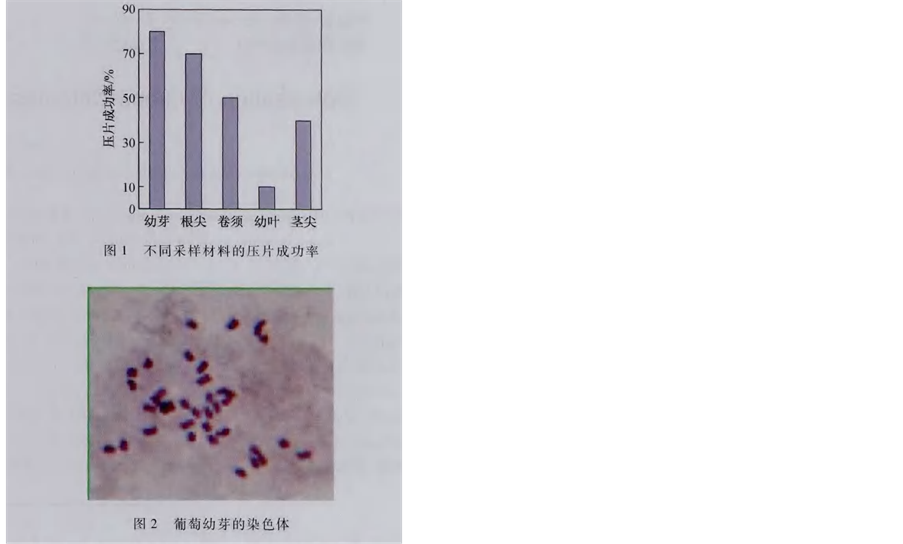
Figure 6. Optimization of grape chromosome specimen making technology (from xiao-li wang, 2012)
图6. 葡萄染色体制片技术优化(引自王小莉,2012)
体的葡萄高尾等)。
4) 对于同质多倍体用上述方法可以鉴定,但对于葡萄嵌合体,除用细胞流式仪式测定相对比值可确定外,还要用根尖、茎尖染色体计数或梢端石蜡切片和气孔来协助确定是否是嵌合体。
5) 如果要鉴定葡萄染色体组型和准确的染色体计数,染色体制片技术要求更高,染色体要分散良好,一个不重叠,拍出的图片要高度清析,才便于染色体组型分析和准确的染色体计数。
6) 如果要活体观察葡萄细胞分裂过程和准确的染色体计数,需要价值更昂贵的激光共聚焦显微镜观察才能实现,国内尚无这方面的报道。
总之葡萄倍性鉴定技术虽有较大进展,但仍需发展,若能向现在医院电子分析血液一样,抽取血样,除把血液化学成分报告出外,还能把红血球、白血球、血小板等大小和数量精确报出,若葡萄鉴定能这样做就好了,这一天我们想总会到来。
基金项目
甘肃省农牧厅农业科技创新项目(GNCX-2013-38)。
参考文献 (References)
- [1] 沈德绪 (1995) 果树育种学.第二版, 农业出版社, 北京, 135-138.
- [2] 贺普超主编 (1999) 葡萄学. 中国农业出版社, 北京, 322-345.
- [3] 曹孜义 (1994) 三个生态地区“胜利”葡萄花药植株的倍性. 植物学报, 36(增刊), 151-154.
- [4] 曹孜义, 李 唯, 张利平 (1993) 葡萄花药三倍体植株的诱导. 科学通报, 5, 440-444.
- [5] 李唯, 曹孜义, 张利平 (1994) 葡萄三倍体花药植株倍性的鉴定. 遗传, 3, 39-41.
- [6] 曹孜义 (2014) 葡萄花药培养诱导不出花粉单倍体植株. 林业世界, 3, 23-27.
- [7] 于振忠 (1989) 葡萄多倍体的研究进展. 农牧情报研究, 24, 36-39.
- [8] 马爱红, 赵胜建, 郭紫娟, 等 (2006) 秋水仙素诱导葡萄四倍体的研究进展. 中国农业学通报, 1, 236-139.
- [9] 马爱红, 范培格, 孙建设, 等 (2005) 四倍体葡萄诱导技术的研究. 中国农业科学, 8, 1645-1651.
- [10] 陶抵辉, 李小红, 王利群, 等 (2009) 植物染色体倍性鉴定方法研究进展. 生命科学研究, 5, 450-455.
- [11] 常永顺 (2009) 葡萄四倍体诱导及其生物学研究. 博士论文, 葡萄诱导技术的研究, 河北农业大学, 河北.
- [12] 赵艳华, 程式东, 吴彩琴 (2011) 葡萄三倍体种质创新及倍性快速鉴定. 园艺学报, 6, 1161-1166.
- [13] 王小利 (2012) 葡萄染色体制片技术优化. 实验室研究与探索, 10, 7-9.
- [14] 张丙秀, 李璐, 杨国慧, 高庆玉 (2011) 京秀葡萄四倍体诱变研究. 东北农业大学学报, 7, 91-97.
- [15] 朱道圩, 杨宵, 理莎莎, 符真珠, 毛俊 (2006) 流式细胞仪在果树作物倍性鉴定上的应用. 安徽农业科学, 24, 6480-6482.
- [16] 石艳, 张剑侠, 王跃进, 唐冬梅, 张朝红 (2012) 利用胚挽救技术创制葡萄多倍体种质的研究. 果树学报, 2, 269-273.
- [17] 陈俊, 李登科, 李太保 (1994) 葡萄多倍体诱导方法及倍性鉴定. 中国农学通报, 3, 5-8.
- [18] 吴雅琴, 常瑞丰, 程和禾 (2006) 流式细胞仪进行倍性分析原理及应用. 云南农业大学学报, 4, 407-409.
- [19] 孙马, 王跃进 (2006) 中国野生葡萄染色体倍性研究. 西北农业学报, 6, 148-152.
- [20] 赵淑兰, 王军, 葛玉香, 沈育杰, 林盛华, 李晓红 (2003) 完全花山葡萄四倍体种质的发现及鉴定. 园艺学报, 4, 436-438.
- [21] 唐晓萍, 陈俊, 马小河, 董志刚, 赵旗峰 (2006) 葡萄新品种早宁夏黑的倍性结构研究. 果树学报, 3, 384-387.
- [22] 戴洪义, 孙敏, 商传明等 (1990) 葡萄的染色体倍性与气孔性状的关系及其判别分析. 葡萄栽培与酿酒, 2, 5-9.
- [23] 常永义, 陈秀蓉 (2004) 应用气孔性状建立线型判别葡萄染色体倍性. 葡萄栽培与葡萄酿酒, 2, 26-27.
- [24] 常金华, 任清, 罗耀武 (2003) 人工诱变四倍体玫瑰香葡萄的倍性鉴定. 核农学报, 3, 22l-224.
- [25] 李胜, 曹孜义, 李唯, 武季玲, 杨德龙, 郝燕 (2004) 葡萄花药三倍体植株花粉状况和结实特性的观察. 农业工程学报, 20 (增刊), 108-111.
- [26] 曹孜义, 康天兰, 张金文 (1996) 葡萄三倍体花药植株倍性完全性的确定. 园艺学报, 2, 194-196.
- [27] 张淑爱, 齐与枢, 魏宝发等 (1989) 用秋水仙紊诱导葡萄试苗获得多倍体. 中国果树, 3, 28-30.
- [28] 曹孜义 ( 1999) 葡萄组织培养. In: 贺普超, 主编, 葡萄学, 中国农业出版社, 北京, 322-334.
- [29] 邹昌杰, 李佩芬 (1981) 葡萄花粉植株的诱导. 植物学报, 4, 79-81.
- [30] Mary-Howell, R., et al. (l988) 一种用于葡萄染色体计数的先进技术. 农业新技术新方法译丛, 王炳云译自HorlScience, 5, 896-898.
- [31] 李佩芬, 卢炳芝, 于向荣等 (1993) 葡萄细胞悬浮培养诱变研究初报. 园艺学报, 3, 301-302.
- [32] 任 清, 罗耀武, 柳术杰等 (2000) 人工诱变四倍体玫瑰香葡萄的遗传稳定性研究. 园艺学报, 4, 285-286.
